Waldo Merino MD. MSc. MBA. 1 ,*, Juan Orellana PhD. 2 , Mauricio Peña MSc. 3 , Oscar Cherres MD. 4 , Fernando Arraiza MD. 4 , Claudio Cárcamo MSc. 2 , Diego González MD. 4 , Michael Soto MD. 4 , Milca Villagran MD. 4 , Rubén Carrasco MD. 4 , Sebastián Herrero 5
Recibido: 03-09-2021
Aceptado: 25-09-2021
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 3 pp. 313-319|https://doi.org/10.25237/revchilanestv5117031411
PDF|ePub|RIS
Abstract
The central venous catheter (CVC) is an essential device in the management of the critical patient. The wrong positioning of the CVC is observed in 20%-48% of cases. Peres’ formula is used to establish the catheter length, and the chest x-ray to confirm if the CVC tip is in an “acceptable location”. Our aim is to describe the use of transthoracic ultrasound to achieve the correct positioning of the catheter tip using the Seldinger wire technique. Seventy patients were recruited. While the guidewire was being advanced, it was observed with transthoracic echocardiography in subcostal-superior vena cava view inside the right atrium, from the right atrium-superior vena cava junction it was withdrawn two centimetres cranially, so that the distal end of the guide was positioned within three centimetres adjacent to the right atrium or “target zone”. Then the distance from the guide to the right atrium-superior vena cava junction was measured with transesophageal ultrasound. The technique described achieved the installation of the tip of the CVC guide in the “target zone” in 94.3% of cases. The distance of the tip to the right atrium- superior vena cava junction estimated with Peres’ method and with the new technique with support of transthoracic ultrasound presented a low correlation of 41% (p = 0.0004). The results here make it possible to state that a correct insertion of the CVC is feasible with ultrasound support, adequately positioning the CVC tip in the “target zone” simply, accurately and in real time.
Resumen
El catéter venoso central (CVC) es un dispositivo esencial en el manejo del paciente crítico y se observa su incorrecto posicionamiento en el 20%-48% de los casos. Para predecir su extensión se utiliza la fórmula de Peres y la localización de su punta se confirma con radiografía de tórax. Nuestro objetivo es describir el uso de la ecografía transtorácica para determinar el correcto posicionamiento de la punta del CVC mediante la técnica de Seldinger. Se reclutaron 70 pacientes para instalación del CVC. En ellos se observó la aparición de la guía metálica en el atrio derecho (AD) mediante visión ecocardiográfica transtorácica (ETT) subcostal con énfasis en vena cava superior (VCS), y se retiró 2 cm hacia cefálico desde la unión AD-VCS, de manera tal que el extremo distal de la guía se sitúe dentro de los 3 cm de la VCS adyacentes al AD, definidos como “Zona Objetivo”. Posteriormente, la distancia de la guía a la unión AD-VCS fue medida con ecografía transesofágica. La técnica descrita logró el posicionamiento de la punta de la guía del CVC en la “Zona Objetivo” en el 94,3% de los casos. La distancia de la punta a la unión atrio derecho-vena cava superior estimada con el método de Peres y con la técnica descrita con la ecografía transtorácica presentó una correlación baja (41%). Los resultados permiten afirmar que una correcta inserción del CVC es factible con apoyo ecográfico, posicionando adecuadamente la punta del CVC de forma simple, precisa y en tiempo real.
-
Introducción
El catéter venoso central (CVC) es un dispositivo esencial en el manejo del paciente crítico durante el perioperatorio. El posicionamiento incorrecto de este dispositivo, especialmente de su punta, se observa en 20%-48% de los casos y puede conducir a mediciones equívocas de la presión venosa central y a complicaciones tales como: lesiones vasculares, lesiones de estructuras nerviosas, arritmias, taponamiento cardiaco, neumotórax, entre otras[1].
Se ha utilizado la fórmula de Peres basada en la altura del paciente para estimar la extensión del CVC desde la piel y evitar su ubicación intracardiaca, pero ésta no considera las diferentes ubicaciones del punto de inserción cutáneo ni las variantes anatómicas individuales[2]. Habitualmente y de manera posterior se usa la radiografía de tórax (RxT) para confirmar la posición “aceptable” de la punta del CVC[3],[4] y para diagnosticar complicaciones del procedimiento[5]. Sin embargo, esta técnica tiene limitaciones importantes: no permite modificaciones en tiempo real, expone al paciente y el operador a la radiación, hay un tiempo de espera para el diagnóstico de complicaciones y con ello retrasos en el uso del catéter, entre otros[6],[7].
Hoy el ultrasonido es la técnica de apoyo de elección para la instalación de un CVC. Este permite acceder a los grandes vasos por vía percutánea, alcanzar la vena cava superior (VCS) con menos complicaciones[8] y a la vez obtener una adecuada ubicación en tiempo real [9]-[11]. Así, el ultrasonido también podría utilizarse para establecer la distancia en la que debe extenderse el CVC desde la piel y lograr un correcto posiciona- miento de su punta.
Nuestro objetivo es describir el uso de la ecografía transtorácica (ETT) en ventana subcostal con énfasis en VCS (ventana subcostal-VCS), como una herramienta para definir la distancia en que se extenderá el CVC, desde la piel del paciente, logrando el correcto posicionamiento de su punta en la “zona objetivo” dentro de la VCS a través de la técnica de Seldinger y comparar los resultados obtenidos con los que nos entrega la fórmula de Peres y la RxT.
-
Materiales y Métodos
Estudio cuantitativo con un diseño analítico, de corte transversal, realizado en un hospital universitario con la autorización del comité de ética institucional, previo consentimiento informado. El reclutamiento se realizó de manera consecutiva en aquellos pacientes programados para cirugía coronaria electiva, con instalación de un CVC a través de la vena yugular interna derecha (YID). Fueron excluidos quienes ya tuvieran un CVC, Swan-Ganz o marcapasos instalados, así como también aquellos con contraindicaciones o impedimento de cateterización por la vena YID y con contraindicaciones de instalación de la sonda de ecocardiografía transesofágica (ETE). Para el análisis comparativo no se pudieron considerar aquellos pacientes en los cuales se obtuvo una ventana ecográfica “Pobre’’ que no permitió realizar mediciones.
El reclutamiento se efectuó por residentes de segundo y tercer año de anestesiología. En el proceso de inclusión de pacientes que permitieran la obtención de imágenes, previo a la inducción anestésica, se obtuvo una primera imagen o “Visión 1” en ventana subcostal, usando un transductor cardiaco (3.5 MHz transducer, Phillips®) para configurar la profundidad, el enfoque, el contraste y la imagen armónica tisular. De acuerdo a su calidad, ésta fue clasificada como “Buena” (visión que permite mediciones), “Regular” (visión que permite mediciones con dificultad) o “Pobre” (visión que no permite realizar mediciones). Luego de la inducción anestésica, como es habitual, se instaló una sonda nasogástrica (SNG) y el transductor transesofágico y se obtuvo una segunda imagen o “Visión 2”. Aquellas imágenes que luego de esto resultaron “Regulares” o “Pobres” se intentaron optimizar a través de una maniobra de reclutamiento (incrementando la presión a 30 – 40 cm H2O por 30 – 40 segundos mientras se monitoriza el compromiso hemodinámico), seguida de la titulación de la PEEP a 8 cm H2O, las imágenes que a pesar de esta intervención (abreviada como “PEEP” en la Tabla 1) no lograron optimizarse. Se intentaron nuevamente de mejorar a través de la aspiración de contenido gástrico con la SNG, obteniendo finalmente una tercera imagen o “Visión 3”. De los 74 pacientes inicialmente reclutados, en 70 de ellos se obtuvo una imagen “Buena” o “Regular” que permitió incluirlos en el análisis comparativo (Figura 1).
Luego del reclutamiento de los pacientes se inició el procedimiento en estudio, éste se realizó por los residentes de anestesiología acompañados por uno de dos anestesiólogos cardiovasculares involucrados en la investigación (primer operador) y un enfermero quirúrgico (segundo operador) capacitado en ETT y ETE, quien capturó las imágenes y realizó las mediciones. Un primer operador instaló el CVC Certofix® Trio S 720 Braun® a través de la vena YID del paciente bajo técnica estéril y guiado por ultrasonido con un equipo Phillips® Affiniti 50G con transductor lineal L13-4.
El procedimiento consistió en introducir, a través del trocar, la guía metálica flexible de 50 cm (técnica de Seldinger), confirmando su ubicación en eje corto y largo. Mientras la guía se avanzaba (tiempo 0), simultáneamente se observó, mediante ETT en visión subcostal-VCS, su aparición dentro del atrio derecho (AD) (Figura 2a), una vez visualizada la guía fue retirada hasta la unión AD-VCS (Crista terminalis) (Figura 2b) y desde esta posición, nuevamente fue retirada, esta vez dos centímetros hacia cefálico, de manera que el extremo distal de la guía se posicione dentro de los tres centímetros de la VCS adyacentes al AD o “Zona Objetivo” definida por los autores (tiempo final).
Para estimar la precisión de la maniobra descrita, el segundo operador, en visión bicava con ETE (Figura 3a), midió la distancia desde el extremo de la guía de Seldinger con el “hook” extendido (Figura 3b) hasta la unión de la VCS con el AD y de esta manera determinó si la punta quedó posicionada en la “Zona Objetivo” (Figura 3c). A continuación, se midió la extensión de la guía desde la piel a la unión AD-VCS, utilizando las marcas métricas y una regla estéril (Figura 4) y con ello se determinó la distancia en que se debía avanzar el CVC a través del Seldinger, desde la piel dentro de la VCS. Así, la punta del CVC se ubicó a la misma distancia de la unión de la AD-VCS que lo hizo la guía de Seldinger en la Figura 3c.
Tabla 1. Características biodemográficas de la población estudiada
| Variable | [Rango] promedio (desviación estándar) |
| Edad (años) | [48 – 83] 66,8 (8,9) |
| Peso (kg) | [50 – 110] 74,8 (12) |
| Talla (cm) | [140 – 178] 161,8 (8,9) |
| IMC (kg/mt2) | [18,9 – 40,1] 28,7 (4,6) |
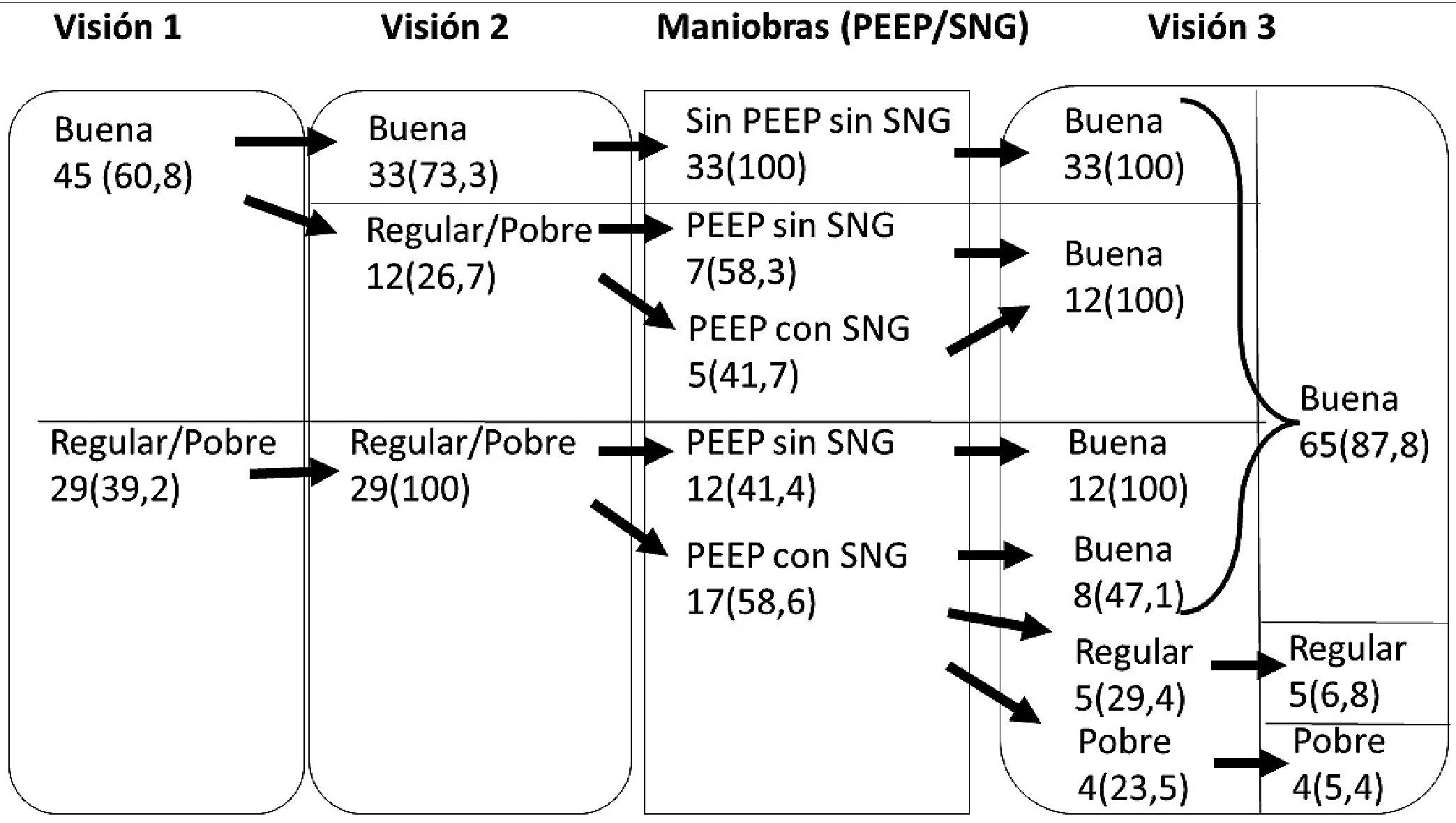
Figura 1. Calidad de las imágenes obtenidas en el proceso de inclusión n (%). SNG: Sonda nasogástrica; PEEP: Presión positiva de final de espiración + maniobra de reclutamiento; Visión 1: Pre anestesia; Visión 2: Luego de entubación endotraqueal y Visión 3: Visión final posterior a maniobras (de haber sido necesarias).
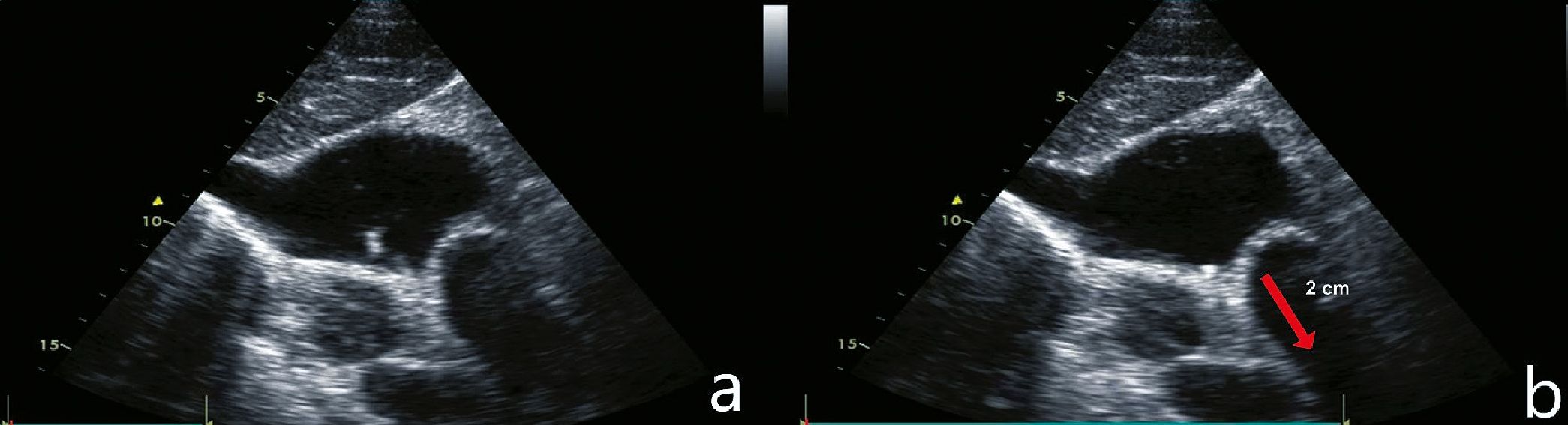
Figura 2. Visión SubCostal-VCS con ETT. Aparición de la guía dentro del Atrio Derecho (a) y posicionamiento en la unión AD-VCS para retirada de 2 cm (b).
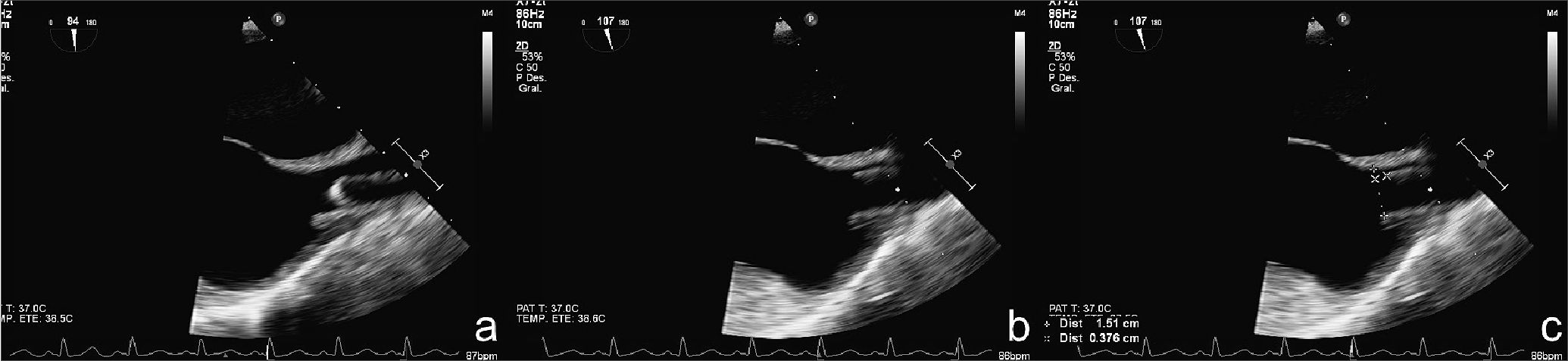
Figura 3. Visión bicava con TEE, se midió la distancia desde el extremo distal de la guía extendida hasta la unión VCS-AD para determinar si la punta quedó posicionada dentro de la “Zona Objetivo”.
Durante el posoperatorio inmediato en la unidad de cuidados intensivos cardio-quirúrgica, como es de rutina, se obtuvo una RxT portátil de cada paciente. Un radiólogo, independiente y ciego al procedimiento determinó la distancia desde la punta del catéter a la Carina, a la base inferior de la segunda vertebra bajo la Carina y a un ancho de costilla por encima del bronquio principal derecho (Figura 5).
El cálculo de tamaño de muestra se hizo para estimar la proporción de casos en la “Zona Objetivo” y consideró los datos de un estudio piloto en 32 pacientes sometidos a cirugía cardiaca en nuestro centro y a los que se les instaló un CVC con ETT, TEE y RxT; donde solo se observó un caso fuera de dicha zona por lo que la proporción fue de 96,9%. Así el tamaño de muestra final, considerando una precisión absoluta de 3,3 puntos porcentuales, un nivel de confianza de 95%, efecto de diseño muestral de 1 y población infinita; fue de 70 pacientes.
El reclutamiento se realizó a través de un muestreo consecutivo hasta alcanzar el tamaño de muestra final. El análisis estadístico comprendió el resumen de los datos mediante el uso de estadígrafos, gráficos y tablas de frecuencias. La evaluación de la validez del método ecográfico transtorácico y la fórmula de Peres con respecto del método ecográfico transesofágico se describe en función de la distancia de la punta del CVC y la zona objetivo mediante gráficos de correlación, regresión lineal simple, cálculo de los estadígrafos promedio, mediana y proporciones. Evaluando la significancia estadística con los test correspondientes.
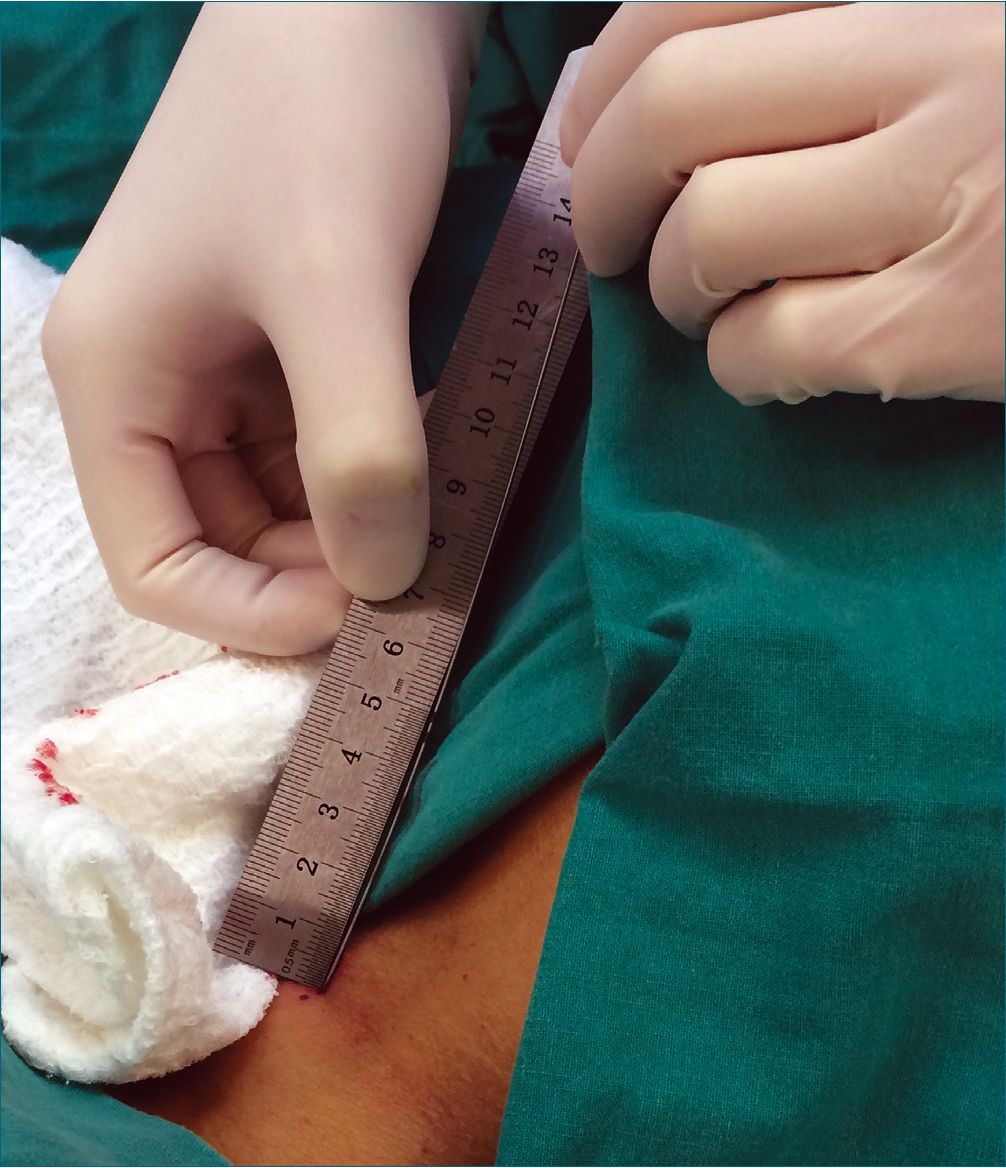
Figura 4. Extensión del Seldinger desde la pie.l
-
Resultados
Se reclutaron 74 pacientes de manera consecutiva. El proceso, descrito en la sección anterior, permitió imágenes de calidad “Buena o Regular” en 70 de ellos por lo que los 4 pacientes que presentaron una imagen “Pobre” no pudieron ser incluidos en el análisis comparativo. Se observó el deterioro de la calidad de imagen luego de la inducción anestésica en 12 pacientes que inicialmente presentaron una “Buena” imagen, pero se logró volver a obtener esta calidad en el 100% de los mismos, tras las maniobras de reclutamiento, la titulación de la PEEP y/o la aspiración de contenido gástrico. Las características biodemográficas de la muestra se encuentran descritas en la Tabla 1.
El procedimiento en estudio se inició con la instalación de la guía metálica flexible o Seldinger (tiempo 0). El tiempo transcurrido hasta el posicionamiento de la guía en la “Zona Objetivo” (tiempo final) tuvo un rango principal de 30 a 323 segundos con mediana (IQR) de 80 (58 a 157) segundos, se registró sólo un valor atípico de 960 segundos.
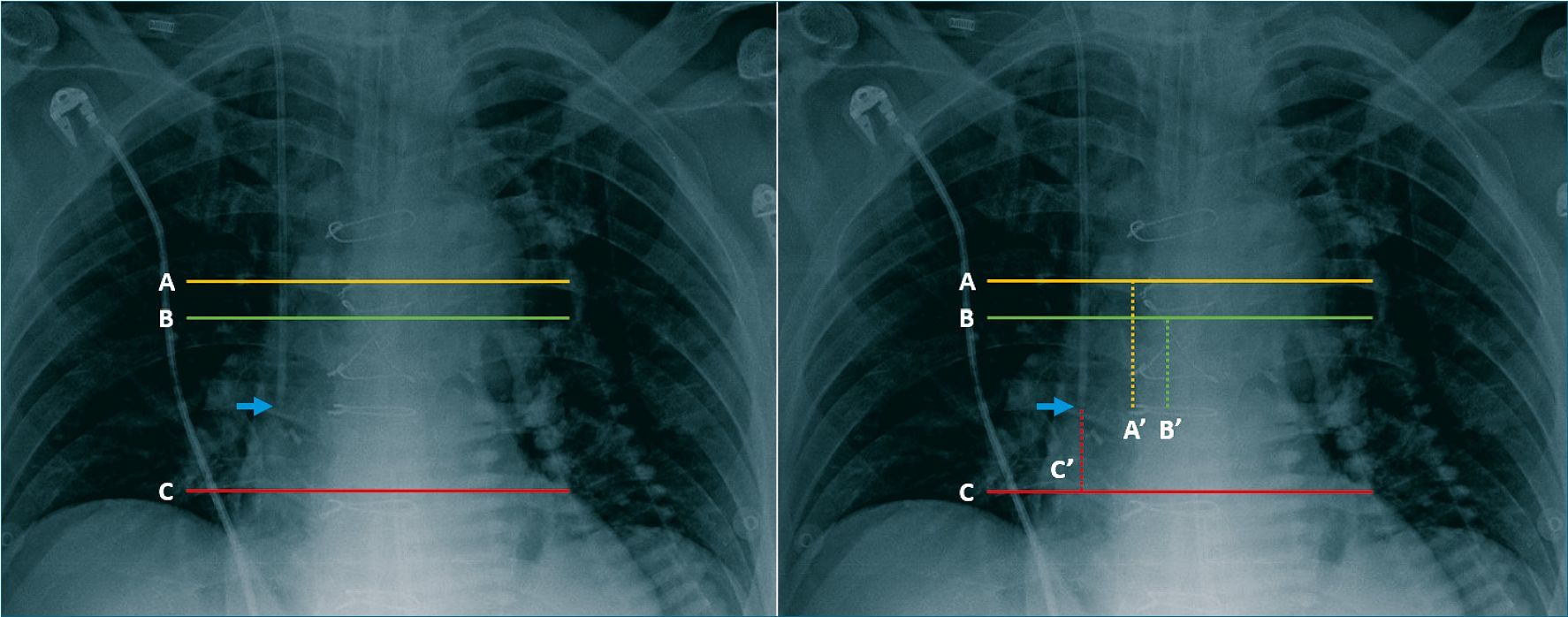
Figura 5. Distancias (A’,B’y C’) desde la punta del catéter (Flecha azul) a un ancho de costilla por sobre el bronquio principal derecho (A), a la Carina (B) y a la base inferior de la segunda vértebra bajo la Carina (C).
El posicionamiento final de la guía con respecto a la unión VCS-AD se distribuyó entre -8 mm (distancia dentro del AD) y 33 mm (distancia dentro de la VCS desde la unión AD-VCS) con una media de 12,8 mm y una desviación estándar (DE) de 7,9 mm. La instalación de la punta de la guía del CVC en la VCS en los 3 cm proximales al AD o “Zona Objetivo” se alcanzó en 66 de 70 casos (94,3%), en tres casos quedó dentro del AD (-2, -3 y -8 mm respectivamente) y en un solo caso a 33mm de la unión VCS-AD. Su distribución se observa en el gráfico superior de la Figura 6. Si el procedimiento se hubiese realizado basándose en la fórmula de Peres, en 14 pacientes la punta del catéter se hubiese ubicado por encima o antes de la “Zona Objetivo”, 38 de ellos dentro de ella y 18 dentro de la aurícula derecha, de los cuales 6 se hubiesen ubicado a más de un cm dentro de la aurícula derecha como se observa en el gráfico inferior de la Figura 6.
Tabla 2. Longitud (mm) del CVC estimado con fórmula de Peres y obtenido con el uso de ETT
| Extensión del CVC | [Rango] promedio (desviación estándar) |
| Fórmula Peres (Talla/10)
ETT |
[135 – 180] 152 (8) [130 – 201] 163,4 (15,3) |
La distancia de la punta del CVC a la unión VCS-AD que resultó con la fórmula de Peres (predicho) y la que resultó con nuestra técnica realizada con ETT y ETE en ventana subxifoidea presentaron una correlación de Pearson positiva estadísticamente significativa de r = 41,1% (p = 0,0004, Ho: R = 0) (Tabla 2). Sin embargo, para cumplir el objetivo de posicionar la punta del catéter dentro de la zona objetivo, se observa un kappa de solo 0,0541, valor no significativo (p = 0,1524, Ho: Kappa = 0) (Figura 7).
La correlación de Pearson, entre la distancia del CVC desde la piel a la unión VCS/AD que resultó con la fórmula de Peres y la que resultó con la técnica usando ETT alcanzó un valor de r = 18,63% no significativo (p = 0,1225, Ho: R = 0).
En la RxT la “ubicación aceptable” de la punta del CVC fue establecida en base a lo comentado por Wright y Williams[12] quienes la limitan entre un ancho de costilla por encima del bronquio principal derecho y dos cuerpos vertebrales por debajo de la carina, nosotros definimos esta zona como “Ventana Segura” (Figura 4. Entre las líneas A y C). El número de pacientes con la punta del CVC dentro de la “Ventana Segura” fue de 44 (63,8%).
La extensión de la “Ventana Segura’’ entre los pacientes mostró una media de 57,1 mm (DS 15,5) un mínimo de 21 mm y un máximo de 107 mm (Figura 4. Líneas A y C).
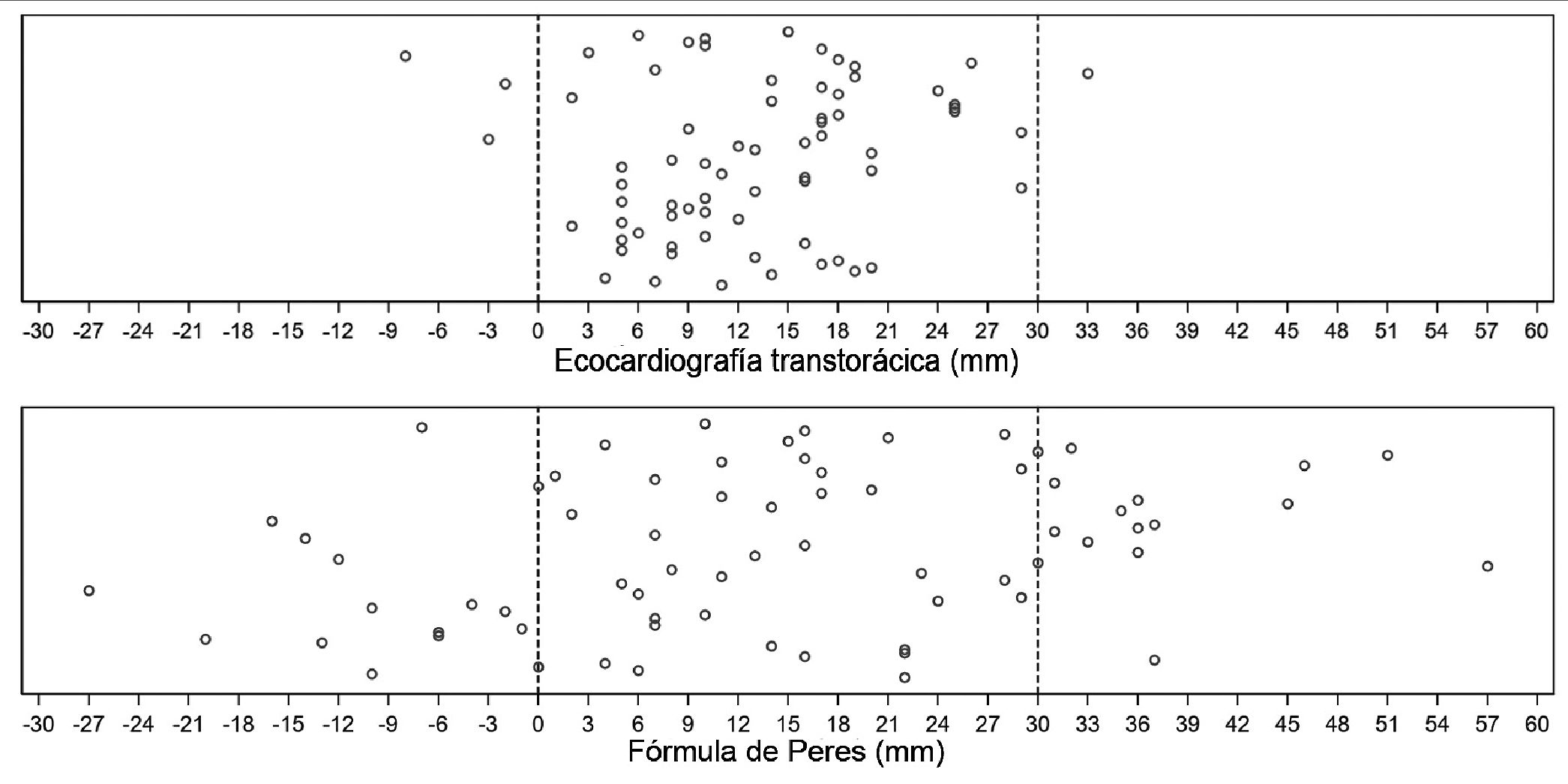
Figura 6. Posicionamiento final (en mm) de la punta de la guía respecto a la unión VCS-AD con el uso de ETT (superior) y con la fórmula de Peres (inferior).
-
Discusión
Los resultados del estudio permiten afirmar que una correcta inserción del CVC, alcanzando una adecuada posición de su punta adyacente al AD en tiempo real, es factible con apoyo ecográfico si se logra conseguir una visión adecuada. La maniobra descrita logró determinar a qué distancia se debe avanzar el CVC desde la piel, posicionando adecuadamente su punta dentro de los tres centímetros de la VCS adyacentes al AD o “Zona Objetivo” en el 94,3% de los casos en los que se logró una visión “Buena” o “Regular”.
Para cumplir el objetivo de posicionar la punta del catéter dentro de la zona objetivo. Esta técnica presentó una correlación de Pearson positiva, estadísticamente significativa de r = 41,1% (p = 0,0004, Ho: R = 0) con el método de Peres, sin embargo, presenta un kappa de solo 0,0541, valor no significativo (p = 0,1524, Ho: Kappa = 0). Así, el grado de acuerdo de ambas técnicas de posicionar la punta del catéter dentro de la zona objetivo, no logra significancia estadística y el hecho de ocurrir, probablemente se deba al azar. Aún más, la correlación de Pearson de la distancia del CVC desde la piel a la unión VCS/AD, con la técnica apoyada con ETT y la fórmula de Peres alcanzó un valor de r = 18,63% no significativo (p = 0,1225, Ho: R = 0). Estos aspectos evidencian las limitaciones en la predictibilidad que tiene la fórmula de Peres para determinar la distancia en que se debe extender el CVC desde la piel y apoyan la utilización de la técnica que hemos descrito en la ejecución del procedimiento.
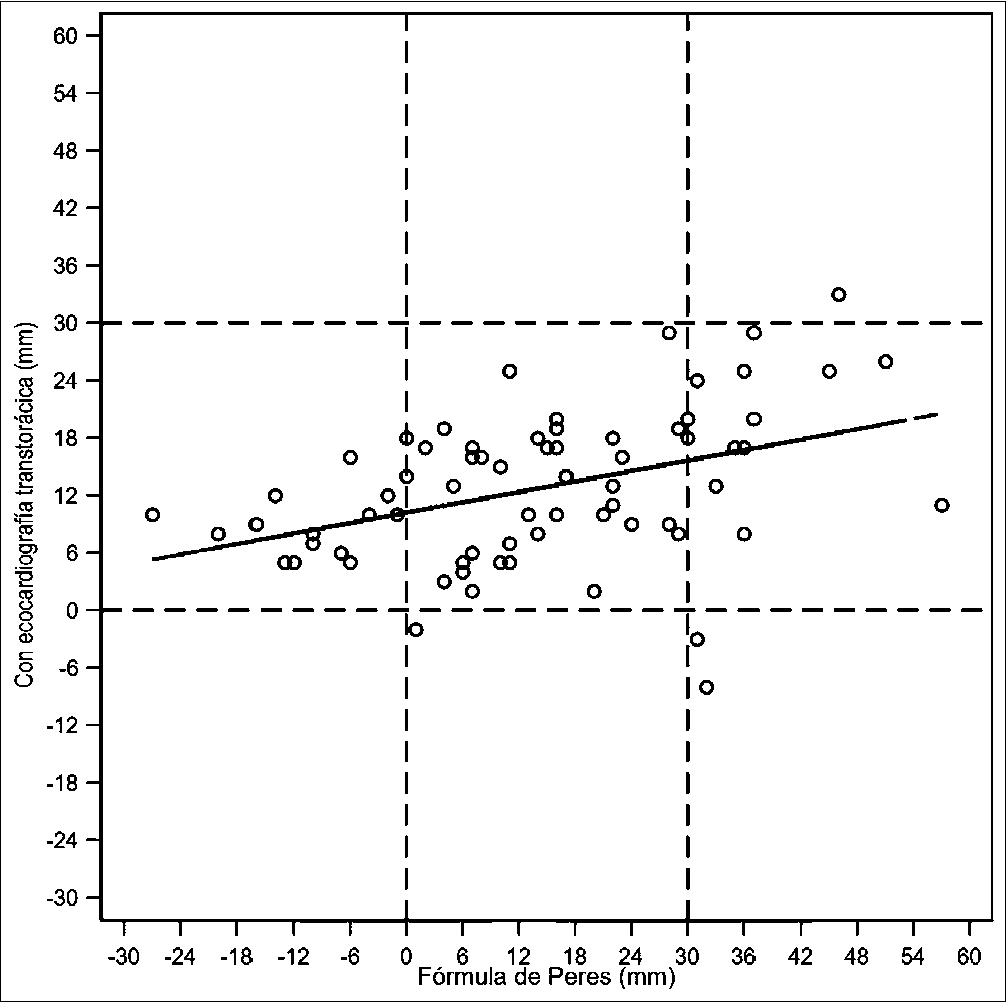
Figura 7. Correlación entre la distancia de la punta del CVC a la unión AD-VCS obtenida con la fórmula de Peres y la obtenida con el uso de ultrasonido.
La guía metálica es muy ecorrefringente y fácil de visualizar en los grandes vasos, a su vez la ETE puede reconocer su posición en relación a la unión VCS-AD en tiempo real, por ello utilizamos esta técnica ecográfica como “gold standard” para determinar la distancia de la guía a la unión VCS-AD[2],[9],[10] luego de haberla retirado 2 cm para posteriormente medir la distancia desde la piel y emplazar a esa distancia el CVC[11]. Cabe destacar que para hacer esto no es necesario estirar el “hook” del Seldinger (de extensión variable) disminuyendo la ecorrefringencia y dificultando la visualización de la punta. La punta con el “hook” estirado fue utilizada en este estudio solo para estimar la distancia de la unión AD-VCS a la guía en ventana bicava en ETE (nuestro “gold standard”) entendiendo que sería la posición final que alcanzaría la punta del CVC al avanzar a través de la guía.
Con la acción de retirar dos centímetros el Seldinger esperábamos disminuir la probabilidad de dejar el catéter dentro del AD y no más allá de tres cm hacia craneal dentro de la VCS. En este rango se evitan lecturas inapropiadas de presión venosa central y eventuales complicaciones (como trombosis, arritmias y perforaciones) permitiendo además administrar fármacos y alimentación parenteral de manera inmediata.
Hubo un caso en que el procedimiento se prolongó por 960 segundos (16 minutos). Al avanzar la guía (tiempo 0) esta no fue visualizada en el AD pues había girado sobre sí misma a cierta distancia del punto de inserción, tras esto fue reubicada con dificultad bajo visión ecográfica sin retirar la guía del lumen vascular y luego avanzada hasta el AD y posicionada según se ha descrito. Para los procedimientos restantes, la mediana del tiempo utilizado en el procedimiento, alcanzó solo 80 seg RI (58 a 157). Por ello consideramos que, en manos expertas, este procedimiento no consume un tiempo clínico significativo.
Con todo lo anterior nos podríamos plantear el uso rutinario de la ETE para la correcta instalación de un CVC en lugar de la ETT, sin embargo, esto no es siempre posible pues para la ETE se debe contar con disponibilidad de sondas esterilizadas luego de cada uso, el paciente este debe estar (por lo menos) sedado y en caso de que este se encuentre con anestesia general debe estar intubado. Por otro lado, la ETT es una opción de más fácil uso y para la cual no se requiere esterilización del equipo ya que al no ser invasivo el transductor puede ser utilizado en múltiples ocasiones interrumpido solo por un breve aseo. La ETT es una herramienta más económica que además hoy es parte habitual del equipamiento de un pabellón quirúrgico. Su principal limitación es el acceso a las ventanas ecográficas cuando la instalación del CVC ocurre una vez iniciada la cirugía y éstas quedan dentro del campo quirúrgico.
En nuestro centro es habitual tomar una RxT al ingreso del paciente a la UCI cardio-quirúrgica. A propósito de una actualización del sistema de registro electrónico perdimos la imagen en un caso. En nuestro trabajo, de las 69 RxT, sólo en tres casos se observó la punta del CVC sobre la carina del paciente en la RxT. El objetivo de ubicar la punta del catéter sobre la reflexión pericárdica, teóricamente, evitaría complicaciones como derrame pericárdico secundario a trauma o perforación por el catéter [3],[4]. Al respecto, compartimos el planteamiento de Tempe et al[13], en el cual señala que la libre flotación del catéter de manera paralela a la VCS, en su parte más baja, es una alternativa más segura previniendo estas complicaciones, evitando el contacto permanente del dispositivo con la pared intravascular y la erosión del tejido. De hecho, es más probable que ocurra el contacto del dispositivo con la pared vascular en ubicaciones más altas por sobre la Carina, especialmente en accesos vasculares del lado izquierdo o subclavios. Así, la técnica que usa la Carina como punto de referencia para posicionar el CVC sobre ella no nos parece la más apropiada.
También, describimos la posición de la punta del CVC de acuerdo a su ubicación en la “Ventana Segura” radiológica[5],[12], donde la mayor parte de los dispositivos instalados en este estudio cumplieron con el objetivo, pero nos parece que esta zona de seguridad no ofrece las ventajas de la técnica con ultrasonografía para ubicar la punta del CVC en tiempo real, y los límites radiológicos pueden ser imprecisos en un examen de rutina.
Opinamos, en base a todo lo anterior, que la ultrasonografía permite la utilización inmediata del CVC sin la necesidad de obtener imágenes radiológicas. Además de la imposibilidad que existe para reconocer adecuadamente la unión VCS-AD en la RxT, el examen se ve afectado por la posición del paciente y del equipo en el momento en que se obtiene. Por otro lado, es un examen tardío que no está disponible de manera inmediata cuando se debe corregir la posición del catéter y su utilidad para descartar complicaciones tempranamente es controvertida. Finalmente, está el hecho de que es deseable evitar la exposición de los pacientes y el personal de salud a la radiación[6],[7],[14].
La primera limitación de este estudio está dada por la posibilidad de conseguir visiones ecográficas adecuadas, de 74 pacientes reclutados hubo 4 que debieron ser excluidos de los análisis estadísticos por no poder realizar mediciones con las imágenes obtenidas, esto en la práctica se traduce en la necesidad de un operador entrenado. Así, los resultados del análisis pudiesen presentar un sesgo de selección.
Otra limitación es que, aún cuando se ha descrito que la instalación de un CVC con ultrasonido por un solo operador es posible, realizamos este estudio con dos operadores para facilitar el procedimiento y no poner en riesgo la asepsia. Estimamos que la técnica completa es posible de efectuar por un solo operador y debe efectuarse por una persona capacitada con experiencia en ultrasonido y en el procedimiento. Las manos expertas hacen factible, segura y expedita la técnica[11].
La técnica de instalación del CVC sólo se realizó por la vena YID y no incorporamos otros accesos vasculares para estandarizar el procedimiento. Estimamos que la determinación de la extensión en la que se instalará el catéter con esta técnica, no tiene relación con el sitio de punción en la piel o del acceso vascular que se utiliza, pues es la posibilidad de visualizar la guía metálica flexible (Seldinger), dentro del AD (Figura 2a) y luego retirarla desde la unión AD-VCS (Figura 2b) el aspecto clave o fundamental para posicionar adecuadamente la punta del CVC.
En otro aspecto, debemos señalar que el catéter Certofix® Trio S 720 Braun® tiene una extensión máxima de 20 cm. En nuestros pacientes la medición más alta de la guía metálica con el apoyo de ETT fue de 201 mm, una medición mayor superará la extensión máxima del catéter, alejando al CVC de la unión AD-VCS, especialmente en los accesos vasculares del lado izquierdo.
Finalmente, consideramos que la maniobra con ultrasonido de retirada de dos centímetros de la guía metálica flexible desde la unión AD-VCS, es más precisa que la fórmula de Peres para establecer la extensión o distancia a la que se debe introducir el CVC y al mismo tiempo nos ofrece una mayor seguridad respecto a su correcto posicionamiento. Así, se propone una nueva técnica para determinar la distancia de inserción del CVC en YID que demuestra ser sencilla, precisa y en tiempo real.
-
Referencias
1. Smit JM, Raadsen R, Blans MJ, Petjak M, Van de Ven PM, Tuinman PR. Bedside ultrasound to detect central venous catheter misplacement and associated iatrogenic complications: a systematic review and meta-analysis. Crit Care. 2018 Mar;22(1):65. https://doi.org/10.1186/s13054-018-1989-x PMID:29534732
2. Ahn JH, Kim IS, Yang JH, Lee IG, Seo DH, Kim SP. Transoesophageal echocardiographic evaluation of central venous catheter positioning using Peres’ formula or a radiological landmark-based approach: a prospective randomized single-centre study. Br J Anaesth. 2017 Feb;118(2):215–22. https://doi.org/10.1093/bja/aew430 PMID:28100525
3. Schuster M, Nave H, Piepenbrock S, Pabst R, Panning B. The carina as a landmark in central venous catheter placement. Br J Anaesth. 2000 Aug;85(2):192–4. https://doi.org/10.1093/bja/85.2.192 PMID:10992822
4. Stonelake PA, Bodenham AR. The carina as a radiological landmark for central venous catheter tip position. Br J Anaesth. 2006 Mar;96(3):335–40. https://doi.org/10.1093/bja/aei310 PMID:16415318
5. Hade AD, Beckmann LA, Basappa BK. A checklist to improve the quality of central venous catheter tip positioning. Anaesthesia. 2019 Jul;74(7):896–903. https://doi.org/10.1111/anae.14679 PMID:31062348
6. Blans MJ, Endeman H, Bosch FH. The use of ultrasound during and after central venous catheter insertion versus conventional chest X-ray after insertion of a central venous catheter. Neth J Med. 2016 Oct;74(8):353–7. PMID:27762217
7. Raman D, Sharma M, Moghekar A, Wang X, Hatipoğlu U. Utilization of Thoracic Ultrasound for Confirmation of Central Venous Catheter Placement and Exclusion of Pneumothorax: A Novel Technique in Real-Time Application. J Intensive Care Med. 2019 Jul;34(7):594–8. https://doi.org/10.1177/0885066617705839 PMID:28443388
8. Lamperti M, Biasucci DG, Disma N, Pittiruti M, Breschan C, Vailati D, et al. European Society of Anaesthesiology guidelines on peri-operative use of ultrasound-guided for vascular access (PERSEUS vascular access). Eur J Anaesthesiol. 2020 May;37(5):344–76. https://doi.org/10.1097/EJA.0000000000001180 PMID:32265391
9. Arellano R, Nurmohamed A, Rumman A, Milne B, Tanzola R. Point-of-care transthoracic echocardiography as an alternative to transesophageal echocardiography to confirm internal jugular guidewire position. Can J Anaesth. 2012 Jan;59(1):103–4. https://doi.org/10.1007/s12630-011-9608-1 PMID:22033860
10. Yoshimura M, Nakanishi T, Sakamoto S, Toriumi T. Confirmation of optimal guidewire length for central venous catheter placement using transesophageal echocardiography. J Clin Anesth. 2016 Dec;35:58–61. https://doi.org/10.1016/j.jclinane.2016.07.032 PMID:27871596
11. Galante O, Slutsky T, Fuchs L, Smoliakov A, Mizrakli Y, Novack V, et al. Single-operator ultrasound-guided central venous catheter insertion verifies proper tip placement. Crit Care Med. 2017 Oct;45(10):e994–1000. https://doi.org/10.1097/CCM.0000000000002500 PMID:28538437
12. Wright D, Williams D. Central venous catheter tip position on chest radiographs. Anaesthesia. 2020 Jan;75(1):124–5. https://doi.org/10.1111/anae.14894 PMID:31794645
13. Tempe DK, Hasija S. Quest to determine the ideal position of the central venous catheter tip. Br J Anaesth. 2017 Feb;118(2):148–50. https://doi.org/10.1093/bja/aew443 PMID:28100515
14. Weekes AJ, Keller SM, Efune B, Ghali S, Runyon M. Prospective comparison of ultrasound and CXR for confirmation of central vascular catheter placement. Emerg Med J. 2016 Mar;33(3):176–80. https://doi.org/10.1136/emermed-2015-205000 PMID:26446313

 ORCID
ORCID