Marina Regato Avilés 1 ,*, Bonifacio Cimadevilla Calvo 1 , José Luis Rábago Moriyón 1 , Nerea Ruiz Andrés 1 , Pablo Del Olmo Ruiloba 1
Recibido: 26-12-2021
Aceptado: 12-02-2022
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 3 pp. 335-338|https://doi.org/10.25237/revchilanestv5122031222
PDF|ePub|RIS
Von Hippel-Lindau syndrome
Abstract
Pheochromocytoma is a catecholamine-producing tumor that can occur sporadically or in association with other entities and syndromes. The anesthetic management of these patients must be very careful, focused mainly on avoiding hypertensive crises and therefore stimuli that can trigger them. The role of the anesthesiologist is very important in these cases, not only intraopera- tively but from the moment a pre-anesthetic assessment is made, since patients usually require drugs such as alpha-blockers to reach surgery in optimal conditions. We present the anesthetic management in a 54-year-old woman previously diagnosed with Von Hippel-Lindau syndrome in whom a pheochromocytoma was observed in the clinical follow-up and required to be scheduled for surgery.
Resumen
El feocromocitoma es un tumor productor de catecolaminas que se puede presentar de forma esporádica o asociada a otras entidades y síndromes. El manejo anestésico de estos pacientes debe ser muy cuidadoso, enfocado principalmente a evitar crisis hipertensivas y por tanto estímulos que puedan desencadenarlas. El papel del anestesiólogo es muy importante en estos casos, no solo de manera intraoperatoria sino desde el momento en el que se hace una valoración preanestésica, ya que los pacientes suelen precisar fármacos como los alfabloqueantes para llegar en unas condiciones óptimas a la cirugía. Presentamos el manejo anestésico en una mujer de 54 años, diagnosticada previamente de síndrome de Von Hippel-Lindau, en la que se objetiva un feocromocitoma en el seguimiento clínico y requiere ser programada para cirugía.
-
Introducción
El feocromocitoma es un tumor productor de una o más catecolaminas tales como adrenalina, nodradelina o dopamina[1]. Se origina en el tejido cromafín del sistema nervioso simpático y en 85% se localiza en la médula adrenal. En ocasiones es esporádico y otras se asocia a enfermedades genéticas como la neoplasia endocrina múltiple tipo 2, la neurofibromatosis tipo 1 o el síndrome de Von Hippel Lindau[2],[3]. En el caso de esta última, la incidencia del feocromocitoma es del 10 al 20% de los pacientes[4].
Lo más frecuente es que se presente entre la cuarta y quinta década de la vida, afectando por igual a hombres y mujeres[5]. Clínicamente puede manifestarse desde la tradicional triada de cefalea, sudoración e hipertensión hasta otros síntomas variados como visión borrosa, hipotensión, pérdida de peso, papiledema o poliuria[3].
El diagnóstico se realiza con la determinación de catecolaminas y metanefrinas en plasma y orina. El tratamiento de elección suele ser la resección quirúrgica (adrenalectomía) preferentemente por vía laparoscópica[5]. Como anestesiólogos debemos asegurarnos que un paciente con feocromocitoma tenga establecido un correcto bloqueo alfa-adrenérgico (y si fuera necesario también beta) antes de la cirugía.
El principal problema durante la cirugía del feocromocitoma es las crisis hipertensiva, sobre todo en momentos con mayor estímulo para el paciente como son la intubación orotraqueal y la manipulación del tumor. Por este motivo la preparación preoperatoria de los pacientes es fundamental.
-
Descripción del caso
Mujer de 54 años. Entre sus antecedentes médicos destacan hipertensión arterial, dislipemia, diabetes mellitus 2 y enfermedad de Von Hippel-Lindau. En relación con esta última ha presentado varias complicaciones que han requerido intervención quirúrgica, a destacar las siguientes: laminectomía por hemangioblastoma medular D2, nefrectomía derecha por neoplasia renal derecha, nefrectomía polar inferior izquierda por neoplasia renal izquierda, dos craniectomías con exéresis de hemangioblastomas cerebelosos y pancreatectomía corpo- rocaudal con esplenectomía por tumor y quistes pancreáticos múltiples. Desde hace siete meses porta una derivación ventrículo peritoneal por hipertensión intracraneal secundaria a la última cirugía craneal. Neurológicamente la paciente presenta inestabilidad de la marcha, una prueba de Romberg positivo, fuerza conservada en extremidades superiores y un balance muscular de 4/5 en extremidades inferiores. Su tratamiento previo al diagnóstico del feocromocitoma consiste en insulinas por la insuficiencia pancreática y lormetazepam.
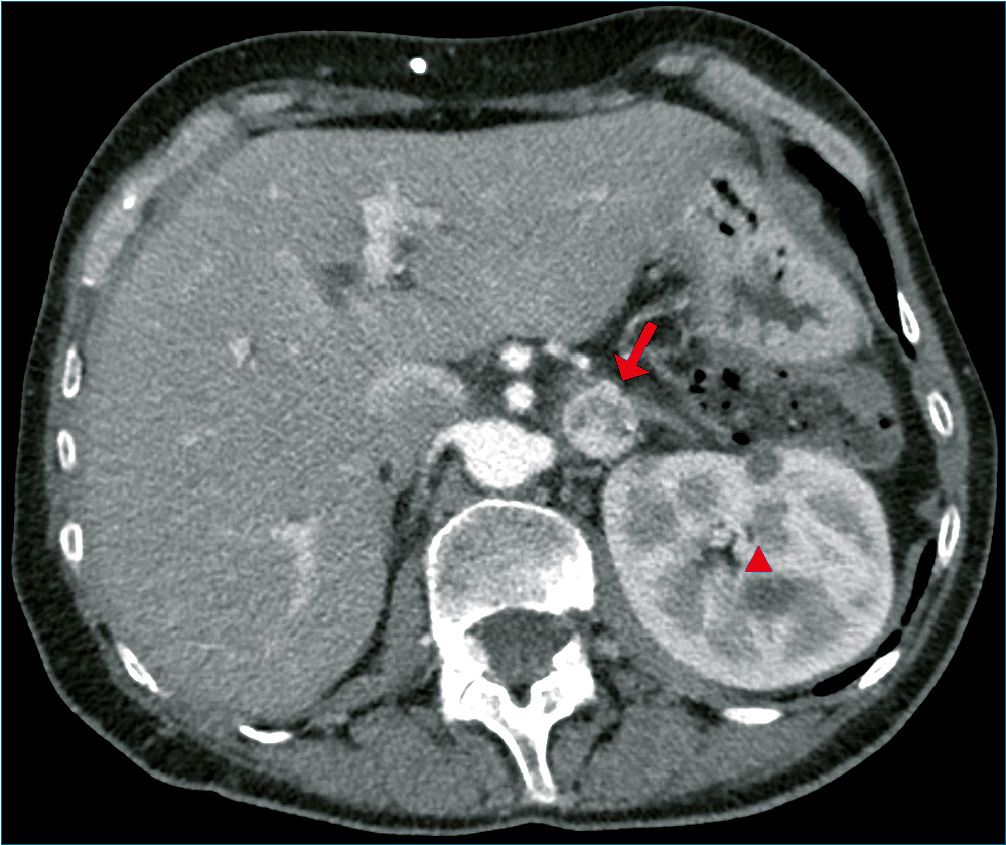
Figura 1. Imagen de tomografía axial computarizada de abdomen. Paciente monorrena. Riñón izquierdo de tamaño compensador con quistes simples dispersos (triángulo) y glándula suprarrenal izquierda con tumoración compatible con feocromocitoma (flecha).
En el seguimiento por TAC realizado por los cirujanos generales que intervinieron previamente el páncreas, se objetiva una tumoración en glándula suprarrenal izquierda (Figura 1).
Dada la asociación entre la enfermedad de Von Hippel-Lin- dau y el feocromocitoma, derivan a la paciente a endocrinología. En la anamnesis, paciente describe sudoración y pérdida de 6 kg de peso en los últimos 6 meses. Se realizan como pruebas complementarias metanefrinas en orina de 24 h y metanefrinas fraccionadas en plasma. Los resultados muestran unos valores de normetanefrina en orina de 24 h y en plasma superiores a tres veces el límite alto de la normalidad fijado por el laboratorio. La paciente es diagnosticada de un feocromocitoma productor de noradrenalina en la glándula suparrenal izquierda.
Por parte de urología se programa una suprarrenalectomía abierta. A pesar de que la literatura indica que la suprarrenalec- tomía debe hacerse de forma laparoscópica preferentemente, los cirujanos decidieron usar un abordaje abierto por el antecedente de varias cirugías abdominales previas. Por otro lado, la cirugía general precisaba hacer una revisión pancreática y tampoco veían técnicamente factible que fuese de manera laparos- cópica. El hecho de ser portadora de una válvula de derivación ventrículo peritoneal, no era una contraindicación absoluta de cirugía laparoscópica, pero los cirujanos no podían garantizar limitar la presión de insuflación máxima del neumoperitoneo y con los antecedentes descritos de la paciente. Un aumento de la presión intracraneal hubiese tenido consecuencias negativas.
-
Manejo preoperatorio
Dos semanas antes de la intervención se inicia tratamiento con fenoxibenzamina 10 mg al día, un alfabloqueante no selectivo de larga duración, consiguiendo tensiones de 140/80 mmHg. Tras 10 días de tratamiento alfabloqueante se añade un betabloqueante, atenolol 25 mg diarios, ya que presenta frecuencias cardiacas en torno a 100-120 por minuto. Ingresa 4 días antes de la cirugía programada y requiere aumento de la dosis de fenoxibenzamina hasta 10 mg cada 6 h por mal control tensional. No obstante, se consigue llegar a la cirugía con cifras que cumplen los criterios de Roizen (1983): tensión arterial < 160/90 mmHg 24 h antes de la intervención, hipotensión ortostática con PA > 80/45 mmHg y electrocardiograma sin cambios del ST-T sin extrasístoles. Se solicita un ecocardiograma transtorácico para evaluar la función ventricular y posibles alteraciones de la contractilidad. El informe muestra una hipertrofia concéntrica ligera de ventrículo izquierdo, con función sistólica normal (65%) y sin alteraciones segmentarias de contractilidad.
-
Manejo intraoperatorio
En la sala de preanestesia se canaliza una vía venosa periférica calibre 18G. Reevaluamos a la paciente y premedicamos con 1 miligramo de midazolam endovenoso. Además se coloca crema anestésica con lidocaína y prilocaína en ambos antebrazos.
Posteriormente, pasa al quirófano y se monitorizan los siguientes parámetros: presión arterial no invasiva, frecuencia cardíaca, electrocardiograma, saturación de oxígeno, índice biespectral, y relajación neuromuscular (TOF). Se administra otro miligramo de midazolam y 75 microgramos de fentani- lo endovenosos. Comprobamos que la crema anestésica en el miembro superior derecho ha sido efectiva. Se infiltran en la zona 150 mg de lidocaína subcutánea y se canaliza la arteria radial con la paciente despierta. Se monitorizan la presión arterial invasiva y se conecta el monitor Mostcare®.
Tras la preoxigenación, se administran propofol 2 mg/kg, rocuronio 1,2 mg/kg y se inicia perfusión continua de remifen- tanilo. Con el videolaringoscopio C-MAC® se realiza la intubación orotraqueal sin incidencias previa instilación de 100 mg de lidocaína en las cuerdas vocales. Con la paciente ya dormida se coloca un catéter venoso central de forma ecoguiada en la vena yugular interna izquierda, ya que en el lado derecho se encuentra la derivación ventrículo peritoneal. A continuación se realiza un bloqueo de la vaina de los rectos ecoguiado con 20 mililitros de levobupivacaína al 0,25% (10 mililitros por hemiabdomen) y se coloca un sondaje vesical con medición horaria.
La cirugía se realiza con la paciente en decúbito supino mediante incisión subcostal bilateral. El mantenimiento anestésico se realiza con sevoflurano, bolos de rocuronio en función de requerimientos indicados por TOF y remifentanilo en perfusión continua (necesidades entre 0,05 y 0,2 mcg/kg/min).
La inducción se produjo sin incidencias, manteniéndose una estabilidad hemodinámica que no precisó de medicación adicional. Las cifras de tensión arterial se mantuvieron en torno a 120/70 mmHg y la frecuencia cardíaca osciló entre 60 y 80 latidos por minuto durante toda la cirugía. Sin embargo, en el momento de la manipulación del tumor se produjo un pico hipertensivo de 182/101 mmHg sin aumento de la frecuencia cardíaca, que precisó el uso de nitroprusiato en perfusión continua durante 5 minutos hasta que la tensión se normalizó de nuevo. Tras la adrenalectomía la paciente presentó hipotensión (hasta 75/43 mmHg), por lo que se inicia noradrenalina en perfusión continua para mantener tensiones arteriales medias por encima de 75 mmHg. Se administran 5 mg de oxicodona, 1 g de paracetamol y 50 miligramos de dexketoprofeno 40 minutos antes de la educción como complemento al bloqueo de la vaina de los rectos realizado inicialmente. El ritmo de diuresis fue de 0,6 ml/kg/h. La fluidoterapia se hizo con cristaloides balanceados (Plasmalyte®) y guiada por objetivos según Mostcare®, administrando en total 15 ml/kg/h. El sangrado estimado fue de 300 ml. Realizamos una gasometría arterial intraoperatoria con intercambio gaseoso, glucemia, iones y lactato en rangos de normalidad. La hemoglobina post resección del feocromocito- ma fue 8,5 g/dL. La noradrenalina se pudo retirar en el momento de la extubación, que se produjo sin incidencias. Se traslada a la paciente a la unidad de reanimación hemodinámicamente estable sin vasoactivos, eupneica y sin referir dolor abdominal.
-
Manejo postoperatorio
La paciente permaneció durante 48 h en reanimación, he- modinámicamente estable y con glucemias controladas. Como complemento de la analgesia se utilizó una bomba de infusión continua de 30 mg de oxicodona a pasar en 48 h (0,013 mg/ kg/h), además de 1 g de paracetamol cada 8 h. Con esto el dolor fue durante todo el ingreso inferior a 4 puntos en la escala visual analógica (EVA) y no precisó analgesia de rescate adicional.
Tras los dos días en reanimación fue dada de alta a la planta de urología, donde permaneció otras 72 h y fue dada de alta a su domicilio sin ninguna complicación postoperatoria. Posteriormente, se realizó seguimiento ambulatorio en consultas externas por parte de urología y endocrinología.
-
Discusión
La optimización preoperatoria de los pacientes con feocro- mocitoma requiere más tiempo que la de otras cirugías rutina- rias[6]. Es clave controlar las cifras de tensión arterial antes de la intervención, ya sea con los fármacos descritos en nuestro caso u otros como los antagonistas del calcio o la metirosina. El bloqueo alfa y beta adrenérgico combinado es lo más utilizado habitualmente[6],[7]. Se inicia bloqueo alfa adrenérgico 10-14 días antes de la cirugía y en aquellos pacientes con taquicardia o arritmias añadiremos bloqueo beta adrenérgico. Nunca debe iniciarse el bloqueo beta antes que el alfa porque el bloqueo de los receptores beta adrenérgicos periféricos de inicio puede producir una mayor elevación de la tensión arterial[3],[7]. Además, es importante normalizar la volemia e incorporar una dieta rica en sodio para favorecer la expansión del compartimento intravascular[8]. Es posible que estos pacientes presenten daño cardiaco debido al exceso de catecolaminas, por lo que debemos realizar un electrocardiograma y un ecocardiograma transtorácico preoperatorios[9]. Se recomienda evaluar a los pacientes de 7 a 14 días antes de la cirugía por si fuera necesario modificar el tratamiento. Previo a esta evaluación el servicio de endocrinología ya habrá titulado la terapia dirigida a minimizar el efecto de las catecolaminas sobre el organismo[3].
El problema principal en la cirugía del feocromocitoma es, como ya hemos mencionado, la aparición de picos y crisis hiper- tensivas que puedan producir daño a nivel de varios órganos[6]. En el caso de nuestra paciente teníamos el riesgo añadido de la existencia de hemangioblastomas en el sistema nervioso central, que podrían causar ictus hemorrágicos con crisis hipertensivas[10]. Por ello fuimos cautelosos en prevenir todas aquellas situaciones que pudieran elevar la presión arterial: el estrés y ansiedad usando premedicación en preanestesia y a su llegada al quirófano, el dolor que produce la canalización de la arteria radial despierta con crema anestésica e infiltración de anestésico local; el estímulo de la intubación orotraqueal usando el videolaringoscopio y depositando lidocaína en las cuerdas vocales, etc. Además, evitamos todos aquellos fármacos endovenosos que pueden liberar histamina, como la morfina y elegimos el sevoflurano como gas de mantenimiento porque su potencial arritmogénico es menor que en el caso del desflurano[6].
A pesar de que la bibliografía recomienda el uso de catéter epidural en el abordaje quirúrgico del feocromocitoma[11], en nuestro caso se desestimó por ser la paciente portadora de una derivación ventrículo peritoneal. Aunque la derivación ventri- culoperitoneal no contraindica de forma absoluta la anestesia neuroaxial[12] preferimos utilizar otro plan analgésico. Por este motivo decidimos hacer un bloqueo regional antes del inicio de la cirugía que proporcionará una analgesia extra desde el inicio. En nuestro caso un bloqueo de la vaina de los rectos bilateral de forma ecoguiada, el cual cubre el territorio de la incisión realizada[13]. De forma ecoguiada es un bloqueo muy seguro y al utilizar levobupivacaína aseguramos un bloqueo de varias horas de duración. Otras opciones de analgesia hubiesen sido un bloqueo TAP subcostal o un bloqueo erector espinal bilateral.
En cuanto al manejo farmacológico de los cambios hemodinámicos, recomendamos seleccionar al menos una medicación para manejo de picos hipertensivos. En nuestro caso teníamos preparada una perfusión continua de nitroprusiato, vasodilatador de acción corta que fue muy eficaz cuando se manipuló el tumor. Aunque no fue nuestro caso, es frecuente que se presenten trastornos del ritmo como la taquicardia supraventricular. Para esta situación teníamos preparada una perfusión continua de esmolol. En ambas situaciones, hipertensión y/o taquicardia, se procura usar fármacos de vida media corta ya que suelen ser situaciones muy cambiantes, pudiendo pasar de forma brusca al otro extremo (hipotensión y/o bradicardia)[3],[6].
Aunque no fue nuestro caso, en aquellos pacientes con disfunción cardíaca está indicada la ecocardiografía transesofágica intraoperatoria[3].
Después de la suprarrenalectomía es habitual que se produzca una hipotensión mantenida por la disminución brusca de cate- colaminas del tumor. Además, el bloqueo alfa y beta instaurado en el preoperatorio, perdura en ese momento y potencia la hipotensión, así como la hipovolemia. Por este motivo es fundamental administrar líquidos intravenosos y utilizar, si es necesario, drogas vasoactivas (de elección la fenilefrina y la noradrenalina[14]).
Cabe destacar también la importancia del control de las glucemias durante toda la cirugía, así como en el postoperatorio, ya que las catecolaminas pueden inducir una resistencia a la insulina o la supresión de ésta[3].
La analgesia postoperatoria consistió en una bomba de infusión continua de oxicodona durante 48 h y paracetamol pautado cada 8 h que complementaron el bloqueo de la pared abdominal realizado en quirófano. Decidimos evitar los antiinflamatorios no esteroideos por tratarse de una paciente con una nefrectomía radical derecha más parcial izquierda con una insuficiencia renal crónica derivada de las intervenciones, dado que la función renal se iba a deteriorar aún más. El motivo por el que usamos oxicodona es que es más potente que la morfina para aliviar el dolor visceral sin producir mayor sedación[15].
Los pacientes intervenidos de feocromocitoma deben permanecer ingresados en una unidad de cuidados críticos durante 24-28 h, ya que algunas complicaciones como la hipotensión con inestabilidad hemodinámica, insuficiencia adrenal e hipoglucemia pueden tener gran repercusión y deben ser monitorizadas[9].
-
Conclusiones
Los pacientes con feocromocitoma requieren una serie de actuaciones especiales cuando van a ser intervenidos. Como anes- tesiólogos debemos comprobar la existencia o no de daños en órganos diana y valorar la necesidad de un bloqueo farmacológico.
En el intraoperatorio todas nuestras medidas deben ir encaminadas a causar el menor estímulo posible sobre el paciente para evitar una crisis hipertensiva. Cabe destacar la importancia de hacer un manejo multimodal de la analgesia.
El posoperatorio debe hacerse en una unidad de cuidados críticos y teniendo en cuenta principalmente complicaciones como inestabilidad hemodinámica o hipoglucemia.
La presente comunicación no ha recibido financiación alguna. Los autores declaran que no existe conflicto de intereses.
Referencias
1. Sbardella E, Grossman AB. Pheochromocytoma: an approach to diagnosis. Best Pract Res Clin Endocrinol Metab. 2020 Mar;34(2):101346. https://doi.org/10.1016/j.beem.2019.101346 PMID:31708376
2. Luis C, Arbonés E, Teixell C, Lorente L, Trillo L. Clevidipino como antihipertensivo en la cirugía de feocromocitoma. Rev Esp Anestesiol Reanim. 2018;65(4):225–8. https://doi.org/10.1016/j.redar.2017.07.001.
3. Akhtar S. Anesthesia for the adult with pheocromocytoma [Internet]. En Jones SB, editor. UpToDate. Waltham, UpToDate;2019 [Consultado el 1 de diciembre de 2019]. Disponible en: https://www-uptodate-com/contents/anesthesia-for-the-adult-with-pheochromocytoma.
4. Delgado MA, Ayala S. Feocromocitoma y paraganglioma [Internet]. Madrid: Fisterra; 2020 [Consultado el 10 de diciembre de 2019]. Disponible en: https://www.fisterra.com/guias-clinicas/feocromocitoma/#33997
5. Oleaga A, Goñi F. Feocromocitoma: actualización diagnóstica y terapéutica. Endocrinol Nutr. 2008;55(5):202–16. https://doi.org/10.1016/S1575-0922(08)70669-7 PMID:22967914
6. Naranjo J, Dodd S, Martin YN. Perioperative Management of Pheochromocytoma. J Cardiothorac Vasc Anesth. 2017 Aug;31(4):1427–39. https://doi.org/10.1053/j.jvca.2017.02.023 PMID:28392094
7. Ramakrishna H. Pheochromocytoma resection: current concepts in anesthetic management. J Anaesthesiol Clin Pharmacol. 2015 Jul-Sep;31(3):317–23. https://doi.org/10.4103/0970-9185.161665 PMID:26330708
8. Ramachandran R, Rewari V. Current perioperative management of pheochromocytomas. Indian J Urol. 2017 Jan-Mar;33(1):19–25. PMID:28197025
9. Azadeh N, Ramakrishna H, Bhatia NL, Charles JC, Mookadam F. Therapeutic goals in patients with pheochromocytoma: a guide to perioperative management. Ir J Med Sci. 2016 Feb;185(1):43–9. https://doi.org/10.1007/s11845-015-1383-5 PMID:26650752
10. Mizobuchi Y, Kageji T, Tadashi Y, Nagahiro S. Craniotomy for cerebellar hemangioblastoma excision in a patient with von Hippel-Lindau disease complicated by uncontrolled hypertension due to pheochromocytoma. Int J Surg Case Rep. 2015;17:96–9. https://doi.org/10.1016/j.ijscr.2015.10.037 PMID:26595895
11. Li N, Kong H, Li SL, Zhu SN, Wang DX. Combined epidural-general anesthesia was associated with lower risk of postoperative complications in patients undergoing open abdominal surgery for pheochromocytoma: A retrospective cohort study. PLoS One. 2018 Feb;13(2):e0192924. https://doi.org/10.1371/journal.pone.0192924 PMID:29466473
12. El-Refai NA. Anesthetic management for parturients with neurological disorders. Anesth Essays Res. 2013 May-Aug;7(2):147–54. https://doi.org/10.4103/0259-1162.118940 PMID:25885824
13. Bermúdez E. Bloqueos de la pared abdominal. Rev Chil Anest. 2011;40:230–7.
14. Peramunage D, Nikravan S. Anesthesia for Endocrine Emergencies. Anesthesiol Clin. 2020 Mar;38(1):149–63. https://doi.org/10.1016/j.anclin.2019.10.006 PMID:32008649
15. Lenz H, Sandvik L, Qvigstad E, Bjerkelund CE, Raeder J. A comparison of intravenous oxycodone and intravenous morphine in patient-controlled postoperative analgesia after laparoscopic hysterectomy. Anesth Analg. 2009 Oct;109(4):1279–83. https://doi.org/10.1213/ane.0b013e3181b0f0bb PMID:19762758

 ORCID
ORCID