Gonzalo Irizaga 1 ,*, Gonzalo Ángulo 2
Recibido: 21-10-2021
Aceptado: 10-12-2021
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 1 pp. 89-93|https://doi.org/10.25237/revchilanestv5129121453
PDF|ePub|RIS
Anesthetic management of the patient undergoing osteosarcoma resection surgery
Abstract
In Uruguay, after cardiovascular diseases, cáncer ranks second as a cause of death. According to official data from the Ministry of Public Health in 2017, 24.6% of deaths were due to this disease. In our specialty, there is great concern about the evolutionary consequences of neoplastic disease related to the surgical anesthetic act, conceptualized from the length of the perioperative period. We consider necessary the inclusion of protocols for neoplastic surgery that favor recovery and evolution in the short and long term. This implies establishing anesthesiological strategies aimed at preserving immunity, by reducing psychological and surgical stress, adequate pharmacological selection, management of the internal environment and analgesia. For these reasons, it is important to establish the implementation of perioperative plans that reduce psychosomatic aggression, which in addition to medical stability, provide quality analgesia, with postoperative well-being that allow rest and recovery. Great advances have been made in tumor resection surgical techniques such as neoadjuvant and adjuvant polychemotherapy techniques, however, tumor recurrence rates have not been reduced as would be desired. Beyond the natural malignancy of the underlying pathology, it is inferred that surgical stress with a long and torpid perioperative period favors tumor recurrence. Hence our special interest in these communications related to patients in the search for solutions that improve their vital prognosis. Based on current evidence, it can be affirmed that the decrease in opiate consumption, especially the decrease in the need for Morphine, may favor better prognoses; maintaining the antimetastatic immune response in a period of special protumoral susceptibility such as the perioperative period. We therefore propose the use of analgesic / anesthetic techniques supported on the basis of regional anesthetic blocks prior to surgical aggression, complemented with the administration of Propofol, NSAIDs and p-blockers during the intraoperative period, through the presentation of 2 clinical cases of patients with osteosarcoma of knee.
Resumen
En Uruguay, luego de las enfermedades cardiovasculares, el cáncer ocupa el segundo lugar como causa de muerte. Según datos oficiales del Ministerio de Salud Pública en el año 2017, el 24,6% de los fallecimientos fue por esta enfermedad. En nuestra especialidad, existe una gran preocupación por las consecuencias evolutivas de la enfermedad neoplásica relacionadas al acto anestésico quirurgico, conceptuado desde la amplitud del período perioperatorio. Consideramos necesaria la inclusión de protocolos para la cirugía neoplásica que favorezcan la recuperación y evolución tanto a corto como a largo plazo. Ello implica establecer estrategias anestésiologicas orientadas a conservar la inmunidad, mediante la disminución del estrés tanto psicológico como quirúrgico, la adecuada selección farmacológica, el manejo del medio interno y de la analgesia. Por estos motivos, es importante establecer la implementación de planes perioperatorios que dismimuyan la agresión psicosomática que, además de la estabilidad médica, aporten analgesia de calidad, con bienestar posoperatorio que permitan el descanso y la recuperación. Se han logrado grandes avances en las técnicas quirúrgicas de resección tumoral como en las técnicas de poliquimioterapia neoadyuvante y adyuvante, sin embargo, las tasas de recurrencia tumoral no se han reducido como se desearía. Más allá de la natural malignidad de la patología de base, se infiere que el estrés quirúrgico con un perioperatorio sufrido y tórpido favorece la recurrencia tumoral. De ahí nuestro especial interés de estas comunicaciones relativas a los pacientes en la búsqueda de soluciones que mejoren su pronóstico vital. En base a evidencia actual, se puede afirmar que la disminución del consumo de opiáceos, especialmente la disminución de la necesidad de morfina, puede resultar favorecedor en mejores pronósticos; manteniendo la respuesta inmune antimetastásica en un período de especial susceptibilidad protumoral como es el perioperatorio. Proponemos entonces la utilización de técnicas analgésicas/anestésicas soportadas en base a bloqueos anestésicos regionales previos a la agresión quirúrgica, complementados con la administración de Propofol, AINES y p bloqueantes durante el intraoperatorio, a través de la presentación de 2 casos clínicos de pacientes con osteosarcoma de rodilla.
Paciente de 19 años, femenino. Asmática en tratamiento con salbutamol a demanda, su última crisis fue hace 6 meses. Peso de 47 kg y altura de 1,61 m (IMC 18). Buena apertura bucal, Test de Mallampati I, dentición completa, flexoextension y distancias conservadas. Ritmo cardíaco regular de 67 cpm sin soplos. Eupneica, MAV presente bilateral sin estertores.
Paraclínica sin alteraciones.
Se realiza en block quirúrgico monitorización estándar de la American Society of Anesthesiologists (ASA)[1], y se coloca monitor “NINDEX” (de: Narcosis INDEX. CONTROLES S.A, Dr. D. Cibils)[2] para valorar la profundidad anestésica con valores objetivo entre 60-70. Se monitoriza temperatura nasofaríngea y se realiza calentamiento con calefactor de aire caliente forzado teniendo como objetivo la normotermia.
Reperado bajo ecografía, en interespacio L2-L3 se coloca catéter peridural (CPD). Se realiza inducción con fentanilo, propofol y atracurio. Intubación orotraqueal (IOT) con tubo endo- traqueal número 7,5. Cormack – Lehane I.
Se continúa con anestesia combinada:
1. Anestesia total intravenosa (TIVA); Remifentanilo 0,15 – 0,2 pg/kg/min + propofol 4-5 mg/kg/h.
2. Infusión de lidocaína 1 mg/kg/h por catéter peridural.
Se completa analgesia con dipirona 2 g intravenosa (iv) y ketoprofeno 100 mg iv. Se realiza profilaxis antiemética con Dexametasona 4 mg iv post inducción anestésica y ondansetrón 4 mg iv aproximadamente 30 minutos antes de finalizada la cirugía. Procedimiento quirúrgico sin incidentes. Hemodinamia estable durante toda la cirugía, sin complicaciones.
Paciente de 11 años, masculino, que excluyendo su patología neoplásica es sano. Peso de 40 kg y altura de 1,58 m (IMC 16). Buena apertura bucal, Mallampati I, dentición completa, flexoextension y distancias conservadas. Ritmo cardíaco regular de 88 cpm sin soplos. Eupneico, con MAV presente bilateral sin estertores.
De la paraclinica consignamos hemoglobina de 10,8 g/dl.
Resto de la paraclínica sin alteraciones.
En block quirúrgico se realiza monitorización estándar de la ASA[1], y se coloca monitor NINDEX[2] para valorar la profundidad anestésica con valores objetivo entre 60-70. Se monitoriza
temperatura nasofaríngea teniendo como objetivo la normotermia.
Se coloca catéter peridural en espacio L2-L3, reperado bajo ecografía. Se realiza inducción con fentanilo, propofol y atracu- rio. IOT con tubo endotraqueal número 6. Cormack – Lehane I.
Se conduce Anestesia combinada:
1. TIVA; Remifentanilo 0,2 – 0,3 pg/kg/min + propofol 4-5 mg/ kg/h.
2. Infusión de lidocaína 1 mg/kg/h por catéter peridural.
Se completa analgesia con dipirona 1 g iv y ketoprofeno 50 mg iv. Se realiza profilaxis antiemética con dexametasona 4 mg post inducción anestésica y ondansetrón 4 mg aproximadamente 30 minutos antes de finalizada la cirugía. Procedimiento quirúrgico sin incidentes. Hemodinamia estable, sin complicaciones.
La Organización Mundial de la Salud (OMS), así como la Organización Panamericana de Salud (OPS) en su revisión de 2017; refieren que en el año 2015 el cáncer ocasionó 8,8 millones de muertes a nivel mundial. Se destacan como los cánceres con mayor mortalidad; el cáncer de pulmón, el hepatocarcinoma, el cáncer colorrectal, el cáncer gástrico y el cáncer de mama[3]. Según la OPS, en latinoamerica el cáncer es la segunda causa de muerte. Se estima que 2,8 millones de personas son diagnosticadas cada año y 1,3 millones de personas mueren por esta enfermedad anualmente[4]. En Uruguay, luego de las enfermedades cardiovasculares, el cáncer ocupa el segundo lugar como causa de muerte. Según datos oficiales del Ministerio de Salud Pública, en el año 2017 el 24,6% de los fallecimientos fue por esta enfermedad[5].
La resección quirúrgica es el principal tratamiento de los tumores malignos y, en muchos casos, el único tratamiento potencialmente curativo. A pesar del constante desarrollo de nuevas técnicas quirúrgicas y de tratamientos quimioterápicos como radioterápicos, la incidencia de recurrencias tumorales ha variado muy poco. Esto hace pensar en otros factores importantes en la recurrencia, algunos de ellos vinculados al procedimiento quirúrgico, que podrían tener un papel fundamental en la progresión del cáncer y la aparición de metástasis. Está demostrado que el estrés psicológico-quirúrgico, así como el inadecuado manejo del dolor, la hipotermia y las transfusiones de hemoderivados, se relacionan con peores resultados oncológicos a largo plazo[6].
Los fármacos anestésicos pueden inducir cambios en la fisiopatología celular tales como la proliferación, la angiogénesis y la apoptosis celular, que pueden ser determinantes en la progresión de la enfermedad oncológica. Es por esto que interesa identificar los principales factores perioperatorios que juegan un rol en la recurrencia tumoral postquirurgica; así como evaluar los fármacos que pueden resultar beneficiosos o no en el periodo perioperatorio[6],[12].
Los dos casos clínicos que presentaremos se refieren a pacientes con osteosarcoma. Se define osteosarcoma según la OMS como un tumor maligno caracterizado por la formación de hueso o de sustancia osteoide por células tumorales. Después del mieloma, el osteosarcoma es el tumor óseo primario más frecuente. Representa alrededor del 20% de los tumores malignos y cerca del doble de casos que el sarcoma de Edwin y condrosarcoma. Su presentación clínica es variable dependiendo del tipo, la ubicación y la edad del paciente[7].
Generalmente, afecta más a los hombres con edades entre 10 y 25 años, con un pico mayor en la segunda década de vida. Es muy infrecuente en edades por debajo de los 5 años. Existe un segundo pico de incidencia en adultos mayores de 35 años; casi siempre relacionados a procesos previos como: enfermedad de Paget, displasia fibrosa o irradiación[8].
Esta neoplasia maligna se caracteriza por formar hueso o directamente sustancia osteoide y abarca una gran variedad de lesiones que difieren en su presentación clínica, radiológica, aspecto microscópico y evolución.
Según su localización en el hueso, pueden distinguirse 3 grupos: los osteosarcomas superficiales, los osteosarcomas intracorticales y los osteosarcomas intramedulares o centrales; siendo estos últimos los más frecuentes. Entre los tumores intramedulares, pueden individualizarse diversos tipos de alto grado de malignidad: la forma denominada clásica o convencional, el osteosarcoma teleangiectasico y la variante de células pequeñas[9]. Si bien el osteosarcoma puede afectar cualquier hueso; se localiza preferentemente en las metáfisis de los huesos largos. Asienta principalmente en la rodilla; extremo distal del fémur (40%), extremo proximal de la tibia (15%) o extremo superior del fémur o del húmero (14%), áreas que correspond den a los segmentos óseos de mayor crecimiento del esqueleto[9].
Al momento del diagnóstico, del 15%-20% presentan metástasis, de las cuales 90% son pulmonares. Esto determina una importante caída en la sobrevida de los pacientes, pudiendo llegar de 20%-25% a los 5 años. El tratamiento se basa clásicamente en poliquimioterapia neoadyuvante, cirugía, poliquimoterapia adyuvante y eventualmente radioterapia. La supervivencia ha mejorado gracias a la poliquimioterapia basada en diferentes fármacos e incluso la reducción tumoral inducida por la poliquimioterapia hace posible la preservación de miembro con técnicas de cirugía conservadora, en ocasiones complejas, que garantizan una resección satisfactoria desde el punto de vista oncológico. Cuando los márgenes quirúrgicos logrados no son satisfactorios, podría plantearse la radioterapia[10].
La técnica quirúrgica consiste en realizar una resección amplia del tumor y de la pieza osea (Figura 1).
En el tejido óseo de la pieza removida va a ser esterilizada por inmersión en nitrógeno líquido por lo que previamente se le realizarán perforaciones para evitar fracturas al ser congelado (Figura 2).
La esterilización de la pieza osea se realiza mediante inmersión en NL a -196 grados Celsius por 20 minutos, después se expone por 15 minutos a temperatura ambiente y luego 10 minutos en agua destilada con el objetivo de ser calentada progresivamente. Una vez culminado este ciclo la pieza así esterilizada es reimplantada y fijada mediante prótesis no convencional tumoral asociada a osteosíntesis del injerto (Figuras 3 y 4).
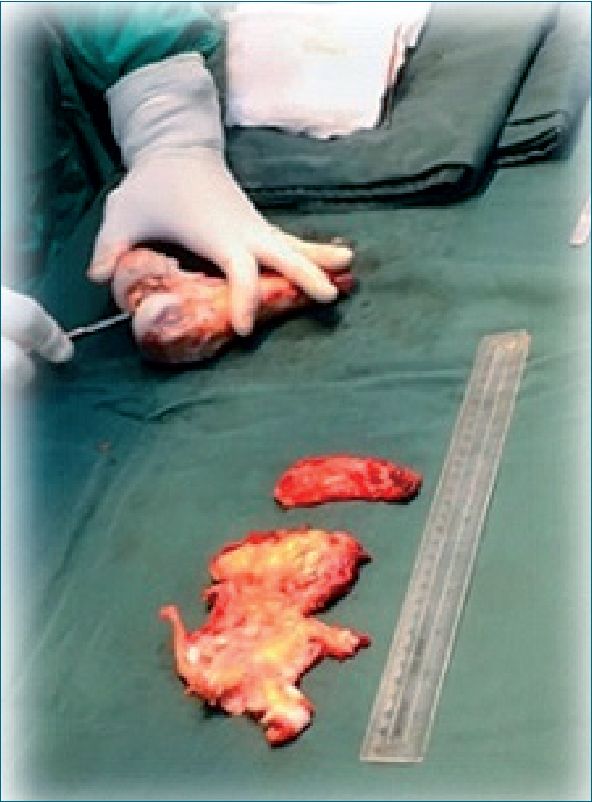
Figura 1. Remoción de tejidos blandos.
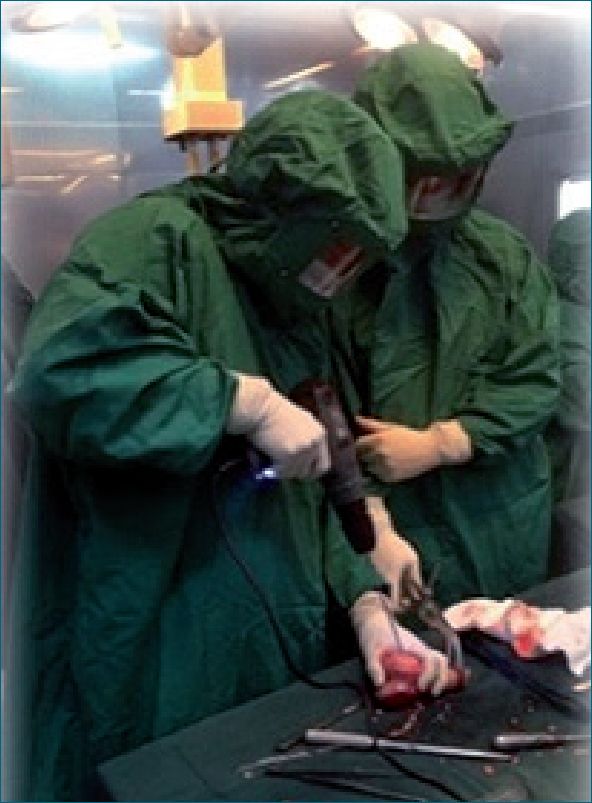
Figura 2. Perforación ósea.

Figura 3. Esterilización mediante inmersión en NL.
-
Técnica anestésica
En base a la evidencia actual revisada en la bibliografía, se planteó una estrategia anestésica que consideramos brinda los mayores beneficios (Figuras 5 y 6).

Figura 4. Reimplantado y fijación mediante prótesis no convencional.
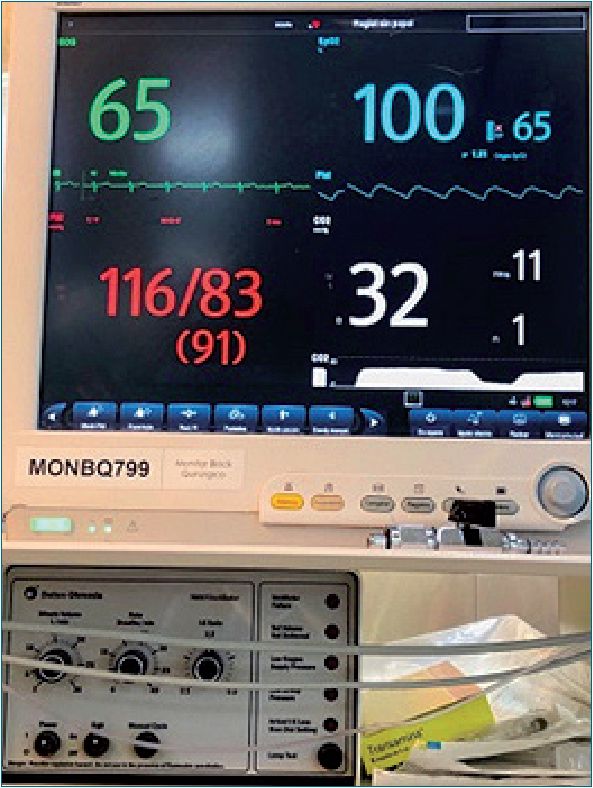
Figura 5. Monitorización estándar ASA.
Figura 6. Monitorización de la profundidad anestésica (NINDEX).
La misma fue una anestesia combinada regional peridural contínua y total intravenous anesthesia (TIVA), Target controlled infusión, effect concetration (TCIce) de Propofol y Remifentanilo. Se complementa con infusión continua de lidocaína al 1%, 1 mg/kg/h por el catéter peridural.
Se realizó además como coadyuvancia analgésica ketoprofeno y dipirona iv.
Se indica un plan de analgesia postoperatoria multimodal consistente en infusión continua por el CPD de bupivacaína al 0,1 % 5 ml/h, sumado a ketoprofeno 100 mg iv c/hs, paracetamol 1g vía oral (vo) c/8 h y dipirona 1g iv c/ 8 h.
Mediante esta técnica anestésica y los distintos fármacos seleccionados se logran múltiples objetivos en vistas a la mejor evolución perioperatoria.
La utilización de propofol en sitio efecto a dosis entre 2-5 pg/ml determina la apoptosis de células tumorales que se pudieran desprender del tumor y que alcancen el torrente sanguíneo. Esto fue demostrado por Zhang Ye y col.[11] en el año 2014.
Se propone que este fármaco no deprime el sistema inmunitario, además de favorecer la citotoxicidad de las células natural killer (NK) y de reducir la motilidad e invasividad de las células tumorales. Por otra parte, inhibe la ciclooxigenasa de tipo 2 (COX-2) y no promueve la síntesis de factores inducibles por hipoxia (HIF), teniendo por ende un favorecedor efecto antiangiogénico[11].
Se ha propuesto también que la inhibición de la COX-2, y de la prostaglandina E2 (PGE2), podría resultar en una mejora de la respuesta antitumoral del sistema inmune, siendo que las prostaglandinas se encuentran en la base de la formación de nuevos vasos sanguíneos[12].
El antagonismo p adrenérgico del Propofol pudiera estar involucrado en su protección antitumoral, siendo que muchas células tumorales presentan receptores p adrenérgicos. Esto le confiere un bloqueo parcial del eje hipotálamo hipofisario adrenal (HPA) con la consiguiente respuesta inmunoprotectora[11].
Incluida en una técnica regional que nos haga lograr mantener un adecuado bloqueo analgésico; que permita entre otras cosas reducir las dosis de opiáceos mayores intravenosos como la morfina, así como también por los propios beneficios que presentan los anestésicos locales per se; la utilización de Lidocaína en el intra y posoperatorio presenta múltiples implicancias beneficiosas en la disminución de la recurrencia tumoral de los pacientes oncológicos que se someten a cirugía[12].
En primer lugar permiten reducir significativamente las concentraciones plasmáticas de cortisol y catecolaminas secundarias a la disminución de las respuestas encocrinometabolicas desencadenadas por la destrucción tisular relacionada con la cirugía[13].
En segundo lugar actúan directamente aumentando la actividad de las células NK y los linfocitos T citotóxicos; células directamente responsables de mantener la indemnidad de la inmunidad celular.
Estudios recientes se han centrado en las propiedades an- titumorales de anestésicos locales; Wang y col.[13], en un estudio publicado en el año 2015, investigaron la influencia de los anestésicos locales en el cáncer de pulmón a células no pequeñas; encontrando que la Lidocaína y la Ropivacaína pueden inhibir el crecimiento, la invasión y la migración de las células cancerígenas, así como inducir su apoptosis.
Las propiedades antitumorales de los anestésicos locales ofrecen una potencial oportunidad de aplicación clínica y por estos importantes motivos han sido incluidos en el plan anestésico quirúrgico.
El hiper funcionamiento de la COX-2 secundario a su sobreproducción en algunos tipos de tumores y a la destrucción tisular propia de la cirugía, da como resultado una mayor síntesis de PGE2 que inhibe la actividad de las células NK, aumenta la angiogénesis y disminuye la apoptosis celular, favoreciendo la progresión tumoral. El uso de AINES COX-2 reduce la síntesis de PGE2, con sus efectos positivos sobre la inmunidad[14].
Múltiples estudios clínicos sugieren que tanto la anestesia como la cirugía inducen inmunosupresión que puede promover la recurrencia tumoral mediante crecimiento locoregional y diseminación a distancia. Circunstancia no deseable que reduce la supervivencia de nuestros pacientes y determina su pronóstico.
De acuerdo a la evidencia actual, el plan anestésico debe incluir acciones inmunoprotectoras que abarquen cabalmente todo el perioperatorio. Entre ellas destacamos: minimizar la respuesta al estrés fisiológico y psicológico, mediante estabilidad médica y una adecuada analgesia pre, intra y posoperatoria.
Proponemos técnicas anestésicas combinadas con la utilización de anestesia y analgesia regional prefiriéndolas a aquellas que se sustentan en la utilización de opioides y agentes halogenados, pues está demostrado que las situaciones que determinen mayor activación del sistema nervioso simpático (SNS), del eje hipotálamo hipofisario adrenal (HPA) y promoviendo un estado pro inflamatorio, generarán alteración negativa de la inmunidad con la consiguiente mayor tasa de recurrencia tumoral.
En estas cirugías prolongadas, con bloqueos simpáticos distales por la anestesia regional, es de vital importancia mantener la normotermia, así como también prevenir la anemia y priorizar técnicas de ahorro de sangre. La circunstancia del bloqueo simpatico por la infusión peridural de lidocaina, permite disminuir la presión arterial intraquirúrgica, estableciendo “per se” un menor sangrado y un mejor campo quirúrgico de disección. Una técnica anestésico-quirúrgica que minimice la lesión tisu- lar, reduzca el sangrado y disminuya el riesgo de transfusión sanguínea será beneficioso en vistas a disminuir la progresión tumoral.
En cuanto a lo farmacológico, por más que la evidencia sobre la influencia de los fármacos anestésicos en la progresión tumoral es acotada, se puede afirmar en base a estudios experimentales y clínicos recientes, que la utilización de técnicas
anestésicas/analgésicas que disminuyan el consumo perioperatorio de opiaceos como la Morfina, resultan favorecedoras para proteger la respuesta inmune antimetastásica en este período quirúrgico de especial susceptibilidad protumoral.
Agradecimientos: Al equipo quirúrgico integrado por los Drs. Nicolás Casales, Claudio Silveri y Pablo Stoppiello quienes ayudaron a realizar la descripción de la técnica quirúrgica. Al Dr. Alejandro Corujo quien llevo a cabo la revisión de este reporte de casos.
Referencias
1. Monitorización estándar de la American Society of Anesthesiologists. https://www.asahq.org/standards-and-guidelines/standards-for-basic-anesthetic-monitoring
2. “NINDEX” (de: Narcosis INDEX. CONTROLES S.A, Dr. D. Cibils).
3. Centro Nacional de Información de Ciencias Médicas. Biblioteca Médica Nacional. Tumores malignos. Tratamiento. Bibliomed [Internet]. 2017 May
4. Organización Mundial de la Salud. Cáncer [Internet]. Fecha de consulta: Enero 20, 2018.
5. Registro Nacional de Cáncer COMISION HONORARIA DE LUCHA CONTRA EL CANCER. Mayo 2020. SITUACION EPIDEMIOLOGICA DEL URUGUAY EN RELACION AL CANCER.
6. H.D. Orozco. Diseminación tumoral perioperatoria. Influencia de los factores Perioperatorios. Mayo 2011. Servicio de Anestesia y Reanimación, Hospital General Universitario Gregorio Marañón, Madrid, España.
7. Davies, A. M., & Petterson, H. (2002). The WHO manual of diagnostic imaging.
8. Fox MG, Trotta BM. Osteosarcoma: review of the various types with emphasis on recent advancements in imaging. Semin Musculoskelet Radiol. 2013 Apr;17(2):123–36. https://doi.org/10.1055/s-0033-1342969 PMID:23673544
9. Guinebretière JM. Osteosarcoma clásico. Encyclopédie Medico – Chirurgicale – 14- 165. Elseviere; 2001.
10. Carlos Ruiz Badilla. Osteosarcoma. REVISTA MEDICA DE COSTA RICA Y CENTROAMERICA. 2014;LXXI(611):383–7.
11. Ye Z, Li J, et al. Propofol Inhibits Proliferation and Invasion of Osteosarcoma Cells by Regulation of MicroRNA-143 Expression. Wuhan, Hubei, China: Hospital of PLA; 2014. https://doi.org/10.3727/096504014X13890370410203.
12. G. Sánchez-Pedrosa. Diseminación tumoral perioperatoria. 2. Efectos de la anestesia y analgesia. Mayo 2011. Servicio de Anestesia y Reanimación, Hospital General Universitario Gregorio Marañón, Madrid, España.
13. Wang HW, Wang LY, Jiang L, Tian SM, Zhong TD, Fang XM. Amide-linked local anesthetics induce apoptosis in human non-small cell lung cancer. J Thorac Dis. 2016 Oct;8(10):2748–57. https://doi.org/10.21037/jtd.2016.09.66 PMID:27867550
14. Fujino H, Toyomura K, Chen XB, Regan JW, Murayama T. Prostaglandin E₂ regulates cellular migration via induction of vascular endothelial growth factor receptor-1 in HCA-7 human colon cancer cells. Biochem Pharmacol. 2011 Feb;81(3):379–87. https://doi.org/10.1016/j.bcp.2010.11.001 PMID:21070749

 ORCID
ORCID