Arian J. Cuba-Naranjo MD.1,2,3, Ariel Sosa-Remón MD.4,*, Ana E. Jeréz-Alvarez MD.1,3,5
Recibido: 15-07-2022
Aceptado: 25-08-2022
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 1 pp. 89-94|https://doi.org/10.25237/revchilanestv5209111522
PDF|ePub|RIS
Mechanical power, a variable related to ventilation-induced lung injury and mortality
Abstract
Mechanical power is a variable of interest in lung protection, involving the amount of energy dissipated in the lung parenchyma in each respiratory cycle by means of calculations derived from the respiratory motion equation. The studies consulted associate mechanical power to mortality in patients with acute respiratory distress syndrome. It allows identifying the risk of ventilator-induced damage and pulmonary complications and can be safely used as a marker of improvement in the objectives and goals in artificial mechanical ventilation.
Resumen
El poder mecánico es una variable de interés en la protección pulmonar, involucra la cantidad de energía que se disipa en el parénquima pulmonar en cada ciclo respiratorio por medio de cálculos derivados de la ecuación del movimiento respiratorio. Los estudios consultados asocian el poder mecánico a la mortalidad en pacientes con síndrome de dificultad respiratoria aguda. Permite identificar el riesgo de daño inducido por la ventilación, complicaciones pulmonares y puede ser usado con seguridad como un marcador de mejoría en los objetivos y metas en ventilación mecánica artificial.
-
Introducción
Durante la infección por el virus SARS CoV-2 algunos pacientes en su presentación clínica más grave desarrollan síndrome de dificultad respiratoria aguda (SDRA), lo cual representa el estado más crítico de la enfermedad y requiere el aporte de ventilación mecánica artificial (VMA) de preferencia invasiva[1],[2].
La VMA se ha consolidado como una herramienta imprescindible en el manejo de la falla respiratoria; sin embargo, se han reconocido diferentes complicaciones asociadas como: riesgo de infecciones, atrofia diafragmática, neuromiopatía e incluso daño pulmonar directo secundario coloquialmente llamada lesión pulmonar inducida por el ventilador (LPIV) ésta última relacionada a insuficiencia multiorgánica y elevada mortalidad[3],[4],[5],[6].
Resulta práctico entonces beneficiarse de una variable que combine todos los posibles factores asociados con la LPIV y la mortalidad, que pudiera evaluarse fácilmente junto a la cama del enfermo. En este sentido, un concepto atractivo resulta el uso del poder mecánico (PM) para configurar un ventilador artificial, ya que combina los efectos antes puntualizados y describe la energía entregada al sistema respiratorio y al pulmón a lo largo del tiempo. Cambiar solamente un parámetro no siempre protege los pulmones, si no resulta en un cambio en el cantidad de energía realmente entregada al tejido pulmonar[7],[8].
Ante la necesidad de establecer estrategias de protección pulmonar que mejoren la sobrevida en pacientes ventilados con patologías pulmonares graves como el SDRA, se realiza esta revisión narrativa. Tiene el objetivo de actualizar contenidos referentes al uso del PM en el SDRA y su utilidad como predictor de protección pulmonar y mortalidad.
-
Desarrollo
La necesidad de tratar a un paciente con los beneficios que le confiere la VMA implica conocer los efectos adversos a los que se le expone desde el inicio de este soporte[9].
La VMA ha sido reconocida como causa de daño pulmonar desde su introducción, aunque el término LPIV se introdujo en 1993. Referido como la presencia de daño pulmonar durante la VMA cuando no se determina un vínculo causal, puede ocurrir en pulmones no enfermos, pero tiene una relevancia particular en el SDRA[4],[10].
La LPIV es el resultado de la interrupción en la mecánica de la barrera hemato-gaseosa, donde la presión transpulmonar (Ptp) aumenta el volumen alveolar más allá del límite de seguridad proporcionado por las fibras de colágeno inextensibles. El ascenso resultante de la permeabilidad, el edema y la liberación de mediadores inflamatorios alteran aún más la mecánica pulmonar, agravando la interacción adversa entre el equipo y el pulmón[11].
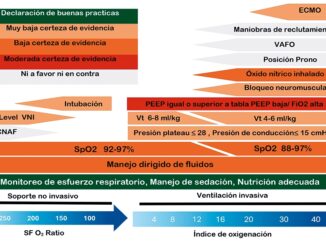
La multiplicidad de los factores responsables de la injuria pulmonar que es llevado a VMA obliga a establecer metas específicas durante el soporte respiratorio. Es recomendado entonces, la vigilancia de variables como la presión meseta (Pm), el nivel de presión positiva al final de la espiración (PEEP) óptimo, presión de distensión alveolar (PDA) y el PM, como variable de gran importancia en la actualidad[12].
En el tratamiento del SDRA, se ha abogado el uso de estrategias de protección pulmonar, de modo que se evite la LPIV.
Estas estrategias están destinadas a reducir las complicaciones ventilatorias, el objetivo es mantener pulmones con distensibilidad baja, basados en los siguientes parámetros: presión plateau (Pplt) < 35 cmH2O (idealmente < 30 cmH2O), presión de distensión alveolar (PDA) < 15 cmH2O y volumen tidálico (Vt) < 6 ml/ kg[13],[14].
Otros factores que pueden intervenir en la protección pulmonar, además de las características anatómicas y fisiopatológicas del enfermo, son la frecuencia respiratoria (FR), la magnitud del flujo (Flw) suministrado, el grado de deformación de las fibras pulmonares (strain), el elongamiento excesivo del tejido funcional (estrés) y la tensión a la que se somete el mis- mo[15],[16].
-
Lesión pulmonar inducida por el ventilador
Desde el momento en que se entendió que la LPIV podría empeorar por decisiones imprudentes en relación con la VMA, se han investigado los mecanismos y los parámetros clínicos relacionados. La LPIV no es más que el excesivo estrés y strain regional/global aplicado al “Baby lung” (Tabla 1).
-
Lesión pulmonar inducida por el paciente
Recientemente se ha propuesto el concepto de lesión pulmonar auto-infligida (LPAI-P) para describir aquellas condiciones en las que el mantenimiento de la respiración espontánea en pacientes con pulmones dañados y un estímulo respiratorio elevado provoca cambios en la presión/volumen global y regional. La LPAI-P se genera por un esfuerzo inspiratorio intenso que produce:[20],[21].
- Oscilaciones en la Ptp con insuflación de grandes volúmenes en un compartimento notablemente reducido por la enfermedad.
- Desviación profundamente negativa en la presión pleural (Ppl) producida por el aumento de la presión trans-mural de los vasos y la permeabilidad vascular lo que favorece el edema pulmonar de presión negativa.
- La contracción del diafragma genera heterogeneidad en la Plp local, lo que origina un desplazamiento de un Vt entre regiones pulmonares no dependientes a dependientes.
- Alto esfuerzo inspiratorio, debido al desarrollo de fuerzas mecánicas excesivamente elevadas dentro del músculo (daño diafragmático). Se caracteriza por la ruptura sarcolemal, desorden sarcomérico e inflamación, lo que en último lugar produce debilidad del diafragma y afecta negativamente el resultado clínico a corto y a largo plazo.
Evolucionando el concepto de ventilación protectora, Gatti- noni y su grupo argumentan que el LPIV no es más que el exceso de PM, aplicada sobre una superficie pulmonar heterogénea. Término acuñado como Ergotrauma[22],[23].
Tabla 1. Mecanismos de LPIV[17],[18],[19]
| Volutrauma Lesión pulmonar por sobre distensión alveolar, ocasionada por volumen tidal excesivo |
| Barotrauma Lesión pulmonar causada por una alta presión transpulmonar que fragmentan las estructuras alveolares |
| Atelectrauma Lesión pulmonar ocasionada por la apertura y cierre cíclico de unidades alveolares |
| Biotrauma Lesión pulmonar ocasionada por mediadores inflamatorios, que además de lesión local pueden ocasionar inflación sistémica
y falla orgánica múltiple |
-
Fisiopatología de la transferencia de energía
La energía utilizada para movilizar los pulmones desde su posición de reposo, capacidad residual funcional (CRF) a un punto dado de la curva de presión/volumen (P/V) puede ser proporcionada por contracciones musculares que generan presión muscular, como se observa durante la respiración espontánea o artificialmente. El ventilador mecánico puede reemplazar parcial o completamente el esfuerzo realizado por los músculos respiratorios, pero con el costo del aumento de las Paw. Se deben superar las fuerzas elásticas y resistivas del sistema respiratorio para generar movimiento (fracción de energía cinética), mientras que el componente estático (energía potencial) se refleja en el nivel de la PEEP, que de hecho representa la tensión de base de las vías aéreas[24].
-
Poder mecánico
El considerar todos los parámetros ventilatorios relacionados con la LPIV es de suma importancia; aunque han sido investigados por separado, son componentes de una sola variable denominada: PM, representa la energía mecánica multiplicada por la frecuencia respiratoria (FR). La cantidad de energía transferida desde el ventilador al paciente se mide en julios (J), mientras que el PM se define como la cantidad de energía transferida por unidad de tiempo (J/min)[25].
En 2016, Gattinoni et al[22] publicaron una nueva visión acerca de las causas de LPIV y las unificaron en una sola variable, el PM. Según este enfoque, cada componente de la VMA, previamente conocido como agente etiológico de LPIV (Vt, PDA, FR y Flw) más PEEP (considerado principalmente protector), contribuye con diferente magnitud al PM entregado por el ventilador al sistema respiratorio.
-
¿Cómo calcular el PM?
Se puede calcular como una medida directa del área inspiratoria dinámica del circuito de presión y volumen de las vías respiratorias durante el ciclo respiratorio (método geométrico) o mediante el uso de ecuaciones de potencia (método algebraico). Una de las primeras ecuaciones propuestas requiere el conocimiento de varias variables como el Vt, la resistencia en la vía aérea (Rva), la FR y la elastancia. Para facilitar el cálculo, se han propuesto ecuaciones simplificadas, que requieren menos variables, útil en la práctica clínica, su uso ha sido generalizado como herramienta para reducir la LPIV y promover la protección pulmonar[22],[26].
Para la ventilación controlada por volumen (VCV), la ecuación de referencia es la propuesta por Gattinoni et al[22], aunque algunas de sus variables, como la Rva y la elastancia del sistema respiratorio, no son fácilmente medibles en la práctica clínica (Ecuación 1):
PMVCV = 0,098xFRxA{[1/2xEsr+FRx ((1+I:E))/(60xI:E) xRva ]+Vtx- PEEP}
Dónde: 0,098 (factor de conversión de L/cmH2O en J/min), Vt (volumen corriente), Esr (elastancia del sistema respiratorio), I:E (relación inspiración/espiración), Rva (resistencia de la vía aérea).
La ecuación simplificada propuesta constituye una readaptación matemática de la versión extendida; o sea, pueden ser consideradas análogas (Ecuación 2):
PM=(0,098xVtxFRxP_pico )-P_plat-(PEEP/2)
Marinni JJ,[27] propuso después una simplificación de esta fórmula sin tomar en cuenta los componentes dependientes del flujo y la resistencia, conocida como poder de distensión alveolar (PDA) (Ecuación 3).
PDA=0,098x(P_plat-PEEP)xVtxFR
Se emplea la constante de 0,098.
Ambas fórmulas no son equivalentes, la diferencia se debe a que la fórmula del PM toma en cuenta elementos de Rva, mientras que, si se elimina el componente resistivo, las fórmulas no son tan diferentes.
Diferentes versiones de ecuaciones han sido propuestas para calcular el PM en ventilación controlada por presión (VCP). Las más utilizadas son las propuestas por van der Meijden et al., y Becher et al., ambas muy precisas pero complejas:
Van der Meijden et al (28) (Ecuación 4):
PMVCP=0,098xFRxVt x[PEEP+AP_insp x(1-e-t_insp/RxC)]
Becher T et al[32] (Ecuación 5):
PMVCP=0,098xRR[(AP_insp+PEEP)xVC-APA2 i_insp xCx(0,5- RxC/T_slope +(RxC/T_slope ) (2@ ))x(1-e (-T_slope)/(R-c))]
Dónde: APinsp (presión inspiratoria en cmH2O), Tinsp (tiempo inspiratorio en segundos), C (compliance en L/cmH2O), e (elastancia), Tslope (tiempo de aumento de la presión inspirato- ria en segundos).
Ecuación simplificada. (Ecuación 6):
PMCVPC=0,098xFRxVt(AP_insp+PEEP)
Entre todos los determinantes del PM, el Vt, APinsp y la PEEP son los que muestran un mayor impacto clínico en la atención a pacientes con SDRA. Esta evidencia ha influenciado en la práctica clínica; conlleva a una VMA con bajos Vt y bajas presiones con un nivel moderado de PEEP[29].
La justificación para incluir PEEP como un componente del PM es que, en su CRF, el pulmón ya está parcialmente estre- sado y tenso; con aplicación de PEEP, hay un aumento en el volumen pulmonar correspondiente a un ascenso en volumen pulmonar al final de la espiración y a una elevación de la Ptp al final de la espiración, pero en una condición estática, esta presión se almacena en las estructuras pulmonares como energía potencial[30].
Un reto crucial en la aplicación del PM es la necesidad de ser adaptado a las diferencias de tamaño pulmonar, el grado de inhomogeneidad y la distribución local de tensión y deformación. En otras palabras, un mismo PM puede generar efectos diferentes en pulmones sanos o dañados[8],[31],[32],[33].
-
Inhomogeneidad pulmonar
Las denominadas “inhomogeneidades” en el pulmón cobran cada vez mayor relevancia en la práctica clínica. Se corresponden con zonas de atelectasia, colapso alveolar, edema o secreciones, que alternan con zonas de pulmón sano. Estas, a su vez, generan elevados índices de estrés en las estructuras alveo
lares que se encuentran inmediatamente adyacentes a las zonas colapsadas concentradoras de estrés alveolar, al generarse tensión en las zonas de transición por la divergencia en los vectores de fuerza, los que convergen hacia la zona colapsada en oposición a los que distienden los alveolos no colapsados. Por tanto, se produce tracción en el esqueleto de la trama alveolar, aumenta el riesgo de ruptura, sobredistensión, mayor strain y riesgo de volutrauma, barotrauma y biotrauma[35],[36].
Parece ser de mayor relevancia clínica encontrar un valor del PM con el que la VMA pueda considerarse segura o por encima del cual pueda resultar peligroso[36],[37].
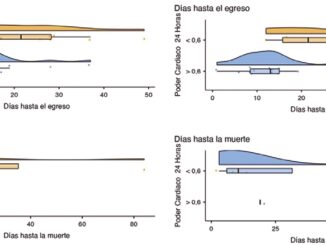
Existen evidencias sobre que un valor mayor de 12 J/min determina el desarrollo de LPIV en sujetos sanos, y el empeoramiento clínico en pacientes con SDRA, con marcada relación a la mortalidad.
Tabla 2. PM o las variables que lo componen y asociación a la mortalidad
| Autor | Objetivo | Resultados |
| Tonna JE et al[43]* | Relación de la PM con la mortalidad en diferentes valores de Fr, Flw y PEEP. | Fr > 26 rpm: OR: 1,82; 114,1-2,35; p < 0,001.
Fr < 26 rpm: OR: 1,10; 10,93-1.30); p < 0,001 Flw > 20 L/min: OR: 1,15; 11,15-1,43; p < 0,001 PEEP > 10 mmHg: OR: 1,22 11,09-1,37; p < 0,001 |
| Wu HP et al[44]t | ||Asociación entre PM y mortalidad en neumonía grave | PM > 27 J/min: OR: 1,076 11,057-1,101; p < 0,001 |
| Schuijt MTU et al[45]* * | Impacto de la intensidad de la VMA en la mortalidad a los 28 días. Pacientes COVID-19 | PM > 17 J/min: OR: 1,17 11,01-1,36); p = 0,031 |
| Zhu Y et al[46]t | Asociación del PM normalizada al Pp y mortalidad | OR: 1,33; 11,16-1,52; p > 0,001 |
| Jiang X et al[47]* | Asociación entre PM y mortalidad | Punto de corte: PM =12,16 J/min
aROC: 0,678; 10,637-0,718) RLm: PM elevado se asoció con mortalidad en UCI (OR: 1,11; 106-1,17; p < 0,001, aumentó el riesgo de mortalidad hospitalaria (OR: 13,4; 110,1-17,6, p < 0,001) |
*Estudio prospectivo; tEstudio retrospectivo; ^Estudio multicéntrico; §CI 95 %; ||Se utilizó la fórmula simplificada para ventilación controlada por presión de Becher et al,[34] demostró que es fácil de usar y el PM calculado tiene una discriminación aceptable para la mortalidad a los 28 días; PM: poder mecánico; Fr: frecuencia respiratoria; PEEP: presión positiva al final de la expiración; VMA: ventilación mecánica artificial; Pp: peso corporal predicho; aROC: área bajo la curva Operador-Receptor; RLm: regresión logística multivariante.
-
PM, LPIV y mortalidad. Evidencia clínica
Aún queda por definir un umbral de PM seguro para pacientes con enfermedades críticas con o sin SDRA aunque, la evidencia disponible apunta hacia un punto de corte > 12 J/min como un excelente discriminativo para la aparición de LPIV o mortalidad.
Fernando C[38], demostró en 12 pacientes la presencia de ergotrauma con PM > 12 J/min. Los factores que mostraron mayor impacto fueron: Vt > 8 ml/kg (OR: 3,5; p = 0,018), Fr > 15 l/min (x2 = 7,23; p = 0,007; OR: 2,5), PDA > 15 cmH2O (x2 = 9,00; p = 0,003; OR: 0,5) y PEEP > 8 cmH2O (x2 = 4,434; p =0 ,035; OR: 2,4).
Serpa-Neto A et al[36], analizaron datos de 8.207 pacientes en estado crítico para dilucidar la asociación entre PM y LPIV en las primeras 48 h de VMA. Los resultados mostraron que un PM
>17 J/min en las primeras 24, se asoció con estadía prolongada en la unidad de cuidados intensivos (UCI) y aumento de la mortalidad hospitalaria (OR: 1,70; CI 95%: 1,32-2,18; p < 0,001).
Ghiani A et al[39], analizaron factores asociados a la falla en el destete en 263 pacientes con más de 3 semanas de VMA. En la regresión logística, quienes presentaron valores significativos mayores de PM (22,4 ± 6,0 vs 19,2 ± 6,7 J/min; p < 0,001), un PM normalizada al peso corporal predicho (Pp) (328 ± 95 frente a 263 ± 80 J/min/kg Pp x 10-3; p < 0,001), y un PM normalizada a la compliance torácica pulmonar, (768 ± 339 frente a 664 ± 347 J/min x cmH2O/ ml x 10-3; p = 0,025).
Xie Y et al[40], comparó la LPIV en diferentes condiciones de PM, para explorar la participación del receptor de quimioci- nas Cxcl10/Cxcr3. Se dividieron en 2 grupos, PM elevada y baja. Se demostró que mientras mayor sea el PM, más grave será la LPIV (p < 0.001). Los niveles séricos de Cxcl10 y Cxcr3 en el grupo de mayor PM, fueron significativamente más altos con diferencia estadística (p < 0,001).
Una cohorte observacional realizado por Parhar KKS et al[41] en pacientes con insuficiencia respiratoria hipoxémica y SDRA. Se utilizaron cortes de ventilación de protección pulmonar de 8 ml/kg de Pp y Pplat < 30 cmH2O. Los resultados mostraron que un valor de PM de 22 J/min se asoció con menor supervivencia hospitalaria a los 28 días y menor supervivencia a los 3 años. La severidad del SDRA también se asoció con un mayor PM. El PM y sus determinantes, la Pplat (> 30 cmH2O) y las PDA (> 15 cmH2O), se asociaron con una menor probabilidad de supervivencia a los 28 días, sin embargo, un Vt más bajo no se asoció con una mayor supervivencia. La PDA se ha asociado con un aumento en la mortalidad y es uno de los determinantes clave y parcialmente modificable del PM, mediante la manipulación del Vt y la PEEP.
Zhang et al[42], normalizó el PM al Pp, como sustituto del tamaño del pulmón, informaron que el PM normalizado predice mejor la mortalidad hospitalaria.
Datos experimentales recientes revelaron que, cuando el PM aumentaba, la FR o el nivel de PEEP fueron capaces de promover inflamación pulmonar y edema. En un estudio posterior de 1.705 pacientes con VMA, el PM se asoció de forma independiente con una progresión al SDRA[43],[44]. Otros resultados se resumen en la Tabla 2.
-
Conclusiones
Se debe fomentar el uso del PM para promover la protección pulmonar. Es un parámetro disponible a la cabecera del enfermo que ayuda a identificar el desarrollo de LPIV. Ha demostrado ser predictor importante de los efectos de la VMA en los resultados del SDRA.
Los datos descritos sugieren un mayor riesgo de muerte en pacientes con PM superior a 12 J/min, si bien aún no se ha identificado un umbral bien tolerado para este parámetro.
Fuente de financiamiento: No existió.
Conflicto de intereses: No existió.
Referencias
1. Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020 Mar;395(10229):1054–62. https://doi.org/10.1016/S0140-6736(20)30566-3 PMID:32171076
2. Carter C, Osborn M, Agagah G, Aedy H, Notter J. COVID-1 9 disease: invasive ventilation. Clinics in Integrated Care. 2020;1:100004. https://doi.org/10.1016/j.intcar.2020.100004.
3. Fuentes-Gómez AJ, Monares-Zepeda E, Aguirre-Sánchez JS, Franco-Granillo J. El poder mecánico permite predecir mortalidad en pacientes en ventilación mecánica invasiva prolongada. Med. crít. (Col. Mex. Med. Crít.) 2019;35(1):10-14. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2448-89092019000100010&lng=es&nrm=iso&tlng=es
4. Cruz FF, Ball L, Rocco PR, Pelosi P. Ventilator-induced lung injury during controlled ventilation in patients with acute respiratory distress syndrome: less is probably better. Expert Rev Respir Med. 2018 May;12(5):403–14. https://doi.org/10.1080/17476348.2018.1457954 PMID:29575957
5. Amado-Rodríguez L, Del Busto C, García-Prieto E, Albaiceta GM. Mechanical ventilation in acute respiratory distress syndrome: the open lung revisited. Med Intensiva. 2017 Dec;41(9):550–8. https://doi.org/10.1016/j.medin.2016.12.012 PMID:28238441
6. Gattinoni L, Tonetti T, Quintel M. Intensive care medicine in 2050: ventilator-induced lung injury. Intensive Care Med. 2018 Jan;44(1):76–8. https://doi.org/10.1007/s00134-017-4770-8 PMID:28331959
7. Gattinoni L, Marini JJ, Collino F, Maiolo G, Rapetti F, Tonetti T, et al. The future of mechanical ventilation: lessons from the present and the past. Crit Care. 2017 Jul;21(1):183. https://doi.org/10.1186/s13054-017-1750-x PMID:28701178
8. Cressoni M, Gotti M, Chiurazzi C, Massari D, Algieri I, Amini M, et al. Chiurazzi C y cols. Mechanical power and development of ventilator-induced lung injury. Anesthesiology. 2016 May;124(5):1100–8. https://doi.org/10.1097/ALN.0000000000001056 PMID:26872367
9. Gómez RJ, Monares ZE, González CB, Camarena AG, Aguirre-Sánchez SJ, Franco GJ. Determinación del poder mecánico en pacientes en ventilación mecánica invasiva en modalidad espontánea. Med Crit 2018;32(1):20-26. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2448-89092018000100020&lng=es
10. Parker JC, Hernandez LA, Peevy KJ. Mechanisms of ventilator-induced lung injury. Crit Care Med. 1993 Jan;21(1):131–43. https://doi.org/10.1097/00003246-199301000-00024 PMID:8420720
11. Ruiz GO, Cardinal-Fernández P, Castell CR, Fernández MA, García AL, Rodríguez ÁP. Poder mecánico. Acta Colomb Cuid Intensivo. 2021;21(3):241–51. https://doi.org/10.1016/j.acci.2020.07.003.
12. Marini JJ. Evolving concepts for safer ventilation. Crit Care. 2019 Jun;23(1 Suppl 1):114. https://doi.org/10.1186/s13054-019-2406-9 PMID:31200734
13. Mc-Guiness G, Zhan C. Rosenberg N y cols. High incidence of barotrauma in patients with COVID-19 infection on invasive mechanical ventilation. Radiology. 2020;297(2):E252–62. https://doi.org/10.1148/radiol.2020202352 PMID:32614258
14. Rubenfeld GD, Shankar-Hari M. Lessons from ARDS for non-ARDS research: Remembrance of Trials Past. JAMA. 2018 Nov;320(18):1863–5. https://doi.org/10.1001/jama.2018.14288 PMID:30357269
15. Protti A, Maraffi T, Milesi M, Votta E, Santini A, Pugni P, et al. Milesi M y cols. Role of strain rate in the pathogenesis of ventilator-induced lung edema. Crit Care Med. 2016 Sep;44(9):e838–45. https://doi.org/10.1097/CCM.0000000000001718 PMID:27054894
16. Gattinoni L, Carlesso E, Caironi P. Stress and strain within the lung. Curr Opin Crit Care. 2012 Feb;18(1):42–7. https://doi.org/10.1097/MCC.0b013e32834f17d9 PMID:22157254
17. Asehnoune K, Roquilly A, Cinotti R. Respiratory management in patients with severe brain injury. Crit Care 2018;22(1):76. Disponible en: https://doi.org/10.1007/978-3-319-73670-9_41.
18. Marini JJ, Gattinoni L. Energetics and the root mechanical cause for ventilator-induced lung injury. Anesthesiology. 2018 Jun;128(6):1062–4. https://doi.org/10.1097/ALN.0000000000002203 PMID:29620572
19. Curley GF, Laffey JG, Zhang H, Slutsky AS. Biotrauma and ventilator induced lung injury: clinical implications. Chest. 2016 Nov;150(5):1109–17. https://doi.org/10.1016/j.chest.2016.07.019 PMID:27477213
20. Brochard L, Slutsky A, Pesenti A. Mechanical ventilation to minimize progression of lung injury in acute respiratory failure. Am J Respir Crit Care Med. 2017 Feb;195(4):438–42. https://doi.org/10.1164/rccm.201605-1081CP PMID:27626833
21. Grieco DL, Menga LS, Eleuteri D, Antonelli M. Patient self-inflicted lung injury: implications for acute hypoxemic respiratory failure and ARDS patients on non-invasive support. Minerva Anestesiol. 2019 Sep;85(9):1014–23. https://doi.org/10.23736/S0375-9393.19.13418-9 PMID:30871304
22. Gattinoni L, Tonetti T, Cressoni M y cols. Ventilator-related causes of lung injury: the mechanical power. Intensive Care Med 2016;42(10):1567-1575. Disponible en: https://doi.org/10.1007/s00134-016-4505-2..
23. Tonetti T, Vasques F, Rapetti F, Maiolo G, Collino F, Romitti F, et al. Driving pressure and mechanical power: new targets for VILI prevention. Ann Transl Med. 2017 Jul;5(14):286. https://doi.org/10.21037/atm.2017.07.08 PMID:28828361
24. Silva PL, Ball L, Rocco PR, Pelosi P. Power to mechanical power to minimize ventilator-induced lung injury? Intensive Care Med Exp. 2019 Jul;7(1 Suppl 1):38. https://doi.org/10.1186/s40635-019-0243-4 PMID:31346828
25. Ortiz GR, Cardinal FP, Rafael Dueña CC, Andrés Garay FM, Lara CA, Patricia Aguirre RA. Poder mecánico. Acta Colomb Cuid Intensivo. 2020;21(3):241–51. https://doi.org/10.1016/j.acci.2020.07.003.
26. Chiumello D, Gotti M, Guanziroli M y cols. Bedside calculation of mechanical power during volume- and pressure-controlled mechanical ventilation. Crit Care 2020;24(1):417. Disponible en https://doi.org/10.1186/s13054-020-03116-w.
27. Marini JJ, Jaber S. Dynamic predictors of VILI risk: beyond the driving pressure. Intensive Care Med. 2016 Oct;42(10):1597–600. https://doi.org/10.1007/s00134-016-4534-x PMID:27637717
28. van der Meijden S, Molenaar M, Somhorst P, Schoe A. Calculating mechanical power for pressure-controlled ventilation. Intensive Care Med. 2019 Oct;45(10):1495–7. https://doi.org/10.1007/s00134-019-05698-8 PMID:31359082
29. Vasques F, Duscio E, Pasticci I y cols. Is the mechanical power the final word on ventilator-induced lung injury? we are not sure. Ann Transl Med. 2018;6(19):395. Disponible en: https://doi.org/10.21037/atm.2018.08.17..
30. Collino F, Rapetti F, Vasques F, Maiolo G, Tonetti T, Romitti F, et al. Vasques F y cols. Positive end-expiratory pressure and mechanical power. Anesthesiology. 2019 Jan;130(1):119–30. https://doi.org/10.1097/ALN.0000000000002458 PMID:30277932
31. Marini JJ. Dissipation of energy during the respiratory cycle: conditional importance of ergotrauma to structural lung damage. Curr Opin Crit Care 2018;24(1):16-22. Disponible en: https://doi.org/10.1097/MCC.0000000000000470..
32. Arnal JM, Saoli M, Garnero A. Airway and transpulmonary driving pressures and mechanical powers selected by INTELLiVENT-ASV in passive, mechanically ventilated ICU patients. Heart Lung. 2020;49(4):427–34. https://doi.org/10.1016/j.hrtlng.2019.11.001 PMID:31733881
33. Das A, Camporota L, Hardman JG, Bates DG. What links ventilator driving pressure with survival in the acute respiratory distress syndrome? A computational study. Respir Res. 2019 Feb;20(1):29. https://doi.org/10.1186/s12931-019-0990-5 PMID:30744629
34. Nieman GF, Satalin J, Andrews P, Aiash H, Habashi NM, Gatto LA. Personalizing mechanical ventilation according to physiologic parameters to stabilize alveoli and minimize ventilator induced lung injury (VILI). Intensive Care Med Exp 2017;5(1):8. Disponible en: https://doi.org/10.1186/s40635-017-0121-x.
35. Bein T, Wrigge H. Airway pressure release ventilation (APRV): do good things come to those who can wait? J Thorac Dis. 2018 Feb;10(2):667–9. https://doi.org/10.21037/jtd.2018.01.107 PMID:29607131
36. Serpa Neto A, Deliberato RO, Johnson AE, Bos LD, Amorim P, Pereira SM, et al.; PROVE Network Investigators. Mechanical power of ventilation is associated with mortality in critically ill patients: an analysis of patients in two observational cohorts. Intensive Care Med. 2018 Nov;44(11):1914–22. https://doi.org/10.1007/s00134-018-5375-6 PMID:30291378
37. Sánchez KR, Gutiérrez ZD, Ulises WC. Asociación y valor predictivo del poder mecánico con los días libres de ventilación mecánica. Med. Crit (Lond). 2017;31(6):320–5. Available from: http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2448-89092017000600320&lng=es
38. Serpa-Neto A, Hemmes SN, Pelosi P, de Abreu MG, Schultz MJ; PROVE Network Investigators. Role of shear stress in ventilator-induced lung injury – Authors’ reply. Lancet Respir Med. 2016;4(8):e43. https://doi.org/10.1016/S2213-2600(16)30161-8.
39. Ghiani A, Paderewska J, Sainis A, Crispin A, Walcher S, Neurohr C. Variables predicting weaning outcome in prolonged mechanically ventilated tracheotomized patients: a retrospective study. J Intensive Care. 2020 Feb;8(1):19. https://doi.org/10.1186/s40560-020-00437-4 PMID:32123565
40. Xie Y, Zheng H, Mou Z, Wang Y, Li X. High expression of CXCL10/CXCR 3 in ventila tor-induced lung injury caused by high mechanical power. BioMed Res Int. 2022 Jan;2022:6803154. https://doi.org/10.1155/2022/6803154 PMID:35036436
41. Parhar KK, Zjadewicz K, Soo A, Sutton A, Zjadewicz M, Doig L, et al. Soo A y cols. Epidemiology, mechanical power, and 3-year outcomes in acute respiratory distress syndrome patients using standardized screening. An observational cohort study. Ann Am Thorac Soc. 2019 Oct;16(10):1263–72. https://doi.org/10.1513/AnnalsATS.201812-910OC PMID:31247145
42. Zhang Z, Zheng B, Liu N, Ge H, Hong Y. Mechanical power normalized to predicted body weight as a predictor of mortality in patients with acute respiratory distress syndrome. Intensive Care Med. 2019 Jun;45(6):856–64. https://doi.org/10.1007/s00134-019-05627-9 PMID:31062050
43. Tonna JE, Peltan ID, Brown SM, Grissom CK, Presson AP, Herrick JS, et al. Positive end-expiratory pressure and respiratory rate modify the association of mechanical power and driving pressure with mortality among patients with acute respiratory distress syndrome. Crit Care Explor. 2021 Dec;3(12):e0583. https://doi.org/10.1097/CCE.0000000000000583 PMID:34909696
44. Wu HP, Chu CM, Chuang LP, Lin SW, Leu SW, Chang KW, et al. Chuang LP y cols. The association between mechanical power and mortality in patients with pneumonia using pressure-targeted ventilation. Diagnostics (Basel). 2021 Oct;11(10):1862. https://doi.org/10.3390/diagnostics11101862 PMID:34679560
45. Schuijt MT, Schultz MJ, Paulus F, Serpa Neto A, van Akkeren JP, Algera AG, et al.; PRoVENT–COVID Collaborative Group. Association of intensity of ventilation with 28-day mortality in COVID-19 patients with acute respiratory failure: insights from the PRoVENT-COVID study. Crit Care. 2021 Aug;25(1):283. https://doi.org/10.1186/s13054-021-03710-6 PMID:34362415
46. Zhu Y, Peng W, Zhen S, Jiang X. Mechanical power normalized to predicted body weight is associated with mortality in critically ill patients: a cohort study. BMC Anesthesiol. 2021 Nov;21(1):278. https://doi.org/10.1186/s12871-021-01497-1 PMID:34753416
47. Jiang X, Zhu Y, Zhen S, Wang L. Mechanical power of ventilation is associated with mortality in neurocritical patients: a cohort study. J Clin Monit Comput. 2022 Dec;36(6):1621–8. https://doi.org/10.1007/s10877-022-00805-5; Epub ahead of print. PMID:35059914

 ORCID
ORCID