Jorge Vallés-Torres MD. PhD.1,2,*, Lucía Gallego-Ligorit MD. PhD.1,2, Victoria P. González-Rodríguez MD.3,4, Blanca Izquierdo-Villarroya MD. PhD.1,2, Belén Hernando-Vela MD. PhD.1,2, Alba Herrero-Izquierdo4
Recibido: 24-11-2022
Aceptado: 12-12-2022
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 4 pp. 390-398|https://doi.org/10.25237/revchilanestv52n04-11
PDF|ePub|RIS
Evaluation of rotational thromboelastometry guided coagulation management in adult cardiac surgery
Abstract
Objective: Rotational thronboelastometry (ROTEM) in cardiac surgery was implemented in our centre during 2019. The objectives were to evalúate changes in the administration of blood products and hemostatic drugs, to analyse changes in perioperative complications, economic analysis. Methods: Single-centre retrospective cohort study. Data of adult patients undergoing cardiac surgery in 2018 (group 1) and 2020 (group 2). In group 1 (n = 438), blood products and hemostatic drugs were administered empirically at the anesthesiologist’s discretion. In group 2 (n = 321), blood products and hemostatic drugs were administered according to an algorithm. Results: A significant reduction was observed in the number of patients who received packed red blood cells (PRBC) (19% vs 29.2%; p = 0.001), fresh frozen plasma (FFP) (1.6% vs 7.5%; p < 0.001), fibrinogen concentrate (FC) (23.4% vs 30.6%; p = 0.028) and recombinant activated factor VII (rFVIIa) (0.3% vs 2.7%; p = 0.011). A significant decrease was observed in the total quantity of PRBC, platelet concentrates (PC), FFP, FC and rFVIIa administered per patient. The economic analysis showed a reduction of 30% in the average cost per patient. Conclusions: Thromboelastometry allows a reduction in administration of blood products and hemostatic drugs, in addition to lowering costs. Further studies on the use of viscoelastic tests in cardiac surgery and reductions in morbidity and mortality are required.
Resumen
Objetivos: Durante el año 2019, se implemento en nuestro centro la tromboelastometría rotacional (ROTEM) en cirugía cardíaca. Los objetivos del estudio fueron evaluar cambios en la administración de hemoderivados y fármacos hemostáticos, analizar cambios en complicaciones perioperatorias, y realizar un análisis económico. Material y Métodos: Estudio de cohortes retrospectivo unicéntrico. Datos de pacientes adultos intervenidos de cirugía cardíaca en 2018 (grupo 1) y 2020 (grupo 2). En el grupo 1 (n = 438) se administraron hemoderivados y fármacos hemostáticos de forma empírica a criterio del anestesiólogo. En el grupo 2 (n = 321), se administraron hemoderivados y fármacos hemostáticos según un algoritmo. Resultados: Se observó una reducción significativa en el número de pacientes que recibieron concentrados de hematíes (CH) (19% frente a 29,2%; p = 0,001), plasma fresco congelado (PFC) (1,6% frente a 7,5%; p < 0,001), concentrado de fibrinógeno (CF) (23,4% vs 30,6%; p = 0,028) y factor VII recombinante activado (rFVIIa) (0,3% vs 2,7%; p = 0,011). Se observó una disminución significativa en la cantidad total de CH, concentrados de plaquetas (CP), PFC, FC y rFVIIa administrados por paciente. El análisis económico mostró una reducción del 30% en el coste medio por paciente. Conclusiones: La tromboelastometría permite una reducción en la administración de hemoderivados y fármacos hemostáticos, además de disminuir costes. Se requieren más estudios sobre el uso de tests viscoelásticas en cirugía cardíaca y la reducción de la morbilidad y la mortalidad.
-
Introducción
Una de las complicaciones más frecuentes en los pacientes sometidos a cirugía cardíaca es la hemorragia, que suele ser consecuencia de una alteración de la hemostasia de origen multifactorial. La hemorragia en cirugía cardíaca aumenta la necesidad de administrar hemoderivados y fármacos hemostáticos. Además, aumenta la necesidad de revisión quirúrgica y se asocia a una mayor morbimortalidad[1]-[3]. Por otro lado, la administración de hemoderivados no está exenta de complicaciones, como daño pulmonar agudo relacionado con la transfusión, sobrecarga circulatoria, inmunomodulación relacionada con la transfusión e infecciones nosocomiales[2]-[4].
El uso de circulación extracorpórea (CEC) es el factor más importante en la aparición de hemorragia en cirugía cardíaca. El uso de CEC produce hemodilución, disfunción plaquetaria y consumo de factores de coagulación. Además, el uso de heparina no fraccionada y su reversión inadecuada puede promover el sangrado. Otros factores, como el tratamiento preoperatorio con antiagregantes plaquetarios o anticoagulantes, la hipotermia intraoperatoria o las dificultades técnicas que puedan surgir durante el procedimiento contribuyen al desarrollo de coagulopatía y hemorragia[5]-[7].
Las diversas alteraciones de la hemostasia que se producen en la cirugía cardíaca pueden presentarse de forma aislada o combinadas entre sí, dando lugar a coagulopatías de difícil manejo terapéutico. Los tests viscoelásticos de la coagulación ofrecen un diagnóstico rápido y preciso de las causas de la hemorragia y permiten un tratamiento individualizado y dirigido por objetivos. El uso de tests viscoelásticos y la implementación de protocolos de tratamiento en cirugía cardíaca disminuye la administración de hemoderivados y fármacos hemostáticos y podría contribuir a reducir las reintervenciones por sangrado y la morbimortalidad asociada[3],[8]-[16]. Las recomendaciones actuales destacan la necesidad de establecer algoritmos guiados por tests viscoelásticos en aquellos procedimientos o pacientes con alto riesgo de sangrado y transfusión[17],[18]. Estos tests están considerados como una medida más dentro de las estrategias de ahorro de sangre contempladas en los programas de Patient Blood Management (PBM)[19].
El objetivo de este estudio fue evaluar los cambios en la administración de hemoderivados y fármacos hemostáticos tras la implementación de tests viscoelásticos en cirugía cardíaca. También, se analizaron los cambios en la tasa de reintervención por sangrado y la aparición de otras complicaciones perioperatorias antes y después de la implantación de la técnica. Finalmente, se realizó un análisis económico sobre el consumo de hemoderivados y fármacos hemostáticos con respecto al coste asociado a la implementación de los tests viscoelásticas.
-
Material y Métodos
El estudio comenzó una vez aprobado por el comité de ética regional. Los datos de los pacientes fueron tratados de forma confidencial y cumplieron con los requisitos de la normativa de protección de datos.
-
Diseño del estudio, criterios de inclusión y exclusión
Se trata de un estudio de cohortes retrospectivo unicéntrico en un hospital universitario de tercer nivel, en el que se compararon dos grupos de pacientes adultos sometidos a cirugía cardíaca antes y después de la implantación de tests viscoelásticos. La técnica utilizada fue la tromboelastometría rotacional (ROTEM) con el dispositivo ROTEM sigma (ROTEM International Inc., Munich, Alemania). La técnica se implantó en 2019 y durante ese año se realizó la formación del personal y se elaboró y estableció un protocolo guiado por ROTEM para el diagnóstico y tratamiento de las alteraciones de la hemostasia. Se compararon los pacientes operados en 2018 (grupo 1) con los pacientes operados en 2020 (grupo 2).
Los criterios de exclusión fueron intervenciones de cirugía cardíaca sin CEC, cirugía emergente, casos de implantación de dispositivos de asistencia circulatoria, trasplante cardiaco, disección de aorta ascendente, pacientes Testigos de Jehová, trastornos congénitos de la hemostasia y enfermedad hepática grave.
-
Manejo perioperatorio del paciente
En todos los casos el manejo perioperatorio de antiagregantes plaquetarios y anticoagulantes se realizó según el documento de consenso publicado por diversas sociedades científicas españolas en 2018[20]. Todos los pacientes fueron intervenidos bajo anestesia general y monitorizados mediante electrocardiograma, oximetría de pulso, presión arterial no invasiva, presión arterial invasiva, temperatura vesical, parámetros ventilatorios, profundidad anestésica mediante análisis biespectral y oximetría cerebral. De acuerdo con el protocolo de monitorización de cirugía cardíaca de nuestro centro, en algunos casos la monitorización se realizó mediante contorno de onda de pulso, catéter de arteria pulmonar y/o ecocardiografía transesofágica. En todas las intervenciones se utilizó recuperador celular de hematíes y se administró tratamiento antifibrinolítico con ácido tranexámico según protocolo. El abordaje quirúrgico fue por esternotomía en todos los casos. La anticoagulación para la CEC se realizó con heparina no fraccionada a una dosis inicial de 3 mg/kg. El seguimiento de la anticoagulación con heparina se realizó mediante la determinación del tiempo de coagulación activado (TCA). El objetivo de TCA durante la CEC fue > 400 s, con la administración de dosis adicionales para mantener este valor. En los casos de resistencia a la heparina o deficiencia de antitrombina, se administró antitrombina humana III según protocolo publicado por Eiguren-Goitiz[21].
Tras finalizar la CEC se realizó reversión de la anticoagulación con protamina con una relación protamina/heparina de 0,8. La transfusión de concentrados de hematíes (CH) se realizó de acuerdo con los criterios clínicos del paciente mediante la evaluación de diferentes parámetros (hemoglobina, presión parcial de oxígeno, saturación venosa de oxígeno, índice cardíaco, perfusión de órganos, etc.).
Después de diez minutos de la administración de protamina y tras la confirmación de hemostasia quirúrgica adecuada, se comprobó la ausencia de hemorragia. Si se observó hemorragia difusa de origen no quirúrgico asociada a posible coagulopatía, se administraron hemoderivados o fármacos hemostáticos según los siguientes procedimientos:
– Grupo 1. Administración empírica de hemoderivados y fármacos hemostáticos a criterio del anestesiólogo. Además, del uso del TCA se utilizaron la determinación de INR mediante coagulómetro portátil, pruebas de laboratorio estándar y variables clínicas como tratamientos previos con agentes antiplaquetarios o anticoagulantes para guiar el manejo terapéutico.
– Grupo 2. Administración de hemoderivados y fármacos hemostáticos guiada por el dispositivo ROTEM sigma utilizando el cartucho “complete+hep”. El tratamiento se administró según el algoritmo de Gorlinger[22] modificado para el manejo de la hemorragia en cirugía cardíaca (Figura 1).
-
Recopilación de datos
Las variables recogidas relacionadas con el preoperatorio fueron edad, sexo, peso, talla, índice de masa corporal (IMC), área de superficie corporal (ASC), nivel de hemoglobina, número de plaquetas, creatinina y filtrado glomerular, tratamiento con ácido acetilsalicílico (AAS) en los 5 días previos a la intervención quirúrgica y antecedente de cirugía cardíaca previa.
En cuanto al período intraoperatorio, se registró el tipo de cirugía cardíaca (cirugía sobre una válvula, combinación de varios procedimientos valvulares, revascularización coronaria aislada, revascularización coronaria más cirugía valvular, cirugía de aorta torácica, cirugía de válvula más aorta torácica, cirugía de reparación de un defecto estructural, resección de un tumor cardíaco) junto con la duración de la CEC.
Se registraron datos sobre la administración de hemoderivados y fármacos hemostáticos durante el período intraoperatorio. Se consideró la administración de CH, concentrados de plaquetas, plasma fresco congelado (PFC), concentrado de fibrinógeno, concentrado de complejo de protrombina (CCP) y factor VII activado recombinante (rFVIIa). Se tuvo en cuenta el número de pacientes que recibieron cada producto y la cantidad administrada.
En cuanto al posoperatorio, se registró la necesidad de reintervención por sangrado en las primeras 24 y si este sangrado fue de origen quirúrgico. También se regisitró la necesidad de ventilación mecánica prolongada (más de 24 h), la aparición de lesión pulmonar aguda (LPA; definida como la aparición aguda de infiltrados pulmonares bilaterales difusos con una PaO2/FiO2 < 300 y sin evidencia clínica de aumento de presión auricular izquierda), infección, eventos trombóticos/tromboembólicos, muerte durante el ingreso hospitalario, días de estancia en UCI y tiempo de estancia hospitalaria.
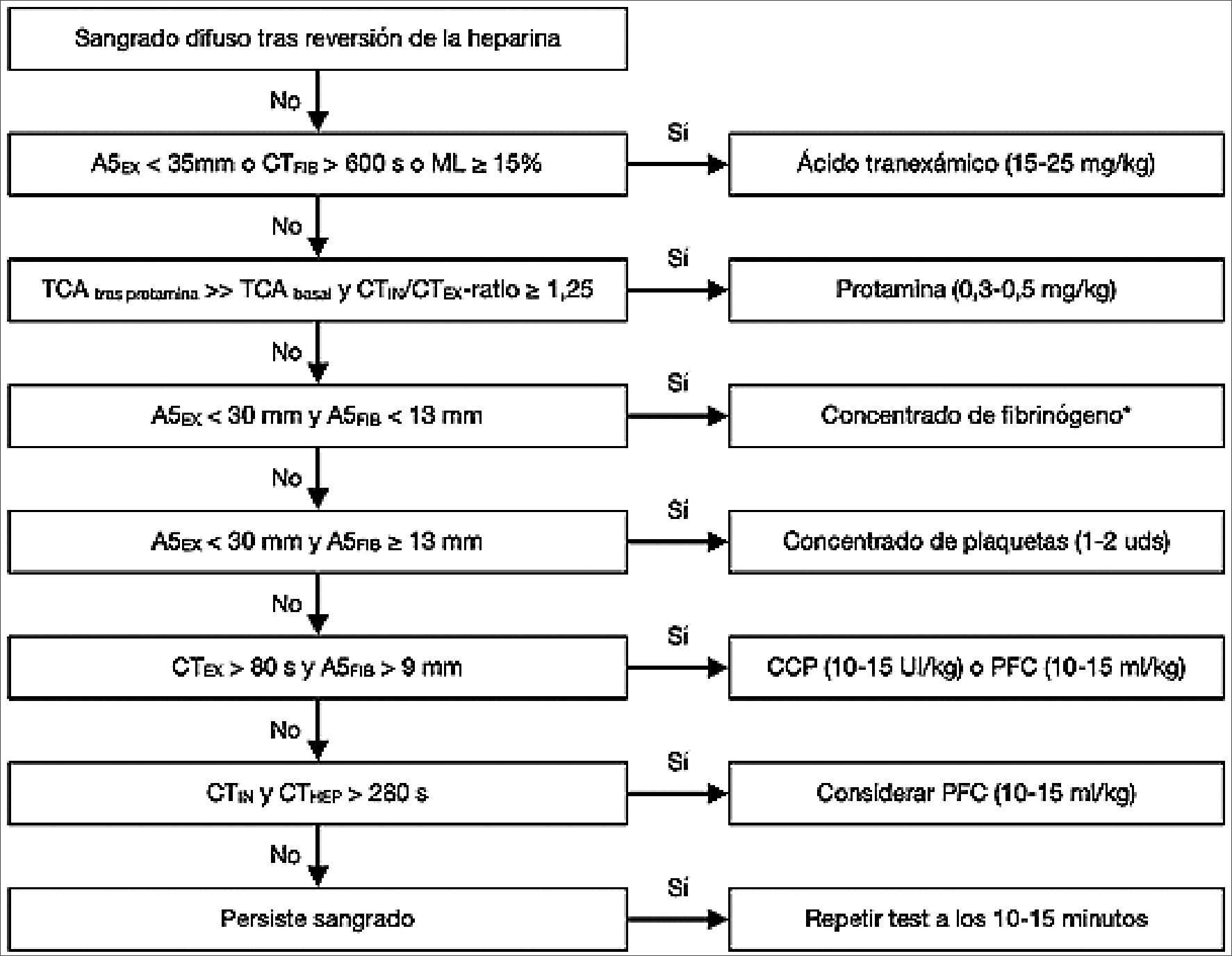
Figura 1. Algoritmo para el manejo del sangrado guiado por ROTEM en cirugía cardíaca.
Algoritmo de Gorlinger y cols[19] modificado. A5, amplitud del coágulo a los 5 minutos; TCA, tiempo de coagulación activado; CT, tiempo de coagulación; EX, test EXTEM; PFC, plasma fresco congelado; FIB, test FIBTEM; HEP, test HEPTEM; IN, test INTEM; ML, máxima lisis; CCP, concentrado de complejo protrombínico.
* Dosis de fibrinógeno (g) = aumento objetivo de A5FIB (mm) x peso (kg)/160.
-
Análisis estadístico
El análisis de datos se realizó utilizando Jamovi versión 2.0.0.0 (The Jamovi Project). Las variables cualitativas se representan mediante frecuencias y porcentajes. La distribución de datos continuos se verificó con la prueba de Shapiro-Wilk. Las variables continuas se presentan como medianas con rangos intercuartílicos. Las diferencias entre grupos se analizaron con la prueba de chi-cuadrado para variables discretas y la prueba U de Mann-Whitney para datos continuos. Posteriormente, se realizó un análisis multivariante para evaluar la influencia de las diferentes variables en los resultados. Se consideró una significación estadística para dos colas p < 0,05.
Tabla 1. Características basales de los pacientes
| Variable | Grupo 1 (438) | Grupo 2 (321) | valor p |
| Edad (años) | 70,0 (15) | 70,5 (13) | 0,782 |
| Sexo (mujer) | 162 (37,0%) | 99 (20,8%) | 0,078 |
| Peso (kg) | 75 (18) | 77 (16) | 1,133 |
| Altura (cm) | 165 (14,75) | 167 (11,10) | 0,075 |
| IMC (kg/cm2) | 27,75 (5,69) | 27,94 (5,37) | 0,515 |
| ASC (m2) | 1,83 (0,29) | 1,85 (0,25) | 0,073 |
| Anemia preoperatoria* | 87 (19,9%) | 50 (15,6%) | 0,129 |
| Contaje plaquetario < 140 x 109/L | 60 (13,7%) | 41 (12,8%) | 0,711 |
| Insuficicnecia renal preoperatoriat | 106 (24,2%) | 77 (24,0%) | 0,946 |
| Administración de AAS | 169 (38,6%) | 101 (31,5%) | 0,043 |
| Cirugía cardiaca previa | 23 (5,3%) | 13 (4,1%) | 0,447 |
| Tiempo de CEC > 120 min | 128 (29,2%) | 85 (26,5%) | 0,406 |
| Tipo de intervención | 0,554 | ||
| Cirugía sobre una válvula | 175 (40,0%) | 136 (42,4%) | |
| Cirugía sobre varias válvulas | 53 (12,1%) | 33 (10,3%) | |
| Cirugía de revascularización coronaria | 107 (24,4%) | 87 (27,1%) | |
| Cirugía coronaria más valvular | 61 (13,9%) | 39 (12,1%) | |
| Cirugía de aorta torácica | 1 (0,2%) | 2 (0,6%) | |
| Cirugía valvular más aorta torácica | 36 (8,2%) | 18 (5,6%) | |
| Reparación de defecto estructural | 5 (1,1%) | 5 (1,6%) | |
| Resección de tumor cardíaco | 0 (0,0%) | 1 (0,3%) |
* Anemia preoperatoria: hemoglobina < 13 g/dl en hombres y < 12 g/dl en mujeres.
t Insuficiencia renal preoperatoria: filtrado glomerular < 60 ml/min.
AAS, ácido acetilsalicílico; IMC, índice de masa corporal; ASC, área de superficie corporal; CEC, circulación extracorpórea.
Las variables cualitativas se representan mediante frecuencias y porcentajes. Las variables continuas se presentan como medianas con rangos intercuartílicos. Significación estadística p < 0,05.
-
Resultados
Se incluyeron en el estudio un total de 759 pacientes, 438 intervenidos en 2018 y 321 en 2020. No hubo diferencias significativas entre grupos en cuanto a edad, sexo, peso, talla, IMC y ASC. Tampoco se encontraron diferencias significativas respecto a la incidencia preoperatoria de anemia, trombocitopenia, insuficiencia renal o antecedentes de cirugía cardíaca previa.
El 38,6% de los pacientes del grupo de 2018 recibieron tratamiento con AAS en los 5 días previos a la intervención quirúrgica frente al 31,5% del grupo de 2020. Esta diferencia fue significativa, con un valor de p de 0,043. No hubo diferencias significativas entre los dos grupos en el tipo de intervenciones quirúrgicas realizadas o el número de intervenciones que requirieron un tiempo de CEC superior a 120 minutos. Las características basales de ambos grupos se muestran en la Tabla 1.
En cuanto a la administración de hemoderivados y fármacos hemostáticos, tras la aplicación de la técnica ROTEM se observó una reducción significativa en el número de pacientes que recibieron CH (19% vs 29,2%; p = 0,001), PFC (1,6% vs 7,5%; p < 0,001), concentrado de fibrinógeno (23,4% frente a 30,6%; p = 0,028) y rFVIIa (0,3% frente a 2,7%; p = 0,011). No hubo cambios significativos en el número de pacientes que recibieron concentrados de plaquetas o CCP (Tabla 2). También se observó una disminución significativa en la cantidad total de CH, concentrados de plaquetas, PFC, concentrado de fibrinógeno y rFVIIa administrados por paciente (Figura 2).
En cuanto a la evolución y complicaciones durante el posoperatorio, se observó una reducción significativa en la incidencia de infección postoperatoria (5,3% vs 10,3%; p = 0,013), estancia en UCI (mediana de 3 días vs 4 días; p < 0,001) y estancia hospitalaria (mediana de 8 días vs 11 días; p < 0,001). No hubo diferencias significativas en la necesidad de ventilación mecánica prolongada, revisión quirúrgica por sangrado, incidencia de LPA, eventos trombóticos/tromboembólicos o muerte durante el ingreso hospitalario (Tabla 3). De los pacientes que requirieron revisión quirúrgica, se encontró un origen quirúrgico del sangrado en 8 pacientes del grupo 1 (66%) y en 5 pacientes del grupo 2 (50%). Esta diferencia no fue significativa (OR 0,50; IC 0,09-2,81; p 0,429).
El análisis multivariante no mostró influencia de otras variables en los resultados obtenidos en ninguno de los dos grupos de estudio.
Para realizar el análisis económico sobre la implantación de la técnica ROTEM en cirugía cardíaca, se compararon los costes relacionados con el consumo de hemoderivados y fármacos hemostáticos en los dos grupos. También se tuvo en cuenta el coste de los cartuchos ROTEM para la realización de los tests en el grupo 2. Se utilizaron los precios de venta al público (PVP) para calcular el coste de los fármacos hemostáticos y los cartuchos ROTEM. Para calcular el coste de los hemoderivados se utilizaron los precios oficiales publicados por el Banco Regional de Sangre y Tejidos.
En la Tabla 4 se muestra el coste total de hemoderivados y hemostáticos por grupo, junto con el uso de cartuchos para realizar la técnica ROTEM en el grupo 2. La técnica ROTEM se aplicó en 123 pacientes del grupo 2 (38,3%) y se usaron un total de 133 cartuchos. El coste total fue de 403.394,99 euros para el grupo 1 y 203.292,97 euros para el grupo 2. El coste medio por paciente fue de 921,00 euros en el grupo 1 y 633,31 euros en el grupo 2, lo que supone una reducción de aproximadamente 30%.
Tabla 2. Tasa de administración de hemoderivados y fármacos hemostáticos
| Variable | Grupo 1 (438) | Group 2 (321) | OR (IC 95%) | valor p |
| Concentrado de hematíes | 128 (29,2 %) | 61 (19,0 %) | 0,57 (0,40-0,80) | 0,001 |
| Concentrado de plaquetas | 241 (55,0 %) | 157 (48,9 %) | 0,78 (0,59-1,04) | 0,096 |
| Plasma fresco congelado | 33 (7,5 %) | 5 (1,6 %) | 0,19 (0,07-0,50) | < 0,001 |
| Concentrado de fibrinógeno | 134 (30,6 %) | 75 (23,4 %) | 0,69 (0,50-0,96) | 0,028 |
| Concentrado de complejo protrombínico | 103 (23,5 %) | 72 (22,4 %) | 0,94 (0,67-1,33) | 0,726 |
| Factor VII activado recombinante | 12 (2,7 %) | 1 (0,3 %) | 0,11 (0,01-0,86) | 0,011 |
Los datos son presentados mediante frecuencias y porcentajes de pacientes que recibieron cada producto. IC, intérvalo de confianza; OR, odds ratio. Significación estadística p < 0,05.
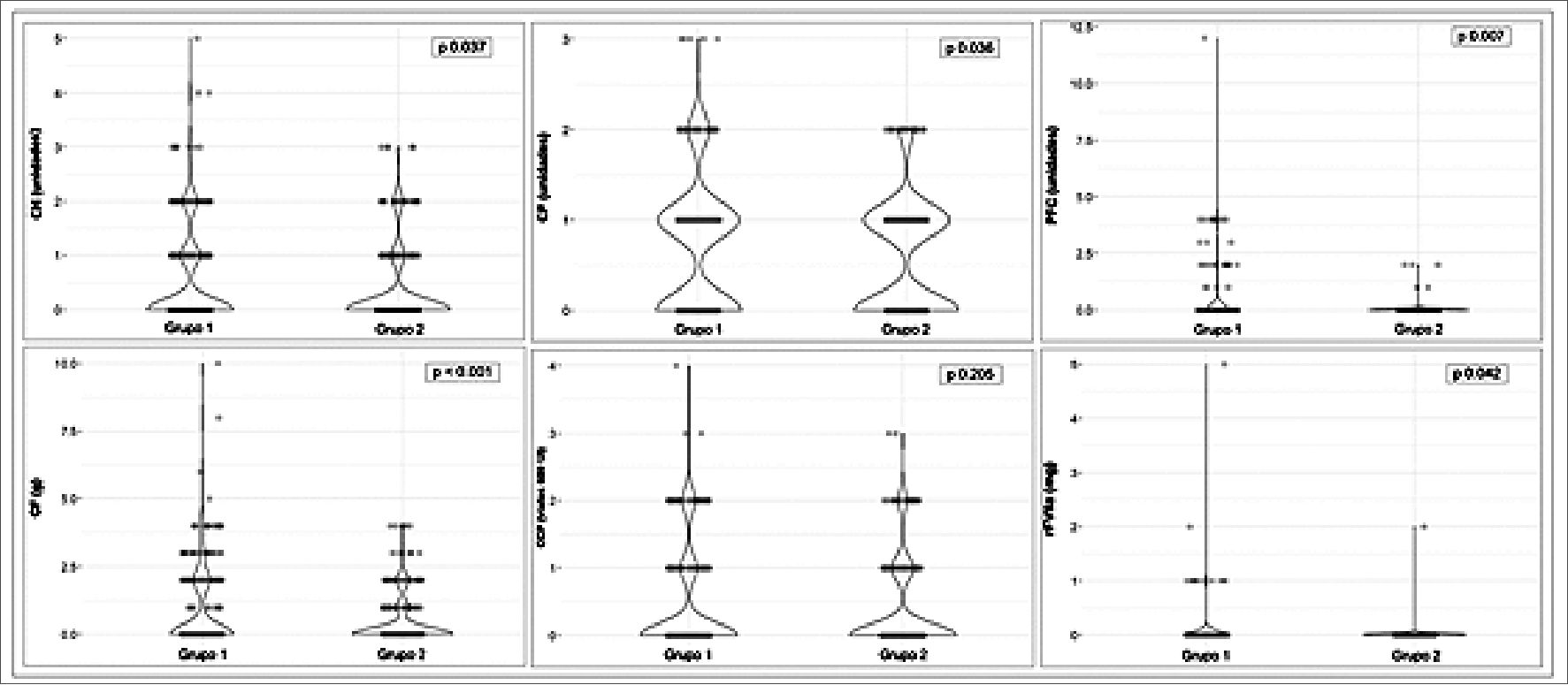
Figura 2. Cantidad de hemoderivados y fármacos hemostáticos utilizados por paciente.
CCP, concentrado de complejo protrombínico; CF, concentrado de fibrinógeno; CH, concentrado de hematíes; CP, concentrado de plaquetas; PFC, plasma fresco congelado; rFVIIa, factor VII activado recombinante.
Diferecnias entre grupos analizadas con el test de chi-cuadrado. Significación estadística p < 0,05.
-
Discusión
Diversos estudios han demostrado que el uso de tests viscoelásticos en cirugía cardíaca reduce el uso de hemoderivados[11]-[15],[23]. Un metaanálisis reciente, que incluyó los principales ensayos clínicos y estudios retrospectivos realizados hasta la fecha, constató una disminución significativa en el número de pacientes que recibieron CH y PFC[11],[16]. En nuestro estudio, además de observar una reducción en el número de pacientes que recibieron CH y PFC, también se observó una dismimnución del número de pacientes que precisaron administración de concentrado de fibrinógeno y rFVIIa. Por otro lado, también se observó una reducción significativa en la cantidad de CH, concentrados de plaquetas, PFC, concentrado de fibrinógeno y rFVIIa administrados por paciente. La reducción en el uso de hemoderivados también se acompañó con una reducción en la administración de concentrados de factores de coagulación.
| Tabla 3. Evolución posoperatoria | ||||
| Variable | Grupo 1 (438) | Grupo 2 (321) | OR (IC 95%) | valor p |
| Vantilación mecánica prolongada* | 31 (7,1%) | 13 (4,0%) | 0,55 (0,28-1,07) | 0,077 |
| Revisión quirúrgicat | 12 (2,7%) | 10 (3,1%) | 1,14 (0,49-2,68) | 0,761 |
| Lesión pulmonar aguda | 16 (3,7%) | 10 (3,1%) | 0,85 (0,38-1,89) | 0,687 |
| Infección | 45 (10,3%) | 17 (5,3%) | 0,49 (0,27-0,87) | 0,013 |
| Eventos trombóticos/tromboembólicos | 3 (0,7%) | 3 (0,9%) | 1,37 (0,27-6,82) | 0,701 |
| Mortalidad | 17 (3,9%) | 11 (3,4%) | 0,88 (0,41-1,90) | 0,743 |
| Estancia en UCI (días) | 4 (2) | 3 (2) | – | < 0,001 |
| Estancia hospitalaria (días) | 11 (7) | 8 (4) | – | < 0,001 |
* Ventilación mecánica > 24 horas; t Revisión quirúrgica en las primeras 24 horas; IC, intérvalo de confianza; UCI, unidad de cuidados intensivos; OR, odds ratio.
Las variables cualitativas se representan mediante frecuencias y porcentajes. Las variables continuas se presentan como medianas con rangos intercuartílicos. Significación estadística p < 0,05.
Tabla 4. Coste de hemoderivados, fármacos hemostáticos y tests ROTEM
| Pruducto y precio por unidad (€) | Grupo 1 (438) | Grupo 2 (321) | ||
| Consumo | Coste (€) | Consumo | Coste (€) | |
| Concentrado de hematíes (123,57) | 203 | 25.084,71 | 94 | 11.615,58 |
| Concentrado de plaquetas (447,58) | 299 | 133.826,42 | 179 | 80.116,82 |
| Plasma fresco congelado (67,90) | 95 | 6.450,50 | 8 | 543,20 |
| Concentrado de fibrinógeno (1 g vial) (497,03) | 338 | 167.996,14 | 137 | 68.093,11 |
| CCP (600 IU vial) (279,14) | 154 | 42.987,56 | 95 | 26.518,30 |
| rFVIIa (1 mg vial) (639,00) | 5 | 3.195,00 | 0 | 0,00 |
| rFVIIa (2 mg vial) (1.220,48) | 7 | 8.543,36 | 2 | 2.440,96 |
| rFVIIa (5 mg vial) (3.062,26) | 5 | 15.311,30 | 0 | 0,00 |
| Cartucho ROTEM (105,00) | 0 | 0,00 | 133 | 13.965,00 |
| Coste total | 403.394,99 | 203.292,97 | ||
| Coste total medio por paciente | 921,00 | 633,31 | ||
CCP: concentrado de complejo protrombínico; rFVIIa: factor VII activado recombinante.
Estos datos demuestran que la administración empírica de estos productos en el grupo 1 implicó un uso excesivo y que la implementación de la técnica ROTEM permite aplicar medidas más específicas para el tratamiento de la coagulopatía y de la hemorragia. La gran reducción observada en el uso de rFVIIa podría deberse a una disminución considerable en la incidencia de coagulopatías de difícil manejo tras la implementación de una terapia dirigida a objetivos. Por otra parte, el hecho de que una mayor proporción de pacientes del grupo 1 hubiera recibido tratamiento antiagregante con AAS en los días previos a la intervención quirúrgica pudo haber influido en la cantidad de concentrados de plaquetas administrada por paciente.
Sin embargo, la frecuencia de administración no se modificó entre los grupos. El análisis multivariante no mostró influencia del tratamiento antiagregante plaquetario preoperatorio en los resultados.
En cuanto a la necesidad de reintervención quirúrgica por sangrado y su origen, no se observaron diferencias significativas entre los grupos. Los valores observados son comparables con los de otros estudios[12],[24]. Actualmente, no existe evidencia concluyente sobre la reducción de la tasa de revisión quirúrgica por sangrado y el uso de tests viscoelásticos[11],[12],[25]. Sin embargo, en el metaanálisis realizado por Meco y cols[16] se observó una reducción de las reintervenciones por sangrado. Karrar y cols[14] también reportaron una reducción significativa en pacientes sometidos a cirugía aórtica con parada circulatoria hipotérmica. Es importante señalar que en caso de sangrado posoperatorio, es fundamental descartar alteraciones en la coagulación para orientar el abordaje terapéutico. El uso de tests viscoelásticos en el posoperatorio podría ayudar a orientar el diagnóstico de hemorragia posoperatoria e influir en la tasa de reintervención quirúrgica por sangrado.
Al igual que otros estudios publicados hasta la fecha, no se observaron cambios significativos en los tiempos de ventilación mecánica posoperatoria ni en la incidencia de LPA[11],[12]. Con respecto a los eventos trombóticos/tromboembólicos, no hubo diferencias en su incidencia. Sin embargo, en el metaanálisis realizado por Deppe y cols[12] se observó una disminución significativa.
La transfusión de hemoderivados en cirugía cardíaca se relaciona con un aumento de infecciones en el posoperatorio[4]. Aunque se ha sugerido que la reducción en la administración de hemoderivados con el uso de tests viscoelásticos podría disminuir la incidencia de infecciones posoperatorias, ningún estudio ha observado esta relación[11]. En nuestro estudio, hubo una disminución significativa de las infecciones posoperatorias en el grupo 2. La magnitud de esta reducción es considerablemente mayor que la disminución en la administración de hemo- derivados, lo que nos hace pensar que este cambio podría estar influenciado por otros factores. Consideramos que la pandemia de coronavirus pudo haber implicado variaciones en las medidas de prevención y en el desarrollo de infecciones nosocomiales[26].
Aunque los resultados de los diferentes metaanálisis no son concluyentes[11],[12], algunos estudios han reportado que los tests viscoelásticos en cirugía cardíaca reducen la mortalidad posoperatoria y la estancia en UCI y hospitalaria[11],[25]. En nuestro estudio no se observaron diferencias en la mortalidad, aunque hubo disminuciones significativas en la duración de la estancia en UCI y hospitalaria. Consideramos que estas disminuciones no pueden atribuirse únicamente al uso de la técnica ROTEM ya que hay otros factores que pueden haber contribuido. Uno de ellos pudo haber sido la carga asistencial vivida durante la pandemia del coronavirus, que podría haber acelerado las altas del grupo 2 en las diferentes unidades asistenciales.
Diversos estudios han demostrado una reducción de costes tras la implantación de tests viscoelásticos en cirugía cardíaca[13],[27],[28]. El análisis económico realizado en nuestro estudio muestra una disminución considerable del gasto en consumo de hemoderivados y fármacos hemostáticos. Ya que el coste de realizar los tests viscoelásticos es considerable, se decidió incluir en el análisis los costes totales de los cartuchos ROTEM utilizados en el grupo 2. El balance final mostró una caída de los costes medios por paciente en torno al 30%, cifra similar a la observada en otros estudios[27],[28]. El ahorro en hemoderivados y fármacos hemostáticos obtenido mediante el uso de la técnica ROTEM es superior al coste de su implantación.
-
Limitaciones del estudio
En primer lugar, se trata de un estudio de cohortes retrospectivo y, como tal, puede contener sesgos asociados a este tipo de estudios. Como las intervenciones quirúrgicas y la atención de los pacientes involucran la participación de muchos profesionales, los procedimientos pueden haberse desviado ocasionalmente del protocolo.
La técnica ROTEM no permite evaluar la funcionalidad plaquetaria y, en algunos casos, la administración de concentrados de plaquetas se realizó excluyendo otros trastornos de la coagulación y mediante el uso de predictores de riesgo más subjetivos. La técnica ROTEM tampoco permite detectar alteraciones de la coagulación menos frecuentes, como el déficit adquirido del factor XIII o determinadas alteraciones congénitas. Algunos pacientes pueden haber presentado alguna de estas alteraciones.
En nuestro estudio no se evaluó la pérdida de sangre durante el posoperatorio ya que estos datos no se registraron sistemáticamente en todos los casos. De acuerdo con estudios similares previos, su evaluación podría haber proporcionado información adicional sobre la efectividad de la implementación de la técnica ROTEM[11],[16],[25].
En el análisis de costes solo se tomaron en cuenta los gastos relacionados con el consumo de hemoderivados, fármacos hemostáticos y tests ROTEM realizados. Existen diversos factores que son difíciles de evaluar económicamente, como el tiempo de quirófano, la estancia hospitalaria o las complicaciones postoperatorias, que también pueden influir en los costes totales.
Aunque no se observaron diferencias significativas en las características basales de los grupos, no se puede descartar que el inicio de la pandemia de coronavirus a principios de 2020 haya podido afectar de alguna forma al manejo perioperatorio de los pacientes.
-
Conclusiones
La implementación de la técnica ROTEM en cirugía cardíaca permitió una reducción del número de pacientes que recibieron CH, PFC, concentrados de plaquetas y rFVIIa. También permitió una disminución en la cantidad total de CH, concentrados de plaquetas, PFC, concentrado de fibrinógeno y rFVIIa administrados por paciente.
Se observó una menor incidencia de infección posoperatoria en el grupo de pacientes manejados con ROTEM (5,3% vs 10,3%; p = 0,013) junto con una menor estancia en UCI (mediana de 3 días vs 4 días; p < 0,001) y en el hospital (mediana de 8 días vs 11 días; p < 0,001). Estos cambios podrían estar influenciados por otros factores de confusión.
Se observó una disminución de aproximadamente 30% en el coste medio por paciente tras la implantación de la técnica ROTEM (633,31 euros frente a 921,00 euros).
En resumen, la tromboelastometría permite un adecuado diagnóstico y tratamiento de las alteraciones de la hemostasia en cirugía cardíaca y una reducción de la administración de hemoderivados y fármacos hemostáticos, además de abaratar costes. Se requieren más estudios que aporten más evidencia sobre el uso de tests viscoelásticos en cirugía cardíaca y la reducción de la morbimortalidad.
Agradecimientos: Agradecemos a D. Bordonaba-Bosque y J.A. López-Cabañas por su ayuda con el análisis estadístico y el diseño de los gráfcios.
Referencias
1. Shander A, Moskowitz D, Rijhwani TS. The safety and efficacy of “bloodless” cardiac surgery. Semin Cardiothorac Vasc Anesth. 2005 Mar;9(1):53–63. https://doi.org/10.1177/108925320500900106 PMID:15735844
2. Murphy GJ, Reeves BC, Rogers CA, Rizvi SI, Culliford L, Angelini GD. Increased mortality, postoperative morbidity, and cost after red blood cell transfusion in patients having cardiac surgery. Circulation. 2007 Nov;116(22):2544–52. https://doi.org/10.1161/CIRCULATIONAHA.107.698977 PMID:17998460
3. Görlinger K, Shore-Lesserson L, Dirkmann D, Hanke AA, Rahe-Meyer N, Tanaka KA. Management of hemorrhage in cardiothoracic surgery. J Cardiothorac Vasc Anesth. 2013 Aug;27(4 Suppl):S20–34. https://doi.org/10.1053/j.jvca.2013.05.014 PMID:23910533
4. Horvath KA, Acker MA, Chang H, Bagiella E, Smith PK, Iribarne A, et al. Blood transfusion and infection after cardiac surgery. Ann Thorac Surg. 2013 Jun;95(6):2194–201. https://doi.org/10.1016/j.athoracsur.2012.11.078 PMID:23647857
5. Woodman RC, Harker LA. Bleeding complications associated with cardiopulmonary bypass. Blood. 1990 Nov;76(9):1680–97. https://doi.org/10.1182/blood.V76.9.1680.1680 PMID:2224118
6. Royston D, Kovesi T, Marczin N. The unwanted response to cardiac surgery: time for a reappraisal? J Thorac Cardiovasc Surg. 2003 Jan;125(1):32–5. https://doi.org/10.1067/mtc.2003.6 PMID:12538980
7. Despotis G, Eby C, Lublin DM. A review of transfusion risks and optimal management of perioperative bleeding with cardiac surgery. Transfusion. 2008 Mar;48(1 Suppl):2S–30S. https://doi.org/10.1111/j.1537-2995.2007.01573.x PMID:18302579
8. Paone G, Spencer T, Silverman NA. Blood conservation in coronary artery surgery. Surgery. 1994 Oct;116(4):672–7. PMID:7940165
9. Avidan MS, Alcock EL, Da Fonseca J, Ponte J, Desai JB, Despotis GJ, et al. Comparison of structured use of routine laboratory tests or near-patient assessment with clinical judgement in the management of bleeding after cardiac surgery. Br J Anaesth. 2004 Feb;92(2):178–86. https://doi.org/10.1093/bja/aeh037 PMID:14722166
10. Brevig J, McDonald J, Zelinka ES, Gallagher T, Jin R, Grunkemeier GL. Blood transfusion reduction in cardiac surgery: multidisciplinary approach at a community hospital. Ann Thorac Surg. 2009 Feb;87(2):532–9. https://doi.org/10.1016/j.athoracsur.2008.10.044 PMID:19161774
11. Li C, Zhao Q, Yang K, Jiang L, Yu J. Thromboelastography or rotational thromboelastometry for bleeding management in adults undergoing cardiac surgery: a systematic review with meta-analysis and trial sequential analysis. J Thorac Dis. 2019 Apr;11(4):1170–81. https://doi.org/10.21037/jtd.2019.04.39 PMID:31179059
12. Deppe AC, Weber C, Zimmermann J, Kuhn EW, Slottosch I, Liakopoulos OJ, et al. Point-of-care thromboelastography/thromboelastometry-based coagulation management in cardiac surgery: a meta-analysis of 8332 patients. J Surg Res. 2016 Jun;203(2):424–33. https://doi.org/10.1016/j.jss.2016.03.008 PMID:27363652
13. Whiting P, Al M, Westwood M, Ramos IC, Ryder S, Armstrong N, et al. Viscoelastic point-of-care testing to assist with the diagnosis, management and monitoring of haemostasis: a systematic review and cost-effectiveness analysis. Health Technol Assess. 2015 Jul;19(58):1–228. https://doi.org/10.3310/hta19580 PMID:26215747
14. Karrar S, Reniers T, Filius A, Bunge JJ, Bekkers JA, Hoeks SE, et al. Filius A y cols. Rotational thromboelastometry-guided transfusion protocol to reduce allogeneic blood transfusion in proximal aortic surgery with deep hypothermic circulatory arrest. J Cardiothorac Vasc Anesth. 2022 Apr;36(4):1029–39. https://doi.org/10.1053/j.jvca.2021.08.020 PMID:34518103
15. Tanaka KA, Bolliger D, Vadlamudi R, Nimmo A. Rotational thromboelastometry (ROTEM)-based coagulation management in cardiac surgery and major trauma. J Cardiothorac Vasc Anesth. 2012 Dec;26(6):1083–93. https://doi.org/10.1053/j.jvca.2012.06.015 PMID:22863406
16. Meco M, Montisci A, Giustiniano E, Greco M, Pappalardo F, Mammana L, et al. Giustiniano E y cols. Viscoelastic blood tests use in adult cardiac surgery: meta-analysis, meta-regression, and trial sequential analysis. J Cardiothorac Vasc Anesth. 2020 Jan;34(1):119–27. https://doi.org/10.1053/j.jvca.2019.06.030 PMID:31445833
17. Ferraris VA, Ferraris SP, Saha SP, Hessel EA 2nd, Haan CK, Royston BD, et al.; Society of Thoracic Surgeons Blood Conservation Guideline Task Force; Society of Cardiovascular Anesthesiologists Special Task Force on Blood Transfusion. Perioperative blood transfusion and blood conservation in cardiac surgery: the Society of Thoracic Surgeons and The Society of Cardiovascular Anesthesiologists clinical practice guideline. Ann Thorac Surg. 2007 May;83(5 Suppl):S27–86. https://doi.org/10.1016/j.athoracsur.2007.02.099 PMID:17462454
18. Thomas D, Wee M, Clyburn P, Walker I, Brohi K, Collins P, et al.; Association of Anaesthetists of Great Britain and Ireland. Blood transfusion and the anaesthetist: management of massive haemorrhage. Anaesthesia. 2010 Nov;65(11):1153–61. https://doi.org/10.1111/j.1365-2044.2010.06538.x PMID:20963925
19. Dhir A, Tempe DK. Anemia and Patient Blood Management in Cardiac Surgery-Literature Review and Current Evidence. J Cardiothorac Vasc Anesth. 2018 Dec;32(6):2726–42. https://doi.org/10.1053/j.jvca.2017.11.043 PMID:29307702
20. Vivas D, Roldán I, Ferrandis R, Marín F, Roldán V, Tello-Montoliu A, et al.; Expert reviewers. Perioperative and Periprocedural Management of Antithrombotic Therapy: consensus Document of SEC, SEDAR, SEACV, SECTCV, AEC, SECPRE, SEPD, SEGO, SEHH, SETH, SEMERGEN, SEMFYC, SEMG, SEMICYUC, SEMI, SEMES, SEPAR, SENEC, SEO, SEPA, SERVEI, SECOT and AEU. Rev Esp Cardiol (Engl Ed). 2018 Jul;71(7):553–64. https://doi.org/10.1016/j.rec.2018.01.029 PMID:29887180
21. Eiguren-Goitiz K, García-Asenjo M. Manejo de la resistencia y la sensibilidad de heparina en circulación extracorpórea. Revista Española de Perfusión. 2015;59:25–30.
22. Görlinger K, Pérez-Ferrer A, Dirkmann D, Saner F, Maegele M, Calatayud ÁA, et al. The role of evidence-based algorithms for rotational thromboelastometry-guided bleeding management. Korean J Anesthesiol. 2019 Aug;72(4):297–322. https://doi.org/10.4097/kja.19169 PMID:31096732
23. Shore-Lesserson L, Manspeizer HE, DePerio M, Francis S, Vela-Cantos F, Ergin MA. Thromboelastography-guided transfusion algorithm reduces transfusions in complex cardiac surgery. Anesth Analg. 1999 Feb;88(2):312–9. https://doi.org/10.1213/00000539-199902000-00016 PMID:9972747
24. Biancari F, Kinnunen EM, Kiviniemi T, Tauriainen T, Anttila V, Airaksinen JK, et al. Kiviniemi T y cols. Meta-analysis of the sources of bleeding after adult cardiac surgery. J Cardiothorac Vasc Anesth. 2018 Aug;32(4):1618–24. https://doi.org/10.1053/j.jvca.2017.12.024 PMID:29338997
25. Dias JD, Sauaia A, Achneck HE, Hartmann J, Moore EE. Thromboelastography-guided therapy improves patient blood management and certain clinical outcomes in elective cardiac and liver surgery and emergency resuscitation: A systematic review and analysis. J Thromb Haemost. 2019 Jun;17(6):984–94. https://doi.org/10.1111/jth.14447 PMID:30947389
26. Su C, Zhang Z, Zhao X, Peng H, Hong Y, Huang L, et al. Changes in prevalence of nosocomial infection pre- and post-COVID-19 pandemic from a tertiary Hospital in China. BMC Infect Dis. 2021 Jul;21(1):693. https://doi.org/10.1186/s12879-021-06396-x PMID:34281515
27. Spalding GJ, Hartrumpf M, Sierig T, Oesberg N, Kirschke CG, Albes JM. Cost reduction of perioperative coagulation management in cardiac surgery: value of “bedside” thrombelastography (ROTEM). Eur J Cardiothorac Surg. 2007 Jun;31(6):1052–7. https://doi.org/10.1016/j.ejcts.2007.02.022 PMID:17398108
28. Haensig M, Kempfert J, Kempfert PM, Girdauskas E, Borger MA, Lehmann S. Kempfert PM y cols. Thrombelastometry guided blood-component therapy after cardiac surgery: A randomized study. BMC Anesthesiol. 2019;19(1):1–10. https://doi.org/10.1186/s12871-019-0875-7.

 ORCID
ORCID