Edgar Andres Duran Mendoza1,*, Manuel Felipe Pardo Fonseca1
Recibido: 12-07-2023
Aceptado: 23-08-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 7 pp. 662-677|https://doi.org/10.25237/revchilanestv52n7-06
PDF|ePub|RIS
Perioperative nefopam
Abstract
Nefopam is a non-opioid, non-NSAID, centrally acting analgesic with multiple mechanisms of action that has been used as a perioperative analgesic. We conducted a systematic review to assess the efficacy of nefopam as a perioperative analgesic. A search strategy was applied in 5 databases where 684 articles were obtained, including 19 articles on nefopam in monotherapy and 13 articles on nefopam as a combination therapy. Regarding analgesic efficacy, nefopam does not appear to be superior to other drugs, but its combined use does reduce perioperative opioid consumption, as observed in about half of the studies. In conclusion, nefopam can be used as an adjuvant drug to current analgesic management rather than as a replacement of it. Furthermore, it is helpful to reduce the consumption of perioperative opioids and in patients with contraindications for other analgesics.
Resumen
El nefopam es un analgésico no opioide, no AINE (Antiinflamatorio no esteroideo), con efecto de acción central, con múltiples mecanismos de acción que ha sido empleado como analgésico perioperatorio. Llevamos a cabo una revisión sistemática para evaluar la eficacia del nefopam como analgésico periperatorio. Se aplicó una estrategia de búsqueda en 5 bases de datos donde se obtuvieron 684 artículos, de los cuales se incluyeron 19 artículos del nefopam en monoterapia y 13 artículos del nefopam en terapia combinada. En cuanto a eficacia analgésica, el nefopam no demostró ser superior a otros medicamentos, pero su uso combinado sí disminuyó el consumo de opioide perioperatorio según lo evidenciado en aproximadamente la mitad de los estudios. En conclusión, el nefopam puede ser usado como un fármaco adyuvante en el manejo analgésico, más que como terapia única. Siendo útil como ahorrador de opioides perioperatorios y en pacientes con contraindicación para otros analgésicos.
-
Introducción
En la última revisión de la asociación internacional para el estudio del dolor, se definió éste como una experiencia sensorial y emocional desagradable asociada o, similar a la asociada a una lesión tisular real o potencial[1]. El dolor puede ser secundario a diferentes causas, como a lesiones tisulares o por inflamación, entre otras. Asimismo, es percibido de manera diferente por cada persona debido a las variaciones psicológicas interindividuales[2]. El dolor puede ser clasificado por su causa, ya sea secundario a patologías o intervenciones quirúrgicas.
El dolor secundario a un procedimiento quirúrgico (posoperatorio) es una respuesta normal a la intervención quirúrgica que ocurre de manera secundaria a la inflamación y a la lesión directa del tejido o al daño de las fibras nerviosas. De esta misma manera, se clasifica dentro de tres categorías: nociceptivo, inflamatorio y patológico neuropático[3].
Las intervenciones quirúrgicas generan un dolor nociceptivo que está directamente relacionado con el trauma tisular que se presenta en el momento de la cirugía; este trauma genera liberación de mediadores inflamatorios como citoquinas y prostaglandinas el cual produce un dolor (inflamatorio) que puede persistir en el tiempo. Finalmente, puede producir dolor patológico neuropático, secundario a un daño tisular que genere una lesión nerviosa[3].
Actualmente, el manejo del dolor posoperatorio se centra en diferentes fármacos que ayudan a modular o inhibir la percepción del dolor. Estos fármacos se pueden clasificar en dos grandes grupos: opioides y no opioides; estos últimos, actúan en diferentes niveles bloqueando la transmisión neuronal por medio de anestésicos locales, disminuyendo la respuesta inflamatoria (AINEs) e inhibiendo vías excitatorias o activando vías inhibitorias (acetaminofén, ketamina, clonidina, dexmedetomi- dina, gabapentina y pregabalina)[3],[4].
A pesar de las diferentes técnicas para el manejo del dolor posoperatorio, aun muchos pacientes presentan dolor moderado o severo en el posoperatorio lo que conlleva a mayores complicaciones como: baja satisfacción del paciente, aumento de la morbimortalidad, retraso en la recuperación, egreso retardado, aumento de infección de herida quirúrgica, complicaciones car- diorrespiratorias, entre otros[3],[4].
Dentro de las alternativas para el control del dolor posoperatorio, el nefopam es un analgésico no opioide, no AINE, derivado de la benzoxazocina con efecto de acción central desarrollado inicialmente en los años 70 como antidepresivo, aunque hoy en día se encuentra como parte del manejo multimodal del dolor[5],[6]. El mecanismo de acción más ampliamente dilucidado es la inhibición de la recaptación de serotonina, norepinefrina y dopamina, así como la modulación de la transmisión glutamatérgica por medio de la inhibición de receptores NMDA (N-metil-D-aspartato)[5].
Otros mecanismos de acción descritos son la inhibición de canales de sodio y calcio en el área sináptica del asta dorsal de la médula espinal, la disminución de la liberación de glu- tamato por inhibición de los canales de sodio y calcio voltaje- dependientes, la inhibición del flujo de calcio y reducción de la expresión del receptor de neurokinina-1 inhibiendo así, la señalización por medio de la sustancia P y neurokinina-1[7],[8]. Debido a sus múltiples mecanismos de acción es considerado una opción para el manejo analgésico multimodal. Por esta razón, se realizó esta revisión sistemática de la literatura acerca del uso perioperatorio del nefopam.
-
Metodología
Siguiendo las guías PRISMA para revisiones sistemáticas[9], dos investigadores (ED y MP), realizaron una revisión de la literatura. Las bases de datos incluidas fueron PubMed (Medline), Embase, LILACS, Scopus y ProQuest One Academic. Para esta búsqueda, se utilizaron términos Mesh y sus relacionados para cada uno de los componentes de la pregunta PICO. Posteriormente, se hizo la combinación de cada término con operadores [OR], realizando una búsqueda inicial en cada uno de los componentes de la pregunta PICO, finalmente se combinaron los componentes de la pregunta PICO con operador [AND] (Anexo 1).
De los resultados obtenidos en todas las bases de datos mediante el uso de la herramienta Rayyan[10], se realizó un cribado inicial excluyendo los artículos duplicados. Posteriormente, se realizó una lectura de los títulos y abstracts seleccionando los artículos que cumplieran los criterios de selección para luego ser leídos y finalmente, tomar los artículos que serían incluidos en la revisión final.
Cada artículo fue sometido a una revisión de sesgos individual por los dos investigadores mediante el uso de la herramienta RoB2.0 para ensayos clínicos aleatorizados[11](Anexo 2).
-
Criterios de inclusión y exclusión
Los estudios seleccionados para ser incluidos en la revisión sistemática fueron los que cumplieron lo siguiente:
– Ensayos clínicos aleatorizados.
– Población mayor de 18 años.
– Comparación nefopam con placebo y/u otro medicamento.
– Publicados en inglés o español.
Se excluyeron de la revisión sistemática los artículos que cumplían lo siguiente:
– Procedimiento quirúrgico cirugía cardiovascular y/o obstétrica.
– Estudios realizados en población de embarazadas.
– Estudios realizados en animales.
-
Resultados
Después de realizar la búsqueda de la literatura en bases de datos, se obtuvieron 684 artículos. De estos artículos, fueron seleccionados 32 para ser incluidos en la revisión sistemática (Figura 1). De éstos, 19 artículos fueron de nefopam en monoterapia y 13 fueron artículos en terapia combinada (Tabla 1 y 2).
Efectos analgésicos
La evaluación del efecto analgésico del nefopam es compleja, pues dentro de la literatura no se cuenta con estudios con dosis estandarizadas. Hubo heterogeneidad en el momento de la aplicación del medicamento (al inicio o al final), así como de las dosis utilizadas y el esquema de administración (bolos 20 – 40 mg o infusiones de 2 mg/h hasta infusiones de 10 mg/h).
Dentro de los estudios incluidos se comparó el nefopam en monoterapia, en terapia combinada (fentanil, ketorolaco, morfina, parecoxib), y en polifarmacia (naproxeno, acetaminofén y analgesia regional). En los que el nefopam fue usado en monoterapia, se demostró un menor puntaje del dolor hasta en 50% en comparación con placebo u otra terapia. De igual manera, cuando éste fue usado en terapia combinada, demostró ser superior en 30% vs el comparador. Sin embargo, al unirse con analgesia multimodal no demostró reducir los puntajes de dolor.
Efectos en medicación de rescate
En cuanto al efecto ahorrador de medicación de rescate durante el posoperatorio, se demostró una reducción significativa, principalmente con la morfina en 50%. Por otro lado, cuando el nefopam fue usado en terapia combinada con otros fármacos, este efecto se mantuvo cerca de 40%.
Efectos adversos
Dentro de los principales efectos reportados se incluyen taquicardia, náuseas, vómito, boca seca, sudoración, entre otros. No existió una diferencia estadísticamente significativa en el aumento de eventos adversos con el uso del nefopam, tanto en monoterapia como en terapia combinada.
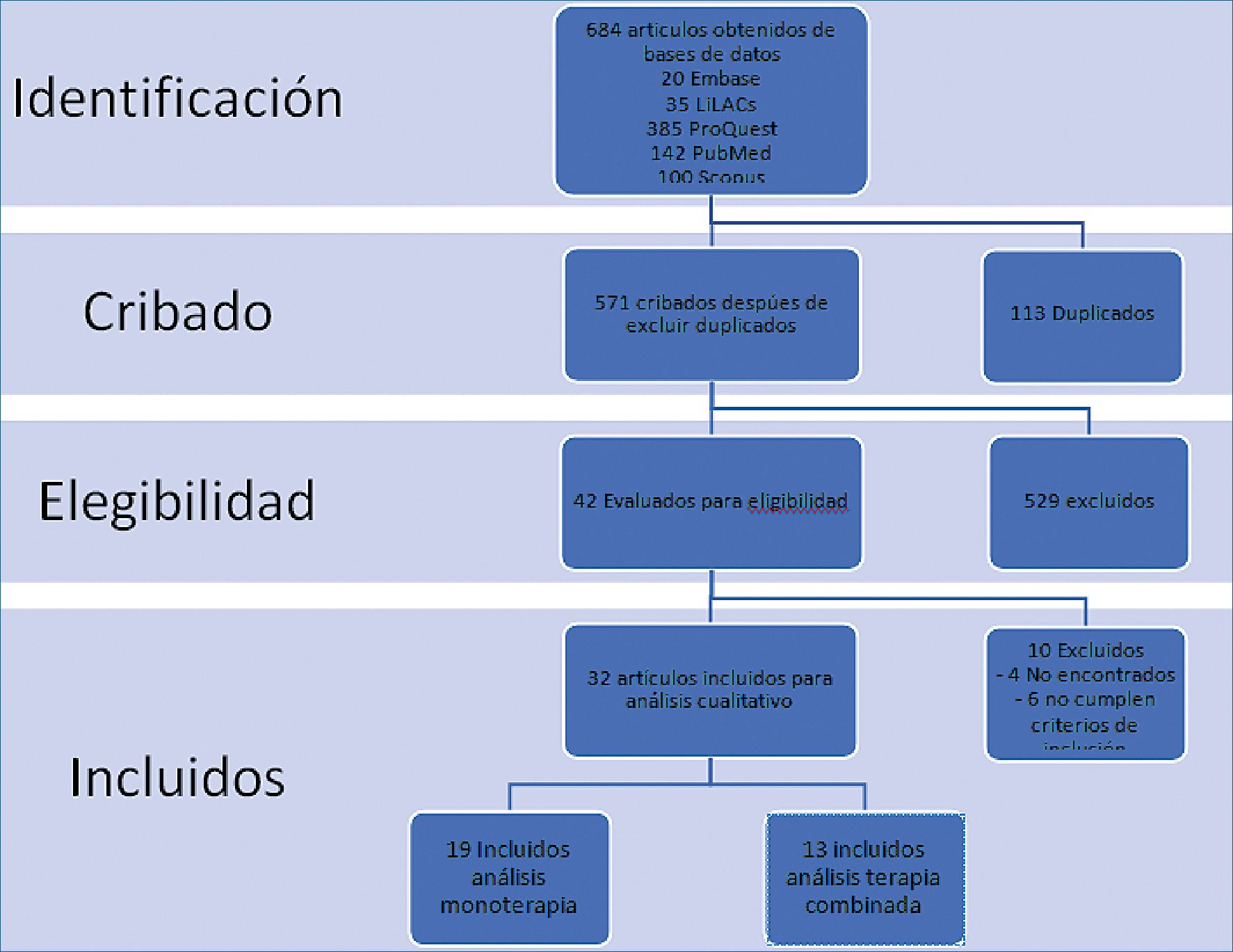
Figura 1. Resultado búsqueda en base de datos.
-
Discusión
Se ha estudiado el nefopam para uso como analgésico posoperatorio desde hace varias décadas con estudios a favor y en contra de su uso. En el año 2008, se realizó una revisión sistemática por Evans et al., en la cual se concluía que el nefopam podría ser útil como analgésico no opioide. Sin embargo, presentó limitaciones debido a dosis respuesta y no incluyó estudios con analgesia multimodal[12]. Por esta razón y ante la nueva información disponible desde ese año hasta la actualidad, se hacía pertinente la realización de una actualización acerca del uso de este medicamento.
En la publicación de Evans et al., incluyeron 9 artículos, con 359 pacientes analizados, en el cual se encontró que, comparado con placebo, el uso de nefopam disminuyó el consumo de opioides y la intensidad del dolor. De este modo concluyeron que es útil como fármaco analgésico no opioide en paciente quirúrgicos, sin embargo, se evidenció un aumento de los efectos adversos como taquicardia y sudoración[12].
En el presente estudio se incorporó literatura nueva, posterior a la última revisión sistemática realizada por Evans et al., con artículos publicados hasta el 13 de marzo de 2023. Se incluyeron 32 artículos los cuales eran ensayos clínicos aleatoriza- dos. De éstos, 19 utilizaron nefopam en monoterapia para un total de 1.539 pacientes y 13 de ellos lo utilizaron en terapia combinada incluyendo 1.074 pacientes.
En el 25% de los estudios en los que se utilizó nefopam como monoterapia, demostró ser superior al uso de placebo. Sin embargo, en el restante 75% no se demostró superioridad al placebo o al uso de otros fármacos como ketorolaco, fentanil o ketamina en cuanto a disminución de dolor posoperatorio.
En los estudios en los que el nefopam fue empleado en te rapia combinada, éste fue usado mayoritariamente junto a un opioide como fentanil, morfina o hidromorfona. En 4 de los estudios fue usado junto a un AINE y en un solo estudio se combinó con un analgésico no opioide (ketamina). En estos estudios, cerca del 30% demostró que el uso de nefopam disminuyó el dolor posoperatorio. No obstante, cerca del 50% no demostró reducción del dolor y el 20% restante fue parcialmente superior en comparación con el uso de opioide sólo, más no cuando el opioide se asociaba a ketamina.
En cuanto al uso de medicación de rescate cuando se usó nefopam en terapia combinada, en cerca del 50% de los estudios se demostró una disminución de medicación de rescate siendo los opioides los medicamentos más empleados.
Respecto a los efectos adversos, en la mayoría de los estudios el uso de nefopam no aumentó la incidencia de taquicardia, náuseas, vómito, boca seca, sudoración u otros efectos adversos. Contrario a los hallazgos publicados en la revisión sistemática de Evans et al., que fundamentaban el temor de su uso en el período perioperatorio y en poblaciones específicas de pacientes[12].
Nuestros hallazgos son comparables con estudios previos como en el publicado por Beloeil H. et al., el cual fue un ensayo clínico multicéntrico aleatorizado, en el que concluyeron que el uso de nefopam en terapia combinada (paracetamol y ketoprofeno) disminuyó el consumo de opioide comparado con el placebo y nefopam en monoterapia[13].
Es importante recalcar que en solo un estudio realizado por Pinsornsak et al., el nefopam fue comparado con la terapia analgésica actual convencional con uso de dos fármacos no opioides y analgesia regional demostrando disminución del dolor en las primeras 6 horas posoperatorias y disminución de consumo opioide en el posoperatorio[14].
Los hallazgos del presente estudio son importantes ya que el dolor es una de las principales quejas de los pacientes sometidos a un procedimiento quirúrgico. Dentro de la fisiopatolo- gía se encuentra la inflamación, la lesión directa del tejido o el daño a las fibras nerviosas[3]. Todo lo anterior se traduce en un aumento de las complicaciones perioperatorias incluidas la baja satisfacción del paciente, aumento de la morbimortalidad, prolongación de la recuperación, egreso retardado, aumento de infección del sitio operatorio, complicaciones cardiorrespiratorias, entre otros[3],[4].
Debido a lo anterior, se cuenta con diferentes estrategias de manejo analgésico, mediante la combinación de varios fármacos y/o técnicas que atacan diferentes vías del dolor. Dentro de éstas destacan los fármacos opioides, el uso de anestésicos locales, los AINEs y fármacos que actúan en las vías descendentes regulatorias del dolor en la médula espinal, como lo son: el ace- taminofén, la ketamina, la clonidina, dexmedetomidina, gabapentina o pregabalina[3],[4]. A pesar de estas técnicas, aún se presenta el dolor posoperatorio en casi 80% de los pacientes, en donde el 75% corresponde a dolor moderado o severo[4].
Por esta razón, se hace importante la utilización de medicamentos adyuvantes como lo es el nefopam, que se tiene disponible en el mercado desde hace varias décadas; sin embargo, su uso no se ha extendido por numerosos factores como el temor de sus efectos adversos. Gracias a que tiene múltiples mecanismos de acción como efecto inhibidor en la recaptación de serotonina, norepinefrina y dopamina, con efectos reguladores de la transmisión glutamatérgica por medio de la inhibición de receptores NMDA, adicionalmente inhibidor de canal de sodio y calcio en el asta dorsal de la médula espinal, cuya inhibición disminuye la liberación de glutamato, la inhibición del flujo de calcio, y la reducción de la expresión del receptor de neurokinina-1[5]-[8]. Todo lo anterior lo convierte en un fármaco ideal para el esquema analgésico multimodal.
En cuanto a limitaciones de la presente revisión, se debe tener en cuenta que en la mayoría de los estudios el nefopam fue usado en monoterapia o en combinación con un solo fármaco, principalmente opioides. Esto representa una limitación dado que esta no es la terapia analgésica actual recomendada en pacientes quirúrgicos. Actualmente, la recomendación es el uso
de 2 o más fármacos no opioides y otras técnicas de analgesia regional para el manejo del dolor posoperatorio. Adicionalmente, muchos de los estudios no tienen una dosis del nefopam estandarizada, lo que deja en evidencia la falta de literatura acerca de la dosis para su uso perioperatorio.
-
Conclusiones
Cuando se resume esta evidencia obtenida, se observa que el uso de nefopam puede ser empleado como fármaco adyuvante al manejo analgésico actual o, alternativo en pacientes con contraindicaciones para uso de otros fármacos. Adicionalmente, puede ser empleado para reducir el consumo de opioides perioperatorios en los pacientes, sin aumentar la incidencia de efectos adversos. No obstante, faltan más estudios que permitan comparar el nefopam con terapias actuales analgésicas perioperatorias en combinación con múltiples fármacos analgésicos no opioides y técnicas de analgesia regional y, de la misma manera, que permitan establecer la dosis analgésica adecuada para su uso.
Referencias
1. Raja SN, Carr DB, Cohen M, Finnerup NB, Flor H, Gibson S, et al. The revised International Association for the Study of Pain definition of pain: concepts, challenges, and compromises. Pain. 1 de septiembre de 2020;161(9):1976-82. https://doi.org/10.1097/j.pain.0000000000001939.
2. Pérez Fuentes J. Versión actualizada de la definición de dolor de la IASP: un paso adelante o un paso atrás. Rev Soc Esp Dolor. agosto de 2020;27(4):232-3.
3. Lovich-Sapola J, Smith CE, Brandt CP. Postoperative pain control. Surg Clin North Am. abril de 2015;95(2):301-18. https://doi.org/10.1016/j.suc.2014.10.002.
4. Chou R, Gordon DB, de Leon-Casasola OA, Rosenberg JM, Bickler S, Brennan T, et al. Management of Postoperative Pain: A Clinical Practice Guideline From the American Pain Society, the American Society of Regional Anesthesia and Pain Medicine, and the American Society of Anesthesiologists’ Committee on Regional Anesthesia, Executive Committee, and Administrative Council. J Pain. febrero de 2016;17(2):131-57.
5. Lekprasert V, Yapanan L, Ittichaikulthol W, Buachai R, Soisod P, Sophonsritsuk A. Perioperative Intravenous Patient-Controlled Analgesic Efficacy of Morphine with Combined Nefopam and Parecoxib versus Parecoxib in Gynecologic Surgery: A Randomized, Double-Blind Study. Pearl RG, editor. Anesthesiol Res Pract. 12 de febrero de 2021;2021:1-7.
6. Jung KT, So KY, Kim SC, Kim SH. Effect of Nefopam-Based Patient-Controlled Analgesia with and without Fentanyl on Postoperative Pain Intensity in Patients Following Laparoscopic Cholecystectomy: A Prospective, Randomized, Controlled, Double-Blind Non-Inferiority Trial. Med Kaunas Lith. 27 de marzo de 2021;57(4):316.
7. Chalermkitpanit P, Limthongkul W, Yingsakmongkol W, Thepsoparn M, Pannangpetch P, Tangchitcharoen N, et al. Analgesic Effect of Intravenous Nefopam for Postoperative Pain in Minimally Invasive Spine Surgery: A Randomized Prospective Study. Asian Spine J. octubre de 2022;16(5):651-7. https://doi.org/10.31616/asj.2021.0337.
8. Pasutharnchat K, Wichachai W, Buachai R. Analgesic efficacy of nefopam for cancer pain: a randomized controlled study. F1000Research. 19 de mayo de 2020;9:378.
9. Page MJ, McKenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. Syst Rev. diciembre de 2021;10(1):89.
10. Rayyan – AI Powered Tool for Systematic Literature Reviews [Internet]. 2021 [citado 12 de marzo de 2023]. Disponible en: https://www.rayyan.ai/
11. Risk of bias tools – RoB 2 tool [Internet]. [citado 19 de abril de 2023]. Disponible en: https://sites.google.com/site/riskofbiastool/welcome/rob-2-0-tool
12. Evans MS, Lysakowski C, Tramèr MR. Nefopam for the prevention of postoperative pain: quantitative systematic review. Br J Anaesth. 1 de noviembre de 2008;101(5):610-7. https://doi.org/10.1093/bja/aen267.
13. Beloeil H, Albaladejo P, Sion A, Durand M, Martinez V, Lasocki S, et al. Multicentre, prospective, double-blind, randomised controlled clinical trial comparing different non-opioid analgesic combinations with morphine for postoperative analgesia: the OCTOPUS study. Br J Anaesth. junio de 2019;122(6):e98-106. https://doi.org/10.1016/j.bja.2018.10.058.
14. Pinsornsak P, Sukkarnkosol S, Boontanapibul K. Does Nefopam Provide Analgesic Effect and Reduce Morphine Consumption After Primary Total Knee Arthroplasty? A Prospective, Double-Blind, Randomized Controlled Trial. J Arthroplasty. mayo de 2022;37(5):845-50.
15. Park HJ, Park JU, Yoo W, Moon YE. Analgesic effects of nefopam in patients undergoing bimaxillary osteotomy: A double-blind, randomized, placebo-controlled study. J Cranio-Maxillofac Surg. febrero de 2016;44(2):210-4.
16. Koh HJ, Joo J, Kim YS, Lee YJ, Yoo W, Lee MS, et al. Analgesic Effect of Low Dose Nefopam Hydrochloride after Arthroscopic Rotator Cuff Repair: A Randomized Controlled Trial. J Clin Med. 24 de abril de 2019;8(4):553.
17. Eiamcharoenwit J, Chotisukarat H, Tainil K, Attanath N, Akavipat P. Analgesic efficacy of intravenous nefopam after spine surgery: a randomized, double-blind, placebo-controlled trial. F1000 Res. 2020 Jun;9:516. https://doi.org/10.12688/f1000research.22909.1 PMID:32934804
18. Hwang BY, Kwon JY, Lee DW, Kim E, Kim TK, Kim HK. A Randomized Clinical Trial of Nefopam versus Ketorolac Combined With Oxycodone in Patient-Controlled Analgesia after Gynecologic Surgery. Int J Med Sci. 30 de julio de 2015;12(8):644-9. https://doi.org/10.7150/ijms.11828.
19. Cuvillon P, Zoric L, Demattei C, Alonso S, Casano F. L’’’’’Hermite J, et al. Opioid-sparing effect of nefopam in combination with paracetamol after major abdominal surgery: a randomized double-blind study. Minerva Anestesiol [Internet]. septiembre de 2017 [citado 10 de marzo de 2023];83(9). Disponible en: https://www.minervamedica.it/index2.php?show=R02Y2017N09A0914
20. Oh CS, Jung E, Lee SJ, Kim SH. Effect of nefopam- versus fentanyl-based patient-controlled analgesia on postoperative nausea and vomiting in patients undergoing gynecological laparoscopic surgery: a prospective double-blind randomized controlled trial. Curr Med Res Opin. 3 de agosto de 2015;31(8):1599-607.
21. Li M, Li L, Xu YT, Wang X. Intravenous analgesics for pain management in postoperative patients: a comparative study of their efficacy and adverse effects. Trop J Pharm Res. 5 de septiembre de 2016;15(8):1799.
22. Kim SY, Huh KH, Roh YH, Oh YJ, Park J, Choi YS. Nefopam as an adjunct to intravenous patient-controlled analgesia after renal transplantation: a randomised trial. Acta Anaesthesiol Scand. septiembre de 2015;59(8):1068-75. https://doi.org/10.1111/aas.12519.
23. Kim BG, Moon JY, Choi JY, Park IS, Oh AY, Jeon YT, et al. The Effect of Intraoperative Nefopam Administration on Acute Postoperative Pain and Chronic Discomfort After Robotic or Endoscopic Assisted Thyroidectomy: A Randomized Clinical Trial. World J Surg. julio de 2018;42(7):2094-101. https://doi.org/10.1007/s00268-017-4421-9.
24. Lim H, Kang S, Kim B, Ko S. Comparison Between Preoperative and Intraoperative Administration of Nefopam for Acute and Chronic Postoperative Pain in Colon Cancer Patients: A Prospective, Randomized, Double-Blind Study. World J Surg. diciembre de 2019;43(12):3191-7.
25. Na HS, Oh AY, Ryu JH, Koo BW, Nam SW, Jo J, et al. Intraoperative Nefopam Reduces Acute Postoperative Pain after Laparoscopic Gastrectomy: a Prospective, Randomized Study. J Gastrointest Surg. mayo de 2018;22(5):771-7.
26. Yoon JU, Byeon GJ, Cheon JH, Choi YM, Ri HS, Baik SW. Post-operative intravenous patient-controlled analgesic efficacy of morphine with ketorolac versus nefopam after laparoscopic gynecologic surgery: a randomized non-inferiority trial. Korean J Anesthesiol. 2016 Apr;69(2):161–6. https://doi.org/10.4097/kjae.2016.69.2.161 PMID:27066208
27. Yoo JY, Lim BG, Kim H, Kong MH, Lee IO, Kim NS. The analgesic effect of nefopam combined with low dose remifentanil in patients undergoing middle ear surgery under desflurane anesthesia: a randomized controlled trial. Korean J Anesthesiol. 2015 Feb;68(1):43–9. https://doi.org/10.4097/kjae.2015.68.1.43 PMID:25664155
28. McLintock TT, Kenny GN, Howie JC, McArdle CS, Lawrie S, Aitken H. Assessment of the analgesic efficacy of nefopam hydrochloride after upper abdominal surgery: a study using patient controlled analgesia. Br J Surg. 1988 Aug;75(8):779–81. https://doi.org/10.1002/bjs.1800750818 PMID:3167526
29. Park M, Jee CH, Kwak KH, Park JM, Kim JH. The effect of preoperative nefopam treatment on postoperative catheter-related bladder discomfort in patients undergoing transurethral bladder tumor resection: a randomized double-blind study. Scand J Urol. 2 de noviembre de 2018;52(5-6):389-94. https://doi.org/10.1080/21681805.2018.1524929.
30. Raksakietisak M, Rushatamukayanunt P, Wilaiwan K, Homprasert C, Nitising A, Sawasdiwipachai P, et al. Postoperative analgesia of intraoperative nefopam in patients undergoing anterior cervical spine surgery: A prospective randomized controlled trial. Medicine (Baltimore). 28 de octubre de 2022;101(43):e31296. https://doi.org/10.1097/MD.0000000000031296.
31. Yoon S, Lee HB, Na KJ, Park S, Bahk J, Lee HJ. Effect of Continuous Infusion of Intravenous Nefopam on Postoperative Opioid Consumption After Video-assisted Thoracic Surgery: A Double-blind Randomized Controlled Trial. Pain Physician. 2022 Sep;25(6):491–500. PMID:36122258
32. Cheon YW, Kim SH, Paek JH, Kim JA, Lee YK, Min JH, et al. Effects of nefopam on catheter-related bladder discomfort in patients undergoing ureteroscopic litholapaxy. Korean J Anesthesiol. 1 de junio de 2018;71(3):201-6. https://doi.org/10.4097/kja.d.18.27113.
33. Du Manoir B, Aubrun F, Langlois M, Le Guern ME, Alquier C, Chauvin M, et al. Randomized prospective study of the analgesic effect of nefopam after orthopaedic surgery † †Declaration of interest. This work has been sponsored by Biocodex Laboratories, in charge of nefopam (Acupan injectableTM) commercialization. Br J Anaesth. diciembre de 2003;91(6):836-41.
34. Oh YN, Kim KN, Jeong MA, Kim DW, Kim JY, Ki HS. Effects of nefopam with fentanyl in intravenous patient-controlled analgesia after arthroscopic orthopedic surgery: a prospective double-blind randomized trial. Turk J Med Sci. 2018 Feb;48(1):142–9. https://doi.org/10.3906/sag-1707-113 PMID:29479974
35. Jin HS, Kim YC, Yoo Y, Lee C, Cho CW, Kim W joong. Opioid sparing effect and safety of nefopam in patient controlled analgesia after laparotomy: A randomized, double blind study. J Int Med Res. agosto de 2016;44(4):844-54.
36. Na HS, Oh AY, Koo BW, Lim DJ, Ryu JH, Han JW. Preventive Analgesic Efficacy of Nefopam in Acute and Chronic Pain After Breast Cancer Surgery: A Prospective, Double-Blind, and Randomized Trial. Medicine (Baltimore). mayo de 2016;95(20):e3705.
37. Lee JH, Kim JH, Cheong YK. The Analgesic Effect of Nefopam with Fentanyl at the End of Laparoscopic Cholecystectomy. Korean J Pain. 31 de octubre de 2013;26(4):361-7. https://doi.org/10.3344/kjp.2013.26.4.361.
38. Lee S, Lee S, Kim H, Oh C, Park S, Kim Y, et al. The Analgesic Efficacy of Nefopam in Patient-Controlled Analgesia after Laparoscopic Gynecologic Surgery: A Randomized, Double-Blind, Non-Inferiority Study. J Clin Med. 3 de marzo de 2021;10(5):1043.
39. Mimoz O, Incagnoli P, Josse C, Gillon MC, Kuhlman L, Mirand A, et al. Analgesic efficacy and safety of nefopam vs. propacetamol following hepatic resection*: Nefopam vs. propacetamol in hepatic resection. Anaesthesia. junio de 2001;56(6):520-5.
40. Moffat AC, Kenny GNC, Prentice JW. Postoperative nefopam and diclofenac Evaluation of their morphine-sparing effect after upper abdominal surgery. Anaesthesia. abril de 1990;45(4):302-5. https://doi.org/10.1111/j.1365-2044.1990.tb14737.x.
41. Yeo H, Choi JW, Lee S, Sim WS, Park SJ, Jeong H, et al. The Lack of Analgesic Efficacy of Nefopam after Video-Assisted Thoracoscopic Surgery for Lung Cancer: A Randomized, Single-Blinded, Controlled Trial. J Clin Med. 18 de agosto de 2022;11(16):4849.
42. Aveline C, Gautier JF, Vautier P, Cognet F, Hetet HL, Attali JY, et al. Postoperative analgesia and early rehabilitation after total knee replacement: A comparison of continuous low-dose intravenous ketamine versus nefopam. Eur J Pain. julio de 2009;13(6):613-9. https://doi.org/10.1016/j.ejpain.2008.08.003.

 ORCID
ORCID