Andrés Felipe Murillo Ruiz MD.1, Alexander Trujillo Mejía MD, MSc, PhD(C)2,3,4,*, Fernando Arango Gómez MD, MSc.3
Recibido: 01-08-2023
Aceptado: 01-09-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 7 pp. 671-677|https://doi.org/10.25237/revchilanestv52n7-07
PDF|ePub|RIS
ketonemia and glycemia in children with 3 different clear liquids one hour before surgery
Abstract
Introduction: To reduce the negative metabolic consequences of prolonged fasting in children, some pediatric anesthesia societies suggest reducing the intake of clear liquids to 1 hour before surgery. However, these recommendations do not mention the caloric content that it should have. Objetives: To determine the effect of ingesting 3 mL/kg of three types of clear liquid on the levels of ketone bodies and capillary glucose in children. Materials and Methods: Controlled, randomized, double-blind clinical trial. Children between 1 month and 47 months scheduled for ambulatory surgery between April and October 2022 were randomized using size 4 permuted blocks. There were 3 intervention groups that received 3 mL/kg of water, aguapanela, or Gatorade® one hour before anesthetic induction and 1 control group. Results: 152 children were randomized (water n: 37, aguapanela n: 40, Gatorade® n: 38 and control n: 37). Patients who received clear liquids had lower levels of ketone bodies (x: 0.36 mmol/L, 95%CI 0.3-0.42) compared to those who did not receive (x: 0.5 mmol/L, 95%CI 0.35-0.65), p: 0.004. Ketone body levels were higher in the control group (x: 0.5 mmol/L, 95%CI 0.35-0.65), compared to patients who received Gatorade® (x: 0.28mmol/L, 95%CI 0.2-0.35), aguapanela (x: 0.42 mmol/L, 95%CI 0.29-0.55), or water (x: 0.39 mmol/L, 95%CI 0.28-0.51), p 0.06. Capillary glucose levels did not present significant differences. Conclusions: Offering 3 mL/kg of clear fluids 1 hour before outpatient surgery is related to lower ketone body values, with no significant differences between the three types of fluids analyzed.
Resumen
Introducción: Con el propósito de disminuir las consecuencias metabólicas negativas del ayuno prolongado en niños, algunas sociedades de anestesia pediátrica sugieren reducir a 1 hora la ingesta de líquidos claros antes de cirugía. Sin embargo, estas recomendaciones no mencionan el contenido calórico que debe tener. Objetivos: Determinar el efecto de la ingestión de 3 mL/kg de tres tipos de líquido claro en los niveles de cuerpos cetónicos y glucosa capilar en niños. Materiales y Métodos: Ensayo clínico controlado, aleatorizado, con doble enmascaramiento. Niños entre 1 mes y 47 meses programados entre abril y octubre de 2022 para cirugía ambulatoria fueron aleatorizados mediante bloques permutados tamaño 4. Hubo 3 grupos de intervención que recibieron 3 mL/kg de agua, aguapanela o Gatorade® una hora antes de inducción anestésica y 1 grupo control. Resultados: Se aleatorizaron 152 niños (agua n: 37, aguapanela n: 40, Gatorade® n: 38 y control n: 37). Los pacientes que recibieron líquidos claros tuvieron menores niveles de cuerpos cetónicos (x: 0,36 mmol/L, IC95% 0,3-0,42) frente a los que no recibieron (x: 0,5 mmol/L, IC95% 0,35-0,65), p = 0,004. Los niveles de cuerpos cetónicos fueron superiores en el grupo control (x: 0,5 mmol/L, IC95% 0,35-0,65), comparado con los pacientes que recibieron Gatorade® (x: 0,28mmol/L, IC95% 0,2-0,35), aguapanela (x: 0,42 mmol/L, IC95% 0,29-0,55), o agua (x: 0,39 mmol/L, IC95% 0,28-0,51), p = 0,06. Los niveles de glucosa capilar no presentaron diferencias significativas. Conclusiones Ofrecer 3 mL/kg de líquidos claros 1 hora antes de cirugía ambulatoria se relaciona con valores inferiores de cuerpos cetónicos sin que existan diferencias significativas entre los tres tipos de líquidos analizados.
-
Introducción
Los períodos de ayuno prolongados en niños se relacionan con efectos adversos no deseados, tales como: cambios del comportamiento, deshidratación, náuseas y vomito posoperatorio, y alteraciones hidroelectrolíticas y metabólicas[1]-[4]. Y es que, durante las primeras horas de ayuno, la glucogenólisis es la principal fuente de glucosa del organismo, sin embargo, al prolongar los tiempos de ayuno las vías metabólicas cambian y toman protagonismo la gluconeogénesis y lipólisis, caracterizadas por la beta oxidación de los ácidos grasos y la cetogénesis[1], lo anterior, constituye un estado catabólico que es más acentuado en la población pediátrica debido a sus bajas reservas de glucógeno, sobre todo en los menores de 24 meses, observándose una mayor producción de cuerpos cetónicos y un desarrollo más rápido de hipoglucemia[2]. Por lo anterior, distintas sociedades de anestesia pediátrica recomiendan acortar los períodos de ayuno preoperatorio, administrando 3 mL/kg de líquidos claros 1 hora antes de la inducción anestésica[1],[5]-[8].
Se definen líquidos claros como líquidos transparentes sin pulpa[9]. Esta definición incluye una gran variedad de líquidos que difieren en la composición de carbohidratos y electrolitos, como el agua, las bebidas deportivas, el néctar de frutas y otros líquidos claros no espesados y sin gas[5],[10]; sin embargo, se desconoce la efectividad específica que cada líquido claro pueda lograr sobre la respuesta catabólica mencionada.
Con base en lo anterior, el presente estudio tuvo como objetivo primario comparar el impacto en los niveles de cuerpos cetónicos y glucosa capilar de 3 diferentes tipos de líquidos claros de uso común, administrados 1 h antes de la inducción anestésica a una dosis de 3 mL/kg, en pacientes de 1 a 47 meses programados para cirugía ambulatoria en el Hospital Infantil Universitario Rafael Henao Toro de la ciudad de Manizales, Colombia.
-
Materiales y Métodos
Esta investigación se realizó en total conformidad con la guía ICH E6 de Buenas Prácticas Clínicas y los principios de la Declaración de Helsinki, así como con lo estipulado en la legislación colombiana vigente, comprendido en la resolución número 8430 del 4 de octubre de 1993. Fue aprobado por el comité de ética de la Universidad de Caldas mediante el acta número 015 de 2021 con el consecutivo CBCS-050, y aprobado por el comité de ética del Hospital Infantil Rafael Henao Toro de la Cruz Roja de Manizales, Colombia, y está inscrito en la página de registro de Ensayos Clínicos de Australia y Nueva Zelanda (ANZCTR) con el número de registro ACTRN12622000557730. Todo el staff de cirugía ambulatoria fue informado de la realiación del estudio para mantener la aleatorización y el enmascaramiento; no se incluyeron casos de prueba previos al inicio de la recolección de pacientes.
Se realizó un ensayo clínico controlado, aleatorizado, uni- céntrico, con doble enmascaramiento, en niños programados para cirugía ambulatoria en el Hospital Infantil Rafael Henao Toro de la Cruz Roja de la ciudad de Manizales, Colombia. Con base en estudios previos[4],[11]se determinó un tamaño de muestra de 152 pacientes para evaluar las diferencias en cuerpos cetónicos y glucosa capilar entre los grupos, con un poder del 80% y un nivel de significancia < 0,05. Se incluyeron niños entre 1 a 47 meses, programados para cirugía ambulatoria ASA I y II. Fueron excluidos pacientes con trastornos gastrointestinales diagnosticados o sospechosos (incluido reflujo gastroesofágico, hernia hiatal o gastritis), falla renal, parálisis cerebral severa, enteropatías, estenosis esofágica, acalasia, trastornos endocrinos, consumo crónico de esteroides y con períodos de ayuno menores de 60 o mayores a 120 minutos entre la ingestión del líquido claro y la inducción anestésica.
La secuencia de aleatorización fue generada por un epidemiólogo que no estuvo en contacto con los pacientes ni con el personal de enfermería ni anestesiología que atendieron a los pacientes, a través de bloques permutados tamaño 4 mediante la aplicación Random Permutation Generator de www.randomization.org. La asignación se mantuvo oculta con sobres opacos sellados; el orden en que se escogieron los sobres fue asignado por aleatorización simple generada por computador (Random Number Generator de stattrek.com). Se obtuvieron 152 sobres, rotulados con números en orden consecutivo, que contenían la etiqueta correspondiente a uno de los 4 grupos de estudio (37 para agua, 40 para aguapanela, 38 para Gatorade® y 37 para el grupo que no recibió líquido).
Los participantes fueron reclutados por la enfermera jefe del área de preparación para cirugía quien abrió un sobre al azar, y administró o no el líquido claro de acuerdo con la etiqueta; los anestesiólogos permanecieron enmascarados.
Los líquidos claros administrados en el presente estudio fueron: agua, aguapanela (producto edulcorante natural extraído de la caña de azúcar muy popular en Colombia[12]) y Gatorade®. Las características de cada bebida se muestran en la Tabla 1. Se conformaron 4 grupos, uno para cada tipo de líquido claro administrado, y un grupo control que no tuvo intervención.
En los casos en que no se cumplieron los tiempos de ayuno o cuando hubo rechazo por parte del paciente para la ingesta de líquido se definió excluir el paciente del estudio y reemplazarlo por otro paciente. Un nuevo sobre con igual número y etiqueta fue introducido al banco de sobres manteniendo el cegamiento.
Se verificó el tiempo transcurrido desde la ingestión del líquido claro antes de la inducción anestésica. La muestra de sangre se obtuvo después de la inducción inhalatoria durante la canalización venosa. Los niveles de glucosa capilar y de cuerpos cetónicos fueron medidos con el equipo FreeStyle Precision Neo®, de Abbott. Este equipo cumple con los requisitos de precisión de la norma internacional ISO 15197:2013 y tiene aprobación de la Agencia de Administración de Medicamentos y Alimentos de Estados Unidos[13]. Dicho instrumento ha sido usado y aprobado para mediciones similares en otros estudios de investigación[11],[14],[15].
Tabla 1. Características de líquidos claros usados en el estudio
| Carbohidratos (g/100 mL) | Calorías/100 mL | Grasa (g/100 mL) | Proteínas (g/100 mL) | |
| Agua | 0 | 0 | 0 | 0 |
| Gatorade® | 6 | 25 | 0 | 0 |
| Agua de panela (10 g de panela) | 9 | 35 | 0 | 0 |
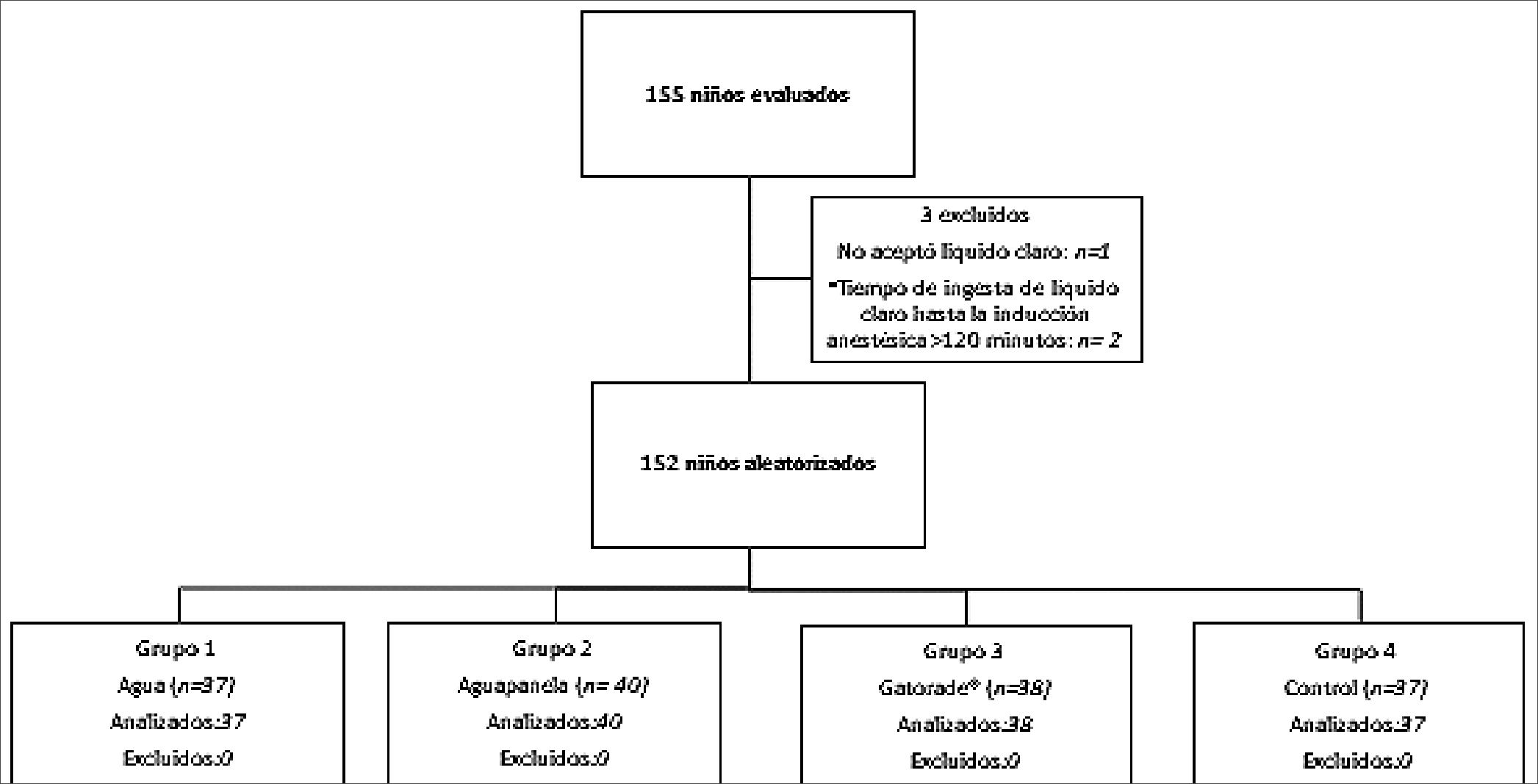
Figura 1.
En la presente investigación y de acuerdo con reportes de otros estudios en niños un valor mayor de 0,5 mmol/L en los niveles de cuerpos cetónicos se definió como anormal[2],[11],[13]. Para la glucosa capilar, un valor menor o igual a 50 mg/dL se definió como hipoglucemia[2],[11],[14]-[17].
La información obtenida se recolectó y digitalizó semanalmente en una base de datos con el programa Excel de Microsoft Office® 365. Los datos fueron analizados con el paquete estadístico stata 16.1 evaluando la distribución normal de las variables continuas mediante la prueba de Kolmogorov-Smirnov. Las diferencias entre los grupos de las variables continuas sin distribución normal se analizaron con la prueba no paramétrica de Kruskal Wallis. Las diferencias de las variables categóricas se evaluaron mediante la prueba de chi cuadrado o la prueba exacta de Fisher. Las diferencias de las variables dependientes
se determinaron mediante análisis de varianza (anova). Un valor p < 0,05 se consideró estadísticamente significativo.
-
Resultados
Datos sociodemográficos
El total de la muestra planteada en el estudio fue recolectado, consiguiendo la participación y análisis de 152 niños (Figura 1); las características demográficas se encuentran resumidas en la Tabla 2. El 70% de los pacientes fueron hombres. La mediana (Me) de edad fue de 36 meses, Rango Inter Cuartil (RIC) 24-40, y del peso, 15 kg (RIC 13-16); no hubo diferencias entre los grupos de intervención y/o el grupo control.
Datos de tiempo de ayuno y de intervención
La mediana de tiempo de ayuno en los pacientes fue de 11,2 h, y de tiempo desde la intervención hasta la medición de niveles de cuerpos cetónicos y glucosa capilar fue de 80 minutos (RIC 70-100). De los 152 procedimientos ambulatorios, 117 (77%) se realizaron entre las 7 am y 1 pm (jornada de la mañana) y el 23% entre la 1 pm y 7 pm (jornada de la tarde). Los datos especificados de cada grupo de intervención se presentan en la Tabla 3.
Tabla 2. Características demográficas de los pacientes
| Género | Agua | Aguapanela | Tipo de intervenciónGatorade® | Ninguna | Total | P |
| Femenino | 12 (32,4%) | 11 (27,5%) | 14 (36,8%) | 8 (21,6%) | 45 (29,6%) | 0,51″ |
| Masculino | 25 (67,6%) | 29 (72,5%) | 24 63,2%) | 29 (78,4%) | 107 (70,4%) | |
| “prueba x2; Fuente: autores. | ||||||
Artículo Original
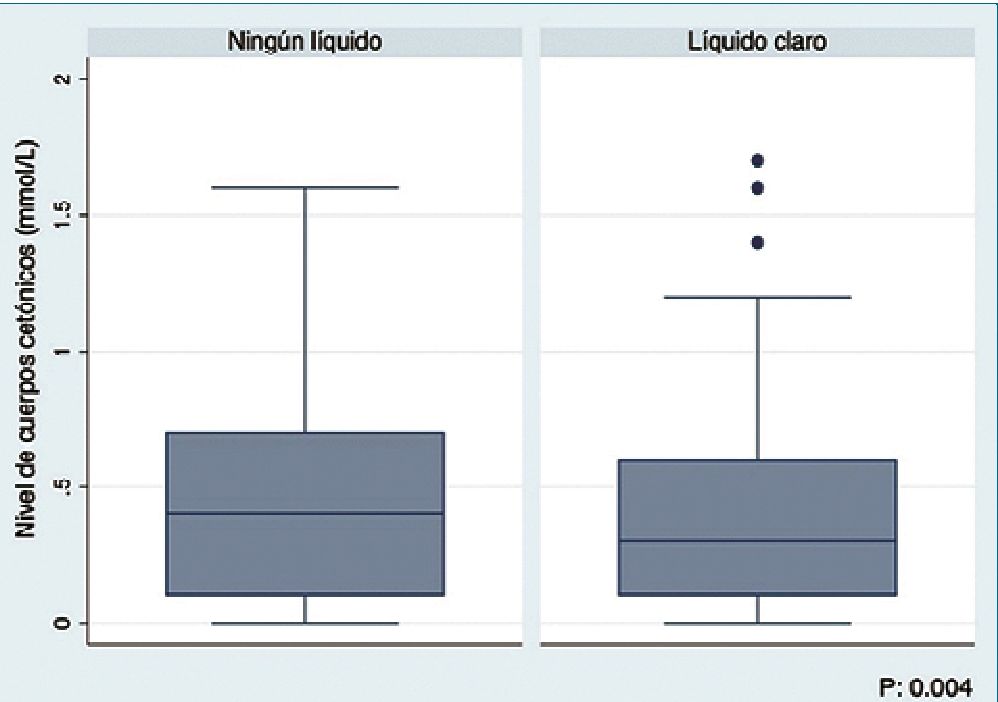
Figura 2.
0,28-0,51), p = 0,06, Tabla 4. Los pacientes que recibieron Gatorade® presentaron los menores niveles de cuerpos cetónicos de los cuatro grupos (Figura 3A).
Hubo diferencia estadísticamente significativa en los niveles de cuerpos cetónicos entre los niños operados en horas de la mañana respecto de los operados en horas de la tarde (x = 0,37 mmol/L, IC95% 0,30 – 0,44 vs x = 0,49 mmol/L, IC95% 0,35 – 0,62) p = 0,09.
Los valores de glucosa capilar no presentaron diferencias entre los distintos grupos analizados Tablas 4 y 5 y Figura 3B, ni con respecto al momento de la cirugía (x = 80,3 mg/dL, IC95% 78,1 – 82,5 en pacientes operados en la mañana vs x = 78,4, IC95% 75,0 – 81,7 en horas de la tarde), p = 0,387.
-
Discusión
Niveles de cuerpos cetónicos y glucosa capilar
Al analizar en conjunto la información de los pacientes que recibieron algún tipo de líquido claro y los que no lo recibieron, se encontró que los niveles de cuerpos cetónicos al ingerir algún líquido claro son significativamente inferiores teniendo una media (x) de 0,36 mmol/L (IC95% 0,3-0,42) versus x: 0,5 mmol/L en el grupo que no ingirió líquidos claros (IC95% 0,350,65) p = 0,004 (Figura 2).
Los niveles de cuerpos cetónicos fueron superiores en el grupo que no ingirió líquidos claros (x = 0,5 mmol/L, IC95% 0,35-0,65), comparado con los pacientes que recibieron Gatorade® (x = 0,28mmol/L, IC95% 0,2-0,35), aguapanela (x = 0,42 mmol/L, IC95% 0,29-0,55), o agua (x = 0,39mmol/L, IC95%
Tabla 3. Mediana de edad en meses y peso en kg según grupos de intervención
| Edad Me (RIC) | 33 (24-38) | 36,5 (24-41,5) | 36 (30-40) | 37 (29-42) | 36 (24-40) | 0,62* |
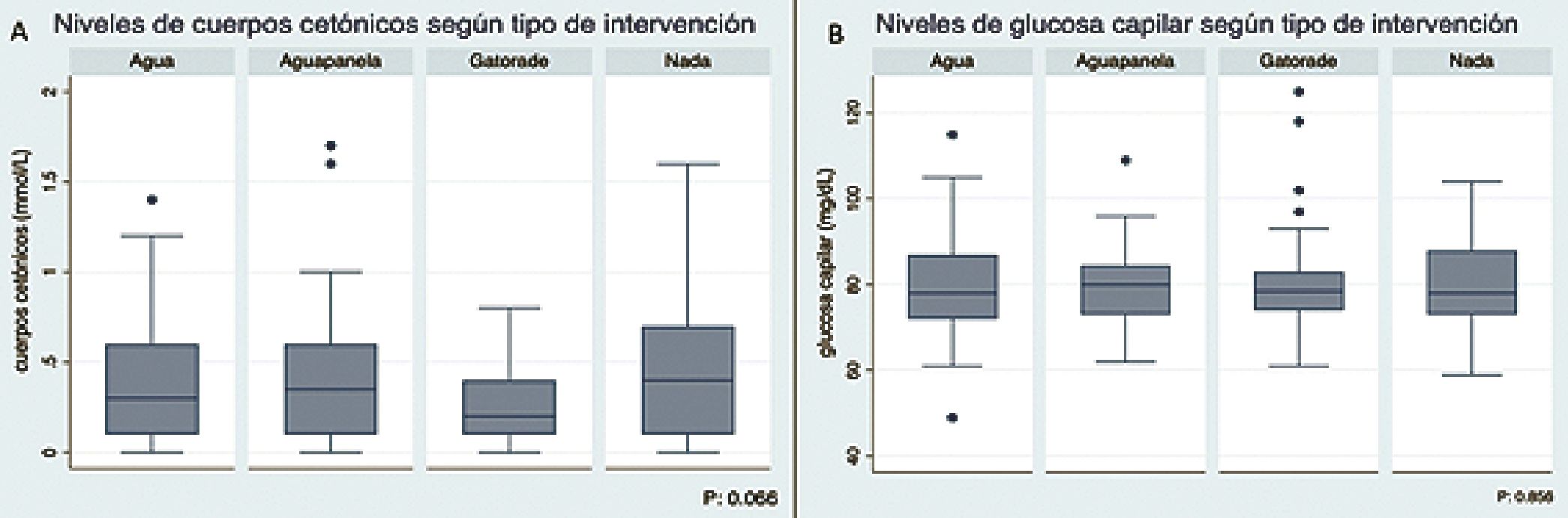
Figura 3.
| Tabla 4. Diferencia en los niveles de cuerpos cetónicos por grupo de intervención. | ||||||
| Tipo de | i intervención | |||||
| Gatorade® | Agua | Aguapanela | Ninguna | Total | p | |
| Cuerpos cetónicos | 0,28 | 0,39 | 0,42 | 0,5 | 0,4 | 0,06* |
| x (IC95%) mmol/L | (0,20-0,35) | (0,28-0,51) | (0,29-0,55) | (0,35-0,65) | (0,34-0,46) | |
| Glucosa capilar | 78,7 | 79,7 | 81,1 | 80,1 | 79,9 | 0,85* |
| x (IC95%) mg/dL | (74,6-82,8) | (76,7-82,7) | (76,7-85,3) | (76,2-83,0) | (78,0-81,7) | |
| *prueba anova; Fuente: autores. | ||||||
| Tabla 5. Niveles de glucosa capilar (mg/dL) según ingesta de líquidos claros vs no ingesta | ||||
| Líquidos claros | Intervención | |||
| Ninguna | total | p | ||
| Glucosa capilar x (IC95%) mg/dL | 79,8 (77,7-81,9) | 80,1 (76,2-83,9) | 79,9 (78,0-81,7) | 0,89* |
| **prueba t de Student | ; Fuente: autores. | |||
De acuerdo con los resultados de este estudio, ofrecer 3 mL/ kg de líquidos claros 1 h antes de cirugía ambulatoria, disminuye los niveles de cuerpos cetónicos de manera estadísticamente significativa comparado con no darlos, (x: 0,36mmol/L, IC95% 0,3-0,42) vs (x: 0,5 mmol/L, IC95% 0,35-0,65), p = 0,004, sin que exista diferencia significativa entre los tres tipos de líquidos administrados Gatorade® (x: 0,28 mmol/L, IC95% 0,2-0,35), agua (x: 0,39 mmol/L, IC95% 0,28-0,51) o aguapanela (x: 0,42 mmol/L, IC95% 0,29-0,55), p = 0,06. Estudios previos indican que la optimización en los tiempos de ayuno preoperatorios genera diversos beneficios en la población pediátrica, especialmente la reducción de los niveles de cuerpos cetónicos en niños menores de 3 años. Un estudio observacional prospectivo realizado en 2016 con 50 niños de 0 a 36 meses de edad, encontró que ofrecer líquidos hasta 2 h antes de cirugía ambulatoria se relacionaba con mejor control metabólico y valores de cuerpos cetónicos inferiores comparados con los grupos donde no se cumplieron las recomendaciones de ayuno, (promedio: 0,2 mmol/L, DE 0,2 vs 0,6 mmol/L, DE 0,6); p < 0,001)[11]. El estudio realizado por Dennhardt y cols.[14], que evaluó los efectos metabólicos del ayuno prolongado en 100 pacientes pediátricos de 0 a 36 meses de edad, encontró que solo el 20% de los pacientes recibió líquidos claros 2 h antes de la inducción anestésica, y para estos pacientes los valores de cuerpos cetó- nicos fueron menores en comparación con los pacientes con un periodo de ayuno más prolongado, (promedio: 0,2 mmol/L, DE 0,2 vs promedio: 0,8 mmol/L, DE 0,9), p < 0,001. También se encontró que el 7% de los niños que no ingirieron líquidos claros tenían niveles superiores a 1,5 mmol/L. Sin embargo, parece que el tiempo de ayuno previo a cirugía no es el único factor determinante en la aparición de altos niveles de cuerpos cetónicos pues el aporte calórico recibido y la actividad física realizada antes del procedimiento quirúrgico deben considerarse. Un estudio que comparó los valores de cuerpos cetónicos y glucosa capilar en niños programados para cirugía en horas de la mañana vs en horas de la tarde, reportó una mayor incidencia de cetonemia en el grupo de cirugía en la tarde, a pesar de que el tiempo de ayuno fue menor, (62,5%; IC 95%: 48,1 – 82 en el grupo de la tarde vs 38,5%; IC 95% 26,5 – 52,5 en el grupo de la mañana; p = 0,02). Estos resultados estuvieron relacionados con un mejor aporte calórico de la cena recibida en la noche previa a la cirugía en los pacientes programados a primeras horas de la mañana, en comparación con una dieta muy restringida en los pacientes programados por la tarde, quienes además tuvieron mayor actividad física y requerimiento energético y al comportamiento según el ciclo circadiano de los niveles de hormonas contrarreguladoras en la noche[15]. Los resultados de estos estudios concuerdan con nuestros hallazgos, y refuerzan las recomendaciones canadienses, europeas y neo zelandesas de ayuno preoperatorio[5]-[8]a favor de dar líquidos claros 1 h antes de cirugía ambulatoria.
Dennhardt, prefiere la ingestión de bebidas azucaradas en lugar de agua antes de cirugía con el fin de mejorar la respuesta metabólica durante el ayuno[11]. La ingestión de bebidas carbohidratadas se relaciona con una disminución en la resistencia a la insulina, haciendo más eficiente el metabolismo de los carbohidratos[18],[19]. Sin embargo, los resultados de la presente investigación plantean dudas respecto a si es el contenido calórico o el volumen de líquido administrado el factor más importante y decisivo a la hora de elegir el tipo de líquido claro para administrar antes de cirugía. En este estudio, dos de los cuatro grupos analizados utilizaron líquidos con glucosa (Gatorade® y aguapanela); el Gatorade® obtuvo los menores niveles de cuerpos cetónicos (x: 0,28 mmol/L, IC95% 0,2-0,35) comparado con agua (x: 0,39 mmol/L, IC95% 0,280,51), aguapanela (x: 0,42 mmol/L, IC95% 0,29-0,55) y ningún líquido (x: 0,5mmol/L, IC95% 0,35-0,65), sin que existieran diferencias estadísticamente significativas en el nivel de cuerpos cetónicos según el tipo de líquido ingerido (p: 0,066).
Lo anterior se debe aplicar con cautela, puesto que en nuestro estudio los pacientes que requirieron ansiolisis preoperatoria recibieron (20 mg/kg de glucosa) (en una mezcla magistral de midazolam y acetaminofén cuyo contenido de azúcar es de 40 mg/mL[20]20 minutos antes de la inducción anestésica de acuerdo con el protocolo institucional, pudiendo esto interferir con las mediciones obtenidas en los grupos.
Las bebidas carbohidratadas estimulan la producción de insulina además de disminuir su resistencia a nivel periférico[21]. Los resultados de los estudios que evalúan la glicemia y el tiempo de ayuno preoperatorio en niños son contradictorios[4],[15],[22],[23]. Acorde a nuestros resultados, no existe diferencia significativa en los valores de glucosa capilar tras ofrecer algún tipo de líquido claro 1 h antes de cirugía ambulatoria (x: 79,8 mg/dL, IC95% 77,7-81,9) comparado con no ingerir ningún líquido (x: 80,1 mg/dL, IC95% 76,2-83,9), p: 0,89. Esto puede explicarse porque el contenido calórico de las bebidas seleccionadas es bajo, lo que puede tener poco impacto en el metabolismo de la glucosa. Además, se debe considerar el intervalo de tiempo entre la ingesta de la bebida y el inicio de la cirugía, pues el efecto de las bebidas carbohidratadas sobre el incremento en la sensibilidad a la insulina inicia a las 3 h después de su ingestión[24], por lo que, solo 1 h puede no ser suficiente para evidenciar beneficios. Estudios con períodos de ayunos optimizados a 2 h tampoco han reportado diferencias significativas en niveles de glucosa en sangre, estos resultados son similares a los nuestros y demuestran la complejidad de este parámetro metabólico[11],[18].
Desde el punto de vista del riesgo de broncoaspiración, la recomendación de disminuir a 1 h el ayuno preoperatorio en niños parece ser segura[25]. El hecho de no haber encontrado diferencia significativa entre los 3 tipos de líquidos administrados, cada uno, con un aporte calórico diferente, resulta importante al recordar la relación existente entre el aporte calórico ingerido y la velocidad del vaciamiento gástrico[26].
Durante la realización del estudio se presentó un episodio de regurgitación en el transoperatorio. Se trató de un paciente de 31 meses de edad sin antecedentes patológicos, sometido a orquidopexia bilateral bajo anestesia general con máscara laríngea que había ingerido líquidos claros 190 minutos antes de la inducción anestésica; durante la cirugía presentó regurgitación de material líquido claro con posterior laringoespasmo que requirió intubación orotraqueal, sin complicaciones posteriores. El paciente no fue incluido en los datos analizados dado que superaba los tiempos descritos en los criterios de inclusión. La incidencia de broncoaspiración en la población pediátrica es variable, en el estudio APRICOT hubo 9,3 eventos de bron- coaspiración por cada 10.000 casos (incidencia del 0,1%)[27], por su parte, el estudio NIKS encontró 32 casos de regurgitación (0,26%), 10 casos de sospecha de aspiración pulmonar (0,08%) y 4 casos de broncoaspiración confirmada (0,03%), todos ellos con recuperación adecuada[28]. Por ello, se debe recordar que los tiempos de ayuno preoperatorio disminuyen el riesgo de broncoaspiración pero no garantizan un estómago vacío[8],[29].
A pesar de los diferentes esfuerzos de nuestra institución por el adecuado cumplimiento de los tiempos de ayuno preoperatorio, en nuestro estudio el tiempo de ayuno tuvo una mediana de 11,3 h (RIC 5-12) en los pacientes que no recibieron líquidos claros. Valores similares se han encontrado en publicaciones anteriores, donde incluso los tiempos de ayuno han superado las 12 h[1],[11],[30]. Diversos motivos que varían desde cambios en la hora programada para el procedimiento quirúrgico hasta poca claridad en las recomendaciones de ayuno otorgadas a los pacientes o familiares, sumado a múltiples factores sociales, llevan a que el tiempo de ayuno para líquidos claros se prolongue[1],[11],[13],[30]. Con el presente estudio, se logró acortar los tiempos de ayuno a Me: 80 minutos (RIC 70100) debido a la administración de 3 mL/kg de líquidos claros, sentando así las bases administrativas y operacionales para los pacientes ambulatorios de la institución.
-
Conclusiones
Los resultados de nuestro estudio sugieren que no existen diferencias estadísticamente significativas en la ingestión de cualquiera de los tres líquidos claros utilizados y los niveles de cuerpos cetónicos o glucosa capilar, sin embargo, la ingestión de cualquiera que sea el líquido claro elegido es benéfica y permite un mejor control metabólico; así, podemos concluir que ofrecer 3 mL/kg de líquidos claros 1 h antes de cirugía ambulatoria se relaciona con valores significativamente inferiores de cuerpos cetónicos en los pacientes pediátricos de 1 a 47 meses.
-
Limitaciones
Nuestro estudio tuvo algunas limitaciones; en primer lugar, a pesar de tener una muestra adecuada, fue realizado en un único centro hospitalario; segundo, como protocolo institucional del centro de estudio, todos los pacientes entre 1 y 8 años programados para cirugía ambulatoria reciben 0,5 mL/kg de una preparación magistral que contiene 1 mg/mL de midazolam y acetaminofén 24 mg/mL[18], cuyo contenido de glucosa 0,2 g/mL[27],[28], lo cual pudo influir en las mediciones de cuerpos cetónicos y glucosa capilar. Este no fue modificado debido a sus beneficios analgésicos y en el confort del paciente, padres y equipo médico. Finalmente, solo se compararon 3 líquidos claros, existiendo en el mercado otras opciones en este grupo de bebidas.
Financiación: El presente estudio no recibió financiación de alguna fuente externa a los investigadores.
Conflicto de intereses: No se declara ningún conflicto de intereses por parte de alguno de los investigadores.
Referencias
1. Andersson H, Schmitz A, Frykholm P. Preoperative fasting guidelines in pediatric anesthesia: are we ready for a change? Curr Opin Anaesthesiol. 2018 Jun;31(3):342–8. https://doi.org/10.1097/ACO.0000000000000582 PMID:29443724
2. van Veen MR, van Hasselt PM, de Sain-van der Velden MG, Verhoeven N, Hofstede FC, de Koning TJ, et al. Metabolic profiles in children during fasting. Pediatrics. 2011 Apr;127(4):e1021–7. https://doi.org/10.1542/peds.2010-1706 PMID:21422093
3. Li C, Shao H, Huang S, Zhang T, Su X, Zhu S. Effects of an Individualized Fasting Program on Fasting Time and Comfort in Infants and Young Children During the Perioperative Period [Internet]. J Perianesth Nurs. 2020 Jun;35(3):326–30. https://doi.org/10.1016/j.jopan.2019.08.014 PMID:31973960
4. Huang X, Zhang H, Lin Y, Chen L, Peng Y, Jiang F, et al. Effect of oral glucose water administration 1 hour preoperatively in children with cyanotic congenital heart disease: A randomized controlled trial. Med Sci Monit. 2020 Jul;26:e922642. https://doi.org/10.12659/MSM.922642 PMID:32621736
5. Thomas M, Morrison C, Newton R, Schindler E. Consensus statement on clear fluids fasting for elective pediatric general anesthesia. Paediatr Anaesth. 2018 May;28(5):411–4. https://doi.org/10.1111/pan.13370 PMID:29700894
6. Linscott D. SPANZA endorses 1-hour clear fluid fasting consensus statement. Paediatr Anaesth. 2019 Mar;29(3):292. https://doi.org/10.1111/pan.13585 PMID:30614151
7. Rosen D, Gamble J, Matava C; Canadian Pediatric Anesthesia Society Fasting Guidelines Working Group. Canadian Pediatric Anesthesia Society statement on clear fluid fasting for elective pediatric anesthesia. Can J Anaesth. 2019 Aug;66(8):991–2. https://doi.org/10.1007/s12630-019-01382-z PMID:31041608
8. Fawcett WJ, Thomas M. Pre-operative fasting in adults and children: clinical practice and guidelines. Anaesthesia. 2019 Jan;74(1):83–8. https://doi.org/10.1111/anae.14500 PMID:30500064
9. Davis, Peter J. and Cladis F. Smith’s Anesthesia for Infants and Children. 9th ed. de Peter J. Davis MD FPCM, editor. St. Louis, MO: Elsevier; 2017. 1424 p.
10. American Society of Anesthesiologists. Practice Guidelines for Preoperative Fasting and the Use of Pharmacologic Agents to Reduce the Risk of Pulmonary Aspiration: Application to Healthy Patients Undergoing Elective Procedures: An Updated Report by the American Society of Anesthesiologists Task Force on Preoperative Fasting and the Use of Pharmacologic Agents to Reduce the Risk of Pulmonary Aspiration. Anesthesiology. 2017 Mar;126(3):376–93. https://doi.org/10.1097/ALN.0000000000001452 PMID:28045707
11. Dennhardt N, Beck C, Huber D, Sander B, Boehne M, Boethig D, et al. Optimized preoperative fasting times decrease ketone body concentration and stabilize mean arterial blood pressure during induction of anesthesia in children younger than 36 months: a prospective observational cohort study. Paediatr Anaesth. 2016 Aug;26(8):838–43. https://doi.org/10.1111/pan.12943 PMID:27291355
12. De Maria G. Panela: the natural nutritional sweetener. Agro Food Ind Hi-Tech. 2013;24(6):44–8.
13. Brannan C. Evaluation of the FreeStyle Precision Neo blood glucose and ketone monitoring system. Perfus. 2015;28(1):4–13.
14. Dennhardt N, Beck C, Huber D, Nickel K, Sander B, Witt LH, et al. Impact of preoperative fasting times on blood glucose concentration, ketone bodies and acid-base balance in children younger than 36 months: A prospective observational study. Eur J Anaesthesiol. 2015 Dec;32(12):857–61. https://doi.org/10.1097/EJA.0000000000000330 PMID:26351828
15. Trujillo A, Ramírez A, Arango F. Difference of ketone levels between diurnal and nocturnal fasting in children: an observational study. Colomb. J. Anesthesiol. [Internet]. 2023 Mar. 9 [cited 2023 Jul. 31];49. Available from: https://www.revcolanest.com.co/index.php/rca/article/view/1064
16. Thornton PS, Stanley CA, De Leon DD, Harris D, Haymond MW, Hussain K, et al.; Pediatric Endocrine Society. Recommendations from the Pediatric Endocrine Society for Evaluation and Management of Persistent Hypoglycemia in Neonates, Infants, and Children [Internet]. J Pediatr. 2015 Aug;167(2):238–45. https://doi.org/10.1016/j.jpeds.2015.03.057 PMID:25957977
17. Gea IL, Ramos JM, Pérez VB, Pedro J, Siguero L. Hipoglucemia. Protocolo diagnostico terapeutico en pediatria. 2019. Protoc diagn ter pediatr 2019;1171-82 [Internet]. 2019;(1):171–82. Available from: https://www.aeped.es/sites/default/files/documentos/11_hipoglucemia.pdf
18. Gawecka A, Mierzewska-Schmidt M. Tolerance of, and metabolic effects of, preoperative oral carbohydrate administration in children – a preliminary report. Anaesthesiol Intensive Ther. 2014;46(2):61–4. https://doi.org/10.5603/AIT.2014.0013 PMID:24858963
19. Ljungqvist O, Nygren J, Thorell A. Modulation of post-operative insulin resistance by pre-operative carbohydrate loading. Proc Nutr Soc. 2002 Aug;61(3):329–36. https://doi.org/10.1079/PNS2002168 PMID:12230794
20. Gómez BL, Ocampo AF, Orozco AJ, Caicedo SJ. Efficacy of anesthetic premedication in pediatric patients using oral midazolam and acetaminophen. Observational study [Internet]. Rev Colomb Anestesiol. 2013;41(1):4–9. https://doi.org/10.1097/01819236-201341010-00002.
21. Svanfeldt M, Thorell A, Hausel J, Soop M, Rooyackers O, Nygren J, et al. Randomized clinical trial of the effect of preoperative oral carbohydrate treatment on postoperative whole-body protein and glucose kinetics. Br J Surg. 2007 Nov;94(11):1342–50. https://doi.org/10.1002/bjs.5919 PMID:17902094
22. Carvalho CA, Carvalho AA, Preza AD, Nogueira PL, Mendes KB, Dock-Nascimento DB, et al. Metabolic and inflammatory benefits of reducing preoperative fasting time in pediatric surgery. Rev Col Bras Cir. 2020 Jun;47(1):e20202353. https://doi.org/10.1590/0100-6991e-20202353 PMID:32578813
23. Jiang W, Liu X, Liu F, Huang S, Yuan J, Shi Y, et al. Safety and benefit of pre-operative oral carbohydrate in infants: a multi-center study in China. Asia Pac J Clin Nutr. 2018;27(5):975–9. PMID:30272844
24. Svanfeldt M, Thorell A, Hausel J, Soop M, Nygren J, Ljungqvist O. Effect of “preoperative” oral carbohydrate treatment on insulin action—a randomised cross-over unblinded study in healthy subjects. Clin Nutr. 2005 Oct;24(5):815–21. https://doi.org/10.1016/j.clnu.2005.05.002 PMID:15979768
25. Valencia, Alejandra1; Trujillo, Alexander1,2,3; Arango, Fernando2. Preoperative ultrasound evaluation of gastric contents in children one hour after ingestion of clear liquid: An observational study. Saudi Journal of Anesthesia 17(3):p 368-372, Jul–Sep 2023. | https://doi.org/10.4103/sja.sja_31_23..
26. Okabe T, Terashima H, Sakamoto A. Determinants of liquid gastric emptying: comparisons between milk and isocalorically adjusted clear fluids. Br J Anaesth. 2015 Jan;114(1):77–82. https://doi.org/10.1093/bja/aeu338 PMID:25260696
27. Habre W, Disma N, Virag K, Becke K, Hansen TG, Jöhr M, et al.; APRICOT Group of the European Society of Anaesthesiology Clinical Trial Network. Incidence of severe critical events in paediatric anaesthesia (APRICOT): a prospective multicentre observational study in 261 hospitals in Europe [Internet]. Lancet Respir Med. 2017 May;5(5):412–25. https://doi.org/10.1016/S2213-2600(17)30116-9 PMID:28363725
28. Beck CE, Rudolph D, Mahn C, Etspüler A, Korf M, Lüthke M, et al. Impact of clear fluid fasting on pulmonary aspiration in children undergoing general anesthesia: results of the German prospective multicenter observational (NiKs) study. Paediatr Anaesth. 2020 Aug;30(8):892–9. https://doi.org/10.1111/pan.13948 PMID:32533888
29. Andersson H, Hellström PM, Frykholm P. Introducing the 6-4-0 fasting regimen and the incidence of prolonged preoperative fasting in children. Paediatr Anaesth. 2018 Jan;28(1):46–52. https://doi.org/10.1111/pan.13282 PMID:29168341
30. Nye A, Conner E, Wang E, Chadwick W, Marquez J, Caruso TJ. A Pilot Quality Improvement Project to Reduce Preoperative Fasting Duration in Pediatric Inpatients. Pediatr Qual Saf. 2019 Dec;4(6):e246. https://doi.org/10.1097/pq9.0000000000000246 PMID:32010870

 ORCID
ORCID