Matias Feijoo P.1,3*, María Loreto Astudillo A.2,3,4, Daniella Rigo-Righi I.2,3,4
Recibido: 28-08-2023
Aceptado: 02-09-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 7 pp. 683-687|https://doi.org/10.25237/revchilanestv52n7-09
PDF|ePub|RIS
Perioperative anaphylaxis
Abstract
Introduction: Anaphylaxis is a severe hypersensitivity reaction that is life-threatening for the patient. Diagnosis and perioperative management represent a challenge for the anesthesiologist, mainly due to the difficulty of making an adequate differential diagnosis and early resuscitation with adrenaline and fluid therapy. Objectives: To describe the epidemiology and clinical presentation of patients who present anaphylaxis during a surgical intervention with general or regional anesthesia in the operating room of the Arturo López Pérez Foundation during the years 2018 to 2022. Material and Method: Descriptive cross-sectional study. Nineteen patients were identified through the laboratory record of request for serum tryptase from the ward. Data were obtained from the electronic and physical clinical record. Results: 19 patients developed perioperative anaphylaxis, with a frequency of 1:1065 cases from 2018 to 2022. The main cause identified was latex. 61% of the reactions were grade 3, of which all received treatment with adrenaline. There were no deaths associated with anaphylactic shock. Conclusions: Perioperative anaphylaxis is a rare event in the ward, but with significant associated morbidity. A high index of suspicion is required for timely diagnosis and treatment. Contrary to what has been reported in Europe and North America, latex continues to be an important cause. Adrenaline as a cornerstone of management must be administered early. Follow-up must be carried out by an immunologist to detect the triggering cause and avoid future reexposure.
Resumen
Introducción: La anafilaxia es una reacción de hipersensibilidad severa que condiciona riesgo vital para el paciente. El diagnóstico y manejo perioperatorio representa un desafío para el anestesiólogo principalmente por la dificultad de realizar un diagnóstico diferencial adecuado y establecer precozmente la reanimación con adrenalina y fluidoterapia. Objetivos: Describir la epidemiologia y presentación clínica de los pacientes que presentan anafilaxia durante una intervención quirúrgica con anestesia general o regional en Pabellón de la Fundación Arturo López Pérez durante los años 2018 a 2022. Material y Método: Estudio descriptivo de corte transversal. Se identificaron 19 pacientes a través del registro de laboratorio de solicitud de triptasa sérica desde pabellón. Se obtuvieron los datos desde la ficha clínica electrónica y física. Resultados: 19 pacientes desarrollaron anafilaxia perioperatoria, con una frecuencia de 1:1.065 casos desde 2018 a 2022. La principal causa identificada fue el látex. El 61% de las reacciones fueron grado 3, de los cuales todos recibieron tratamiento con adrenalina. No se registraron defunciones asociadas a shock anafiláctico. Conclusiones: La anafilaxia perioperatoria es un evento infrecuente en pabellón, pero con morbilidad importante asociada. Se requiere un alto índice de sospecha para diagnóstico y tratamiento oportuno. A diferencia de lo reportado en Europa y América del Norte, el látex continúa siendo una causa importante. La adrenalina como piedra angular del manejo debe ser administrada de forma precoz. El seguimiento debe ser realizado por inmunólogo para detectar la causa desencadenante y evitar una futura re exposición.
-
Introducción
La anafilaxia es una reacción de hipersensibilidad inmediata severa con riesgo de amenaza vital para el paciente, secundaria a la liberación masiva de múltiples mediadores activos desde células inflamatorias[1]. En el ámbito perioperatorio los pacientes frecuentemente reciben gran variedad de medicamentos o están expuestos a distintos agentes con potencial de desarrollar reacciones de hipersensibilidad[1]. El mecanismo fisiopatológico más frecuente es mediado por inmunoglobulina E (IgE) en alrededor del 60% de los casos[1]. Otros mecanismos involucrados son reacciones por inmunoglobulina G (IgG) y activación del sistema de complemento[1].
La frecuencia de anafilaxia perioperatoria depende en general del país estudiado, agentes usados y métodos de reporte, variando entre 1:353 a 1:18.600 procedimientos[1],[2]. La mortalidad asociada se estima de 1,4% a 6%, y 2% de los sobrevivientes desarrollan daño cerebral anóxico[1]. Globalmente, representa de 9% a 19% de todas las complicaciones quirúrgicas y 5% a 7% de las muertes durante la anestesia[1].
Si bien las reacciones de hipersensibilidad no son predictibles, existen factores de riesgo bien conocidos; múltiples cirugías previas, pacientes con espina bífida, alergia a frutas exóticas y trabajadores de la salud en caso de alergia al látex.1,3 Un episodio previo de reacción anafiláctica es un factor de riesgo mayor para recurrencia.1 Por otro lado, existen factores de riesgo que contribuyen a la severidad de la reacción como cirugía de urgencia, ASA alto, obesidad, uso de beta bloqueadores o inhibidores de la enzima convertidora de angiotensina[1],[3]. El antecedente de asma no ha sido asociado a un aumento del riesgo de anafilaxia intraoperatoria[1].
| Tabla 1. Clasificación modificada de Ring y Messmer | |
| Grado de severidad | Signos clínicos |
| Grado 1 | Rash cutáneo, eritema generalizado, urticaria y angioedema |
| Grado 2 | Signos no potencialmente mortales; hipotensión, taquicardia y disnea |
| Grado 3 | Síntomas que amenazan la vida; colapso cardiovascular, broncoespasmo y arritmias |
| Grado 4 | Paro cardiorrespiratorio |
Fisiopatológicamente, la anafilaxia puede ocurrir con sensibilización previa por un antígeno o sin esta[1],[4]. En el primer caso, el antígeno a través del complejo mayor de histocompa- tibilidad es presentado a linfocitos T quienes estimulan a linfo- citos B produciendo anticuerpos de IgE específicos que se unen a un receptor de gran afinidad en la superficie de mastocitos y basófilos[1],[4]. Frente a una reexposición, la unión del antíge- no a este complejo gatilla la liberación masiva de vesículas con sustancias responsables de la anafilaxia[1],[4]. Otro mecanismo de sensibilización postula el desarrollo de anticuerpos específicos de IgG frente a drogas como dextranos, aprotinina y rocu- ronio. Por el contrario, existen mecanismos que no requieren la exposición previa a un antígeno como en el caso de liberación no especifica de histamina descrita para drogas como atracurio, mivacurio y morfina, activación del sistema de complemento y del sistema kinina-calicreína[1],[4].
La activación de mastocitos y basófilos libera mediados inflamatorios como histamina, triptasa y serotonina e inducen la producción de otros mediadores como factor activador de plaquetas, prostaglandinas y leucotrienos, responsables de la presentación clínica de la anafilaxia[1],[2],[4].
El diagnóstico de anafilaxia se basa en la aparición de síntomas y signos posterior a la exposición del agente con un intervalo de tiempo consistente con la vía de administración de este, el cual resulta ser una situación desafiante durante el periopera- torio[1],[3]. La anafilaxia mediada por IgE puede ser detectada por la positividad in vitro e in vivo y el aumento de los niveles de triptasa sérica durante la reacción[3]. La concentración de trip- tasa es máxima después de 30 minutos de las primeras manifestaciones clínicas y tienen una vida media de 90 minutos[3]. Los resultados siguen siendo positivos durante más de seis horas en casos graves. La duplicación de una triptasa basal se considera un aumento significativo[3]. En el caso de una reacción mu- cocutánea, las concentraciones a menudo son normales[3]. La sensibilidad es de 64%, especificidad de 89,3%, valor predicti- vo positivo de 92,6% y negativo de 54,4%, por lo que niveles normales de triptasa no excluyen completamente una reacción inmunológica, pero su positividad apoya firmemente el diag- nóstico[3]. El alza de los niveles de histamina es muy fugaz, por lo que es poco utilizada[3].
La determinación de IgE especificas se hace en relación con drogas con grupo de amonio cuaternario como bloqueadores neuromusculares (BNM), pentotal, látex, antibióticos betalac- támicos y clorhexidina[3]. Deben ser detectadas de forma inmediata, pudiendo tomar una segunda determinación hasta 6 meses posterior a la reacción[3]. Por otro lado, las pruebas cutáneas deben realizarse 4 a 6 semanas después de la reacción[3]. Deben incluir el conjunto de medicamentos usados antes de la reacción y el látex. Su resultado debe ser positivo o negativo, y si es necesario debe repetirse la prueba a distancia del sitio elegido inicialmente. Su sensibilidad disminuye con el tiempo[3].
La severidad de un episodio de anafilaxia puede ser graduada de acuerdo con la Clasificación Modificada de Ring y Messmer (Tabla 1)[5].
Los agentes causales más frecuentemente implicados son los antibióticos, especialmente, betalactámicos y glicopéptidos, bloqueadores neuromusculares como rocuronio y succinilcoli- na, colorantes como azul patente, clorhexidina y látex[1],[6],[7]. El orden de frecuencia difiere entre distintos países esencialmente por prácticas clínicas distintas.
El manejo inicial de una anafilaxia empieza por un reconocimiento precoz de la crisis y resucitación cardiopulmonar con epinefrina, administración de volumen y mantención de la vía aérea[1]. La adrenalina es la droga de elección y más eficaz en el tratamiento del shock anafiláctico[1],[4],[8]. Debido a sus propiedades alfa produce vasoconstricción de los vasos sanguíneos de capacitancia, revirtiendo la vasodilatación y el edema[4],[6]. Su acción en receptores beta 1 adrenérgicos aumenta el gasto cardíaco y la activación de receptores beta 2 adrenérgicos produce broncodilatación, disminuye resistencia venosa hepática aumentando el retorno venoso y aumenta el AMP cíclico en mastocitos y basófilos, deteniendo la liberación de mediadores inflamatorios[4],[6]. En pacientes que no se ha establecido un acceso venoso o se haya perdido, se puede administrar de forma intramuscular en dosis de 0,3 a 0,5 mg y puede repetirse después de 5 a 10 minutos dependiendo de los efectos hemodinámicos. Es posible administrarla por vía intratraqueal teniendo en cuenta que solo un tercio de la dosis administrada llegara al torrente sanguíneo[4]. En pacientes que requieren el uso de adrenalina en infusión continua, esta debe mantenerse hasta después de controlada la sintomatología por su efecto en la detención de neoformación de mediadores inflamatorios en mastocitos y basófilos[4].
La reanimación con fluidoterapia debe ser precoz debido al aumento de plasma en el espacio intersticial secundario al aumento de la permeabilidad vascular[4],[6]. Esta perdida puede afectar hasta el 70% de la volemia. El volumen dependerá de la situación clínica, iniciando con bolos de cristaloides hasta 20 ml/kg[4]. El uso de coloides se recomienda frente a escasa o nula respuesta a cristaloides, especialmente cuando se ha excedido de 30 ml/kg. En caso de que se haya administrado un coloide previo a la reacción anafiláctica, este debe ser evitado en la reanimación[1],[4],[6].
La oxigenoterapia es fundamental para compensar el aumento de consumo de oxígeno, especialmente en aquellos con inestabilidad hemodinámica[1],[4],[6]. El soporte de la vía aérea con intubación traqueal y ventilación mecánica es ineludible en reacciones grade 3 o 4, así como en pacientes con edema de la vía aérea[1],[4].
La terapia de segunda línea consiste en el uso de otros vasopresores como vasopresina, noradrenalina y azul de me- tileno, uso de broncodilatadores, corticoesteroides, antihista- mínicos y finalmente circulación extracorpórea en shock refrac- tario[1],[4],[6].
El propósito de este estudio es describir y analizar a pacientes que desarrollaron anafilaxia perioperatoria durante los años 2018 a 2022 en la Fundación Arturo López Pérez (FALP) correlacionándolo con la literatura médica actual.
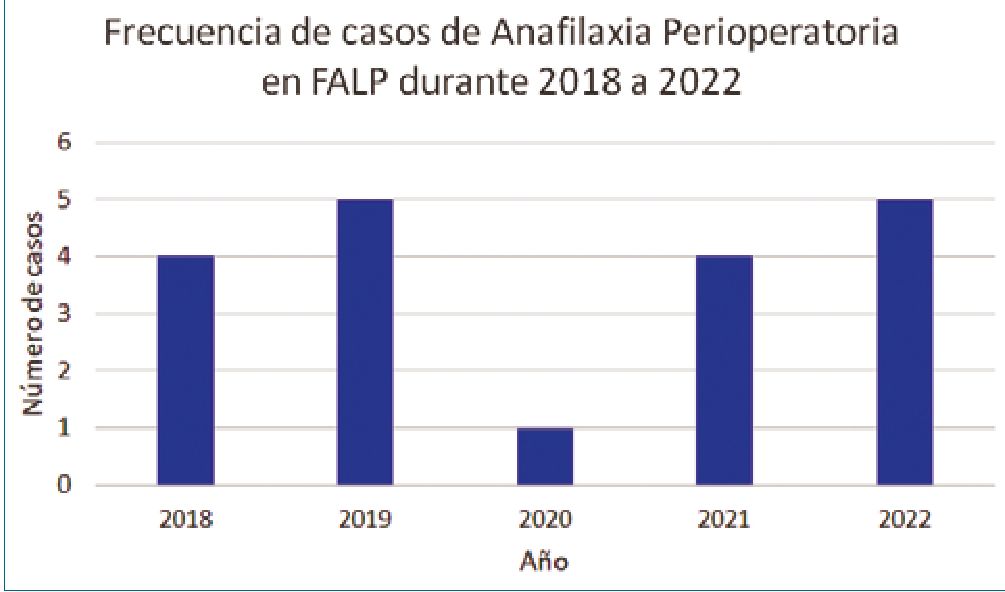
Figura 1. Frecuencia de anafilaxia perioperatoria en Fundación Arturo López Pérez durante los años 2018 a 2022.
-
Metodología
Previa aprobación por comité de ética, se realizó búsqueda de solicitudes de niveles de triptasa entre los años 2018 y 2022 en la FALP. Se obtuvieron 34 órdenes de laboratorio, de las cuales 19 fueron emitidas en relación con un procedimiento quirúrgico. Aunque en 3 de estos casos no hubo registro del resultado de la triptasa en la ficha clínica; el resto de las variables se consideraron en el análisis final. Se tabularon en Microsoft® Excel® variables demográficas y clínicas obtenidas del registro clínico de los 19 pacientes. Se definió el grado de reacción según el compromiso de sistema cutáneo (rash, urticaria, eritema y angioedema), sistema respiratorio (disnea, estridor, sibilancias, aumento de presión en vía aérea, disminución de disten- sibilidad pulmonar, caída de saturometría arterial de oxígeno, aumento de requerimiento de fracción inspirada de oxígeno), sistema cardiovascular (taquicardia, bradicardia, arritmias, hipotensión intraoperatoria refractaria) y desarrollo de paro cardiorrespiratorio.
-
Resultados
Se presentó una media de edad de 56 años con un rango etario entre 18 a 70 años. Se detectaron 19 casos. La frecuencia por año se detalla en la Figura 1. El 63,1% de los pacientes habían sido sometidos a tres o más procedimientos quirúrgicos.
De los 19 casos, 10 pacientes resultaron tener IgE látex positiva. Dos pacientes presentaron como agente causal el antibiótico, de los cuales uno corresponde a ampicilina-sulbactam y el otro a cefazolina. En cuanto al uso de bloqueo neuromuscular, se presentó 1 caso de anafilaxia secundaria al uso de rocuronio y en tres casos se desaconsejó el uso de atracurio por inmunología. Finalmente, se presentó 1 caso de alergia a azul patente. En cinco casos no se logró identificar agente causal según registro clínico.
Todos los casos ocurrieron bajo anestesia general, de los cuales el 50% ocurrió durante la inducción anestésica, 44% en la mantención y solo se reportó un caso en el posoperatorio inmediato.
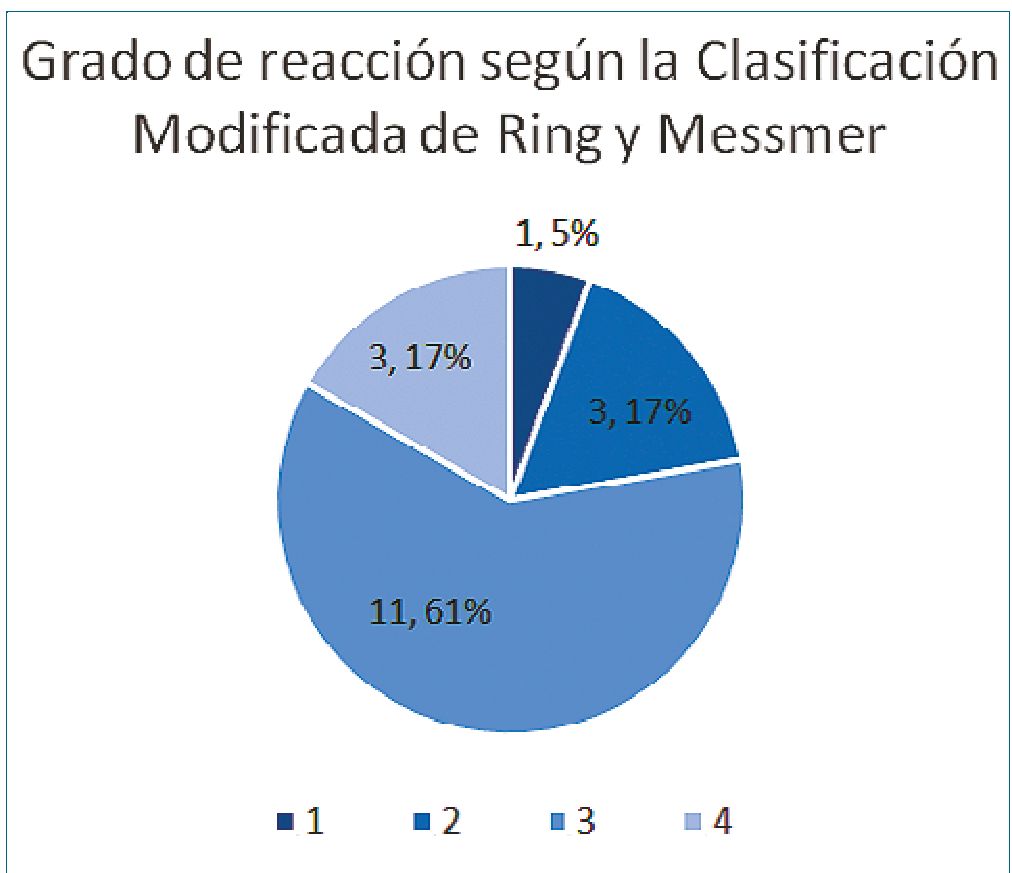
Figura 2. Grado de reacción de anafilaxia perioperatoria según la Clasificación Modificada de Ring y Messmer
El grado de reacción se pudo identificar en 18 pacientes representados en la Figura 2. Hubo 11 pacientes reportados como grado tres, correspondiendo a 61% de los casos y tres pacientes desarrollaron reacción grado 4, correspondiente al 17% de los casos. El 83% de los pacientes desarrolló compromiso hemodinámico y el 44% presentó compromiso respiratorio. Finalmente, 11 pacientes manifestaron signos cutáneos.
De los 18 pacientes, el 83% requirió tratamiento con drogas vasoactivas. Como tratamiento coadyuvante, se utilizó la fluidoterapia en el 61% de los casos totales y en el 78% de los pacientes con reacciones grado 3 y 4. En el 78% de los pacientes se administró corticoterapia y el uso de antihistamínicos se identificó en el 69% de los casos.
-
Discusión
Distintos estudios han reportado incidencias variables de anafilaxia perioperatoria, variando de acuerdo con el lugar y población de estudio, clase de reporte y tipo de reacción[2]. En el Sexto Proyecto de Auditoria Nacional (NAP6) en Reino Unido (UK), se reporta que la incidencia varía entre 1:6.000 a 1:20.000 anestesias, mientras que la incidencia de reacciones mediadas por IgE se estima en 1:10.000 anestesias[2]. Otros reportes europeos informan una frecuencia entre 1:353 a 1:18.600 procedimientos, mientras que en Estados Unidos (US) en un período de nueve años se reportó una incidencia de 1:6.825 procedi- mientos[1],[2]. En Chile, actualmente, no existen reportes epidemiológicos sobre anafilaxia perioperatoria debido probablemente a la dificultad de realizar el diagnóstico. Pocos centros cuentan con la capacidad de procesar triptasa sérica y el acceso en hospitales públicos a consulta con inmunología es escasa. En FALP se ha realizado toma muestras de triptasa a pacientes con sospecha de anafilaxia junto a IgE de látex, lo que ha permitido identificar reacciones de hipersensibilidad y realizar un estudio inmunológico. Desde el año 2018 al año 2022 se ha observado una frecuencia de 1:1.065 procedimientos quirúrgicos identificados por solicitud de triptasa.
El contexto perioperatorio presenta desafíos para el diagnóstico de anafilaxia[1]. En general, la mayor parte de las reacciones de hipersensibilidad se da con el paciente inconsciente y bajo el efecto de múltiples agentes anestésicos que producen cambios en la fisiología cardiovascular y pulmonar llevando a estos a presentar hipotensión, taquicardia o bradicardia, aumentos de presión en vía aérea, cambios en la distensibilidad pulmonar, disminución de saturometría de oxígeno y capno- grafía[6]. Por otro lado, el uso de sabanas quirúrgicas puede ocultar la aparición de signos cutáneos o estos pueden estar ausentes inicialmente y aparecer posterior a la restauración de la perfusión sistémica[9],[10]. Sera fundamental identificar los signos y síntomas posterior a la exposición antigénica y considerar la vía de exposición con un intervalo de tiempo consistente a este como por ejemplo las reacciones de alergia al látex se presentarán durante la mantención o el despertar, mientras que las drogas endovenosas lo harán cercano al período de administración[1]. Por otro lado, el paciente despierto puede presentar distintos síntomas y signos como malestar general, disnea aguda, prurito, estridor, náuseas y vómitos, taquicardia, eritema y perdida de conciencia, los cuales no necesariamente se manifiestan simultáneamente o en todos los pacientes, lo que genera un amplio abanico de diagnóstico diferencial impidiendo realizar muchas veces un tratamiento específico oportuno en caso de crisis (Tabla 2)[1]. En este sentido la presentación clínica de los pacientes de FALP que presentaron anafilaxia perioperatoria es similar a lo reportado en literatura internacional, siendo la hipotensión casi universal, el eritema se presenta en cerca del 56% de los pacientes y el compromiso ventilatorio por broncoespasmo o aumento de la presión en vía aérea en el 48% de los casos (NAP6). La aparición de signos mucocutáneos estuvo presente en el 61% de los casos estudiados, valor similar al reportado en el NAP6[2]. Los agentes causales más frecuentemente implicados son los antibióticos, bloqueadores neuro- musculares y la clorhexidina[1],[2]. En reportes internacionales, la incidencia de alergia al látex ha disminuido drásticamente por la disminución de uso elementos con látex, lo que ha prevenido su sensibilización[2]. En US los antibióticos representan la causa más frecuente, mientras que en UK los bloqueadores neuro- musculares son los más frecuentemente implicados[1],[2]. Se describe que en aproximadamente el 40% de los casos no se logra identificar el agente. En Chile, no hay reportes sobre drogas implicadas. En FALP el 52,6% de los pacientes resultó presentar alergia a látex, seguido de dos casos por antibiótico, un caso a rocuronio, un caso de hipersensibilidad a azul patente y en cinco pacientes no se identificó agente causal. Ambos casos de antibióticos fueron de la clase betalactámicos. Es importante mencionar que en esta institución el uso de insumos con látex ha disminuido durante los últimos años, quedando únicamente los guantes quirúrgicos, un desafío por lograr.
De las anafilaxias perioperatorias, según lo reportado por NAP6, el 3% ocurre previo a la inducción, 81% posterior a la inducción, 13% durante la cirugía y 3% posterior a la ciru- gía[2]. Los agentes endovenosos como antibióticos en general desencadenan la reacción antes de 10 minutos desde la administración, similar a los bloqueadores neuromusculares[1]. Por otro lado, agentes como látex, clorhexidina y tintas como el azul patente desarrollan la anafilaxia de forma más tardía[1],[2]. Esto puede explicar que en este estudio la ocurrencia durante la inducción es menor a lo reportado internacionalmente (50%) y mayor durante la mantención (44 %).
| Tabla 2. Diagnóstico diferencial shock anafiláctico perioperatorio | |
| Sistema respiratorio | Edema pulmonar |
| Neumotorax | |
| Crisis asmática | |
| Broncoaspiración | |
| Estridor postextubación | |
| Embolia aérea | |
| Sistema cardiovascular | Shock hipovolémico |
| Taponamiento cardíaco | |
| Profundidad anestésica | |
| Tromboembolismo pulmonar | |
| Sepsis | |
| Shock cardiogénico | |
El pilar del tratamiento en las reacciones grado 3 y 4 es la administración precoz de adrenalina[7],[8],[10],[11],[12]. En el NAP6 se reportó que en el 19% de los casos no se administró y en el 8,4% fue administrada tardíamente[8]. Esto puede estar relacionado a que la anafilaxia es un evento poco frecuente, al uso de vasopresores más comunes frente a hipotensión in- traoperatoria, al reconocimiento precoz de una crisis y a que pudiera existir poca experiencia con el uso de adrenalina[4]. En la FALP todos los pacientes que evolucionaron con compromiso hemodinámico recibieron tratamiento con adrenalina endovenosa. En este contexto, el uso de ayudas cognitivas es de vital importancia, evitando que factores mencionados anteriormente afecten el desenlace.
A pesar de que el uso de resucitación con fluidos durante una anafilaxia perioperatoria es bien conocido, existe la preocupación de los riesgos de una sobrecarga hídrica, especialmente en pacientes adultos mayores o en aquellos con enfermedades cardiovasculares preexistentes en quienes se pudiera precipitar una falla cardíaca[4],[12]. En el NAP6 se evidenció que la administración de fluidos fue frecuentemente insuficiente e inapropiada en el 19% de los casos, similar a lo observado en FALP[8].
Finalmente, si bien este estudio es un primer acercamiento a la epidemiología de la anafilaxia perioperatoria en Chile, encontramos importantes limitaciones. Primero, se identificaron los casos a partir del estudio de las muestras de triptasa en laboratorio, lo que puede influye en que los pacientes que no fueron estudiados con triptasa no están incluidos en el estudio. Segundo, corresponde a un estudio descriptivo que carece de potencia estadística en sus resultados. Tercero, se utilizó el registro clínico físico y electrónico de los pacientes, en donde no siempre se describen todas las variables de estudio.
Referencias
1. Tacquard C, Iba T, Levy JH. Perioperative Anaphylaxis. Anesthesiology. 2023 Jan;138(1):100–10. https://doi.org/10.1097/ALN.0000000000004419 PMID:36413685
2. Harper NJ, Cook TM, Garcez T, Farmer L, Floss K, Marinho S, et al. Anaesthesia, surgery, and life-threatening allergic reactions: epidemiology and clinical features of perioperative anaphylaxis in the 6th National Audit Project (NAP6). Br J Anaesth. 2018 Jul;121(1):159–71. https://doi.org/10.1016/j.bja.2018.04.014 PMID:29935567
3. Ebo DG, Clarke RC, Mertes PM, Platt PR, Sabato V, Sadleir PH. Molecular mechanisms and pathophysiology of perioperative hypersensitivity and anaphylaxis: a narrative review. Br J Anaesth. 2019 Jul;123(1):e38–49. https://doi.org/10.1016/j.bja.2019.01.031 PMID:30916022
4. Bustamante R. Anafilaxia y Shock Anafiláctico. Rev Chil Anestesia. Vol 50 Núm. 1 pp. 27-55, https://doi.org/10.25237/revchilanestv50n01-04.
5. Rose MA, Green SL, Crilly HM, Kolawole H. Perioperative anaphylaxis grading system: ‘making the grade’. Br J Anaesth. 2016 Nov;117(5):551–3. https://doi.org/10.1093/bja/aew251 PMID:27574285
6. Dewachter P, Savic L. Perioperative anaphylaxis: pathophysiology, clinical presentation and management. BJA Educ. 2019 Oct;19(10):313–20. https://doi.org/10.1016/j.bjae.2019.06.002 PMID:33456852
7. Garvey LH, Dewachter P, Hepner DL, Mertes PM, Voltolini S, Clarke R, et al. Management of suspected immediate perioperative allergic reactions: an international overview and consensus recommendations. Br J Anaesth. 2019 Jul;123(1):e50–64. https://doi.org/10.1016/j.bja.2019.04.044 PMID:31130272
8. Harper NJ, Cook TM, Garcez T, Lucas DN, Thomas M, Kemp H, et al. Anaesthesia, surgery, and life-threatening allergic reactions: management and outcomes in the 6th National Audit Project (NAP6). Br J Anaesth. 2018 Jul;121(1):172–88. https://doi.org/10.1016/j.bja.2018.04.015 PMID:29935569
9. Kannan JA, Bernstein JA. Perioperative anaphylaxis: diagnosis, evaluation, and management. Immunol Allergy Clin North Am. 2015 May;35(2):321–34. https://doi.org/10.1016/j.iac.2015.01.002 PMID:25841554
10. Savic LC, Garvey LH. Perioperative anaphylaxis: diagnostic challenges and management. Curr Opin Anaesthesiol. 2020 Jun;33(3):448–53. https://doi.org/10.1097/ACO.0000000000000857 PMID:32371637
11. Solé D, Spindola MA, Aun MV, Araújo Azi LM, Bernd LA, Garcia DB, et al. [Update on perioperative hypersensitivity reactions: joint document from the Brazilian Society of Anesthesiology (SBA) and Brazilian Association of Allergy and Immunology (ASBAI) – Part II: etiology and diagnosis]. Braz J Anesthesiol. 2020;70(6):642–61. https://doi.org/10.1016/j.bjane.2020.10.005 PMID:33308829
12. Kolawole H, Marshall SD, Crilly H, Kerridge R, Roessler P. Australian and New Zealand Anaesthetic Allergy Group/Australian and New Zealand College of Anaesthetists Perioperative Anaphylaxis Management Guidelines. Anaesth Intensive Care. 2017 Mar;45(2):151–8. https://doi.org/10.1177/0310057X1704500204 PMID:28267936

 ORCID
ORCID