María Fernanda Minutti Martínez1,*, Cristhian Camilo Bastidas Bastidas2, Cuauhtémoc Peralta Sánchez1,2
Recibido: 04-09-2023
Aceptado: 10-09-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 8 pp. 818-823|https://doi.org/10.25237/revchilanestv52n8-18
PDF|ePub|RIS
Anesthetic considerations for glioma resection in the asleep – awake – asleep protocol
Abstract
Awake craniectomy is returning to the standard protocol for tumors located in the proximity of eloquent areas, with improved survival, greater extension of tumor resection, less neurological deficit, reduction in days of hospital stay, and less incidence in postoperative nausea and vomiting. In this review we focus on gliomas since it is the most diagnosed primary tumor in adults, but due to the diversity of anesthetic management, lack of evidence, there is no consensus regarding its management, so we conducted a review of the literature. . and we made an algorithm with certain recommendations for awake craniectomy for glioma resection, our suggestions are merely based on the literature and institutional protocols, however additional studies are required for a high level of evidence.
Resumen
La craniectomía despierto se esta volviendo el protocolo estándar para tumoraciones que se encuentran en la proximidad de áreas elocuentes, con mejoría en la supervivencia, mayor extensión de la resección tumoral, menor déficit neurológico, disminución en los días de estancia hospitalaria y menor incidencia en la aparición de náuseas y vómitos posoperatorios. En esta revisión nos enfocamos en los gliomas ya que es la tumoración primaria más diagnosticada en el adulto, pero debido a la diversidad de manejos anestesicos, falta de evidencia no hay un consenso respecto a su manejo, por lo que realizamos una revisión de la literatura y realizamos un algoritmo con ciertas recomendaciones para la craniectomía despierto para la resección de gliomas, nuestras sugerencias son basadas meramente en la literatura y en los protocolos institucionales, sin embargo, se requieren estudios adicionales para un nivel alto de evidencia.
Los tumores cerebrales son raros, pero es un problema de salud grave, que impacta en la morbimortalidad, los gliomas son el tumor primario más frecuente en el adulto y ocupa el 80% de los tumores malignos. Presentan una incidencia anual de 6 por cada 100.000, diagnosticándose en hombres 1,6 más veces con relación a las mujeres[1].
El glioblastoma ahora se define como un glioma astrocítico difuso sin mutaciones en los genes IDH ni en los genes de la histona H3 y se caracteriza por proliferación microvascular, necrosis y/o características moleculares específicas, incluida la mutación del promotor TERT, la amplificación del gen EGFR y/o un +7/-10 firma citogenética. La clínica característica es epilepsia de nueva aparición, síntomas focales (parestesias o alteraciones sensitivas), deterioro neurocognitivo, signos y síntomas de aumento en la presión intracraneal[2]. La rápida progresión hacia la malignidad es debido a que las células tumorales migran por la sustancia blanca, llegan al sistema nervioso central y tienden a diseminar rápidamente. La cirugía juega un papel central en el manejo, ya que se ha demostrado que la extensión de la resección del tumor mejora la supervivencia general y libre de progresión[2].
-
Biología celular del cáncer y su progresión
Se ha relacionado la microglía/macrófagos con la progresión de las células tumorales, ya que estas células se reclutan cerca de la masa tumoral. La microglía se diferencia en dos tipos: M1 con efecto antitumoral, que suprime el crecimiento; M2 con efecto protumoral, mediante mecanismos inmunosupresores[3]. El Aumento de factores solubles secretados por células del glioma son detectados por receptores tipo Toll (TLRs) especialmente TLR2, como interleucina 6 (IL6) y el factor de crecimiento transformador (TGF)-b, mismas que estimulan la secreción de metaloproteinasas y con ello favorecen la migración de células del glioma, además de favorecer la angiogénesis[4]. El factor inducible de hipoxia (HIF) está relacionado con la progresión celular, varios anestesicos están relacionados en la activación o inhibición de este factor (halogenados, propofol respectivamente). Por lo que, es importante conocer el impacto que tienen los anestesicos con la proliferación, migración y progresión celular.
-
Cirugía dormido – despierto – dormido
Los pacientes con gliomas se benefician del mayor porcentaje de resección que se pueda alcanzar ya que eso garantizara el mayor tiempo de sobrevida libre de enfermedad y libre de recaídas.
El papel de la neuro-oncoanestesia en este contexto es ofrecer las mejores condiciones en el paciente durante el período de despierto, para que se pueda llevar a cabo todas las pruebas y test necesarios para optimizar el área de resección, evitando al máximo las complicaciones que se puedan presentar en esta fase. La cirugía con paciente despierto se ha convertido en el tratamiento de elección para los gliomas difusos, la cual se divide en tres etapas: 1) Craniectomía; 2) Resección tumoral, donde se realiza el mapeo por estimulación cortical y axonal, permitiendo disminuir el riesgo de disfunción neurológica al preservar las estructuras cerebrales circundantes elocuentes y 3) Cierre[5].
La craniectomía con el paciente despierto para la resección de tumores cerebrales se está volviendo cada vez más un estándar de atención para lesiones que residen dentro o en estrecha proximidad a regiones que tienen función del lenguaje o sensoriomotora, hay evidencia de mayor extensión de la resección, menos déficits neurológicos tardíos, una estancia hospitalaria más corta además de una supervivencia más larga en comparación a la anestesia general[6].
-
Objetivos
• Control hemodinámico, respiratorio, neurológico, circulatorio.
• Confort del paciente durante el procedimiento.
• Evitar y/o controlar crisis convulsivas.
• Prevención de náuseas y vómitos.
• Analgesia adecuada.
• Anestésicos con adecuada cobertura analgésica y que no afecten el despertar durante el procedimiento.
-
Preanestésico
Selección adecuada del paciente, la única contraindicación absoluta es el rechazo de la intervención, sin embargo, hay condiciones psiquiátricas que se relacionan con la falla en la colaboración. Una adecuada comunicación es fundamental para resultados exitosos.
-
Transanestésico
-
Sedación consciente
El anestésico más recomendado es la dexmedetomidina, es un agonista alfa 2, actuando como analgésico, ansiolítico, sedante, simpaticolítico y ahorrador de opioides, tiene mínimo impacto en la función neurológica, que no causa depresión respiratoria. En múltiples estudios se ha valorado su uso durante el mapeo cerebral, con resultados favorables, sin necesidad de manejo avanzado de la vía aérea. Las complicaciones de su uso a dosis altas es la bradicardia, hipotensión y prolongación de la sedación[7].
-
Bloqueo de escalpe
Para lograr un adecuado control de dolor durante la craniectomía es indispensable realizar el bloqueo de las ramas aferentes del trigémino a nivel del escalpe. Existen diferentes técnicas descritas para lograr el mejor control de dolor peri y posoperatorio, como lo muestra Mathew R et al.[8], en su metaanálisis donde incluyo 325 pacientes, en donde se compara principalmente el momento del bloqueo de escalpe regional (BER) (Figura 1), y los agentes anestésicos locales, donde concluye que para alcanzar hasta 12 h libres de dolor posoperatorio realizan el BER después del momento quirúrgico, sin embargo, para lograr el mejor control hemodinámico y disminución de opioides se debe realizar en el perioperatorio, posterior a la inducción anestésica y previo a la colocación del cabezal de Mayfield. De ser insuficiente el bloqueo de escalpe esta descrito que se puede realizar un refuerzo a nivel del sitio de incisión del cabezal e incluso con gasas mojadas con anestésico local (AL), para aplicar directamente en los bordes de la duramadre durante la resección cuidando las dosis máximas permitidas por tipo de AL. No existen estudios que se inclinen a favor de uno u otro agente comparando la efectividad de bupivacaina y ropivacaína cuyos perfiles de farmacocinética son similares en cuanto a inicio de acción y vida media, sin embargo, la selección de ellos debe basarse en el perfil del paciente en cuanto a la toxicidad cardiaca se refiere por la bupivacaína, cabe mencionar que la levobupivacaína también es una opción en este escenario pero dependerá de la disponibilidad en cada institución para escoger el AL.
Se ha estudiado utilizar como adyuvante a la dexmedetomidina para bloqueo de escalpe en pacientes sometidos a craniectomía, uno de estos estudios fue realizado por Chrysoula et al[9], donde en 105 pacientes, se dividieron aleatoriamente, en el grupo R se administró 40 ml de ropivacaína al 0,5%, en el grupo RD se colocó 40 ml de ropivacaína al 0,5% más dex- medetomidina 1 pg/kg, y en el grupo C se administró 40 ml de solución salina como placebo. Después de una secuencia de inducción estándar con propofol, fentanilo y una dosis única de rocuronio, los pacientes fueron intubados, posteriormente se realizó el bloqueo bilateral del cuero cabelludo con las ramas supraorbitaria, supratroclear, auriculotemporal, occipital y postauricular de los nervios auriculares mayores, el mantenimiento transanestésico con propofol y remifentanilo. Se demostró que en el grupo RD mostró una frecuencia cardíaca menor durante la incisión de duramadre y la piel, además de menor consumo de opioides que los otros grupos (p < 0,001), en cuanto al dolor posoperatorio a las 24 y 48 h no mostró significancia (p = 0,284, y p = 0,385 respectivamente).
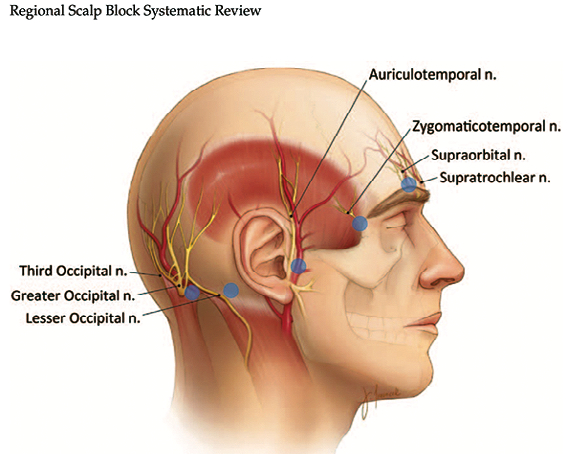
Figura 1. Ramas aferentes del nervio trigémino y ramas cervicales que inervan el escalpe[8].
-
Mantenimiento
El anestesiólogo debe titular de una manera eficiente las concentraciones plasmáticas o sitio efecto para llegar a la fase de despierto en el momento exacto que permita que el paciente sea capaz no solo de proteger su vía aérea si no, sea capaz de responder el test específico por parte del personal entrenado el cual incluye pruebas visuales, de lenguaje, motoras y especificas relacionadas al área elocuente que se está interviniendo. Para esto el doctor Lobo et al.[10], ha realizado comparaciones de diferentes agentes anestesicos desde el 2007 para documentar las concentraciones necesarias a la hora de alcanzar las metas por fases de la craniectomía en paciente despierto. En su publicación compara las concentraciones en sitio efecto para propofol y remifentanilo que son los agentes hasta el momento de mayor facilidad de titulación y permitiendo rápida emersión, de manera que para alcanzar el restablecimiento de la conciencia (RC1) se necesitan concentraciones en sitio efecto (Ce) por debajo de 2 mcg/ml ± 0,1 para propofol y remifentanilo por debajo de Ce 1,8 ± 0,1 ng/ml en donde el paciente es capaz de ventilar por sí solo, y para tener capacidad de responder el test en su estudio, se necesitan Ce 0,9 ± 0,1 mcg/ml para propofol y las mismas descritas para remifentanil correlacionado con el nivel de índice biespectral (BIS). En este apartado, cobra importancia el monitoreo del estado neurológico y así de la profundidad anestésica lo cual asegura el mejor estado del paciente en la fase de despierto, y así disminuir al máximo las posibles complicaciones. En lo particular Navdeep S et al.[11], en su publicación hace un análisis de las complicaciones en la cirugía con paciente despierto donde destaca la hipertensión arterial como la más frecuente hasta 17%, seguida de las convulsiones 9% y la desaturación 7,4% entendida esta como saturación por pulsioximetría por debajo de 90%, sin llegar a la apnea la cual se reporta con 3% (Figura 2), de frecuencia en su estudio retrospectivo donde incluye 54 pacientes en un hospital de la India. Como podemos ver la incidencia de la apnea para el autor, al igual que otros reportes publicados es muy baja por si sola, más aún cuando realizamos un monitoreo preciso del estado neurológico se disminuye aún más esta complicación además de garantizar la mejor titulación de los agentes anestésicos con una correcta interpretación del trazado del electroencefalograma continuo no procesado (EEG) con dispositivos no invasivos así como el análisis de la matriz de densidad espectral (DSA) para lo cual cobra especial importancia el papel del neuroanestesiólogo y así optimizar al máximo la seguridad del procedimiento.
-
Técnica anestésica
En cuanto a la técnica a escoger, existen descripciones de
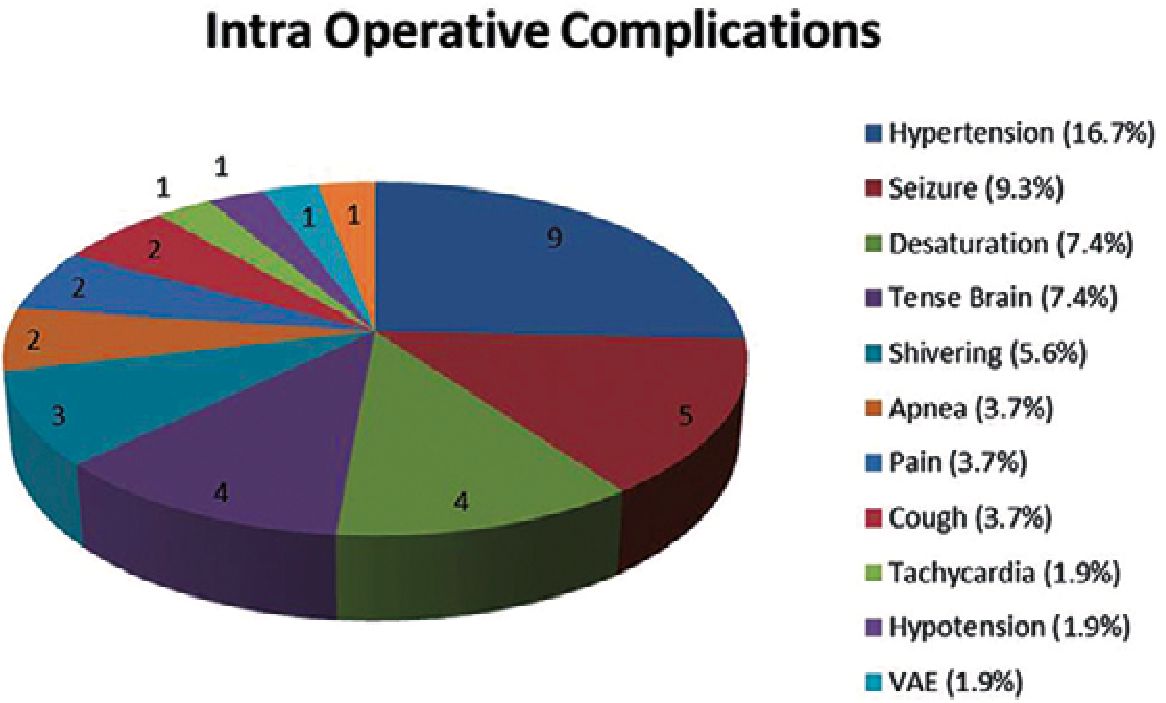
Figura 2. Frecuencia de las complicaciones durante la craniectomía en paciente despierto, VAE (venous air embolism)[11].
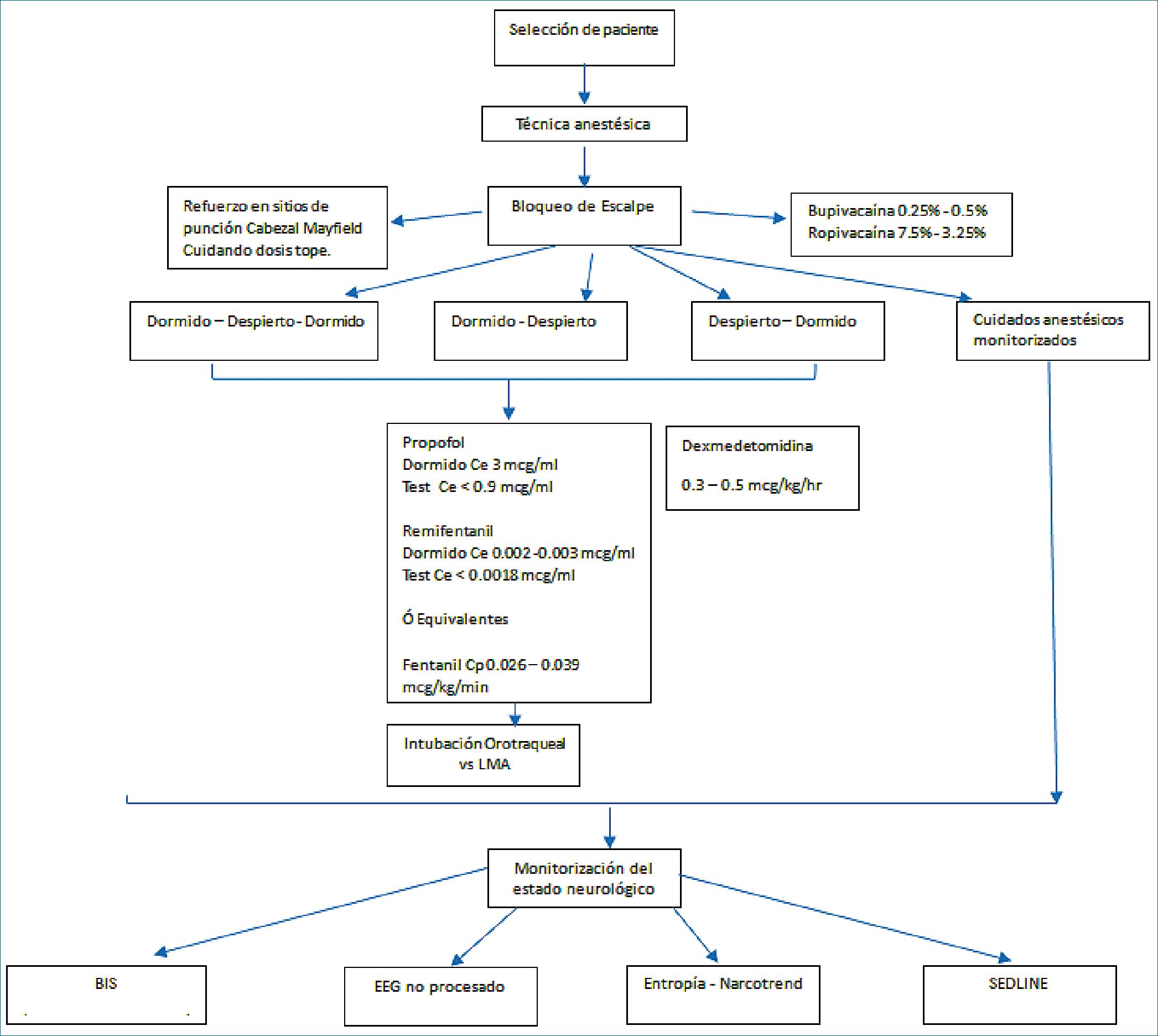
Figura 3. Algoritmo de manejo para craniectomía despierto para resección de gliomas.
varias combinaciones diferentes, como se evidencia en la última revisión de manejo anestésico para craniectomía despierto realizada en europa Arzoine J et al.[12], donde se hace referencia a la técnica clásica de dormido – despierto – dormido (DDD), Despierto – Dormido o Dormido – Despierto (DD) hasta el final de procedimiento, así como si se realiza intubación orotraqueal o uso de dispositivos supraglóticos, para lo cual dependerá de la mejor experiencia del equipo anestésico para seleccionar una u otra, ya que como se muestra en el metaanálisis de Steanovic et al.[13], no existe diferencia estadísticamente significativa a la hora de comparar una técnica sobre otra. La técnica ideal dependerá del tipo de paciente y de la experiencia del neuroanestesiólogo[14]. Una vez que durante la valoración preanestésica se asegura que el paciente no cumple con los criterios de exclusión mayores como es la negativa del paciente al procedimiento y criterios de exclusión menores los cuales incluyen obesidad con IMC > 38, presencia de síndrome de apnea obstructiva del sueño (SAOS) entre otros[15].
Es por esto que en base a la evidencia en la literatura se
propone el siguiente algoritmo de manejo para craniectomía despierto para resección de gliomas (Figura 3).
-
Ventajas
• Disminuir supresión de las células Natural Killer por anestésicos.
• Disminuye daño pulmonar secundario a la ventilación mecánica.
• Disminuye días de estancia intrahospitalaria.
• Disminución de náuseas y vómito postoperatorios.
-
Complicaciones[16]
• Convulsiones (3%-30%).
• Hipertensión (17%-24%).
• Desaturación (7%-16%).
• Náuseas y vómitos (0% a 9%).
• Edema cerebral leve (7%-14%).
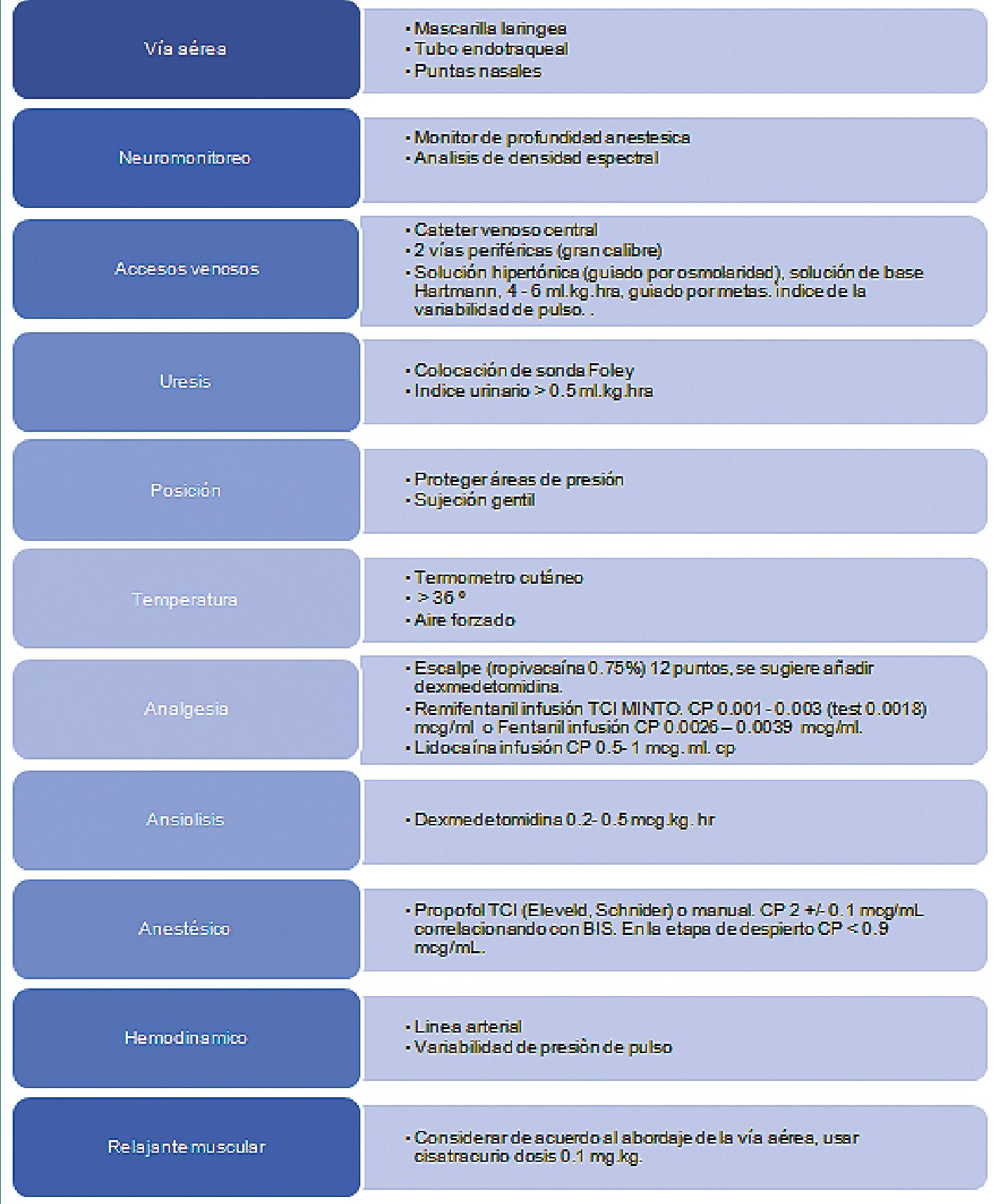
Cuadro 1. Recomendaciones basadas en la literatura para craniectomía despierto.
-
Postanestésico
Las nuevas tecnologías y el desarrollo de nuevos protocolos en la neuroanestesia y craniectomía despierto, con mejores desenlaces e incluso se ha implementado la cirugía ambulatoria en pacientes selectos (tumores supratentoriales, que se encuentre a menos de una hora durante la recuperación, cuidadores disponibles); con impacto favorable para su recuperación y satisfacción en general. Para que esto sea posible se requieren los siguientes puntos: una resonancia magnética previa al procedimiento, generalmente no se colocan accesos venosos centrales, únicamente vías de alto flujo venoso, uso profiláctico de antibióticos. En el posoperatorio se mantiene en la unidad de cuidados posanestésicos durante dos hora y vigilancia 4 h posteriores, también se requiere una tomografía 4 h posteriores a la intervención, si a la valoración no cumple con ninguno de los puntos o se encuentra con alguna anormalidad se decide su hospitalización[17].
Se requiere un compromiso multidisciplinario y del paciente para que esto se lleve a cabo, además de tener comunicación continua ya que las complicaciones se presentaran las primeras 24 h.
-
Conclusiones
La decisión de una técnica sobre otra dependerá de múltiples factores, tanto del paciente, de los recursos disponibles, así como de los factores propios del padecimiento, pero hoy en día se ha demostrado resultados favorecedores con la craniectomía despierto en gliomas para la calidad de vida y del pronóstico del paciente. Hay muy poco descrito en la literatura y con la innovación tecnológica se requieren tener más consensos y recomendaciones para este tipo de cirugías, además que se requiere un mayor número de estudios para validar ciertos abordajes. De acuerdo con la revisión de la literatura se brindan una serie de recomendaciones (Cuadro 1) y proponemos un algoritmo (Figura 3) para la toma de decisiones en el manejo anestésico de los pacientes neuro oncológicos que serían sometidos a craniectomía y que es aplicable a cualquier combinación de dormido despierto.
Conflicto de interese: Todos los autores declaran no tener conflicto de intereses alguno.
-
Referencias
1. Saito J, Masters J, Hirota K, Ma D. Anesthesia and brain tumor surgery: Technical considerations based on current research evidence. Vol. 32, Current Opinion in Anaesthesiology. Lippincott Williams and Wilkins; 2019. p. 553–62.
2. Weller M, van den Bent M, Preusser M, Le Rhun E, Tonn JC, Minniti G, et al. EANO guidelines on the diagnosis and treatment of diffuse gliomas of adulthood. Nat Rev Clin Oncol. 2021 Mar;18(3):170–86. https://doi.org/10.1038/s41571-020-00447-z PMID:33293629
3. Sarkar S, Döring A, Zemp FJ, Silva C, Lun X, Wang X, et al. Therapeutic activation of macrophages and microglia to suppress brain tumor-initiating cells. Nat Neurosci. 2014 Jan;17(1):46–55. https://doi.org/10.1038/nn.3597 PMID:24316889
4. Wu SY, Watabe K. The roles of microglia/macrophages in tumor progression of brain cancer and metastatic disease. Front Biosci (Landmark Ed). 2017 Jun;22(10):1805–29. https://doi.org/10.2741/4573 PMID:28410147
5. Arzoine J, Levé C, Pérez-Hick A, Goodden J, Almairac F, Aubrun S, et al. Anesthesia management for low-grade glioma awake surgery: a European Low-Grade Glioma Network survey. Vol. 162, Acta Neurochirurgica. Springer; 2020. p. 1701–7.
6. Meng L, Berger MS, Gelb AW. The Potential Benefits of Awake Craniotomy for Brain Tumor Resection: An Anesthesiologist’s Perspective [Internet]. 2015. Available from: www.jnsa.com
7. Sewell D, Smith M. Awake craniotomy: Anesthetic considerations based on outcome evidence. Vol. 32, Current Opinion in Anaesthesiology. Lippincott Williams and Wilkins; 2019. p. 546–52.
8. Guilfoyle MR, Helmy A, Duane D, Hutchinson PJ. Regional scalp block for postcraniotomy analgesia: a systematic review and meta-analysis. Anesth Analg. 2013 May;116(5):1093–102. https://doi.org/10.1213/ANE.0b013e3182863c22 PMID:23477962
9. Stachtari C, Stergiouda Z, Koraki E, Sifaki F, Bagntasarian S, Chatzopoulos S. Dexmedetomidine as an adjuvant to scalp block in patients undergoing elective craniotomy: A prospective randomized controlled trial. Clin Neurol Neurosurg. 2023 Apr;227:107669. https://doi.org/10.1016/j.clineuro.2023.107669 PMID:36924695
10. Lobo F, Beiras A. Propofol and remifentanil effect-site concentrations estimated by pharmacokinetic simulation and bispectral index monitoring during craniotomy with intraoperative awakening for brain tumor resection. J Neurosurg Anesthesiol. 2007 Jul;19(3):183–9. https://doi.org/10.1097/ANA.0b013e31805f66ad PMID:17592350
11. Sokhal N, Rath GP, Chaturvedi A, Dash HH, Bithal PK, Chandra PS. Anaesthesia for awake craniotomy: A retrospective study of 54 cases. Indian J Anaesth. 2015 May;59(5):300–5. https://doi.org/10.4103/0019-5049.156878 PMID:26019355
12. Arzoine J, Levé C, Pérez-Hick A, Goodden J, Almairac F, Aubrun S, et al.; collaborators of the ELGGN. Anesthesia management for low-grade glioma awake surgery: a European Low-Grade Glioma Network survey. Acta Neurochir (Wien). 2020 Jul;162(7):1701–7. https://doi.org/10.1007/s00701-020-04274-0 PMID:32128618
13. Stevanovic A, Rossaint R, Veldeman M, Bilotta F, Coburn M. Anaesthesia Management for Awake Craniotomy: Systematic Review and Meta-Analysis. PLoS One. 2016 May;11(5):e0156448. https://doi.org/10.1371/journal.pone.0156448 PMID:27228013
14. Li SZ, Su N, Wu S, Fei XW, He X, Zhang JX, et al. Monitored anesthesia care and asleep-awake-asleep techniques combined with multiple monitoring for resection of gliomas in eloquent brain areas: a retrospective analysis of 225 patients. Chin Neurosurg J. 2022 Dec;8(1):45. https://doi.org/10.1186/s41016-022-00311-2 PMID:36582003
15. Pascual JS, Omar AT 2nd, Gaddi MJ, Iglesias RJ, Ignacio KH, Jose GR, et al. Awake Craniotomy in Low-Resource Settings: Findings from a Retrospective Cohort in the Philippines. World Neurosurg. 2021 Jan;145:500–507.e1. https://doi.org/10.1016/j.wneu.2020.10.070 PMID:33091650
16. Eseonu CI, ReFaey K, Garcia O, John A, Quiñones-Hinojosa A, Tripathi P. Awake Craniotomy Anesthesia: A Comparison of the Monitored Anesthesia Care and Asleep-Awake-Asleep Techniques. World Neurosurg. 2017 Aug;104:679–86. https://doi.org/10.1016/j.wneu.2017.05.053 PMID:28532922
17. Marigil M, Bernstein M. Outpatient neurosurgery in neuro-oncology. Neurosurg Focus. 2018 Jun;44(6):E19. https://doi.org/10.3171/2018.3.FOCUS1831 PMID:29852775

 ORCID
ORCID

 Creative Commons Attribution
Creative Commons Attribution