Martín Astete B.1, María Ignacia Muñoz A.2, Martín Lacassie3, Héctor J. Lacassie4
Recibido: 23-02-2024
Aceptado: 19-04-2024
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 3 pp. 266-271|https://doi.org/10.25237/revchilanestv53n3-10
PDF|ePub|RIS
Rational use of neuromuscular blockers guided by neuromonitoring
Abstract
This narrative review focuses on the use of neuromuscular blockers in anesthesia, their monitoring, and reversal strategies with a specific emphasis on their economic and anesthetic implications. From an economic standpoint, health expenditure in Chile is substantial, underlining the importance of appropriate selection and dosage of medications as a cost containment measure. A comparison of costs between drugs is provided, stressing the significance of making economic decisions that are based on resource efficiency. Neuromuscular blockers are medications that hinder nerve conduction at the motor plate, inducing reversible skeletal muscle paralysis. Their usage is prevalent in anesthesia to aid tracheal intubation, enhance surgical conditions, and reduce the effort needed for ventilation in intubated patients. Monitoring neuromuscular function is crucial for assessing the degree of blockade, managing medication dosages, reversing its effects, and diminishing the occurrence of residual blockade. Concerning reversal strategies, there is a growing preference for sugammadex over neostigmine, despite the former’s higher cost. The safety of sugammadex across various patient demographics is discussed, alongside new evidence supporting the judicious use of neostigmine, guided by quantitative monitoring. In summary, the review underscores the anesthesiologist’s responsibility in utilizing resources wisely, advocating for evidence-based protocols that are guided by quantitative neuromuscular monitoring.
Resumen
La presente revisión narrativa tiene como objetivo abordar la utilización de bloqueadores neuromusculares en anestesia, su monitorización y estrategias de reversión con un enfoque particular en sus consideraciones económicas y anestésicas. Desde una perspectiva económica, el gasto en salud en Chile es significativo y se destaca la necesidad de una adecuada selección y dosificación de los medicamentos, como una de las medidas de contención de costos. Se proporciona una comparación de costos entre el fármacos, subrayando la importancia de decisiones económicas fundamentadas en la eficiencia de recursos. Los bloqueadores neuromusculares son fármacos que inhiben la conducción nerviosa en la placa motora, generando una parálisis muscular esquelética reversible. Su uso es común en anestesia para facilitar la intubación traqueal, mejorar las condiciones quirúrgicas y disminuir el trabajo ventilatorio en pacientes intubados. La monitorización neuromuscular es esencial para evaluar el nivel de bloqueo, la dosificación y reversión de su efecto, así como en la reducción en la incidencia de bloqueo residual. En cuanto a estrategias de reversión, se menciona el aumento en la preferencia por sugammadex en comparación con neostigmina, aunque se destaca su mayor costo. Se discute la seguridad de sugammadex en diversos grupos de pacientes y se presenta nueva evidencia que respalda el uso prudente de neostigmina, guiado por monitorización cuantitativa. En conclusión, se enfatiza la responsabilidad del anestesiólogo en el uso racional de recursos, abogando por la implementación de protocolos basados en la evidencia y guiados por monitorización neuromuscular cuantitativa.
-
Introducción
Los bloqueadores neuromusculares son medicamentos que inhiben la conducción nerviosa en la placa motora mediante su unión al receptor colinérgico nicotínico en la unión neuromuscular mediante un mecanismo agonista (bloqueado- res neuromusculares despolarizantes) o antagonista (bloquea- dores neuromusculares no despolarizantes) generando una parálisis del músculo esquelético en forma transitoria y reversible[1]. Corresponden a medicamentos de uso habitual por el anestesista para facilitar la intubación traqueal, brindar condiciones quirúrgicas apropiadas y disminuir el trabajo ventilatorio en pacientes intubados[2]. A su vez, la neuromonitorización corresponde a diferentes métodos que permiten estimar el nivel (profundidad) de bloqueo neuromuscular de forma cualitativa o cuantitativa[2],[3].
El uso racional de bloqueadores neuromusculares hace referencia a la apropiada dosificación de estos fármacos y los medicamentos que revierten su acción guiados por neuro- monitorización, con la finalidad de disminuir la incidencia de bloqueo neuromuscular residual, optimizando la utilización de recursos[2],[4].
La presente revisión narrativa tiene como finalidad describir el estado actual del bloqueo neuromuscular, su reversión y monitorización en el contexto del manejo anestésico perioperatorio, con énfasis en la costo-efectividad de su correcta utilización.
| Tabla 1. Características de los bloqueadores neuromusculares más utilizados en cirugía. | ||||||
| Familia | Agente | ED95/DI (mg/kg) | T inicio (min) | Duración (min) | Eliminación | Efectos adversos* |
| Despolarizante | Succinilcolina | 0,3 – 0,6/1 | < 1 | 6 – 10 | Renal (< 2%) y Esterasas plasmáticas con metabolito inactivo | • Aumento del K+
• Alt. del ECG. • Hipertemia maligna • Fasciculaciones |
| No despolarizante Aaminoesteroide | Rocuronio | 0,3/0,6 | 1,5 — 3 | 20 – 70 | Biliar (90%) y renal (10%) con metabolito inactivo | Taquicardia |
| No despolarizante aminoesteroide | Vecuronio | 0,05/0,1 | 3 – 5 | 20 – 40 | Biliar (60%) y renal (40%) con metabolito activo (3-desacetil- vecuronio) | Bradicardia |
| No despolarizante benzilisoquinolina | Atracurio | 0,25/0,5 | 3 – 5 | 20 – 35 | Reacción de Hoffman y esterasas plasmáticas con metabolito inactivo | • Aumento del umbral convulsivo (Laudanosina)
• Reacciones histaminérgicas |
| No despolarizante benzilisoquinolina | Cisatracurio | 0,0,5 – 0,07/0,15 | 4 – 7 | 35 – 50 | Reacción de Hoffman y esterasas plasmáticas con metabolito inactivo | |
ED95: dosis del medicamento con el que se produce una disminución en la respuesta motora del 95%; DI: dosis para intubación traqueal; TInicio: tiempo de inicio de acción; ECG: electrocardiograma. *: Todos los bloqueadores neuromusculares no despolarizantes tienen riesgo de bloqueo residual. En pacientes con mutación genética homocigota para la enzima pseudocolinesterasa plasmática, el bloqueo con succinilcolina puede prolongarse 4 – 8 h.
-
Consideraciones económicas y anestésicas
Según datos aportados a la Organización Mundial de la Salud (OMS), en 2022 el gasto público en salud de Chile fue 18,1% del gasto fiscal[5] y el gasto en salud por persona ascendió a aproximadamente 2.400 dólares (US$) por persona, como promedio de pacientes que se atendieron por modalidad con pago cero o en forma privada[6]. En términos farmacoepi- demiológicos, para la OMS ningún bloqueador neuromuscular cuenta con una unidad de medida de dosis diaria definida- (defined daily dose measuring unit), lo que dificulta la obtención de datos de consumo e impide la comparación entre diferentes centros en forma estandarizada[7].
El uso de bloqueadores neuromusculares ha demostrado mejorar las condiciones quirúrgicas en cirugía laparoscópica[8], sin embargo, el estudio POPULAR demostró que su uso aumentó en la incidencia de complicaciones respiratorias posoperatorias, mientras que el estudio NAP5 demostró una mayor incidencia de awareness[9],[10]. Esto pone en perspectiva la dualidad de su beneficio, pero a costa de riesgos potencialmente graves.
Existe una amplia oferta de bloqueadores neuromusculares disponibles en el mercado. La dosificación y selección dependerán del contexto médico y quirúrgico de cada paciente, teniendo presente la duración del bloqueo y la indicación en su uso (Tabla 1)[11]. Por lo tanto, el claro beneficio en su utilización versus las complicaciones asociadas hace imperativa la adecuada selección y dosificación de los medicamentos.
-
Monitorización neuromuscular
El uso de monitorización neuromuscular intraoperatoria es esencial, donde la monitorización cuantitativa, es el están- dar[2],[12],[13]. Es conocido que el bloqueo neuromuscular no es homogéneo en toda la musculatura siendo diferente en cada grupo muscular, iniciando su efecto en forma más rápida, pero con menor duración, en la musculatura central[14]. Es por esta razón que la monitorización en el aductor corto del pulgar (inervado por el nervio ulnar) es hoy el único sitio recomendado para medición, dado que aporta un margen de seguridad al relajarse más tardíamente que el diafragma y la laringe, mientras que su recuperación ocurre igualmente de forma más tardía que aquellos grupos musculares[2],[3],[13] (Figura 1).
Existen diferentes métodos de neuromonitorización siendo el más utilizado la aceleromiografía, aunque el más preciso es la electromiografía[13],[14]. En clínica se prefiere el primero por su facilidad de uso y amplia disponibilidad, sin comprometer mayormente la efectividad. La aceleromiografía es un método de medición que se fundamenta en la primera ley de Newton, donde la fuerza producida es directamente proporcional a la masa por la aceleración, por lo tanto, al mantener la masa constante, la fuerza depende exclusivamente de la aceleración (movimiento) generada, que es detectada por el monitor[14].
Existen diferentes modalidades de neuroestimulación, entre las que se encuentran: el estímulo único (single twitch), el tren de cuatro (train of four, TOF), la estimulación a doble ráfaga (double bust stimulation, DBS), el tétanos (TET, por sus siglas en inglés) y otras modalidades mixtas como el conteo post tetánico (post tetanic count, PTC), recomendado para identificar un bloqueo neuromuscular profundo[12]-[15].
El TOF consta de cuatro estímulos consecutivos a una frecuencia de 2 Hz (separados por 0,5 ms) y permite el cálculo de una relación entre la cuarta versus la primera respuesta (T4:T1) lo que representa el TOF ratio (TOFR). Este índice representa el estándar de medición cuantitativa recomendado para la determinación del bloqueo neuromuscular residual (TOFR < 0,9) porque el volumen corriente, la capacidad vital y los reflejos protectores de la vía aérea se recuperan completamente cuando el TOFR > 0,4, 0,6 y 0,9, respectivamente[2],[14]. En la Figura 2 se indica la correcta programación del neuroestimulador en la modalidad TOF para la neuromonitorización del bloqueo neuromuscular.
-
Estrategias de reversión del bloqueo neuromuscular
La correcta aplicación intraoperatoria de la monitorización neuromuscular permite el uso juicioso de los bloqueadores neuromusculares y de los agentes reversores disponibles. La profundidad del bloqueo neuromuscular se determina según el TOF, TOFR y el conteo post tetánico (PTC). Se considera un bloqueo completo con PTC = 0; profundo con TOF = 0 y PTC > 1; moderado con TOF > 1 – 3 y TOFR 0; superficial con TOF = 4 y TOFR < 0,4 y mínimo con TOFR > 0,4 – 0,9[15]. Se considera seguro extubar a un paciente con TOFR > 0,9 (Figura 3)[2],[3],[14].
En la actualidad el uso de sugammadex (ciclodextrina que encapsula rocuronio y en menor medida vecuronio) en desmedro de la neostigmina (inhibidor de la acetilcolinesterasa) ha sido una tendencia en aumento, lo que ha sido reforzado por las nuevas recomendaciones de la Sociedad Americana de Anestesiólogos (American Society of Anesthesiologists [ASA]) en su guía clínica de 2023 donde en su sexta recomendación se señala que: “recomienda sugammadex sobre neostigmina en bloqueo neuromuscular profundo, moderado y superficial inducido por rocuronio o vecuronio, para evitar el bloqueo neuromuscular residual”[2]. Sin embargo, el gran argumento en contra del uso de sugammadex es su elevado precio. Según los datos aportados por la Central de Abastecimiento en Chile (CENABAST), el costo de un tratamiento estándar para un adulto de 70 kg de sugammadex (2 mg/kg) vs. neostigmina (50 mcg/ kg) asciende a US$57,41 y US$0,67, respectivamente, representando una diferencia 8.500%. Dicha comparativa y el alto gasto público en salud, hacen imperativa la adecuada selección y dosificación de los medicamentos.
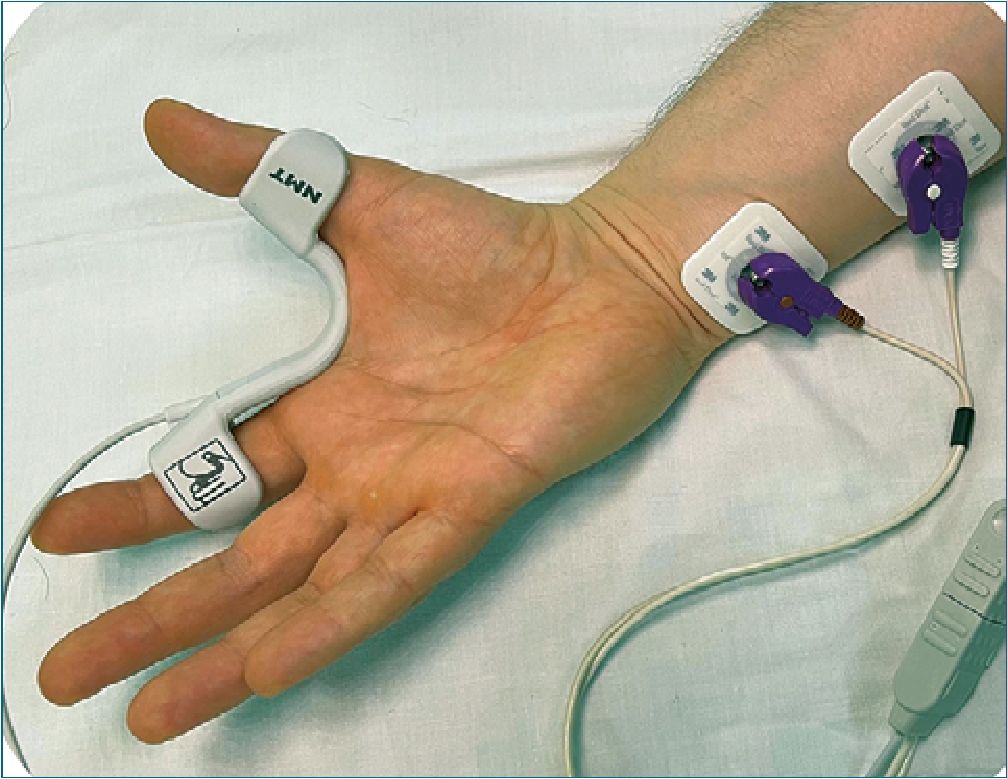
Figura 1. Posicionamiento del aceleromiógrafo en el dedo pulgar para la medición del bloqueo neuromuscular a nivel del aductor corto del pulgar. El posicionamiento de los electrodos es en la cara interna del antebrazo, en la piel a lo largo del trayecto del nervio ulnar, con el electrodo negativo (habitualmente de color negro o café) a distal y el positivo (de color rojo o blanco), 2 a 3 cm a proximal. De ubicarse más cerca entre ellos, la polaridad no es tan relevante.
Una revisión Cochrane en 2017, presentó un metaanálisis con los resultados de 825 pacientes de diez trabajos donde mostró que al comparar sugammadex en dosis de 2 mg/kg y neostigmina 50 mcg/kg para la reversión del bloqueo neuromuscular moderado, el tiempo necesario para alcanzar un TOFR > 0,9 eran de 1,96 y 12,87 min, respectivamente, es decir, sugammadex fue 10,22 minutos (6,6 veces) más rápido que la neostigmina para revertir la parálisis moderada. A su vez, sugammadex fue 45,78 minutos (16,8 veces) más rápido que la neostigmina (2,9 frente a 48,8 minutos) para revertir la parálisis profunda. Además, se demostró una incidencia de eventos adversos de 16% y 28% para sugammadex y neostigmina, respectivamente. Así, los participantes que recibieron sugam-madex parecieron tener un riesgo 40% menor de experimentar eventos dañinos que aquellos que recibieron neostigmina. Estadísticamente, ocho personas pueden ser tratadas con sugam-madex en lugar de neostigmina para evitar que una persona experimente un único evento dañino (number needed to harm, NNH = 8). La aparición de eventos perjudiciales graves fue casi inexistente y los datos no muestran diferencias entre los grupos comparados[16]. Este metaanálisis reforzó la recomendación de la ASA para el uso de sugammadex.
A su vez, diversos estudios han demostrado la seguridad de sugammadex en diferentes grupos de pacientes. Una revisión sistemática determinó su seguridad en usuarios con enferme-
dad renal crónica (ERC) con una demora de 2 min más en alcanzar un TOFR > 0,9 en comparación a pacientes sin ERC, donde tampoco se reportaron efectos adversos graves en pacientes con clearance de creatinina < 30 ml/min o trasplantados rena- les[17]. Un trabajo prospectivo de fase cuatro, con 276 pacientes entre 2 y 17 años demostró la seguridad de sugammadex en pacientes pediátricos con un tiempo para alcanzar un TOFR
> 0,9 de 1,6 min para una dosis de 2 mg/kg y una incidencia de bradicardia de 2%, la que fue el evento adverso más frecuente reportado[18].
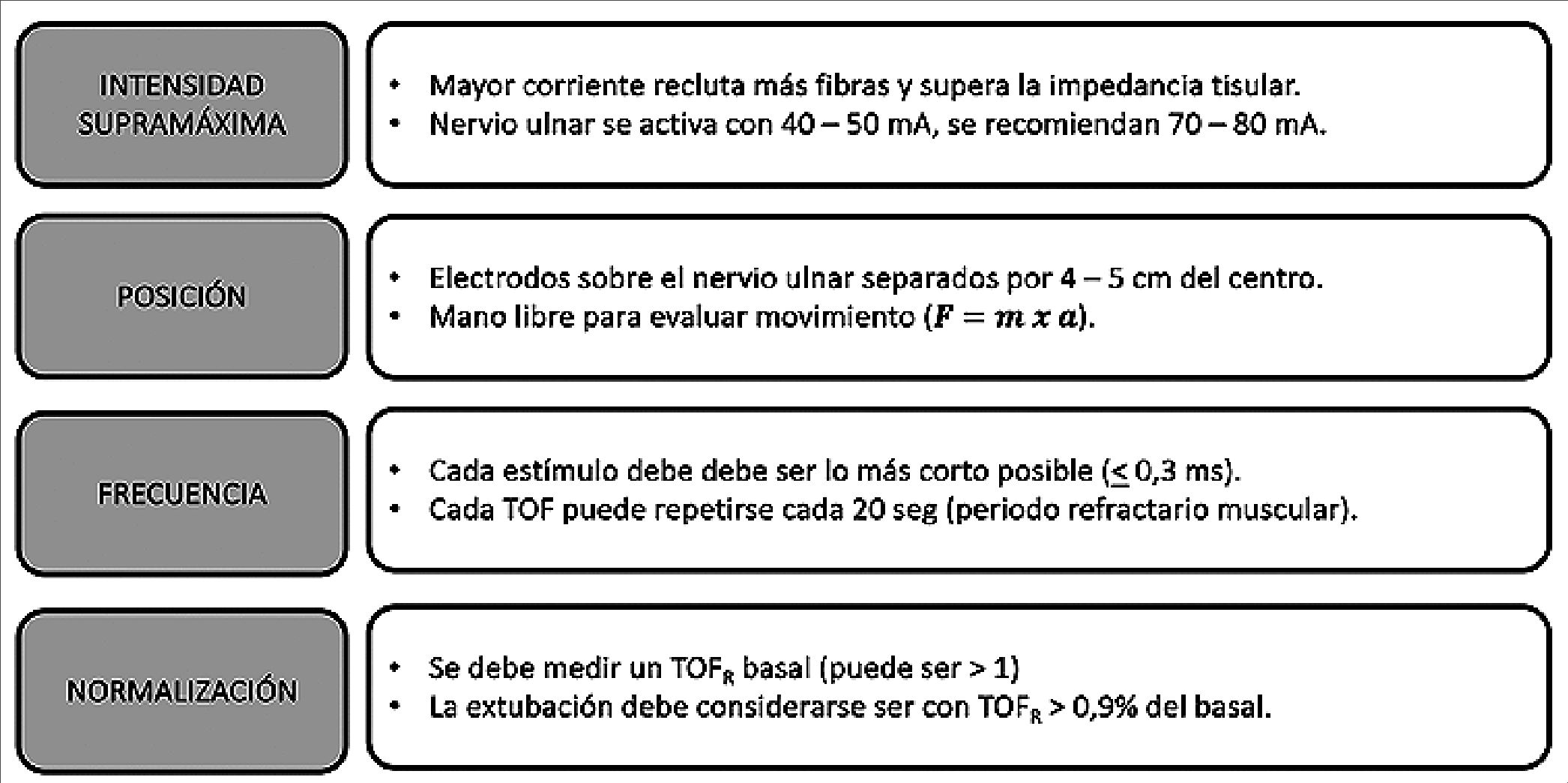
Figura 2. Recomendaciones sobre la correcta programación del TOF para la neuromonitorización.
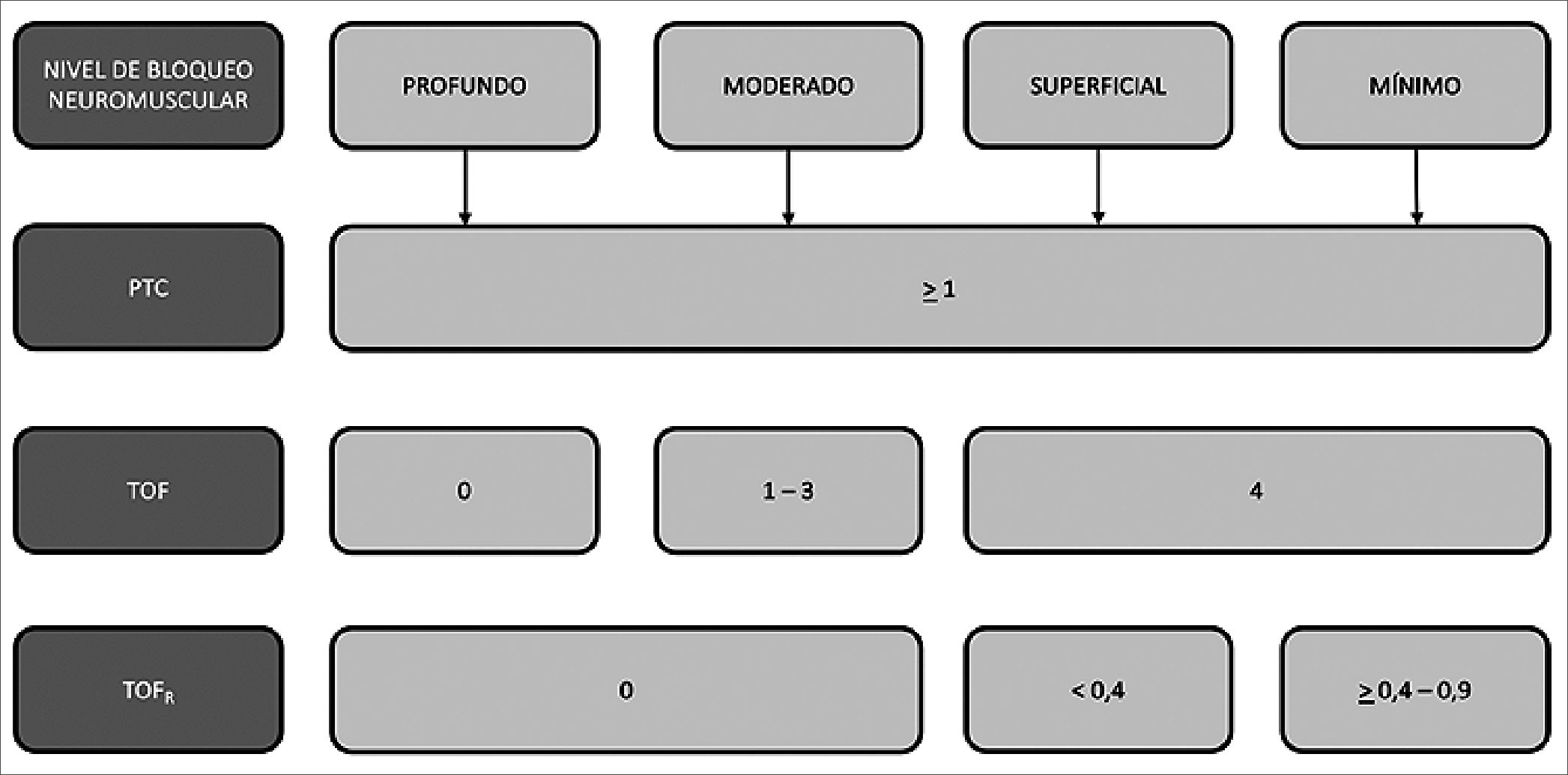
Figura 3. Esquema respecto a la relación entre el nivel de bloqueo neuromuscular y los valores de PTC, TOF y TOFR. PTC: conteo post tetánico; TOF: tren de cuatro.
Sin embargo, nueva evidencia refutaría la recomendación de la ASA y avalaría el uso prudente y seguro de neostigmina. Una revisión de Ruetzler y cols., con 70.690 pacientes, donde 82% recibió neostigmina (dosis promedio: 100 mcg/kg) y 18% recibió sugammadex (dosis promedio: 2,5 mg/kg), mostró una incidencia acumulada de eventos adversos de 3% y 3,4%, donde la bradicardia fue el evento más común con 2,2% y 2,4%, para neostigmina y sugammadex, respectivamente[19]. A su vez, un estudio prospectivo de Thilen y cols., de 189 pacientes con reversión del bloqueo neuromuscular guiado por mo- nitorización cuantitativa, donde los con TOFR > 0,4 recibieron neostigmina (15 – 30 mg/kg) y los con TOFR < 0,4 recibieron sugammadex (2 mg/kg), mostró una incidencia de bloqueo neuromuscular residual de 0% en ambos grupos estimando una reducción en los costos de atención de aproximadamente US$70 por cada paciente[20]. Esta estrategia clínica da cuenta de la disyuntiva que se vive a diario en los quirófanos y puede ser una aproximación pragmática ahorradora de recursos y costos.
Existe evidencia creciente respecto al uso de sugammadex y anafilaxis intraoperatoria. Una revisión de Zecic y cols., determinó una incidencia entre 0,02% – 0,04% en estudios obser- vacionales, no quedando claro si esta es producto del mismo medicamento o el complejo sugammadex-rocuronio[21]. Además, un trabajo reciente de Bowdle y cols., demostró en 97 pacientes sometidos a cardiocirugía que 87% de ellos requirieron menores dosis que las recomendadas por el fabricante, las cuales variaron entre 0,43 y 5,6 mg/kg, con una relación directa entre mayor profundidad del bloqueo neuromuscular y mayor dosis requerida[22].
Uno de los grandes inconvenientes del sugammadex es su costo. Recientemente, el royalty de la formulación original (Bridion®, MSD, precio venta U$ 59) venció, por lo que podrá coexistir con otras formulaciones. Esto permitirá disminuir progresivamente el costo de la droga genérica. Por lo pronto, existe una alternativa en Chile (Sagomyl®, Novartis), cuyo precio de venta es de U$ 38. Aún no se acerca al costo de la neostigmina, sin embargo, en ciertas condiciones clínicas, el beneficio del uso de sugammadex podría ser mayor que el costo.
Por lo pronto, el uso de neostigmina como agente para revertir el bloqueo neuromuscular inducido por rocuronio es una alternativa válida y segura, siempre y cuando sea guiado mediante neuromonitorización cuantitativa (Tabla 2).
Tabla 2. Esquema recomendado para la reversión del bloqueo neuromuscular de rocuronio utilizando monitorización cuantitativa
| Momento quirúrgico | Nivel de BNM | Objetivo de monitorización | Dosis de BNM | Dosis de reversor |
| Inducción | Profundo | ST
TOF 0 PTC > 1 |
Rocuronio 0,6 mg/kg IBW
Rocuronio 1,2 mg/kg IBW |
SGX 16 mg/kg ABW* |
| Cirugía | Profundo | Rocuronio 25% dosis inducción | SGX 4 m/kg ABW | |
| Cierre | Moderado | Desde TOF > 2 hasta TOFR < 0,4 | Evitar dosificación al menos 30 min antes del cierre | SGX 2 mg/kg ABW |
| Superficial | TOFR > 0,4 | NEO 15 – 30 mcg/kg IBW» + atropina 1:5 IBW | ||
| Extubación | Sin bloqueo | TOFR > 0,9 | No administrar | Esperar:
Al menos 10 min desde NEO Al menos 3 min desde SGX |
| ST: estímulo único; TOF: tren de cuatro; TOFR: TOF ratio; PTC: conteo post tetánico; IBW: peso ideal; ABW: peso actual; SGX: sugammadex; NEO: neostigmina.
♦: dosis recomendada para revertir una secuencia rápida de intubación con rocuronio. »: se recomienda no superar los 50 mcg/kg de neostigmina. |
||||
-
Conclusión
El gasto en salud a nivel nacional es alto, por lo tanto, el uso racional de los recursos es una responsabilidad de cada anestesista. La monitorización neuromuscular en caso de utilizarse bloqueadores neuromusculares debe ser siempre utilizada y la modalidad recomendada es la utilización de un monitor cuantitativo. En base a la nueva evidencia disponible, neostigmina sigue siendo una alternativa válida y segura para la reversión del bloqueo neuromuscular inducido por relajantes neuromus- culares no depolarizantes. Por lo tanto, la generación de protocolos para la reversión del bloqueo neuromuscular guiado por neuromonitorización cuantitativa es un desafío que debe ser abordado por cada institución.
Los autores no tienen conflictos de intereses.
-
Referencias
1. Stäuble CG, Blobner M. The future of neuromuscular blocking agents. Curr Opin Anaesthesiol. 2020 Aug;33(4):490–8. https://doi.org/10.1097/ACO.0000000000000891 PMID:32628397
2. Thilen SR, Weigel WA, Todd MM, Dutton RP, Lien CA, Grant SA, et al. 2023 American Society of Anesthesiologists Practice Guidelines for Monitoring and Antagonism of Neuromuscular Blockade: A Report by the American Society of Anesthesiologists Task Force on Neuromuscular Blockade. Anesthesiology. 2023 Jan;138(1):13–41. https://doi.org/10.1097/ALN.0000000000004379 PMID:36520073
3. Fuchs-Buder T, Romero CS, Lewald H, Lamperti M, Afshari A, Hristovska AM, et al. Peri-operative management of neuromuscular blockade: A guideline from the European Society of Anaesthesiology and Intensive Care. Eur J Anaesthesiol. 2023 Feb;40(2):82–94. https://doi.org/10.1097/EJA.0000000000001769 PMID:36377554
4. Drzymalski DM, Marino J, Higgins HD. Will the American Society of Anesthesiologists practice guidelines for monitoring and antagonism of neuromuscular blockade result in increased costs to the healthcare system? J Clin Anesth. 2023 Sep;88:111140. https://doi.org/10.1016/j.jclinane.2023.111140 PMID:37172555
5. WHO, Global Health Observatory. (2022) – processed by Our World in Data. “Indicator: Domestic general government health expenditure (GGHE-D) as percentage of general government expenditure (GGE) (%)” [dataset]. WHO, Global Health Observatory (2022) [original data]. URL: https://ourworldindata.org/grapher/health-expenditure-government-expenditure?tab=chart&country=CHL. Acceso: 22 de febrero 2024.
6. World Health Organization. (via World Bank) – processed by Our World in Data. “Current health expenditure per capita, PPP (current international $)” [dataset]. World Health Organization (via World Bank) [original data]. URL: https://ourworldindata.org/grapher/annual-healthcare-expenditure-per-capita?tab=chart&country=CHL. Acceso: 22 de febrero 2024.
7. Rasmussen L, Wettermark B, Steinke D, Pottegård A. Core concepts in pharmacoepidemiology: measures of drug utilization based on individual-level drug dispensing data. Pharmacoepidemiol Drug Saf. 2022 Oct;31(10):1015–26. https://doi.org/10.1002/pds.5490 PMID:35819240
8. Liu S, He B, Deng L, Li Q, Wang X. Does deep neuromuscular blockade provide improved perioperative outcomes in adult patients? A systematic review and meta-analysis of randomized controlled trials. PLoS One. 2023 Mar;18(3):e0282790. https://doi.org/10.1371/journal.pone.0282790 PMID:36893114
9. Kirmeier E, Eriksson LI, Lewald H, Jonsson Fagerlund M, Hoeft A, Hollmann M, et al.; POPULAR Contributors. Post-anaesthesia pulmonary complications after use of muscle relaxants (POPULAR): a multicentre, prospective observational study. Lancet Respir Med. 2019 Feb;7(2):129–40. https://doi.org/10.1016/S2213-2600(18)30294-7 PMID:30224322
10. Accidental Awareness during General Anaesthesia in the United Kingdom and Ireland Report and findings 2014. Disponible en: www.rcoa.ac.uk. Fecha de acceso: 1 de febrero de 2024.
11. Rodríguez-Blanco J, Rodríguez-Yanez T, Rodríguez-Blanco JD, Almanza-Hurtado AJ, Martínez-Ávila MC, Borré-Naranjo D, y cols. Neuromuscular blocking agents in the intensive care unit. Journal of International Medical Research 2022; 50.
12. Murphy GS. Neuromuscular monitoring in the perioperative period. Anesth Analg. 2018 Feb;126(2):464–8. https://doi.org/10.1213/ANE.0000000000002387 PMID:28795964
13. Motamed C. Intraoperative Monitoring of Neuromuscular Blockade. Life (Basel). 2023 May;13(5):13. https://doi.org/10.3390/life13051184 PMID:37240830
14. Naguib M, Brull SJ, Johnson KB. Conceptual and technical insights into the basis of neuromuscular monitoring. Anaesthesia. 2017 Jan;72(S1 Suppl 1):16–37. https://doi.org/10.1111/anae.13738 PMID:28044330
15. Naguib M, Brull SJ, Kopman AF, Hunter JM, Fülesdi B, Arkes HR, et al. Arkes HR y cols. Consensus statement on perioperative use of neuromuscular monitoring. Anesth Analg. 2018 Jul;127(1):71–80. https://doi.org/10.1213/ANE.0000000000002670 PMID:29200077
16. Hristovska AM, Duch P, Allingstrup M, Afshari A. Efficacy and safety of sugammadex versus neostigmine in reversing neuromuscular blockade in adults. Cochrane Database Syst Rev. 2017 Aug;8(8):CD012763. https://doi.org/10.1002/14651858.CD012763 PMID:28806470
17. Oh SK, Lim BG. Sugammadex administration in patients with end-stage renal disease: a narrative review with recommendations. Anesth Pain Med. 2023 Jan;18(1):11–20. https://doi.org/10.17085/apm.22259 PMID:36746897
18. Voss T, Wang A, DeAngelis M, Speek M, Saldien V, Hammer GB, et al. Sugammadex for reversal of neuromuscular blockade in pediatric patients: results from a phase IV randomized study. Paediatr Anaesth. 2022 Mar;32(3):436–45. https://doi.org/10.1111/pan.14370 PMID:34878707
19. Ruetzler K, Li K, Chhabada S, Maheshwari K, Chahar P, Khanna S, et al. Sugammadex Versus Neostigmine for Reversal of Residual Neuromuscular Blocks After Surgery: A Retrospective Cohort Analysis of Postoperative Side Effects. Anesth Analg. 2022 May;134(5):1043–53. https://doi.org/10.1213/ANE.0000000000005842 PMID:35020636
20. Thilen SR, Sherpa JR, James AM, Cain KC, Treggiari MM, Bhananker SM. Management of Muscle Relaxation With Rocuronium and Reversal With Neostigmine or Sugammadex Guided by Quantitative Neuromuscular Monitoring. Anesth Analg [Internet] 2023. URL: www.anesthesia-analgesia.org. Acceso: 22 de febrero 2024. https://doi.org/10.1213/ANE.0000000000006511.
21. Zecic F, Smart MH, Abbey TC, Pazhempallil A, Korban C. Sugammadex-induced anaphylactic reaction: A systematic review. J Anaesthesiol Clin Pharmacol. 2022;38(3):360–70. https://doi.org/10.4103/joacp.JOACP_573_20 PMID:36505200
22. Bowdle TA, Haththotuwegama KJ, Jelacic S, Nguyen ST, Togashi K, Michaelsen KE. A Dose-finding Study of Sugammadex for Reversal of Rocuronium in Cardiac Surgery Patients and Postoperative Monitoring for Recurrent Paralysis. Anesthesiology. 2023 Jul;139(1):6–15. https://doi.org/10.1097/ALN.0000000000004578 PMID:37027807

 ORCID
ORCID