Marcos Antonio Amezcua-Gutiérrez1,2, Nikolett Iren Medveczky-Ordóñez2, Jessica Garduño-López1, Marcos Vidals-Sánchez1, José Carlos Gasca-Aldama1, Luis Antonio Gorordo-Delsol1
Recibido: 04-08-2023
Aceptado: 12-09-2023
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 6 pp. 621-627|https://doi.org/10.25237/revchilanestv53n6-11
PDF|ePub|RIS
Reversible posterior encephalopathy syndrome: Report of four cases
Abstract
Posterior reversible encephalopathy syndrome (PRES) is an acute reversible neurological disorder, characterized by seizures, headache, confusion, and visual disturbances, as well as radiological findings of vasogenic edema in parietal and occipital lobes. It is caused by a wide variety of causes, with eclampsia, hypertension and immunosuppressive drugs being the most common. We present four clinical cases with reversible posterior encephalopathy syndrome during pregnancy, with visual alterations and hypertensive state, cerebral edema by neuroimaging and a favorable evolution after the antihypertensive-anticonvulsant therapy and the pregnancy interruption. We also performed brief review is carried out on the most outstanding aspects of this disease, so that any doctor who is in contact with this type of patient can identify and in early initiate a treatment to favor an adequate evolution.
Resumen
El síndrome de encefalopatía posterior reversible (PRES por sus siglas en inglés) es un desorden neurològico agudo reversible, caracterizado por crisis convulsivas, cefalea, confusión, alteraciones visuales y hallazgos radiológicos sugerentes de edema vasogénico en lóbulos parietales y occipitales. Está asociado a múltiples etiologías, siendo la eclampsia, hipertensión y fármacos inmunosupresores las más comunes. En este artículo presentamos cuatro casos clínicos con síndrome de encefalopatía posterior reversible durante el embarazo, con alteraciones visuales y estado hipertensivo, edema cerebral por neuroimagen y con evolución favorable después del control del estado hipertensivo-convulsivo, además de la interrupción del embarazo. Se realiza una breve revisión sobre los aspectos más destacados de este padecimiento, para que los médicos en contacto con este tipo de pacientes puedan identificar e iniciar tratamiento oportuno para favorecer una adecuada evolución.
-
Introducción
El síndrome de encefalopatía posterior reversible (posterior reversible encephalopaty syndrome – PRES), es un desorden clínico-radiológico reversible caracterizado por cefalea, déficit visual, alteración del estado de alerta, convulsiones y déficit neurológico focal, asociado a hallazgos típicos en neuroimagen sugerentes de edema cerebral en regiones posteriores[1]. Presenta un inicio insidioso, evolución aguda y transitoria, que amerita en la mayoría de las pacientes neuromonitoreo continuo e ingreso a la Unidad de Cuidados Intensivos (UCI).
En 1996, Hinchey y cols., fue el primero en describir una serie de 15 pacientes (13 mujeres y 2 hombres) con cefalea, alteración en las funciones mentales, vómito, convulsiones y pérdida de la visión, que presentaban en imágenes de tomografía computada (TC) y resonancia magnética nuclear (RMN), anormalidades bilaterales extensas en sustancia blanca, sugerentes de edema vasogénico en las regiones posteriores de los hemisferios cerebrales. Se presentaba en pacientes con diferentes enfermedades como enfermedad renal, eclampsia, hipertensión y fármacos inmunosupresores[2]. Inicialmente, Hinchey lo denominó “síndrome de leucoencefalopatía posterior reversible”. Actualmente es un término en desuso, porque mediante imágenes de resonancia magnética se demostró que existe compromiso tanto de sustancia blanca como gris, aunque esta última con menor frecuencia, por lo que se eliminó el término leuco.
Predomina en mujeres, lo cual puede reflejar algunas causas subyacentes. No existe asociación causal con la edad, se ha documentado en pacientes desde 4 años hasta 90 años, sin embargo, la mayoría de los casos se manifiestan en adultos jóvenes y de mediana edad. No existen registros estadísticos del síndrome, siendo desconocida su incidencia y en muchas ocasiones no es diagnosticada. En 2013, Raj y cols., realizaron un estudio retrospectivo de 2.588 pacientes menores de 21 años, identificando solo 10 pacientes con síndrome de encefalopatía posterior reversible, estimando una incidencia de 0,4% en esta población, sin embargo, la incidencia en pacientes adultos permanece desconocida[3],[4].
El objetivo de este trabajo es presentar cuatro casos de pri- migestas ingresadas a la unidad de cuidados intensivos, con hallazgos compatibles con síndrome de encefalopatía posterior reversible y realizar una puntual descripción de dicha patología que debe conducir a un abordaje terapéutico integral.
-
Caso clínico 1
Paciente primigesta 23 años, sin antecedentes patológicos, cursando embarazo de 33,5 semanas de gestación, ingresa al servicio de urgencias con cefalea holocraneana de 5 h de evolución, intensidad 8/10, sin irradiaciones, náuseas y vómitos, alteración neurológica con desorientación en tiempo, lugar y amaurosis bilateral. Se documenta presión arterial de 180/110 mmHg, frecuencia cardíaca 50 latidos por minuto (lpm), frecuencia cardíaca fetal 120 lpm y episodio de crisis convulsiva tónico-clónico generalizada de un minuto de duración, sin cambios en la mirada, ni relajación de esfínteres, con período post-ictal caracterizado por agitación psicomotriz, amaurosis bilateral y fotorreactividad pupilar. Se inició tratamiento antihi- pertensivo con hidralazina, impregnación e infusión de sulfato de magnesio.
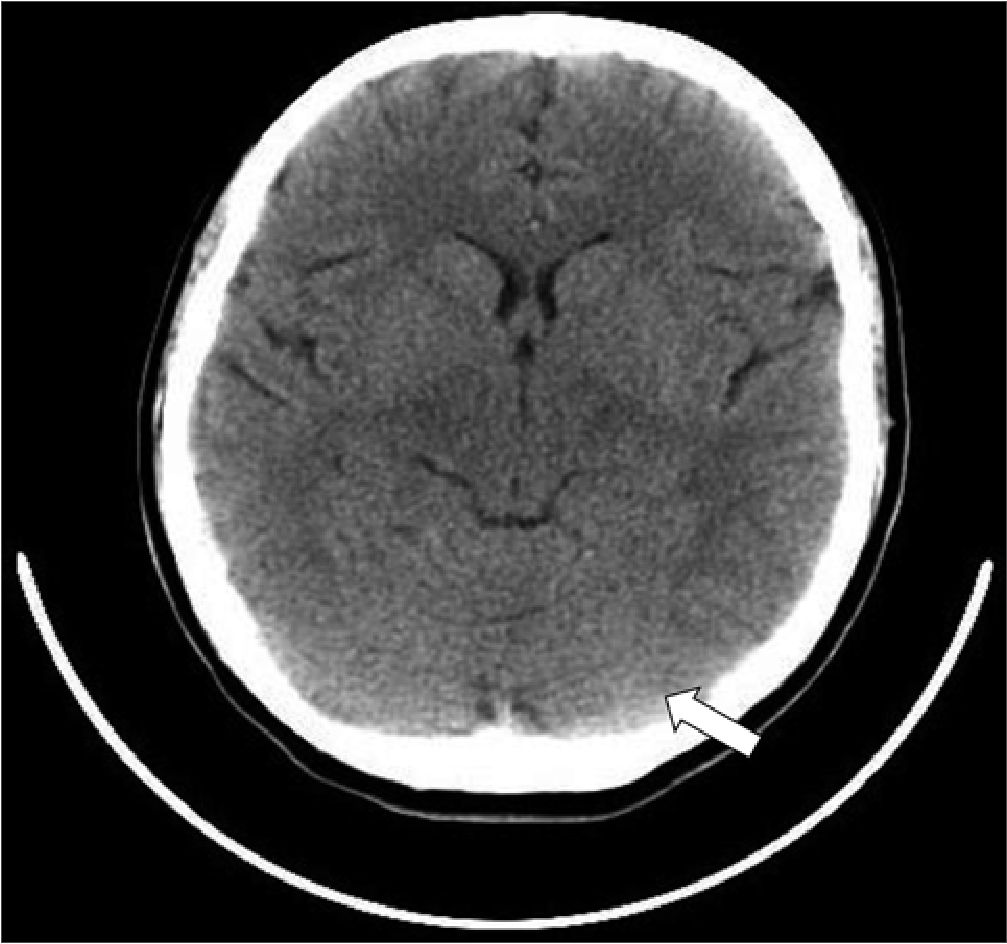
Figura 1. Tomografía computada simple de cráneo, en corte axial con borramiento de circunvoluciones en región occipital (flecha).
Ante el cuadro clínico se realizó tomografía computada de cráneo (Figura 1) donde se observa borramiento de circunvoluciones en región occipital, sin datos compatibles con evento vascular cerebral, trombosis venosa cerebral o afección de parénquima cerebral. Los estudios de laboratorio reportaron: examen general de orina: proteínas > 300 mg/dL, sangre y nitritos; aminotransferasas elevadas (ALT 315 U/L, AST 354 U/L), bilirrubina total (BT) 1,6 mg/dL, bilirrubina directa (BD) 0,6 mg/ dL, deshidrogenasa láctica (DHL) 568 U/L, creatinina 0,88 mg/ dL, glucosa 95 mg/dL, nitrógeno ureico 23 mg/dL, leucocitos 18.890 /uL, hemoglobina 15,5 g/dL, hematocrito 43,9%, plaquetas 52.000 /uL, fibrinógeno 740 mg/dL.
Con base en los hallazgos clínicos y de laboratorio se diagnostica eclampsia, síndrome de hemólisis, elevación de enzimas hepáticas y trombocitopenia (HELLP por sus siglas en inglés) incompleto y síndrome de encefalopatía posterior reversible, decidiéndose interrupción del embarazo vía abdominal mediante anestesia general; obteniendo recién nacido vivo, masculino, peso 1.180 g, talla 37 cm, APGAR 4-7, edad gestacional estimada de 32 semanas y placenta completa. Posteriormente, ingresa con apoyo mecánico ventilatorio a UCI para manejo integral y neuromonitorización continua.
Durante su estancia en cuidados intensivos, continuó tratamiento antihipertensivo con hidralazina intravenosa y nifedi- pino vía oral, estrecha monitorización hemodinámica; sulfato de magnesio 1 g/h durante 24 h posteriores a la interrupción del embarazo y dexametasona intravenosa 10 mg BID hasta normalizar conteo plaquetario (mayor de 100.000 /uL). Presentando adecuada evolución clínica, con integridad neurológica, recuperación completa de la visión en las primeras 12 h, sin evidencia de nueva crisis convulsiva, hemodinámicamente estable con niveles de presión arterial normales, retiro de la ventilación mecánica exitoso y mejoría de los parámetros bioquímicos, por lo que egresa de la unidad de cuidados intensivos a las 48 h, con plaquetas de 195.000 /uL, AST 36 U/L, ALT 107 U/L, DHL
320 U/L, creatinina 0,45 mg/dL, BT 0,2 mg/dL. En hospitalización cursa evolución clínica satisfactoria, asintomática, siendo egresada a su domicilio 48 h después.
-
Caso clínico 2
Paciente primigesta 16 años, con embarazo normoevolutivo de 35 semanas de gestación, sin antecedentes patológicos y con control prenatal, presenta súbitamente cefalea frontoparietal, intensidad 10/10, sin irradiaciones, acompañada de acúfe- nos, fotopsias, epigastralgia, náuseas, vómitos y posteriormente amaurosis bilateral; acude a valoración médica, ingresando a unidad tocoquirúrgica con presión arterial de 154/111 mmHg, frecuencia cardíaca 122 lpm, escala de coma de Glasgow 15 puntos, pupilas isocoricas, hiporreactivas a la luz e hiperreflexia.
Se inicia manejo con sulfato de magnesio e hidralazina intravenosa, se realiza interrupción del embarazo con abordaje abdominal y anestesia con bloqueo subaracnoideo, obteniendo recién nacido vivo, masculino, peso 3.150 g, talla 50 cm, APGAR 8/9 y edad gestacional estimada de 35 semanas. Laboratorios postquirúrgicos reportan: hemoglobina 11,9 g/dL, hematocrito 35%, leucocitos 11.200 /uL, plaquetas 154.400 / uL, creatinina 0,5 mg/dL, BT 0,7 mg/dL, albúmina 2,1g/dL, ALT 13 U/L. AST 27 U/L, DHL 379 U/L. Ingresa inmediatamente a UCI, se realiza tomografía computada simple de cráneo (Figura 2A), observando edema cerebral difuso leve, hiperdensidad y edema en región occipital izquierda, por lo que se realiza RMN en fase simple y contrastada (Figura 2B), que reporta ambos hemisferios cerebelosos y regiones occipitoparietales con hiper- intensidad en T2 y FLAIR, con áreas focales de isquemia aguda
en hemisferio cerebeloso derecho y lesión en lóbulo parietal izquierdo.
Se mantuvo en la unidad de cuidados intensivos con vigilancia del estado neurológico y monitoreo cardíaco continuo, asi como esquema de sulfato de magnesio a 1 g/h durante 24 h posteriores a interrupción del embarazo. Se inició manejo anti- hipertensivo con esmolol intravenoso y nifedipino vía oral, con adecuada respuesta hemodinámica, retirando antihipertensi- vo parenteral 24 h después. Presenta mejoría clínica, remisión completa de amaurosis al tercer día de tratamiento, siendo egresada a hospitalización y cuatro días después a su domicilio, neurológicamente íntegra, con visión normal y control hiper- tensivo.
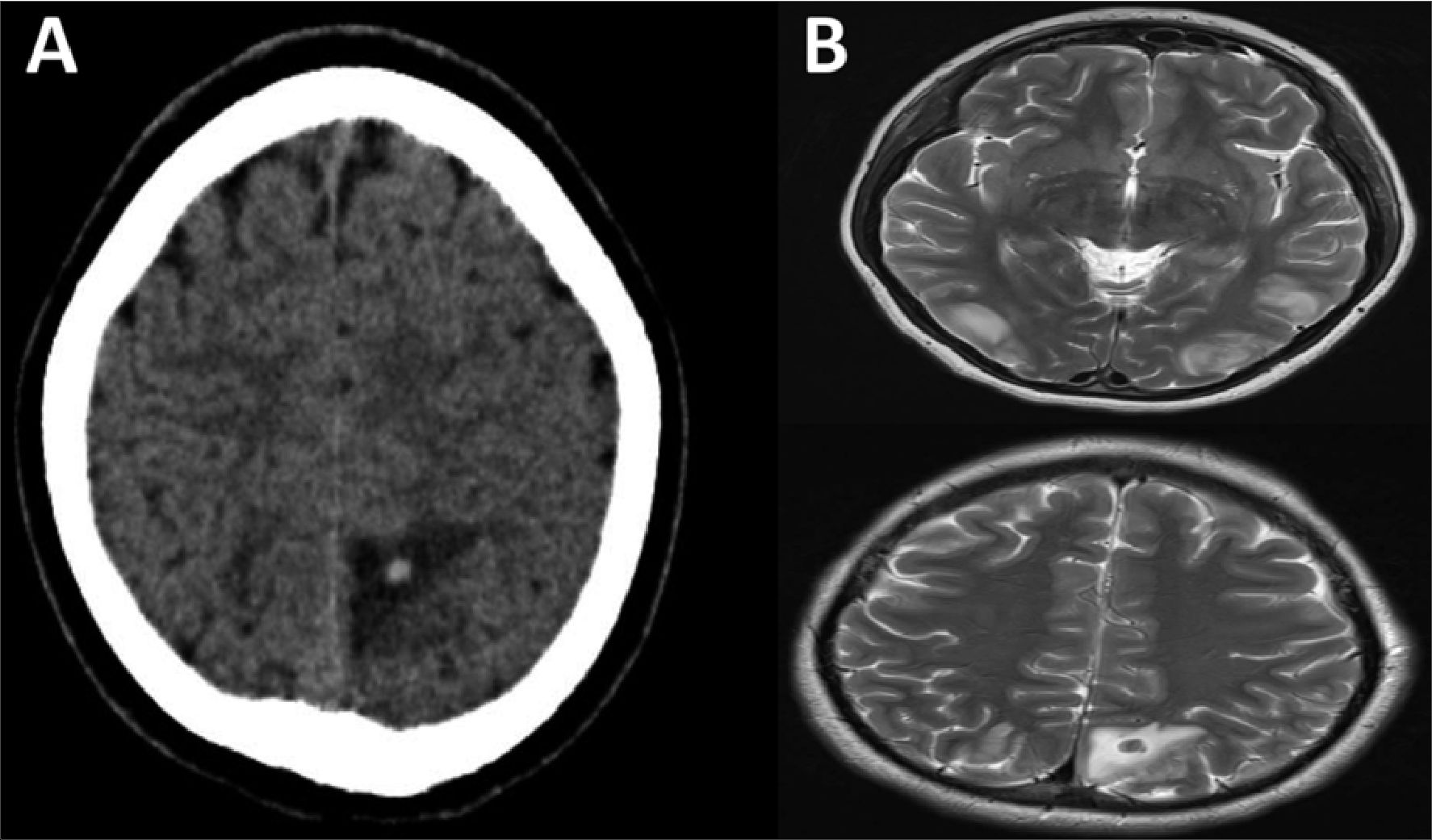
Figura 2. A) Tomografía computada simple de cráneo, con edema cerebral difuso de leve a moderado, con hiperdensidad y edema perilesional en región occipital izquierda; B) Imagen de resonancia magnética cerebral en fase T2, con hipertintensidad en ambos hemisferios cerebelosos y regiones occipito-parietales, asociado con áreas focales de isquemia aguda en hemisferio cerebeloso derecho, lesión en lóbulo parietal izquierdo con datos de hemorragia reciente.
-
Caso clínico 3
Paciente primigesta de 20 años, con embarazo de 36 semanas de gestación, sin antecedentes patológicos, con buen control prenatal. Una semana previa a su hospitalización presenta cefalea holocraneana de intensidad 7/10 sin irradiaciones, sin exacerbantes y que cede con analgésicos, niega fotopsias, acúfenos y/o alteraciones visuales. Posteriormente, se agudizó con cefalea pulsátil frontal de intensidad 9/10, acúfenos, crisis convulsivas tónico-clónicas generalizadas con duración aproximada de 5 minutos, con relajación de esfínter vesical y pérdida del estado de alerta. En el servicio de urgencias se documenta preeclampsia con datos de severidad, con presión arterial de 170/90 mmHg. Se inicia esquema antihipertensivo e impregnación con sulfato de magnesio, así como interrupción del embarazo vía abdominal bajo anestesia general. Se obtiene recién
nacido vivo, masculino, peso 3.000 g, talla 48 cm, APGAR 7/9 y edad gestacional estimada de 37 semanas. Laboratorios postquirúrgicos con AST 28U/L, ALT 22 U/L, DHL 41,4 U/L, plaquetas 246.000 /uL y creatinina 0,6 mg/dL. Ingresa a UCI en estatus de ventilación mecánica, para continuar abordaje diagnóstico- terapéutico, donde se realiza tomografía simple de cráneo sin encontrar alteraciones estructurales, por lo que se realiza protocolo de destete y extubación traqueal. La RMN de encéfalo (Figura 3) evidenció lesiones en región parieto-occipital bilateral de predominio izquierdo.
Durante su estancia con adecuado control de la presión arterial con calcioantagonista, sin presentar nuevos eventos convulsivos, ni deterioro rostrocaudal, con remisión de la sintoma- tología, se egresó de unidad de cuidados intensivos a las 48 h y posteriormente a domicilio.
-
Caso clínico 4
Paciente primigesta de 33 años, con gestación de 35,3 semanas, sin antecedentes patológicos, con adecuado control prenatal, consulta por pérdida súbita del estado de alerta y episodio de crisis convulsiva tónico-clónico generalizada, sin relajación de esfínter, desconociendo duración del evento, con período postictal caracterizado por cefalea, acúfenos, además de actividad uterina irregular, motivo por el que acude a valoración. A su ingreso en urgencias, con presión arterial de 180/130 mmHg, extremidades hiperreflécticas y persistencia de cefalea, por lo que se inicia manejo antihipertensivo con hidralazina intravenosa y nifedipino vía oral, impregnación con sulfato de magnesio y se decide interrupción del embarazo vía abdominal mediante anestesia general con administración de opiode y propofol, obteniendo recién nacido vivo, femenino, peso 2.400 g, talla 40 cm, APGAR 6/9 y edad gestacional estimada de 36 semanas. Se ingresa a UCI para manejo integral, realizándose
RMN de encéfalo (Figura 4) con imágenes hiperintensas en T2 y Flair en región parietoccipital de predominio izquierdo. Los estudios de laboratorio reportaron plaquetas 72.000 /uL, BT 0,27 mg/dL, AST 81 U/L, ALT 48 U/L, DHL 511 U/L, creatinina 1,03 mg/dL.
Se continuó con tratamiento antihipertensivo con calcioantagonista vía oral y estrecha monitorización hemodinámica; sulfato de magnesio 1 g/h durante 24 h posteriores a la interrupción del embarazo y dexametasona intravenosa 10 mg BID hasta normalizar conteo plaquetario. Evolucionó satisfactoriamente, con integridad neurológica, sin evidencia de nuevas crisis convulsivas, hemodinámicamente estable, egresando de UCI a las 48 y posteriormente a domicilio.
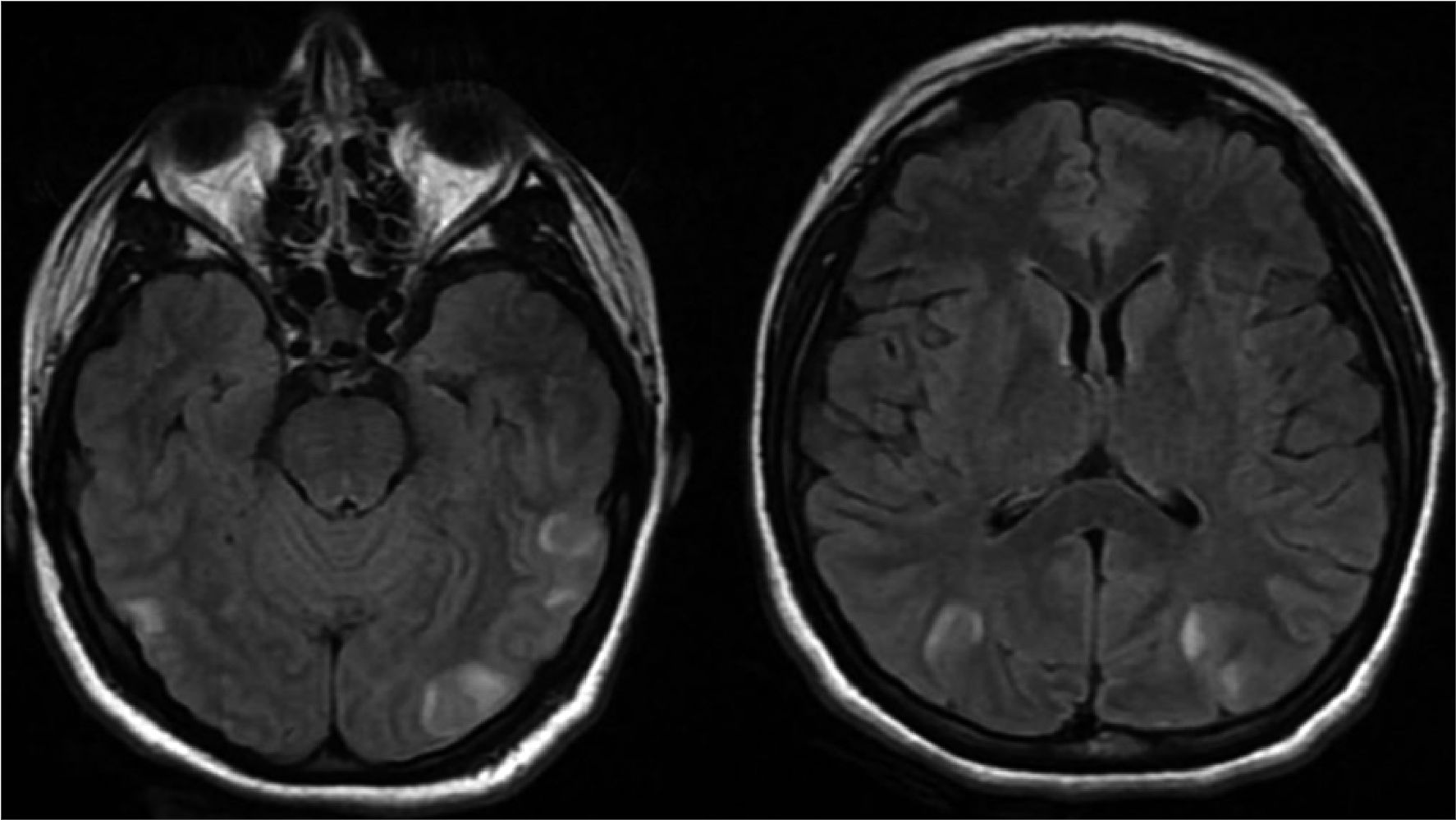
Figura 3. Resonancia magnética cerebral en fase T2 y Flair que denotan de manera intraaxial a nivel de sustancia blanca parieto-occipital bilateral de predominio izquierdo, imágenes de predominio irregular, de bordes indefinidos de comportamiento hiperintenso, sin restricción a la difusión.
-
Discusión
El síndrome de encefalopatía posterior reversible es un desorden neurológico, caracterizado por edema cerebral predominantemente en la sustancia blanca, con afectación occipital y parietal[4], con evolución transitoria y buen pronóstico cuando se identifica de manera temprana y se inicia tratamiento apropiado dirigido a la causa subyacente. En pocos casos se han documentado secuelas como isquemia, infarto masivo o muerte. De manera puntual hasta el 4% presentan síndrome de encefalopatía posterior reversible recurrente, el 44% presenta alguna alteración funcional y hasta el 40% presentan lesiones residuales[5]. Se asocia a múltiples etiologías: eclampsia, hipertensión arterial, inmunosupresores (ciclosporina A, tacrolimus), lupus eritematoso sistémico, purpura trombocitopénica trombótica, hipercalcemia, hipomagnesemia, hemotransfusión masiva y síndrome de Guillain Barré[6],[7].
Es un estado de neurotoxicidad, con pérdida de la autorregulación cerebral, por un factor desencadenante como libera-
ción de sustancias vasoactivas en el endotelio vascular, óxido nítrico, tromboxano A2 y endotelina[7].
Existen dos hipótesis fisiopatológicas con mayor aceptación. La primera hipótesis (vasogénica) y más popular sugiere que un rápido incremento en la presión arterial mayor al límite superior de autorregulación genera hipoperfusión cerebral de manera inicial, que conduce a fuga vascular, edema vasogénico y disfunción de la berrera hematoencefálica, causando extravasación de plasma y macromoléculas. Las regiones cerebrales posteriores son más susceptibles a hipoperfusión, debido a la reducida densidad de inervación simpática, en comparación con la circulación anterior, donde está densamente inervada por el ganglio cervical superior[8],[9]. Esta teoría es apoyada por estudios que demuestran que la hipertensión arterial acompañada en el síndrome de encefalopatía posterior reversible y el manejo oportuno para controlar la presión arterial resulta en mejoría clínica y radiológica, sin embargo, del 15% a 20% de estos pacientes se encuentran normotensos o hipotensos, además menos de la mitad de los pacientes que desarrollan hipertensión arterial, alcanzan niveles de presión arterial media superiores al límite de autorregulación cerebral[10].
La segunda hipótesis (citotóxica) sugiere que la circulación de toxinas endógenas y exógenas observada en pacientes con preeclampsia, sepsis, quimioterapia, fármacos inmunosupre- sores y alteraciones autoinmunes causa disfunción endotelial, fuga vascular, formación de edema con liberación de sustancias vasoactivas e inmunogénicas. Estos pacientes pueden presentar incremento de los niveles de presión arterial sistémica como consecuencia de la disfunción endotelial primaria[6],[9],[11].
Existen dos hipótesis adicionales, la inmunogénica, que hace énfasis en el rol del sistema inmune, con activación de las células T, liberación de citocinas e incremento de la permeabilidad endotelial, resultando en edema vasogénico. Estos cambios generan inestabilidad vascular, disfunción de la barrera hema-
toencefálica, vasoconstricción e hipoperfusión. Y finalmente, la hipótesis del neuropéptido, que postula que la liberación de potentes vasoconstrictores como endotelina-1, prostaciclina y tromboxano A2 producen vasoespasmo e isquemia, con subsecuente edema cerebral[11].
La presentación clínica del síndrome de encefalopatía posterior reversible puede ser aguda o subaguda, con desarrollo de síntomas en 24 a 48 h. Se caracteriza por encefalopatía (50%-80%), misma que se presenta como somnolencia, confusión leve o estupor; convulsiones (60%-75%), cefalea (50%), desórdenes visuales (33%) como alucinaciones, hemianopsias y ceguera cortical; déficit neurológico focal como hemiparesia y afasia (10%-15%), y estado epiléptico (5%-15%). La cefalea es sorda, difusa y gradual inicialmente. En caso de presentar una cefalea en thunderclap (cefalea de instalación súbita, que alcanza su máxima intensidad en un minuto), debe conducir a la sospecha de síndrome de vasoconstricción cerebral reversi- ble[8],[12].
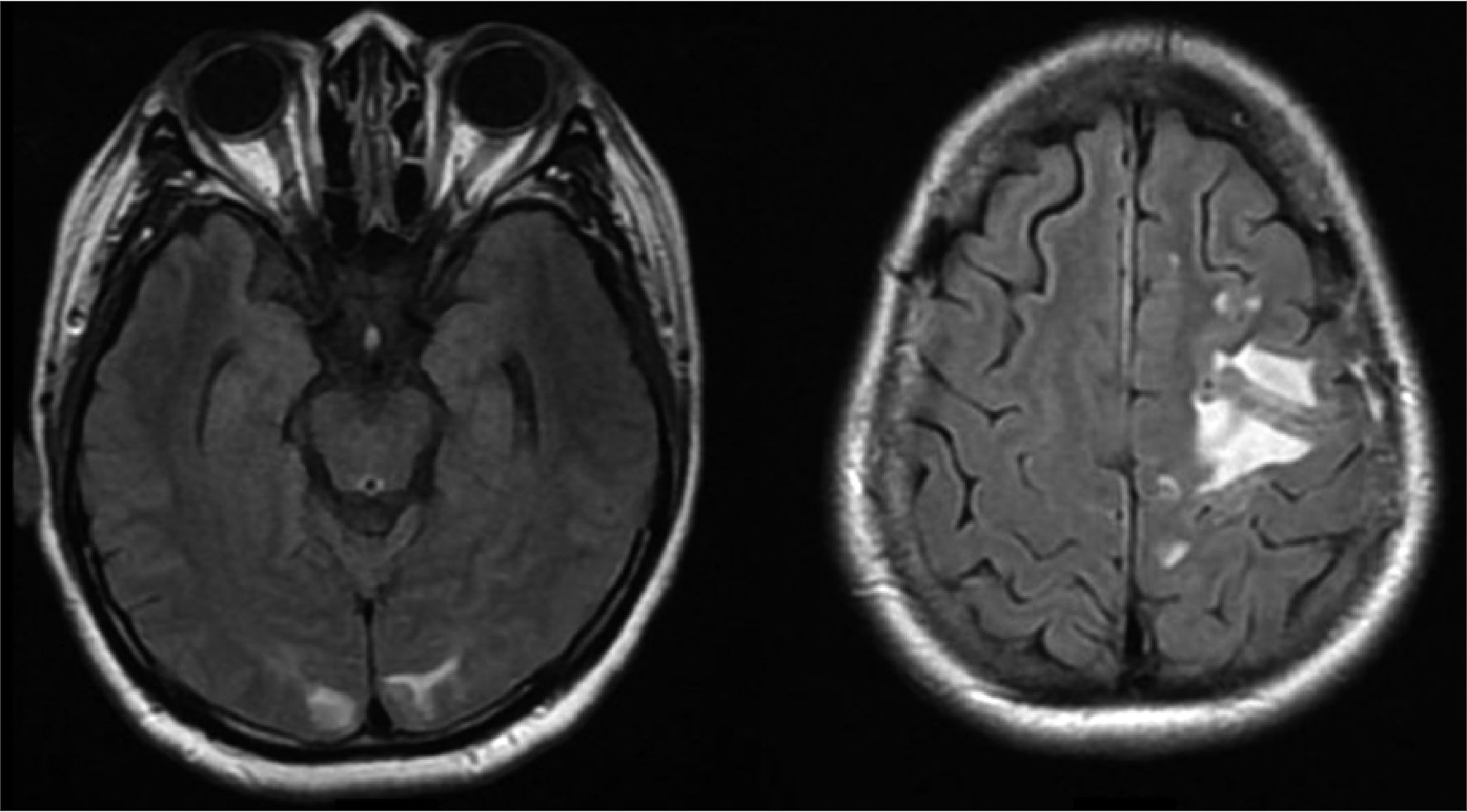
Figura 4. Resonancia magnética cerebral en fase T2 y Flair, con imágenes hiperintensas con morfología ovoidea, amorfas, puntiformes y rectangulares, algunas de las cuales tienden a confluir, sin mostrar efecto fluorescente en eco de gradiente. Sin lesiones en secuencia de difusión.
Actualmente, no existen criterios diagnósticos bien establecidos, por ello el diagnóstico se realiza al descartar alteraciones frecuentes, como: evento vascular cerebral, encefalitis infecciosa y/o autoinmune, trombosis venosa cerebral, vasculitis, traumatismo, síndrome de desmielinización osmótica y leu- coencefalopatía tóxica. En 2010, Fugate y cols., sugirieron los siguientes criterios diagnósticos: síntomas neurológicos de inicio agudo, edema vasogénico en neuroimagen y reversibilidad de los hallazgos clínicos y radiológicos[13].
Los estudios de tomografía computada de cráneo usualmente muestran edema vasogénico con distribución en ambos hemisferios, sin embargo, es menos sensible que la resonancia magnética en detectar hallazgos iniciales, que permite identificar lesiones más pequeñas y focales que no se observan mediante tomografía computada. La resonancia magnética se reconoce como el patrón de referencia diagnóstico de la ence-
falopatía posterior reversible. Existen 3 patrones distintivos mediante RMN: 1) patrón dominante parieto-occipital; 2) patrón del surco frontal superior y 3) patrón holohemisférico. Dichos patrones apoyan el diagnóstico de síndrome de encefalopatía posterior reversible, más no son patognomónicos. Schweitzer y cols., realizaron una revisión retrospectiva de 99 casos de síndrome de encefalopatía posterior reversible, en cuyos estudios de imagen encontraron: edema vasogénico extenso (39%), hemorragia (36%), hemorragia con efecto de masa (7%) y difusión restringida (16%), siendo el edema vasogénico extenso y la hemorragia los hallazgos con peor pronóstico[14],[15].
No existe tratamiento específico para este síndrome. El primer paso es eliminar o reducir los factores causantes, además de optimizar la volemia, mantener adecuada oxigenación arterial, control glucémico, equilibrio hidroelectrolítico y de coagulación. Al igual que en nuestras pacientes, la interrupción del embarazo está indicado. Se deberá tener el control inmediato del evento convulsivo, así como el registro electroencefalográfi- co continuo para detectar actividad eléctrica anormal. El sulfato de magnesio es el agente más efectivo para prevenir y tratar convulsiones en pacientes con eclampsia, su mecanismo de acción es incierto, sin embargo, se ha propuesto que actúa como calcio antagonista, disminuyendo el calcio intracelular y, subsecuentemente reduce el vasoespasmo; genera antagonismo del receptor N- Metil-D-Aspartato, disminuye la permeabilidad de la barrera hematoencefálica y el edema cerebral[12],[15],[16].
En caso de descontrol hipertensivo se recomienda disminuir los niveles de presión arterial no más del 25% en la primera hora y reducirla por debajo del rango de severidad (< 160/110 mmHg). Los fármacos de elección son nicardipino, labetalol, ni- modipino e hidralazina. Se sugiere evitar nitroglicerina, porque altera las resistencias vasculares uterinas y genera mayor vaso- dilatación cerebral[17],[18].
En tres de las cuatro pacientes incluidas en el estudio, se llevó a cabo una intervención de embarazo mediante cirugía abdominal bajo anestesia general. Esta decisión se basó en la presencia de deterioro neurológico con episodios de crisis convulsivas que comprometían la integridad del binomio maternofetal. Además, en dos de los casos, se desarrolló el síndrome de HELLP, lo que incrementó el riesgo de hemorragia y la formación de hematomas. La administración de anestesia general requirió de un equipo multidisciplinario compuesto por anes- tesiólogos y ginecólogos con amplia experiencia, dado que el factor tiempo se erigió como un determinante crítico durante el procedimiento quirúrgico. El objetivo primordial es mejorar las condiciones del recién nacido. En este contexto, la administración de opioides intravenosos se empleó como componente fundamental en la estrategia para mitigar el dolor y prevenir picos hipertensivos, que podrían desencadenar un deterioro neurológico adicional debido a emergencias hipertensivas o eventos cerebrovasculares. La administración de opioides se llevó a cabo antes de la incisión quirúrgica, utilizando dosis bajas, y se ajustó posteriormente, tras el pinzamiento del cordón umbilical, complementándola con infusión de propofol y anestesia inhalatoria con sevoflurano manteniendo concentración alveolar mínima 1,0, además de dosis fraccionadas de opioides. Por otra parte, en los casos de pacientes que presentan una mayor estabilidad hemodinámica y requieren una intervención quirúrgica urgente, se opta por la anestesia subaracnoidea con bupivacaina 0,5% hiperbárica, en virtud de su perfil farmacoci-
nético. Esto fue evidente en el segundo caso clínico registrado. En todas las pacientes se mantuvo infusión de sulfato de magnesio y tratamiento antihipertensivo durante el período transanestésico.
El pronóstico es bueno cuando se corrige el factor desencadenante y se realiza adecuado neuromonitoreo, por lo que su manejo debe llevarse a cabo dentro de la unidad de cuidados intensivos.
-
Conclusión
El síndrome de encefalopatía posterior reversible es una patología inadvertida que requiere vigilancia estrecha y neuro- monitoreo continuo. El tratamiento consiste en el control de la tensión arterial, manejo farmacológico de las crisis convulsivas y resolución del embarazo. El conocimiento de esta enfermedad permite la sospecha e identificación temprana, favoreciendo el control de la causa asociada como parte primordial, limitando así la posibilidad de complicaciones, permitiendo recuperación completa en la mayoría de los casos, sin embargo, el daño no siempre es reversible.
Agradecimientos: Los autores agradecen al Hospital Juárez de México, las facilidades proporcionadas para realizar este trabajo.
Declaración de conflicto de intereses: Los autores declaran no tener conflicto de interés respecto a esta revisión.
Responsabilidades éticas. Derecho a la privacidad y consentimiento informado: Los autores declaran que en este artículo no aparecen datos de pacientes y se cuenta con consentimiento informado en cada caso por paciente y/o representante legal, así como se siguen los protocolos éticos institucionales.
Confidencialidad de los datos: Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
-
Referencias
1. Fischer M, Schmutzhard E. Posterior reversible encephalopathy syndrome. J Neurol. 2017 Aug;264(8):1608–16. https://doi.org/10.1007/s00415-016-8377-8 PMID:28054130
2. Hinchey J, Chaves C, Appignani B, Breen J, Pao L, Wang A, et al. A reversible posterior leukoencephalopathy syndrome. N Engl J Med. 1996 Feb;334(8):494–500. https://doi.org/10.1056/NEJM199602223340803 PMID:8559202
3. Raj S, Overby P, Erdfarb A, Ushay HM. Posterior reversible encephalopathy syndrome: incidence and associated factors in a pediatric critical care population. Pediatr Neurol. 2013 Nov;49(5):335–9. https://doi.org/10.1016/j.pediatrneurol.2013.06.007 PMID:23916861
4. Rijal JP, Giri S, Dawadi S, Dahal KV. Posterior reversible encephalopathy syndrome (PRES) in a patient with late postpartum eclampsia. BMJ Case Rep. 2014 Feb;2014:bcr2013203162. https://doi.org/10.1136/bcr-2013-203162 PMID:24577180
5. Triplett JD, Kutlubaev MA, Kermode AG, Hardy T. Posterior reversible encephalopathy syndrome (PRES): diagnosis and management. Pract Neurol. 2022 Jun;22(3):183–9. https://doi.org/10.1136/practneurol-2021-003194 PMID:35046115
6. Shankar J, Banfield J. Posterior Reversible Encephalopathy Syndrome: A Review. Can Assoc Radiol J. 2017 May;68(2):147–53. https://doi.org/10.1016/j.carj.2016.08.005 PMID:28131335
7. Avecillas-Chasín JM, Matías-Guiu JA, Bautista-Balbás L. Encefalopatía posterior reversible: más allá de la descripción original. Rev Neurol. 2015 Jul;61(2):75–84. https://doi.org/10.33588/rn.6102.2015068 PMID:26156443
8. Fugate JE, Rabinstein AA. Posterior reversible encephalopathy syndrome: clinical and radiological manifestations, pathophysiology, and outstanding questions. Lancet Neurol. 2015 Sep;14(9):914–25. https://doi.org/10.1016/S1474-4422(15)00111-8 PMID:26184985
9. Bartynski WS. Posterior reversible encephalopathy syndrome, part 1: fundamental imaging and clinical features. AJNR Am J Neuroradiol. 2008 Jun;29(6):1036–42. https://doi.org/10.3174/ajnr.A0928 PMID:18356474
10. Rabinstein AA, Mandrekar J, Merrell R, Kozak OS, Durosaro O, Fugate JE. Blood pressure fluctuations in posterior reversible encephalopathy syndrome. J Stroke Cerebrovasc Dis. 2012 May;21(4):254–8. https://doi.org/10.1016/j.jstrokecerebrovasdis.2011.03.011 PMID:21536456
11. Marra A, Vargas M, Striano P, Del Guercio L, Buonanno P, Servillo G. Posterior reversible encephalopathy syndrome: the endothelial hypotheses. Med Hypotheses. 2014 May;82(5):619–22. https://doi.org/10.1016/j.mehy.2014.02.022 PMID:24613735
12. Servillo G, Bifulco F, De Robertis E, Piazza O, Striano P, Tortora F, et al. Posterior reversible encephalopathy syndrome in intensive care medicine. Intensive Care Med. 2007 Feb;33(2):230–6. https://doi.org/10.1007/s00134-006-0459-0 PMID:17119920
13. Granata G, Greco A, Iannella G, Granata M, Manno A, Savastano E, et al. Posterior reversible encephalopathy syndrome—insight into pathogenesis, clinical variants and treatment approaches. Autoimmun Rev. 2015 Sep;14(9):830–6. https://doi.org/10.1016/j.autrev.2015.05.006 PMID:25999210
14. Osorio-Rodríguez EL, García-Perlaza CJ, Navarro-Devia AJ, Salas-Danies EM, Pineda-Tovar MP, Guevara Romero E. Posterior reversible encephalopathy syndrome secondary to hypertensive disorders of pregnancy. Case series. Ginecol Obstet Mex. 2021;89(10):770–8. https://doi.org/10.24245/gom.v89i10.6781.
15. Fugate JE, Claassen DO, Cloft HJ, Kallmes DF, Kozak OS, Rabinstein AA. Posterior reversible encephalopathy syndrome: associated clinical and radiologic findings. Mayo Clin Proc. 2010 May;85(5):427–32. https://doi.org/10.4065/mcp.2009.0590 PMID:20435835
16. Schweitzer AD, Parikh NS, Askin G, Nemade A, Lyo J, Karimi S, et al. Imaging characteristics associated with clinical outcomes in posterior reversible encephalopathy syndrome. Neuroradiology. 2017 Apr;59(4):379–86. https://doi.org/10.1007/s00234-017-1815-1 PMID:28289809
17. ElFarra J, Bean C, Martin JN Jr. Management of hypertensive crisis for the obstetrician/gynecologist. Obstet Gynecol Clin North Am. 2016 Dec;43(4):623–37. https://doi.org/10.1016/j.ogc.2016.07.005 PMID:27816151
18. Hernández-Pacheco JA. Espino-y Sosa S, Estrada-Altamirano A, Nares-Torices MA, Ortega Casitillo VM, Mendoza-Calderón SA. Instrumentos de la Guía de Práctica Clínica. Diagnóstico y Tratamiento de la preeclampsia y eclampsia en el embarazo, parto y puerperio. Perinatol Reprod Hum. 2013;27(4):262–80.

 ORCID
ORCID