Juan Pablo Molina1,2, Diana Carolina Carmona1,2, Fernando Yévenes1,2,3,*
Recibido: 13-06-2024
Aceptado: 10-10-2024
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 2 pp. 182-192|https://doi.org/10.25237/revchilanestv54n2-12
PDF|ePub|RIS
Abstract
Cancer is a highly prevalent disease associated with high mortality. As part of its treatment, a significant percentage of patients will require surgery, some of them with a high probability of major bleeding. To reduce the impact of surgical bleeding, patient blood management (PBM) programs have been developed and implemented, which include intraoperative blood-saving strategies, including the collection of blood from the surgical field for processing and re-infusion, also known as intraoperative autologous transfusion or intraoperative cell salvage (ICS). In relation to its use in oncologic surgery, there have been historical considerations related to the concern of collecting tumor cells, which, if re-infused together with red blood cells, could eventually participate in the generation of metastasis and tumor recurrence. Different accumulated evidence would indicate that the risk of this occurrence would be low or non-existent and that its potential occurrence would be compensated through the benefits obtained with the use of the ICS technique in an indirect manner. Thus, some medical societies have made recommendations on its use in this specific subgroup of patients. This paper will review generalities about the technique, analyzing its advantages and disadvantages. The process of metastasis formation will be described and how different stages of the perioperative period, including ICS, could affect this process. We will also review the experimental evidence accumulated in relation to the use of ICS in oncologic surgery and finally we will end with a summary of the main recommendations regarding its use published to date.
Resumen
El cáncer es una enfermedad de alta prevalencia y asociada a gran mortalidad. Como parte de su tratamiento, un porcentaje importante de pacientes requerirá cirugía, algunas de ellas con alta probabilidad de sangrado importante. Para disminuir el impacto que implica el sangrado quirúrgico, se han desarrollado e implementado los programas de manejo de sangre del paciente (PBM), que dentro de sus estrategias incluyen estrategias intraoperatorias de ahorro de sangre, entre la que destaca la recolección de sangre del campo quirúrgico para procesamiento y reinfusión, también conocida como transfusión autóloga intra operatoria o por su nombre en inglés “intraoperative cell salvage” (ICS). En relación con su uso en cirugía oncológica han existido consideraciones históricas relacionadas a la preocupación de recolectar células tumorales, las cuales, en caso de ser reinfundidas junto a los glóbulos rojos, eventualmente podrían participar en la generación de metástasis y recidiva tumoral. Distinta evidencia acumulada indicaría que el riesgo de que ello ocurra sería bajo o inexistente y que su potencial ocurrencia estaría compensada a través de beneficios obtenidos con el uso de la técnica de ICS de manera indirecta. De esta forma, algunas sociedades médicas han realizado recomendaciones sobre su uso en este subgrupo específico de pacientes. En este trabajo se revisarán generalidades sobre la técnica, analizando sus ventajas y desventajas. Se describirá el proceso de formación de metástasis y como distintas etapas del perioperatorio, incluido el ICS podrían afectar este proceso. Se revisará también la evidencia experimental acumulada en relación con el uso de ICS en cirugía oncológica para finalmente terminar con un resumen de las principales recomendaciones en relación con el su uso publicadas hasta la fecha.
-
Introducción
El cáncer es una enfermedad de gran prevalencia y una de las principales causas de muerte en el mundo, siendo Chile parte de esta misma realidad.
Se estima que se producen más de 19 millones de nuevos casos de cáncer y unos 10 millones de muertes a nivel mundial[1]. De acuerdo a base de datos de mortalidad de la World Health Organization (WHO), en Estados Unidos se produjeron el 2020, 602.372 muertes por enfermedad maligna, constituyendo 17,8% del total de muertes, mientras que en Chile, se atribuyeron un total de 27.435 con un porcentaje aún mayor, 21,7%[2].
La enfermedad diseminada, constituyen un estado avanzado de la enfermedad. La gran mayoría de los pacientes con cáncer mueren como consecuencia de su enfermedad metastásica y no a causa de tumores primarios[3],[4],[5].
Actualmente, la cirugía constituye uno de los pilares fundaméntales del tratamiento. Al menos el 80% de los pacientes con tumores sólidos se someterá algún procedimiento quirúrgico durante el curso de su enfermedad. Estos procedimientos, consideran múltiples intervenciones, algunas de las cuales pueden asociar cambios que influyen en el desarrollo de la enfer- medad[4]. Una de estas intervenciones corresponden a la transfusión alogénica de glóbulos rojos, las cuales se han asociado a peores resultados oncológicos[6].
Diversas estrategias se se han desarrollado para disminuir este impacto, entre las que se encuentran los programas de manejo de sangre del paciente (PBM), que incluyen técnicas de ahorro para el intra operatorio, destacando las técnicas de recolección intra operatoria de sangre o intra operative cell salvage (ICS).
Aunque varios estudios de PBM se han desarrollado en distintas poblaciones de pacientes con cáncer, sus intervenciones se han centrado principalmente en la optimización de la anemia preoperatoria y la implementación de programas restrictivos de transfusión, con buenos resultados.
Su uso en cirugía oncológica ha sido limitado por consideraciones en relación al potencial de re infusión de células malignas con la consecuente diseminación de la enfermedad primaria. Ya en 1975, se publicó un caso de un paciente con cáncer de pulmón, en el que se atribuyó la reinfusión de sangre recolectada en el intra operatorio con la aparición de enfermedad a distancia[7]. En 1986, el American Medicine Council publicó recomendaciones en las que la exposición de la sangre recolectada en el intra operatorio a células malignas constituía una contraindicación para su re infusión[8].
En esta revisión, se realizará en primer lugar una breve descripción de la técnica de cell salvage (ICS), o transfusión autólo- ga de sangre recolectada en el intra operatorio.
A continuación seguirá una actualización de los mecanismos a través de los cuales se producen las metástasis, y como el perioperatorio en general, y específicamente las transfusiones, pueden influir en esos mecanismos para favorecer el desarrollo de metástasis.
La sección siguiente se referirá a la descripción las revisiones que se han realizado en relación a ICS y los resultados oncológicos encontrados en cuanto a recidiva de la enfermedad y a sobre vida.
La última parte se revisarán las recomendaciones que algunas sociedades han realizado en relación a este tema en específico, a la luz de la evidencia acumulada.
-
Desarrollo
-
Generalidades de la técnica
La recuperación celular intra operatoria o intra operative cell salvage (ICS) es el método de recolectar los glóbulos rojos desprendidos durante la cirugía, procesarlos y prepararlos para su retorno seguro a la circulación del paciente como una transfusión autóloga de glóbulos rojos durante o inmediatamente después de la cirugía.
La primera experiencia publicada sobre recuperación de sangre en humanos fue en 1818 por el ginecólogo, James Blundell, aunque sin buenos resultados[9]. Fue la década de 1960 cuando las publicaciones en relación a las técnicas de recuperación de sangre para reinfusión aumentaron progresivamente, adquiriendo su forma reconocible actual y cobrando cada vez mas importancia como estrategia perioperatoria para el manejo de la sangre.
Carrol y cols., describen la técnica de ICS[10]. La técnica consiste inicialmente en recoger la sangre del campo quirúrgico, a partir de un aspirador graduado (-100 a -150 mmHg) o del lavado de los campos quirúrgicos, combinándose con heparina, para a continuación realizar un filtrado, antes de las etapas de separación y lavado. Los glóbulos rojos son separados de los otros componentes de la sangre rescatada en una centrífuga de alta velocidad (5.600 rpm) para luego ser lavados en solución salina, quedando en su presentación para la reinfusión a un hematocrito de 60% aproximado. La Figura 1 representa esquemáticamente un sistema de recuperación de sangre intra operatoria.
-
Existen varias ventajas descritas para el uso de cell salvage
Una de las principales implica la reducción de la necesidad de transfusión alogénica[11],[12], un umbral menos restrictivos de transfusiones asociados a PBM, mejor disponibilidad de la entrega de oxígeno en comparación con la sangre de donantes y la ausencia de efectos inmunológicos adversos[10].
Los glóbulos rojos obtenidos tienen diferencias en comparación a las almacenadas alogénicas. Conservan su perfil elíptico, tienen mayor elasticidad y mantiene mayores concentraciones de 2,3 difosfoglicerato y ATP, resultando en una mayor capacidad de entrega de oxígeno que se ha observado hasta 3 días después de la transfusión[13]. Adicionalmente, no presentarían reacciones de inmuno modulación de forma inicial, y solo la estaría presente al almacenarse de la misma forma que la sangre alogénica[10].
Entre las desventajas se encuentran la necesidad de un personal entrenado y eventualmente el costo. El procesamiento requiere de algunos minutos y la disponibilidad de sangre obtenida para transfundir es limitada. Por otra parte, los glóbulos rojos del ICS, tienen cantidades insignificantes de plaquetas y factores de coagulación, por lo que si se transfunden volúmenes importantes, se debe considerar su reposición[10].
Entre los riesgos se encuentran la hemólisis no inmune, los émbolos aéreos, reacción febril hemolítica no inmune, perdidas de la transfusión, coagulopatía y contaminación, todas las cuales disminuyen con el entrenamiento y la experiencia[13].
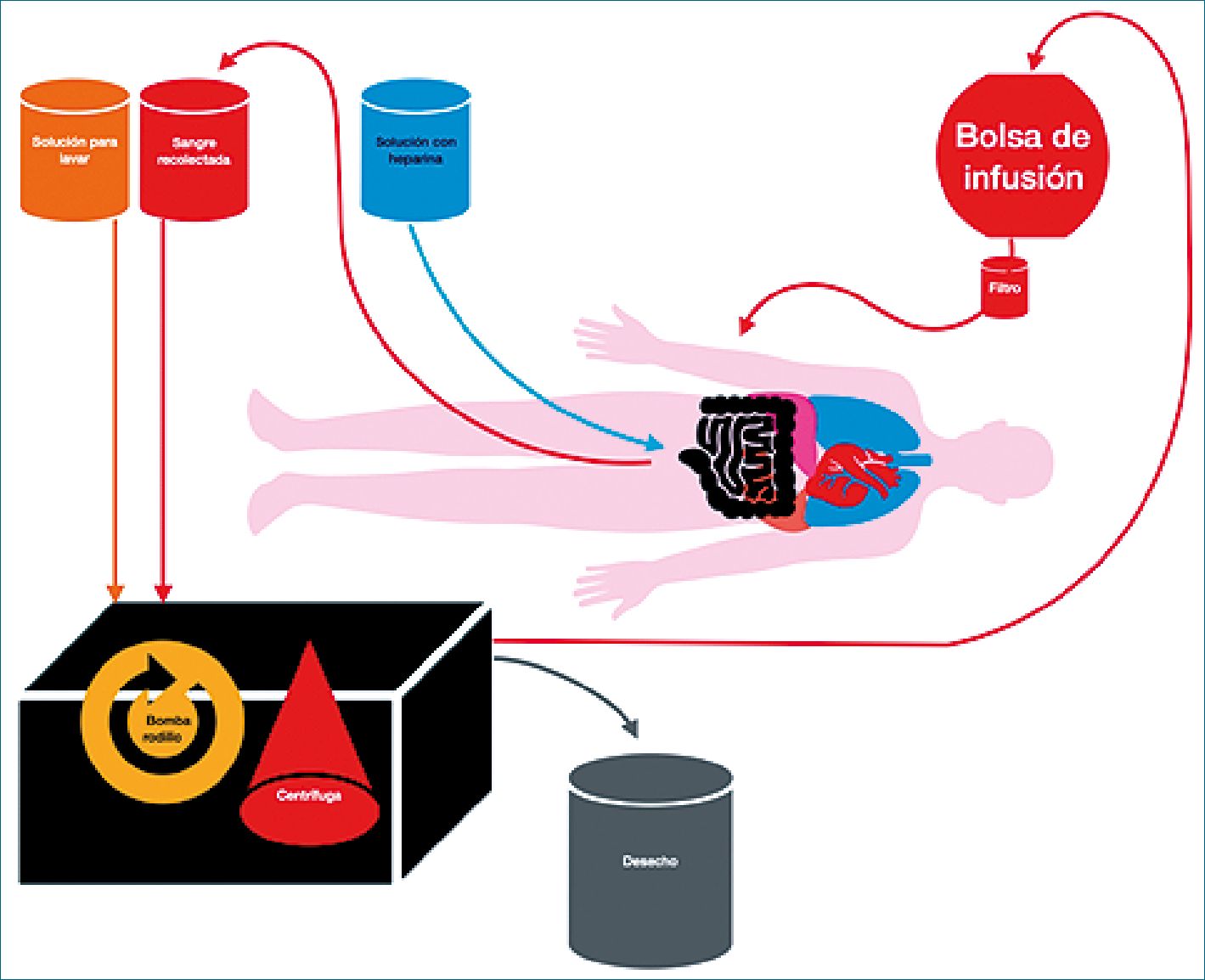
Figura 1. Esquema.
A pesar de las que esas reacciones adversas pueden ocurrir y deben ser investigadas en caso de sospecharse, la frecuencia de reacciones adversas es mucho menor que al transfundir sangre autóloga[14].
Al momento de re infundir pueden usarse distintos tipos de filtros, dentro de los cuales el filtro de depleción de leucocitos (LDF), se usa habitualmente en cirugía oncológica. Corresponde a un filtro de afinidad[10]. Si bien existe evidencia experimental de disminución de la cantidad de células tumorales re infundidas con su uso[15] presenta algunas desventajas, como la necesidad de ser previamente cebado antes de su uso y de reducir la velocidad de re infusión (40 – 100 ml/min) significativamente[10].
La hipotensión por re infusión es una complicación conocida del ICS y se cree que se ve incrementada significativamente con el uso de LDF, lo que podría aumentar aún más al infundir bajo presión contra el filtro. No se conoce su causa claramente, sin embargo se ha planteado una posible asociación bradiquininas o a hipo calcemia aguda[10].
-
Proceso de metástasis
La comprensión de las metástasis deriva de la hipótesis planteada por Paget llamada de “semilla y suelo” que en 1889 publicó sus observaciones en relación a las metástasis de cáncer de mama que observó que estas no ocurrían al azar[16].
Gerstberger y cols.[17], definen las metástasis y señalan sus principales etapas y características. La metástasis engloba una serie de eventos biológicos en los que las células de un tumor primario adquieren progresivamente la capacidad de invadir a través de la mucosa hasta tejidos más profundos; diseminarse a través de la sangre, los linfáticos o mediante infiltración directa de estructuras vecinas; sembrando órganos distantes; y eventualmente reanudar la proliferación en sitios distantes para colonizar estos órganos. Para eso, requiere la adquisición de una sucesión de rasgos para diseminarse, entrar y salir del estado de latencia de forma variable y colonizar órganos distantes. El éxito de estos eventos está impulsado por la selección clonal, el potencial de las células metastásicas para realizar una transición dinámica entre distintos estados y su capacidad para colaborar el entorno inmunológico.
Según los autores, las etapas de la metástasis son 3, pu- diendo superponerse. Ellas son la diseminación, la latencia y la colonización.
En la diseminación, ciertas células adquieren la capacidad de invadir la membrana basal y sobrevivir fuera de su nicho específico, invadiendo de forma directa o saliendo a la circulación sistémica o vasos linfáticos, transformándose en células tumorales circulantes (CTC), que finalmente por extravasación alcanzarán órganos distantes. En su viaje por la circulación las CTC sufrirán de un importante estrés, tanto físico, redox e in- munológico, sumando a su llegada la falta de factores de soporte y los mecanismos inmunológicos locales.
Al alcanzar los órganos distantes, las CTC se denominan células tumorales diseminadas (DTC), las cuales dependen de desarrollar un microambiente tumoral (TME) en el órgano distante, entrando en un período variable de reposo, conocido como etapa de latencia. Esta etapa se considera micrometás- tasis, ya que desde el punto de vista clínico, la enfermedad es asintomática e indetectable.
Finalmente, la formación de macro metástasis, depende de el éxito de las células iniciadoras de metástasis (MIC), que logran adaptan y comandar su TME logrando crecer a través de programas de regeneración, angiogénesis e inmunosupresión, proceso llamado colonización.
Un concepto clave es el de la plasticidad fenotípica, que se refiere a la capacidad de adaptación no genética frente a distintos estresantes y cambios en el TME. Ello le permite entrar y salir de distintos estados de célula progenitora símil y trans diferenciarse[17].
Para el caso de las metástasis que se presentan luego de una intervención quirúrgica, que corresponde a un tipo de recidiva tumoral[18], Murphy y cols., plantean adicionalmente y previo al proceso quirúrgico, que el tumor primario a medida que se desarrolla libera vesículas extracelulares que contienen factores de crecimiento y RNAm, los cuales preparan nichos en órganos distantes para el implante de las micrometástasis. Luego de la cirugía, en el cual células tumorales se remueven del tumor primario y pasan a la circulación sistémica transformándose en CTC, estas viajarían a través del torrente sanguíneo para finalmente alojarse en los nichos previamente preparados, formando metástasis[19].
Para que estos procesos sean posibles, una etapa fundamental es la transición epitelial-mesenquimatosa (EMT) por el cual las células cancerosas epiteliales se transforman en células cancerosas mesenquimales. Esta transformación fenotípica permite que las células mesenquimales migren, invadan y resistan la apoptosis mientras colonizan sitios distantes[5].
-
Factores del perioperatorio que aumentan el potencial metastásico
Las etapas previamente descritas pueden ser afectados por el proceso quirúrgico propiamente tal a través de distintos mecanismos.
Según Wall y cols.[18], los tipos de recurrencia después de una cirugía curativa son 4: recidiva local, metástasis en linfono- dos, metástasis a distancia y siembra a través de una cavidad. La recurrencia de la enfermedad luego de una intervención con intención curativa es un mecanismo complejo y aún no bien comprendido.
Se han planteado los mecanismos de inmunosupresión, inflamación y angiogénesis como participantes de este proceso de recurrencia.
La incisión quirúrgica, por una parte, generaría liberación de CTC que transportadas en la sangre o el plasma se alojarían en órganos distantes.
Sumado a ello, el estrés quirúrgico y el dolor a través de la activación del eje hipotálamo hipófisis adrenal provocaría aumento de cortisol y de catecolaminas, con la subsiguiente in- munosupresión; a través de activación de la inmunidad celular y consecuente liberación de mediadores proinflamatorias (IL6, COX2, MMP2/9, nFKB) constituirían mecanismos de desbalance de la TME con aumento de la motilidad, invasión y proliferación; y la hipóxia titular con consecuente aumento del HIF 1a y factor de crecimiento endotelial vascular (VEGF) promueven la angiogénesis, mecanismos todos que favorecerán la proliferación de DTC en estados latentes[18],[19].
Si bien el acto quirúrgico esta implicado de forma directa en los mecanismos previamente planteados, existen otras intervenciones que se asocian al contexto perioperatorio y que podrían contribuir a través de sus propios mecanismos al proceso de recidiva y metástasis, como es el caso de las transfusiones de hemoderivados.
En el caso de las tranfusiones alogénicas se han relacionado a resultados adversos en cancer. Aunque sus beneficios en ciertos escenarios clínicos no están en debate, como por ejemplo condiciones que amenacen la vida asociado a bajo recuento de glóbulos rojos o sangrado, existe evidencia creciente que relaciona las estrategias liberales de transfusión a alteraciones de la inmunidad que pueden llevar a crecimiento tumoral, propagación y diseminación[20].
El mecanismo principalmente asociado a este resultado adverso vendría siendo la inmunomodulación relacionada a transfusión (TRIM). Este fenómeno corresponde a una serie compleja de mecanismos fisiopatológicos que incluyen tanto efectos inmunosupresores como pro-inflamatorios mediado por leucocitos residuales, células apoptóticas, y una serie de modificadores biológicos como citoquinas, mediadores solubles y péptidos HLA solubles, así como micropartículas (MP) y micro- vesículas (MV) extracelulares derivadas de células y hemoglobina libre[21].
En relación a los efectos oncológicos, los cambios infligidos por los residuos de leucocitos implican aumento del factor de crecimiento tumoral beta (TGF B) genera secreción de interleu- cinas, degeneración osteoclástica en la matriz óseas que favorece la implantación de metástasis, y supresión de natural killers (NK), modulación de células T con secreción de mediadores proinflamatorios y de forma directa o indirecta el crecimiento tumoral. Las MP y MV juegan un rol fundamental, sobre todo las MP derivadas de plaquetas (PMP) las cuales favorecen la angiogénesis a través del factor de crecimiento endotelial vascular (VEGF) y con ello permiten el crecimiento tumoral. A traves de este se estimula también la linfa angiogénesis, favoreciendo la diseminación tumoral linfática[21].
-
Se ha planteado que existe evidencia clínica de este efecto adverso
Goubran y cols.[20] en 2016, plantearon que el cáncer de cólon correspondería al prototipo de estudio de resultados adversos en relación a transfusión. Ya 1988, Tartter y cols.[22], asociaron complicaciones infecciosas posoperatorias a transfusiones, atribuyendo dicha asociación inmunosupresión[22]. Esta tendencia se incrementó cuando Amato y cols.[23], en 2006 realizaron un metaanálisis chochrane demostraron asociación entre transfusión perioperatoria y recurrencia de cáncer de colon curable[23]. También, se describe este efecto adverso en estudios de cancer de esófago, cancer gástrico, metanalisis de carcinoma hepatocelular, enfermedad maligna urotelial, carcinoma de ovario y sarcoma de alto grado de partes blandas[20].
A pesar de toda la evidencia que sugiere esta asociación, ya en 2013 Tarantino y cols.[24], a través de un estudio de propensión no encontró asociación a resultados adversos en cáncer de colon, y atribuyo esta asociación a condiciones más graves que hacían más probable una transfusión, a la ves que un peor resultado oncológico. Lo mismo sugirieron Zhang en 2023 para cáncer gástrico y nuevamente cancer de colon[25].
-
Mecanismos de diseminación asociados a ICS
A pesar de que la evidencia indica que la cirugía es capaz de favorecer el desarrollo de enfermedad diseminada a través de los mecanismos antes mencionados, Kumar y cols., plantean que no ocurriría lo mismo en el caso de cell salvage. Esto se basa principalmente por una parte en que la sangre recogida a partir de cell salvage no tendría celular tumorales o tendría al menos un recuento mucho menor que el originalmente se presenta en la sangre de la circulación del paciente. Por otra parte, las células tumorales recogidas, perderían sus propiedades de replicación[15].
Para demostrar la falta de células tumorales en la sangre recuperada y, por tanto, su seguridad para la reinfusión en cirugía oncológica Kumar y cols., siguieron tres pasos hacia una secuencia lógica para probar el concepto. El primero es establecer evidencia celular básica, que probaría la hipótesis de que la sangre recuperada carece de células tumorales. El segundo paso es establecer evidencia celular avanzada, que debería cuantificar la cantidad de células tumorales en la sangre recuperada, si las hay, y demostrar que es significativamente menor que la cantidad de CTC en la sangre de los pacientes en cualquier momento. Establecer evidencia clínica sería el último paso, evaluando los resultados en relación a progresión o recurrencia del tumor, o la supervivencia de los pacientes sometidos a transfusión de sangre recuperada[15].
Kumar y cols.[26], realizaron en 2016 un estudio de marcadores inmunohistoquímicos de anticuerpos monoclonales para líneas celulares epiteliales de sangre recolectada del campo quirúrgico, luego del procesamiento a través de su recuperador de sangre y centrifugado se realizó un paso a través del filtro de depleción de leucocitos. De 50 pacientes que cumplieron los criterios, se demostró presencia de células tumorales en 24, 4 y 0 respectivamente, concluyendo que el procesamiento en ICS y luego el paso a través del filtro eran efectivos en disminuir el número de células malignas circulantes[26]. Similar experiencias se han descrito para en cirugía de tumores primarios para gine-oncología (endometrio, ovario y cuello uterino)[27], uro- oncología[28], pulmón[29] y hepatobiliar[30]. Zong y cols., más recientemente en 2022 desarrollaron un estudio similar, con nuevas técnicas de detección de células tumorales, encontrando la misma tendencia a la reducción luego del procesamiento y filtrado e incorporando filtros de depresión de leucocitos modificados, logrando mejores resultados[31].
En relación a la segunda etapa de demostrar la viabilidad de células tumorales, Kumar y cols.[32], realizaron en 2016 experiencia en la que estudiaron la sangre de pacientes con cánceres de distinto tipo con indicación quirúrgica para metástasis de columna. Para ello recolectaron muestras de sangre de 5 diferentes momentos de la cirugía; muestra venosa durante la inducción de la anestesia, sangre venosa durante la máxima manipulación del tumor, sangre recolectada del campo quirúrgico durante la máxima manipulación del tumor antes del procesamiento por ICS, luego del procesamiento y la última muestra después del procesamiento en ICS y del paso a través del filtro de depleción de leucocitos. Luego de realizar los cultivos respectivos, observaron que hubo crecimiento tumoral en las muestras recolectadas de las 3 primeras etapas, pero no así de las muestras obtenidas luego del procesamiento con ICS ni después del filtrado con filtro de depresión de leucocitos[32].
Estos hallazgos se correlacionan con estudios previos in vitro, en que las células tumorales se analizaron luego de filtrado a través de sistema de ICS, demostrando un alto porcentaje de retención (55%-76%) y de las restantes hasta 62% de células con trauma letal demostrado por sus alteraciones morfológicas[33].
Estas CTC que han fallado en completar las etapas de su proceso metastásico, son rápidamente eliminadas de la circulación por el sistema reticuloendotelial[15].
-
ICS y transfusión alogénica
Aunque la transfusión alogénica se usa ampliamente en la práctica clínica, también tiene riesgos que deben ser considerados. Algunas limitaciones inherentes a ella corresponden a reacciones alérgicas, infecciones, hemólisis, infarto de miocardio perioperatorio, insuficiencia cardíaca posoperatoria de bajo gasto, inmunomodulación relacionada con transfusiones (TRIM), lesión pulmonar aguda relacionada con transfusiones (TRALI) y infección viral potencialmente[34].
Lo anterior debe ser considerado ya que existe evidencia que incluye múltiples disciplinas quirúrgicas que muestras que el uso de ICS reduce la exposición a sangre alogénica hasta en 39%[35]. Lloyd y cols., en una revisión Chochrane encontraron que el uso de ICS podía reducir la necesidad y el volumen de sangre alogénica, aunque sin demostrar diferencias en otros resultados[12].
La reducción en la necesidad de uso de transfusión alogé- nica y sus complicaciones asociadas podría constituir otro argumento a favor de su uso.
Las ventajas y desventajas del ICS se resumen en la Tabla 1.
Tabla 1. Ventajas y desventajas del ICS en cirugía oncológica
| Ventajas
Reducción de la necesidad de transfusión alogénica (Carless 2006) (Lloyd 2023) |
Desventajas
Riesgos asociado hemolisis no inmuyne, émbolos aereos, reacción febril hemolítica no inmune, per-didas de la transfusión, coagulopatía y contami-nación (Ashworth 2010) |
| Sin necesidad de umbral restrictivo de transfusión | Necesidad de reponer plaquetas y factores de coagulación para volúmenes importantes (Carroll 2021) |
| Sin riesgo de TRIM (Carrol 2021) | Volúmenes y velocidad limitados para transfundir |
| Glóbulos rojos con mejor capacidad de transporte de oxígeno (Ashworth 2010) | Recomendación de uso de filtro para cirugía on-cológica |
| Con uso de filtros velocidad limitada de transfu-sión y riesgo de hipotensión asociada al filtro |
-
Experiencia en ICS en cirugía oncológica
Friedrish y cols. en 2022[36], realizaron una revisión sistemática a cerca de la seguridad del cell salvage en cirugía oncológica. Esta revisión tenía por objetivo actualizar las revisiones previas realizadas en 2012[37] y el 2020[38] en las que no se identificó aumento de la recurrencia de cáncer con el uso de ICS. Encontraron 7 nuevos trabajos que se agregaron a los 27 de la revisión previa, hasta marzo de 2022. Al igual que en las revisiones previas, los resultados con el uso de ICS fueron similares o mejores que en aquellos en los que no se uso.
Ellos en total, encontraron 34 estudios, observaciones, con 8.503 participantes enrolados y 3.161 tratados con ICS en total. Los resultados de la estimación del riesgo se presentaron a partir de cirugías contra el cáncer que comparan el uso de ICS y la re transfusión versus el control (sin transfusión o solo transfusión alogénica). La tasa de recurrencia del cáncer disminuyó en los grupos ICS. No se observaron diferencias entre los grupos con respecto a la mortalidad y días de estadía. Debido a la gran heterogeneidad entre los estudios, no se calculó un efecto combinado para la tasa de transfusión y el volumen transfundido[36].
Wu y cols.[34], en 2019 en su revisión tuvieron resultado similar.
Basados en la metodología PRISTMA, revisaron las bases de datos Chochane, Library, MEDLINE and EMBASE hasta noviembre 2017, incluyendo estudios que incluyeran solo ICS comparado con transfusión alogénica.
Este metaanálisis incluyó 9 estudios con 4.354 pacientes, 1.346 pacientes en el grupo de ICS y 3.008 pacientes en el grupo de transfusión de sangre alogénica. No hubo diferencias significativas en el resultado de supervivencia general a 5 años), resultado de supervivencia libre de enfermedad a 5 años, o tasa de recurrencia a 5 años entre los 2 grupos de estudio. Ademas realizaron un análisis para el sub grupos de transplante hepático para pacientes con cáncer hepatocelular pa, el cual tampoco mostró diferencias significativas en el resultado de supervivencia general a 5 años.
El grupo de intervención considerado fue solo de ICS, excluyendo auto donación (ABD) y dilución aguda normo volémica (ANH). El resultado primario estudiado fue taza de recurrencia de tumor. Otros resultados examinados fue sobreviva, taza libre de enfermedad.
Para todos los estudios, ninguno mostró diferencias significativas en sobreviva global, sobre vida libre de enfermedad o taza de recurrencia, y en el análisis de sub grupo tampoco hubo diferencia de tasa de recurrencia al 1er, 3er y 5o año post operatorio. Adicionalmente, ICS mostró una menor tasa de recurrencia a los dos años en 2 de los estudio, aunque la sobrevivan global y tiempo libre de enfermedad no mostraron diferencias[34].
La cirugía hepática por su alto potencial de sangrado ha recibido un especial interés, ya que una de sus indicaciones es el hepatocarcinoma. Aijtink y cols.[38] en 2022, Wang y cols.[40] en 2022, Hinojosa González[41] 2024, realizaron revisiones sistemáticas con meta-análisis para transplante hepático por cancer hepatocelular, mostrando que el uso de ICS no disminuye la supervivencia libre de enfermedad, aumenta la recurrencia del CHC o disminuye la supervivencia en general. Por lo tanto, concluyen que el uso de ICS durante el trasplante de hígado en pacientes con CHC es un procedimiento seguro[39],[40],[41].
Rajendran 2023[42], en su revisión además de cirugía de transplante hepático, incluyó hepatectomías, demostrando que el uso de ICS disminuye el uso de sangre alogénica sin impactar en la recurrencia o la sobrevida global[42] similar a lo descrito por los autores previos.
Murtha-Lemekhova[43] en 2022, encontró resultados similares en su revisión sistemática, incluyendo tanto estudios de transplante hepático como de hepatectomía e incluyendo ademas de ICS, autotransfusión con sangre recolectada preoperatoria, sin demostrar tampoco un peor resultado en cuanto a recurrencia y sobre vida global[43].
En otros campos, Fereroni y cols.[44] en 2017 revisaron la evidencia en relación al uso de ICS para cirugías uro-oncológicas las cuales también están asociadas a una potencial alto sangrado. En su revisión, demostraron que la IOCS es una estrategia eficaz de gestión de la sangre intraoperatoria , su seguridad para su uso en cirugía oncológica urológicas sugiriendo que un podría tener un beneficio en cuanto a impacto en los resultados oncológicos mediados por el sistema inmunológico. Dentro de los nueve estudios incluidos en el análisis se consideraron cirugía de cáncer de células renales, próstata y urotelial[44].
Li y cols.[45] 2017, realizaron una revisión sistemática específicamente para cancer de próstata, describiendo sobrevida libre de recurrencia bioquímica, sobre vida global y sobrevida específica de cancer, los cuales no mostraron diferencias significativas en el uso de ICS. Realizaron también un análisis con 9 de los estudios incluidos en los cuales encontraron asociación entre transfusión alogénica peores resultados en los parámetros previamente mencionados[45].
Kumar y cols.[46] en 2023, realizaron el 1er estudio prospectivo en pacientes de cirugía de metástasis de columna, comparando ICS vs Transfusión autóloga y no transfusión, demostrando mejores resultados en el grupo ICS. Este estudio no se incluye en ningún metanalisis[46].
-
Recomendaciones en relación al uso de ICS
En 2022, la International Foundation for Patient Blood Management (IFPBM) que agrupa varias sociedades científicas, redactó una definición global de PBM[47]. Dicho documento no realiza recomendaciones específicas en relación al uso de ICS en cirugía oncológica, sin embargo, algunas de las sociedades participantes tienen sus propias recomendaciones al respecto. A continuación se describen algunas de las más relevantes y la Tabla 2 de resumen incluye estas y otras recomendaciones.
La Sociedad Americana de Anestesiólogos (ASA), publicó una guía practica de PBM de actualización de su grupo de trabajo en 2015[48]. Si bien tanto los consultores como los miembros de la ASA están totalmente de acuerdo en considerar la re infusión de glóbulos rojos recuperados como una intervención ahorradora de sangre en el período intra operatorio y/o postoperatorio, no se realiza ninguna recomendación específica respecto del uso en cirugía oncológica.
La Sociedad Europea de Anestesióloga en 2022, publicó su segunda actualización de manejo de sangrado perioperatorio severo, el cual tiene las recomendaciones más específicas encontradas en relación al uso de ICS. Para ello, el uso de ICS esta recomendado en distintos escenarios clínicos (cirugía cardíaca 1b, ortopédica mayor 2b, ginecología B, obstetricia C y cesárea 2b) incluyendo escenarios oncológicos; transplante hepático para pacientes con hepatocarcinoma, usando filtro de leucode- plesión 2c y gine oncología 2b[49].
Tabla 2. Resumen recomendaciones de uso ICS en cirugía oncológica
| Sociedad | Año |
Recomendación |
Nivel |
| ASA[48] | 2015 |
Uso ICS para ahorro de transfusión alogénica intra y post operatoria. Sin mención específica a casos oncológicos |
– |
| ESC[49] | 2022 |
Uso de ICS esta recomendado en cirugía cardíaca, ortopédica mayor, ginecología, obstetricia y cesárea |
1b, 2b, B, C, 2b |
|
Uso de ICS esta recomendado en transplante hepático para pacientes con hepatocarcinoma, usando filtro de leucodeplesión |
2c | ||
| Uso de ICS esta recomendado en gine oncología | 2b | ||
|
ICS no esté contraindicada en la cirugía del cáncer, siempre que se evite la aspiración de sangre cerca del sitio del tumor y se utilicen filtros de leucodepleción |
2C | ||
| RCoA[52] | 2018 |
En cirugía oncológica no lo considera una contraindicación absoluta, recomiendan que los riesgos y beneficios potenciales se discutan con los pacientes antes de la cirugía oncológica y se obtenga un consen-timiento específico |
– |
| Panel exper-to español alternativas a la transfusión[53] | 2013 |
Uso de ICS para cirugía hepática y urológica oncológica con recomendación |
2c |
| IAKH[55] | 2019 |
Recomienda el uso de ICS en cirugía oncológica con uso de filtro de depresión de leucocitos de 2da generación Recomienda la suspensión del uso de la succión si es necesario el corte del tumor durante el procedimiento Recomienda que para los procedimientos sin “abrir” el proceso ma-ligno podría usarse la sangre recolectada sin irradiar ni filtrar |
– |
| STS[54] | 2011 |
Recomiendan para paciente con enfermedad maligna conocida de alto riesgo que requieren CEC, considerar ICS |
2b |
| Asociación brasileña de hematología[56] | 2024 |
Recomendamos el uso de ICS en casos de cirugías grandes y complejas, especialmente en cirugías con alto riesgo de pérdida sanguí-nea significativa. No hay mención a cirugía oncológica |
– |
Sugieren que el ICS no esté contraindicada en la cirugía del cáncer, siempre que se evite la aspiración de sangre cerca del sitio del tumor y se utilicen filtros de leucodepleción. 2C[50] (Kietaibl 2022). Esta recomendación ya se encontraba presente en la versión previa de esta guía, la primera actualización en 2017 de forma general[50], pero no se mencionaba en la primera versión de 2014[51].
El documento de consenso elaborado por miembros de un grupo de trabajo establecido por la Asociación de Anestesistas del Reino Unido en 2018 por su parte, recomiendan el uso de ICS cuando se espera que este reduzca la probabilidad de transfusión de glóbulos rojos alogénicos (y/o anemia posoperatoria grave. Para el caso específico de la cirugía oncológica no lo considera una contraindicación absoluta y que los riesgo potenciales que no han sido probados se compensan con los beneficios probados, en cuanto a reducción de la transfusión alogénica y de inmunomodulación, por lo que recomiendan que los riesgos y beneficios potenciales se discutan con los pacientes antes de la cirugía oncológica y se obtenga un consentimiento específico[52].
La declaración de Consenso Español sobre alternativas a la transfusión de sangre alogénica en su actualización de 2013 del “Documento de Sevilla” recomienda el uso de ICS para cirugía hepática y urológica oncológica con recomendación 2c[53].
La Sociedad de Cirujanos Torácicos y la Sociedad de Anes- tesiólogos Cardiovasculares en sus Guías de práctica clínica para la conservación de la sangre de 2011, recomiendan el uso de ICS en varios escenarios clínicos. Específicamente, para los pacientes con enfermedad maligna conocida, de alto riesgo y que requieren de circulación extracorpóreas (CEC) recomiendan (clase 2b) considerar la recuperación de sangre mediante centrifugación de la sangre recuperada del campo operatorio, ya que hay datos sustanciales que respaldan el beneficio en pacientes sin malignidad y nueva evidencia sugiere un peor resultado cuando se requiere transfusión alogénica en pacientes. con malignidad. (Nivel de evidencia B)[54].
El grupo de trabajo interdiciplinario para le hemoterapia clínica (IAKH) de Alemania, publicó recomendaciones en su página web. En ellas señala varias consideraciones para el uso de ICS en cirugía oncológica de las cuales en relación directa al uso de la técnica destaca el uso de filtro de depresión de leucocitos de 2da generación, la suspensión del uso de la succión si es necesario el corte del tumor durante el procedimiento, y para aquellos que no se realiza podría usarse la sangre recolectada sin irradiar ni filtrar.
-
Conclusiones
Dentro de los programas de manejo de sangre del paciente, las técnicas de recolección de sangre forman parte de las es trategias de reducción de pérdida. La cirugía oncológica asocia perdidas de sangre importante en algunos casos, por lo que la técnica de ICS podría presentar utilidad a la hora de conservar la sangre del paciente. A pesar de las consideraciones que se tienen en cuanto a su seguridad para esta indicación, asociado al eventual riesgo de recuperar y posteriormente re infundir células malignas con potencial generación de recidiva tumoral, diversos mecanismos se han propuesto para explicar porque estas consideraciones serían infundadas, para en resumen demostrar que la reinfusión de glóbulos rojos estarían libres de células tumorales capaces de generar metástasis. Asociado a ello, creciente evidencia surgida a partir de distintos estudios concordaría en señalar que el uso de ICS en cirugía oncológica de distintos tipos, no generaría un aumento de la recidiva tumoral ni tampoco un efecto negativo en relación a otros resultados, como sobre vida global y tasas libres de enfermedad, a pesar de la limitada calidad de esta evidencia.
Considerando todo esto es que distintas sociedades médicas han elaborado recomendaciones clínicas entre las que se encuentra el uso de ICS en cirugía oncológica, existiendo consenso en que no existe actualmente contraindicación absoluta, y que por el contrario estarían recomendó su uso, incorporando filtros e intentando evitar recolectar sangre directamente en contacto con tejido tumoral.
Se requiere por ahora evidencia de mejor calidad para precisar las indicaciones específicas y dar un mayor grado de recomendación.
-
Referencias
1. Ferlay J, Colombet M, Soerjomataram I, Parkin DM, Piñeros M, Znaor A, et al. Cancer statistics for the year 2020: an overview. Int J Cancer. 2021 Apr;149(4):778–89. https://doi.org/10.1002/ijc.33588 PMID:33818764
2. World Health Organization. Mortality Database. Health Statistics and Information Systems. Geneva, Switzerland: WHO. Accessed January 31, 2020
3. Gerstberger S, Jiang Q, Ganesh K. Metastasis. Cell. 2023 Apr;186(8):1564–79. https://doi.org/10.1016/j.cell.2023.03.003 PMID:37059065
4. Wall T, Sherwin A, Ma D, Buggy DJ. Influence of perioperative anaesthetic and analgesic interventions on oncological outcomes: a narrative review. Br J Anaesth. 2019 Aug;123(2):135–50. https://doi.org/10.1016/j.bja.2019.04.062 PMID:31255291
5. Ramirez MF, Cata JP. Anesthesia Techniques and Long-Term Oncological Outcomes. Front Oncol. 2021;11:788918. Published 2021 Dec 8. https://doi.org/10.3389/fonc.2021.788918.
6. Amato A, Pescatori M. Perioperative blood transfusions for the recurrence of colorectal cancer. Cochrane Database Syst Rev. 2006;2006(1):CD005033. Published 2006 Jan 25. https://doi.org/10.1002/14651858.CD005033.pub2.
7. Yaw PB, Sentany M, Link WJ, Wahle WM, GGlover JL. Tumor cells carried through autotransfusion. Contraindication to intraoperative blood recovery? JAMA. 1975 Feb;231(5):490–1. https://doi.org/10.1001/jama.1975.03240170032013 PMID:1172829
8. McKenna SJ; Council on Scientific Affairs. Autologous blood transfusions. JAMA. 1986 Nov;256(17):2378–80. https://doi.org/10.1001/jama.1986.03380170094025 PMID:3773142
9. Blundell J. Experiments on the Transfusion of Blood by the Syringe. Med Chir Trans. 1818;9(Pt 1):56–92. https://doi.org/10.1177/09595287180090P107 PMID:20895353
10. Carroll C, Young F. Intraoperative cell salvage. BJA Educ. 2021 Mar;21(3):95–101. https://doi.org/10.1016/j.bjae.2020.11.007 PMID:33664978
11. Carless PA, Henry DA, Moxey AJ, O’connell DL, Brown T, Fergusson DA. Cell salvage for minimising perioperative allogeneic blood transfusion. Cochrane Database Syst Rev. 2006;(4):CD001888. Published 2006 Oct 18. https://doi.org/10.1002/14651858.CD001888.pub2.
12. Lloyd TD, Geneen LJ, Bernhardt K, et al. Cell salvage for minimising perioperative allogeneic blood transfusion in adults undergoing elective surgery. Cochrane Database Syst Rev. 2023;9(9):CD001888. Published 2023 Sep 8. https://doi.org/10.1002/14651858.CD001888.pub5.
13. Ashworth A, Klein AA. Cell salvage as part of a blood conservation strategy in anaesthesia. Br J Anaesth. 2010 Oct;105(4):401–16. https://doi.org/10.1093/bja/aeq244 PMID:20802228
14. Domen RE. Adverse reactions associated with autologous blood transfusion: evaluation and incidence at a large academic hospital. Transfusion. 1998 Mar;38(3):296–300. https://doi.org/10.1046/j.1537-2995.1998.38398222875.x PMID:9563411
15. Kumar N, Zaw AS, Kantharajanna SB, Khoo BL, Lim CT, Thiery JP. Metastatic efficiency of tumour cells can be impaired by intraoperative cell salvage process: truth or conjecture? Transfus Med. 2017 Oct;27 Suppl 5:327–34. https://doi.org/10.1111/tme.12453 PMID:28833768
16. Paget S. The distribution of secondary growths in cancer of the breast. 1889. Cancer Metastasis Rev. 1989 Aug;8(2):98–101. PMID:2673568
17. Gerstberger S, Jiang Q, Ganesh K. Metastasis. Cell. 2023 Apr;186(8):1564–79. https://doi.org/10.1016/j.cell.2023.03.003 PMID:37059065
18. Zaw AS, Bangalore Kantharajanna S, Kumar N. Is Autologous Salvaged Blood a Viable Option for Patient Blood Management in Oncologic Surgery? Transfus Med Rev. 2017 Jan;31(1):56–61. https://doi.org/10.1016/j.tmrv.2016.06.003 PMID:27421661
19. Murphy O, Forget P, Ma D, Buggy DJ. Tumour excisional surgery, anaesthetic-analgesic techniques, and oncologic outcomes: a narrative review. Br J Anaesth. 2023 Dec;131(6):989–1001. https://doi.org/10.1016/j.bja.2023.07.027 PMID:37689540
20. Goubran HA, Elemary M, Radosevich M, Seghatchian J, El-Ekiaby M, Burnouf T. Impact of Transfusion on Cancer Growth and Outcome. Cancer Growth Metastasis. 2016;9:1-8. Published 2016 Mar 13. https://doi.org/10.4137/CGM.S32797.
21. Goubran H, Sheridan D, Radosevic J, Burnouf T, Seghatchian J. Transfusion-related immunomodulation and cancer. Transfus Apher Sci. 2017 Jun;56(3):336–40. https://doi.org/10.1016/j.transci.2017.05.019 PMID:28606449
22. Tartter PI. Blood transfusion and infectious complications following colorectal cancer surgery. Br J Surg. 1988 Aug;75(8):789–92. https://doi.org/10.1002/bjs.1800750822 PMID:3167530
23. Amato A, Pescatori M. Perioperative blood transfusions for the recurrence of colorectal cancer. Cochrane Database Syst Rev. 2006;2006(1):CD005033. Published 2006 Jan 25. https://doi.org/10.1002/14651858.CD005033.pub2.
24. Tarantino I, Ukegjini K, Warschkow R, Schmied BM, Steffen T, Ulrich A, et al. Blood transfusion does not adversely affect survival after elective colon cancer resection: a propensity score analysis. Langenbecks Arch Surg. 2013 Aug;398(6):841–9. https://doi.org/10.1007/s00423-013-1098-x PMID:23838797
25. Zhang W, Xu H, Huang B, Xu Y, Huang J. Association of perioperative allogeneic blood transfusions and long-term outcomes following radical surgery for gastric and colorectal cancers: systematic review and meta-analysis of propensity-adjusted observational studies. BJS Open. 2023 Jul;7(4):zrad075. https://doi.org/10.1093/bjsopen/zrad075 PMID:37584435
26. Kumar N, Ahmed Q, Lee VK, Zaw AS, Goy R, Wong HK. Are we ready for the use of intraoperative salvaged blood in metastatic spine tumour surgery? Eur Spine J. 2016 Dec;25(12):3997–4007. https://doi.org/10.1007/s00586-015-4112-x PMID:26188770
27. Catling S, Williams S, Freites O, Rees M, Davies C, Hopkins L. Use of a leucocyte filter to remove tumour cells from intra-operative cell salvage blood. Anaesthesia. 2008 Dec;63(12):1332–8. https://doi.org/10.1111/j.1365-2044.2008.05637.x PMID:19032302
28. Poli M, Camargo A, Villa L, Moura R, Colella R, Deheinzelin D. Intraoperative autologous blood recovery in prostate cancer surgery: in vivo validation using a tumour marker. Vox Sang. 2008 Nov;95(4):308–12. https://doi.org/10.1111/j.1423-0410.2008.01109.x PMID:19138260
29. Perseghin P, Viganò M, Rocco G, Della Pona C, Buscemi A, Rizzi A. Effectiveness of leukocyte filters in reducing tumor cell contamination after intraoperative blood salvage in lung cancer patients. Vox Sang. 1997;72(4):221–4. https://doi.org/10.1046/j.1423-0410.1997.7240221.x PMID:9228711
30. Martin RC, Wellhausen SR, Moehle DA, Martin AW, McMasters KM. Evaluation of intraoperative autotransfusion filtration for hepatectomy and pancreatectomy. Ann Surg Oncol. 2005 Dec;12(12):1017–24. https://doi.org/10.1245/ASO.2005.12.018 PMID:16244796
31. Zong YN, Xu CY, Gong YQ, et al. Effectiveness of intraoperative cell salvage combined with a modified leucocyte depletion filter in metastatic spine tumour surgery. BMC Anesthesiol. 2022;22(1):217. Published 2022 Jul 12. https://doi.org/10.1186/s12871-022-01743-0.
32. Kumar N, Zaw AS, Khoo BL, Nandi S, Lai Z, Singh G, et al. Intraoperative cell salvage in metastatic spine tumour surgery reduces potential for reinfusion of viable cancer cells. Eur Spine J. 2016 Dec;25(12):4008–15. https://doi.org/10.1007/s00586-016-4478-4 PMID:26951173
33. Karczewski DM, Lema MJ, Glaves D. The efficiency of an autotransfusion system for tumor cell removal from blood salvaged during cancer surgery. Anesth Analg. 1994 Jun;78(6):1131–5. https://doi.org/10.1213/00000539-199406000-00017 PMID:8198270
34. Wu WW, Zhang WY, Zhang WH, Yang L, Deng XQ, Ou MC, et al. Survival analysis of intraoperative blood salvage for patients with malignancy disease: A PRISMA-compliant systematic review and meta-analysis. Medicine (Baltimore). 2019 Jul;98(27):e16040. https://doi.org/10.1097/MD.0000000000016040 PMID:31277097
35. Meybohm P, Choorapoikayil S, Wessels A, Herrmann E, Zacharowski K, Spahn DR. Washed cell salvage in surgical patients: A review and meta-analysis of prospective randomized trials under PRISMA [published correction appears in Medicine (Baltimore). 2018 Apr;97(17):e0640]. Medicine (Baltimore). 2016 Aug;95(31):e4490. https://doi.org/10.1097/MD.0000000000004490 PMID:27495095
36. Frietsch T, Steinbicker AU, Horn A, et al. Safety of Intraoperative Cell Salvage in Cancer Surgery: An Updated Meta-Analysis of the Current Literature. Transfus Med Hemother. 2022;49(3):143-157. Published 2022 May 11. https://doi.org/10.1159/000524538.
37. Waters JH, Yazer M, Chen YF, Kloke J. Blood salvage and cancer surgery: a meta-analysis of available studies. Transfusion. 2012 Oct;52(10):2167–73. https://doi.org/10.1111/j.1537-2995.2011.03555.x PMID:22321196
38. Frietsch T, Steinbicker AU, Hackbusch M, Nguyen XD, Dietrich G. Sicherheit der maschinellen Autotransfusion in der Tumorchirurgie : Systematisches Review mit Metaanalyse [Safety of cell salvage in tumor surgery : Systematic review with meta-analysis]. Anaesthesist. 2020 May;69(5):331–51. https://doi.org/10.1007/s00101-020-00751-4 PMID:32221621
39. Aijtink VJ, Rutten VC, Meijer BE, de Jong R, Isaac JL, Polak WG, et al. Safety of Intraoperative Blood Salvage During Liver Transplantation in Patients With Hepatocellular Carcinoma: A Systematic Review and Meta-analysis. Ann Surg. 2022 Aug;276(2):239–45. https://doi.org/10.1097/SLA.0000000000005476 PMID:36036990
40. Wang Z, Li S, Jia Y, et al. Clinical prognosis of intraoperative blood salvage autotransfusion in liver transplantation for hepatocellular carcinoma: A systematic review and meta-analysis. Front Oncol. 2022;12:985281. Published 2022 Oct 18. https://doi.org/10.3389/fonc.2022.985281.
41. Hinojosa-Gonzalez DE, Salgado-Garza G, Tellez-Garcia E, Escarcega-Bordagaray JA, Bueno-Gutierrez LC, Madrazo-Aguirre K, et al. Blood salvage and autotransfusion during orthotopic liver transplantation for hepatocellular carcinoma: A systematic review and meta-analysis. Clin Transplant. 2024 Jan;38(1):e15222. https://doi.org/10.1111/ctr.15222 PMID:38064310
42. Rajendran L, Lenet T, Shorr R, Abou Khalil J, Bertens KA, Balaa FK, et al. Should Cell Salvage Be Used in Liver Resection and Transplantation? A Systematic Review and Meta-analysis. Ann Surg. 2023 Mar;277(3):456–68. https://doi.org/10.1097/SLA.0000000000005612 PMID:35861339
43. Murtha-Lemekhova A, Fuchs J, Ritscher E, Hoffmann K. Effect of Autotransfusion in HCC Surgery on Survival and Recurrence: A Systematic Review and Meta-Analysis. Cancers (Basel). 2022;14(19):4837. Published 2022 Oct 3. https://doi.org/10.3390/cancers14194837.
44. Ferroni MC, Correa AF, Lyon TD, Davies BJ, Ost MC. The use of intraoperative cell salvage in urologic oncology. Rev Urol. 2017;19(2):89–96. https://doi.org/10.3909/riu0721 PMID:28959145
45. Li SL, Ye Y, Yuan XH. Association between Allogeneic or Autologous Blood Transfusion and Survival in Patients after Radical Prostatectomy: A Systematic Review and Meta-Analysis. PLoS One. 2017;12(1):e0171081. Published 2017 Jan 30. https://doi.org/10.1371/journal.pone.0171081.
46. Kumar N, Tan JY, Chen Z, Ravikumar N, Milavec H, Tan JH. Intraoperative cell-salvaged autologous blood transfusion is safe in metastatic spine tumour surgery: early outcomes of prospective clinical study. Eur Spine J. 2023 Jul;32(7):2493–502. https://doi.org/10.1007/s00586-023-07768-4 PMID:37191676
47. Shander A, Hardy JF, Ozawa S, Farmer SL, Hofmann A, Frank SM, et al.; Collaborators. A Global Definition of Patient Blood Management. Anesth Analg. 2022 Sep;135(3):476–88. https://doi.org/10.1213/ANE.0000000000005873 PMID:35147598
48. American Society of Anesthesiologists Task Force on Perioperative Blood Management. Practice guidelines for perioperative blood management: an updated report by the American Society of Anesthesiologists Task Force on Perioperative Blood Management*. Anesthesiology. 2015 Feb;122(2):241–75. https://doi.org/10.1097/ALN.0000000000000463 PMID:25545654
49. Kietaibl S, Ahmed A, Afshari A, Albaladejo P, Aldecoa C, Barauskas G, et al. Management of severe peri-operative bleeding: Guidelines from the European Society of Anaesthesiology and Intensive Care: Second update 2022. Eur J Anaesthesiol. 2023 Apr;40(4):226–304. https://doi.org/10.1097/EJA.0000000000001803 PMID:36855941
50. Kozek-Langenecker SA, Ahmed AB, Afshari A, Albaladejo P, Aldecoa C, Barauskas G, et al. Management of severe perioperative bleeding: guidelines from the European Society of Anaesthesiology: First update 2016. Eur J Anaesthesiol. 2017 Jun;34(6):332–95. https://doi.org/10.1097/EJA.0000000000000630 PMID:28459785
51. Kozek-Langenecker SA, Afshari A, Albaladejo P, Santullano CA, De Robertis E, Filipescu DC, et al. Management of severe perioperative bleeding: guidelines from the European Society of Anaesthesiology [published correction appears in Eur J Anaesthesiol. 2014 Apr;31(4):247]. Eur J Anaesthesiol. 2013 Jun;30(6):270–382. https://doi.org/10.1097/EJA.0b013e32835f4d5b PMID:23656742
52. Klein AA, Bailey CR, Charlton AJ, Evans E, Guckian-Fisher M, McCrossan R, et al. Association of Anaesthetists guidelines: cell salvage for peri-operative blood conservation 2018. Anaesthesia. 2018 Sep;73(9):1141–50. https://doi.org/10.1111/anae.14331 PMID:29989144
53. Leal-Noval SR, Muñoz M, Asuero M, Contreras E, García-Erce JA, Llau JV, et al.; Spanish Expert Panel on Alternatives to Allogeneic Blood Transfusion. Spanish Consensus Statement on alternatives to allogeneic blood transfusion: the 2013 update of the “Seville Document”. Blood Transfus. 2013 Oct;11(4):585–610. https://doi.org/10.2450/2013.0029-13 PMID:23867181
54. Ferraris VA, Brown JR, Despotis GJ, Hammon JW, Reece TB, Saha SP, et al.; Society of Thoracic Surgeons Blood Conservation Guideline Task Force; Society of Cardiovascular Anesthesiologists Special Task Force on Blood Transfusion; International Consortium for Evidence Based Perfusion. 2011 update to the Society of Thoracic Surgeons and the Society of Cardiovascular Anesthesiologists blood conservation clinical practice guidelines. Ann Thorac Surg. 2011 Mar;91(3):944–82. https://doi.org/10.1016/j.athoracsur.2010.11.078 PMID:21353044

 ORCID
ORCID