Pablo Tapia M.1* Edoardo Horlacher A.2, Francesca Astele G.3
Recibido: 03-08-2025
Aceptado: 02-09-2025
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 5 pp. 717-724|https://doi.org/10.25237/revchilanestv54n5-30
PDF|ePub|RIS
Anesthesia for fetal in-utero myelomeningocele repair
Abstract
Introduction: Open in-utero repair of myelomeningocele (MMC) reduces hydrocephalus and improves fetal motor function, yet the anaesthetic technique remains non-standardised. Objective: To describe the anaesthetic management of fetal MMC repair in a high-complexity hospital, emphasising drugs used, maternal haemodynamics and peri-operative complications. Methods: Retrospective case series (2014-2025) of 32 pregnant patients. Demographic data, anaesthetic technique, opioid/hypnotic doses, adjunct drugs, haemodynamic variables, surgical times and adverse events were recorded and expressed as mean ± SD or percentage. Results: Surgical success was 100%. General anaesthesia combined with a neuraxial technique predominated. Remifentanil was the opioid of choice for induction and maintenance (effect-site concentration 3.45.4 ng mL). Induction was achieved with propofol and maintenance with sevoflurane. No airway complications or haemodynamic events were observed. Total operative time was 210 ± 31 min; the neurosurgical phase 76 ± 24 min. Post-operative epidural analgesia was provided in 75% of patients, and only three required rescue analgesia. Conclusions: General anaesthesia combined with neuraxial block delivered adequate maternal-fetal anaesthesia and haemodynamic stability without relevant complications. Target-controlled remifentanil plus sevoflurane and titrated phenylephrine afforded optimal surgical conditions without compromising fetal safety. Prospective studies are needed to define the optimal anaesthetic regimen and standardise practice in fetal MMC surgery.
Resumen
Introducción: La reparación abierta in útero del mielomeningocele (MMC) reduce la hidrocefalia y mejora la función motora fetal; sin embargo, la técnica anestésica sigue sin estandarizarse. Objetivo: Describir el manejo anestésico de la reparación fetal de MMC en un hospital de alta complejidad, con énfasis en: fármacos utilizados, hemodinamia materna y complicaciones perioperatorias. Métodos: Serie retrospectiva (2014-2025) de 32 gestantes. Se consigna los datos demográficos, la técnica anestésica, las dosis de opioides/hipnóticos, los coadyuvantes, las variables hemodinámicas, los tiempos quirúrgicos y los eventos adversos. Los resultados se expresan como media ± DE o porcentaje. Resultados: Se reporta una tasa de éxito del 100% de los procedimientos quirúrgicos. La anestesia general asociada a técnica neuraxial mostró predominio. Remifentanilo fue el opioide de elección para inducción y mantención (rango entre 3,4 y 5,4 ng mL). La inducción anestésica se realizó con propofol y la mantención con sevofluorano. No se observaron complicaciones de la vía aérea ni eventos hemodinámicos. Duración quirúrgica total 210 ± 31 min; fase neuroquirúrgica 76 ± 24 min. El 75% recibió analgesia epidural posoperatoria y solo tres pacientes requirieron rescate analgésico. Conclusiones: La combinación de anestesia general con neuraxial proporcionó anestesia maternofetal adecuada y estabilidad hemodiná- mica sin complicaciones relevantes. El uso de remifentanilo en TCI en conjunto con sevofluorane y fenilefrina titulada permitieron la reparación del defecto aportando óptimas condiciones sin comprometer la seguridad fetal. Se precisan estudios prospectivos para definir el esquema óptimo y uniformar la práctica en cirugía fetal de MMC.
-
Introducción
La espina bífida (EB) es una anomalía congénita del tubo neural caracterizada por un defecto en su cierre, proceso que normalmente ocurre entre la 3a y 4a semana de gestación. Constituye un espectro de gravedad variable, que incluye espina bífida oculta, meningocele, mielomeningocele (MMC o espina bífida abierta) y raquisquisis[1],[2].
En el MMC existe una fusión incompleta de los arcos neurales y ausencia de cierre de los planos óseo, muscular y cutáneo, lo que condiciona protrusión y exposición de las meninges y del tejido neural (médula espinal y raíces nerviosas)[1]. La pérdida de líquido cefalorraquídeo (LCR) a través del defecto favorece el descenso del tronco encefálico y la malformación de Chiari tipo II, caracterizada por una fosa posterior y un cuarto ventrículo pequeños, herniación de amígdalas cerebelosas, del vermis y del tronco hacia el foramen magno, con alteración del flujo de LCR y desarrollo de hidrocefalia[2].
Las complicaciones se relacionan con el nivel y la extensión de la lesión e incluyen déficit motor y sensitivo por debajo del nivel afectado, disfunción vesical e intestinal, disfunción sexual, alteraciones cognitivas, hidrocefalia, médula anclada y manifestaciones vinculadas a la malformación de Chiari tipo II que incluye apnea/hipoventilación central, disfunción oromotora, parálisis de cuerdas vocales y trastornos de la deglución[1].
El MMC es un defecto del tubo neural no letal, que afecta a 4,4 casos por cada 10.000 nacidos vivos[3]. A pesar de que su incidencia ha disminuido en las últimas décadas con la su- plementación materna de ácido fólico, sigue siendo la forma más común de espina bífida. Su manejo histórico consiste en el cierre quirúrgico del defecto después del nacimiento, con el objetivo de cubrir la médula expuesta y minimizar el riesgo de infección; no obstante, esta corrección posnatal no revierte el daño neurológico prenatal ni previene la herniación del rombencéfalo ni la hidrocefalia asociada. Con el fin de reducir la carga de cirugías posteriores, las complicaciones médicas y mejorar la calidad de vida, hace más de dos décadas se comenzó a investigar el cierre prenatal del defecto[4]. Tras resultados alentadores en modelos animales y series clínicas iniciales, se llevó a cabo el ensayo clínico aleatorizado “Management of Myelomeningocele Study” (MOMS), desarrollado por tres centros de Estados Unidos y publicado en 2011[5]. El MOMS demostró que la reparación fetal antes de las 26 semanas de gestación puede realizarse con seguridad materno-fetal aceptable y se asocia a beneficios significativos: menor necesidad de derivación ventriculoperitoneal, reducción de la herniación cerebelosa y mejor función motora al año de vida[4],[5]. Estos resultados se explican, en parte, por la reversión del descenso amigdaliano y el desarrollo más adecuado de la fosa posterior craneal tras el cierre temprano[5].
A raíz de los hallazgos del estudio MOMS, Chile inició su experiencia en cirugía fetal abierta de MMC en 2011, cuando un equipo de la Clínica Las Condes (CLC) realizó la primera intervención del país. Poco después, el Hospital Regional de Rancagua se convirtió en el centro pionero dentro del sistema público[2]. En 2014, especialistas del Hospital Carlos Van Buren efectuaron la primera cirugía en la Región de Valparaíso y, hasta la fecha, han realizado más de 30 procedimientos, situando a este establecimiento entre los de mayor experiencia nacional.
No existe un protocolo anestésico universal para la reparación fetal del mielomeningocele. Las guías internacionales[6] reconocen esta heterogeneidad y recomiendan adaptar la técnica a los recursos de cada centro. En Chile, los tres centros con mayor experiencia (Clínica Las Condes, Hospital Regional de Rancagua y Hospital Carlos Van Buren) probablemente emplean esquemas distintos de anestesia reflejando esa misma variabilidad.
-
Materiales y Métodos
El presente estudio, previo a su ejecución, contó con la aprobación del Comité de Ética Científica del Servicio de Salud Valparaíso San Antonio, acreditado por el Ministerio de Salud en conformidad al Decreto 114 y la Ley 20.120 de la República de Chile.
Se realizó un estudio observacional descriptivo que incluyó a mujeres embarazadas con diagnóstico imagenológico antenatal de disrafia espinal o mielomeningocele fetal, sometidas a intervención quirúrgica de reparación in útero de mielomeningocele fetal entre los años 2014 y 2025 en el Hospital Carlos Van Buren de Valparaíso.
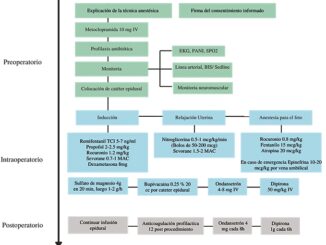
La reparación prenatal de MMC fetal en este centro se realiza utilizando los siguientes criterios: en embarazos únicos, diagnóstico de mielomeningocele que compromete entre los segmentos T1 y S1, presencia de malformación fetal de Arnold Chiari, edad gestacional entre 24 y 27 semanas y edad materna > 18 años. Se excluyen aquellos con anomalía fetal no relacionada con MMC, cifosis o escoliosis fetal grave, riesgo de parto prematuro (medición ecográfica de cuello uterino y antecedentes de parto prematuro) y patología materna que contraindique cirugía.
El protocolo de manejo perioperatorio obstétrico local contempla: maduración pulmonar fetal con corticoides (betametasona), tocolisis (indometacina, fenoterol y nifedipino), neuro- protección fetal y tocolisis (sulfato de magnesio), prevención de parto prematuro y profilaxis antibiótica (Tabla 1).
La reparación abierta in útero del mielomeningocele se realiza bajo anestesia general materna. Tras una laparotomía transversa o media, se exterioriza el útero, se confirma eco- gráficamente la posición fetal y placentaria y se selecciona el sitio de la incisión. La histerotomía se inicia entre dos puntos de tracción; una vez identificadas las membranas amnióticas, se abren y se suturan a todo el espesor miometrial. El feto se posiciona exponiendo el defecto, manteniendo infusión continua de solución salina 0,9% tibia para preservar el volumen y la temperatura intrauterinos.
El cierre del mielomeningocele se efectúa bajo magnificación. Se realiza una liberación cortante de la placoda neural del tejido circundante y se reduce al canal medular, se identifica y se realiza la aposición de la duramadre y durorrafia con sutura reabsorbible continua. Cuando existe un defecto amplio, se coloca injerto dural. La piel se cierra con monofilamento, con o sin incisiones de descarga. Completada la reparación, se practica histerorrafia en tres planos y, con el último punto, se instila solución salina 0,9% isotérmica hasta alcanzar un índice de líquido amniótico normal. Se realiza el cierre habitual de peritoneo, fascia y piel. Durante todo el procedimiento se monito- riza la frecuencia cardíaca y el bienestar fetal ecográficamente. La paciente ingresa posteriormente a una unidad de paciente crítico, vigilando la actividad uterina y el bienestar fetal.
La técnica anestésica utilizada en nuestro centro en la actualidad se inicia con la instalación de un catéter peridural fundamentalmente para manejo analgésico durante cierre laparotomía y el período posoperatorio, seguido de anestesia general basada en remifentanilo en infusión controlada por objetivo (TCI) y gases halogenados (sevorane). Se utiliza como agente inductor propofol y como relajante muscular succinilcolina y/o rocuronio. El procedimiento se complementa con tocolisis farmacológica mediante infusión de sulfato de magnesio y administración de bolos de nitroglicerina; el efecto tocolítico es potenciado con el uso de halogenados según requerimiento[10]. Como vasopresor se utiliza fenilefrina titulada con el objeto de mantener la presión arterial materna y garantizar una adecuada perfusión útero-placentaria[7]. La madre se monitoriza con oximetría de pulso, presión arterial invasiva, electrocardiografía, temperatura esofágica, profundidad anestésica, dióxido de carbono espirado (ETCO2), analizador de gases y diuresis. Las guías NAFTNet recomiendan individualizar el protocolo según los recursos de cada centro, manteniendo siempre anestesia materno-fetal adecuada, tocolisis activa y control hemodinámi- co estricto mediante un equipo multidisciplinario experimentado[6].
De cada historia clínica se obtuvo los datos demográficos y clínicos maternos (edad, paridad, IMC y comorbilidades), la técnica anestésica empleada (general, general-espinal, generalepidural o general-combinada), la dosis mínima y máxima de remifentanilo administrado por TCI, la concentración alveolar mínima (CAM) de sevoflurano y el uso de fármacos concomitantes (propofol, bloqueadores neuromusculares, vasopresores, entre otros). Se consignaron los tiempos quirúrgicos, el volumen total de fluidoterapia (solución fisiológica, ringer lactato u otras) y las variables hemodinámicas intraoperatorias, incluida la presión arterial media, sistólica y diastólica (valores mínimos y máximos), la frecuencia cardíaca y el ETCO2. La profundidad anestésica se monitoriza mediante electroencefalografía procesada continua (SEDline®) y medido en Patient State Index (PSI).
Tres revisores independientes extrajeron los datos de historias clínicas y registros anestésicos en una planilla electrónica estandarizada; las discrepancias se resolvieron por consenso. Se aplicó estadística descriptiva, expresando las variables continuas como medias ± DE, y las categóricas como frecuencias y porcentajes. Se excluyeron dos registros anestésicos incompletos para las variables específicas de anestesia.
-
Resultados
-
Características de las participantes
La serie incluyó 32 binomios materno-fetales, en los cuales se completó con éxito la corrección in útero del mielomeningocele el mismo día de la intervención. La edad materna media fue de 27,5 ± 6,1 años y 15 gestantes (45%) eran primigestas. La cirugía se realizó, en promedio, a las 26 ± 0,7 semanas de gestación.
En relación con las comorbilidades, 12 gestantes (37%) no presentaban patologías previas. La afección más frecuente fue la obesidad, observada en 15 mujeres (47%), seguida de hipertensión arterial crónica en 4 (13%) e hipotiroidismo en 3 (9%).
Tabla 1. Protocolo de manejo perioperatorio obstétrico para cirugía de corrección in útero de mielomeningocele fetal
| Maduración corticoidal fetal | Betametasona 12 mg intramuscular cada 24 h por 2 veces
Maduración inicial a las 24 semanas. Dosis de rescate previa a cesárea electiva y/o de urgencia Indometacina 50 mg vía oral 2-4 h previo a cirugía, luego 50 mg cada 6 h por las primeras 24 h. Luego 25 mg cada 6 h hasta completar 5 días |
| Tocolisis | Fenoterol en BIC a 20 cc/h por 24 h (preparar 4 ampollas de 0,5 mg en 500 mL de solución glucosada). Iniciar al momento del término de la cirugía y mantenerlo por 24 h durante la recuperación
Nifedipino 10-20 mg vía oral cada 6-8 h. Iniciarlo una vez terminado el ciclo de indometacina. Mantenerlo hasta el momento de la interrupción del embarazo |
| Neuroprotección fetal y tocolisis | Sulfato de magnesio 5 g en bolo endovenoso al momento de la cirugía, luego mantener a 1 g/h por 24 h en infusión continua |
| Prevención de parto prematuro | Progesterona natural micronizada 200 mg vía oral o vaginal. Iniciarlo durante el primer día posoperatorio hasta el momento de la interrupción del embarazo |
| Antibiótico | Cefazolina 1g cada 8 h por 3 días |
Otras enfermedades se registraron con menor frecuencia y se detallan en la Tabla 2.
Respecto a los datos antropométricos, la talla media fue de 1,60 ± 0,10 m y el peso promedio de 75,5 ± 15,5 kg, lo que corresponde a un IMC promedio de 30,0 ± 5,3 kg-m 2 (Tabla 2).
Tabla 2. Características generales de la población (n = 32)
| Característica | Valor |
| Edad materna (años) | 27,9 ± 6,1 |
| Edad gestacional (semanas) | 26,0 ± 0,7 |
| Nuliparidad, n | (%) 15 (46,9) |
| Peso materno (kg) | 75,5 ± 15,5 |
| Talla materna (m) | 1,60 ± 0,10 |
| IMC (kg-m-2) | 30,0 ± 5,3 |
| Comorbilidades | n (%) |
| – Obesidad | 15 (46,9) |
| – HTA Crónica | 4 (12,5) |
| – Hipotiroidismo | 3 (9,4) |
| – Asma Bronquial | 2 (6,3) |
| – Resistencia a la insulina | 1 (3,1) |
| – Diabetes Mellitus | 1 (3,1) |
| – Trastorno Depresivo | 1 (3,1) |
| – Trastorno de Pánico | 1 (3,1) |
| – Epilepsia | 1 (3,1) |
| – Déficit Cognitivo | 1 (3,1) |
| – Enfermedad de Chagas | 1 (3,1) |
| – Anemia | 1 (3,1) |
| – Tabaquismo Crónico | 1 (3,1) |
| – Miomatosis Uterina | 1 (3,1) |
| – ITU | 1 (3,1) |
| Los datos se expresan como media ± desviación estándar (DE) o número (porcentaje); IMC: índice de masa corporal (peso/estatura2). Los porcentajes de comorbilidades se calculan sobre el total de gestantes (n = 32). La suma de porcentajes excede 100% debido a comorbilidades múltiples. | |
-
Características generales de la anestesia
En 17 intervenciones (57%) se empleó anestesia general con técnica neuroaxial combinada (epidural + espinal). La asociación de anestesia general con espinal única se utilizó en 11 casos (37%). Solo un procedimiento se realizó con anestesia general más epidural y otro exclusivamente con anestesia general, sin abordaje neuraxial. Se excluyeron 2 casos del análisis de las variables anestésicas por la ausencia de los protocolos anestésicos en las fichas clínicas. Se describen estos resultados en la Tabla 3.
Todas las pacientes fueron monitorizadas con electrocardiograma, presión arterial no invasiva, pulsioximetría, capnografía y diuresis. En 19 cirugías (58%) se añadieron temperatura esofágica, presión arterial invasiva y electroencefalografía procesada mediante Patient State Index (SedLine®, Masimo).
El manejo de la vía aérea se efectuó principalmente mediante secuencia de intubación rápida, utilizada en 22 procedimientos (73%). El dispositivo más empleado fue el videolaringoscopio Storz C-MAC® con hoja Macintosh convencional, presente en 19 casos (63%), seguido de laringoscopia directa con hoja Macintosh en 9 (30%) y videolaringoscopia Storz C-MAC® D- Blade en 1 (3%). La visualización de la glotis fue óptima (Cormack-Lehane I) en 25 pacientes (83%); se registraron grados superiores en 2 (6%) y en 3 casos no se consignó el grado. Un registro anestésico no especificó la técnica empleada. No se documentaron complicaciones relacionadas con el manejo de la vía aérea.
-
Inducción y mantención de la Anestesia General
En todas las intervenciones, la inducción se realizó con propofol con una dosis media de 2,2 ± 0,5 mg-kg 1. Remifentanilo fue el opioide de elección para inducción y mantenimiento, administrado por infusión TCI (modelo Minto, dispositivo Base Primea SP de Fresenius Kabi) con una concentración objetivo efecto (Ce) de 3,9 ± 0,6 ng-mU durante la inducción. En la fase de mantención, la Ce osciló entre 3,4 ± 0,8 ng-mL’i (mínima) y 5,4 ± 0,8 ng-mL–i (máxima); durante el período neu- roquirúrgico la Ce-máx promedio fue de 5,1 ± 0,7 ng-mL–i. Como relajante neuromuscular en la inducción se utilizó ro- curonio en 28 casos (0,8 ± 0,2 mg-kg–i) y succinilcolina en los dos restantes (0,9 y 1 mg-kg–i). Estos resultados se detallan en la Tabla 4. La mantención anestésica incluyó sevoflurano en todos los pacientes, aunque la CAM o la concentración de sevoflurano en porcentaje (Vol%) se consignó de manera inconsistente en los registros.
-
Técnica Anestésica Neuroaxial
Se intentó una técnica anestésica peridural en 19 pacientes. Se utilizó trocar Tuohy de 16 G en 10 casos y de 18 G en 9. La distancia al espacio peridural fue de 4,0-5,9 cm en 10 procedimientos (60%), 6,0-6,9 cm en 4 (23%) y 7,0-7,9 cm en 3 (17%). El catéter se avanzó 2-6 cm dentro del espacio en 14 pacientes (82%) y > 6 cm en 3 (18%). Entre las complicaciones destacan la necesidad de múltiples intentos en cinco pacientes. En uno de estos 5 pacientes se desiste en utilizar esta técnica. En un paciente se documentó una localización intravascular del catéter y en un paciente se documentó el desplazamiento del catéter; en ambos casos se reinstaló el catéter previo al despertar de la paciente. Se describen estos resultados en la Tabla 5.
La anestesia espinal se empleó en 28 procedimientos: 11 mediante anestesia general más anestesia espinal y 17 dentro de una técnica combinada espinal-peridural. Para la combinación se utilizó aguja lápiz 27 G de 119 mm, mientras que en la raquianestesia sola se empleó aguja lápiz 27 G de 90 mm.
Tabla 3. Técnicas anestésicas empleadas (n = 32)
| Técnica anestésica (GA = anestesia general) | n (%) |
| GA + combinada espinal-epidural (CSE) | 17 (53,1) |
| GA + espinal | 11 (34,4) |
| GA + epidural | 1 (3,1) |
| GA sola | 1 (3,1) |
| Registros anestésicos incompletos* | 2 (6,3) |
| *Dos historias sin detalles completos para registros anestésicos. | |
Tabla 4. Analgesia intratecal y peridural
| Intratecal (n = 28) | |
| Morfina intratecal usada, n | 28 |
| Dosis morfina (pg^kg i), media ± DE | 1,3 ± 0,3 |
| Dosis absoluta más frecuente (pg) | 100 |
| Bupivacaína 0,75 % añadida | 2 casos (5,25 mg y 3 mg) |
| Fentanilo intratecal adicional | 1 caso (20 pg) |
| Peridural (n = 18) | |
| Bolo pre-despertar únicamente, n | 2 |
| Bolo pre-despertar + infusión/bolos programados posoperatorios, n | 15 |
| Solo bolo programado posoperatorio, n 1 | |
| Bolos peridurales pre-despertar (n = 17) | |
| Concentración bupivacaína (%), media ± DE | 0,125 ± 0,04 |
| Volumen (mL), media ± DE | 13,1 ± 3,7 |
| Analgesia peridural posoperatoria | |
| Infusión continua, n | 12 |
| Bupivacaína infusión (%), media ± DE | 0,10 ± 0,02 |
| Velocidad (mL-h’i), media ± DE | 5,25 ± 0,9 |
| PIEB (bolo programado), n
– Bupivacaína 0,1%, bolo 4 ml cada 30 minutos – Bupivacaína 0,08% 4 ml cada 90 minutos – Bupivacaína 0,078% 9 ml cada 45 minutos |
3 |
| PCEA (infusión + bolo), n 1
– Bupivacaína 0,1%, Infusión 1 ml/h, bolo 4 ml, Lockout 40 minutos |
|
| Duración del catéter (h) | 24 – 48 |
PCEA: Analgesia peridural controlada por la paciente; PIEB: Bolo peridural programado intermitente.
Tabla 5. Signos vitales intraoperatorios (n = 30)
| Variable | Mínimo | Máximo | Unidad |
| Presión arterial media (PAM) | 60 ± 6 | 99 ± 9 | mmHg |
| Presión arterial sistólica (PAS) | 89 ± 7 | 138 ± 11 | mmHg |
| Presión arterial diastólica (PAD) | 45 ± 6 | 79 ± 10 | mmHg |
| Frecuencia cardíaca materna | 62 ± 5 | 100 ± 16 | lpm |
| SpO2 | 97 ± 1 | 99 ± 1 | % |
| ETCO2 | 30 ± 3 | 36 ± 3 | mmHg |
| Temperatura | 36 | 37 | °C |
| Profundidad anestésica (PSI) | 28 ± 7 | 31 ± 18 | – |
| Frecuencia cardíaca fetal | 115 ± 14 | 150 ± 9 | lpm |
Valores corresponden a promedios ± desviación estandar de los mínimos y máximos; PSI: Patient State Index (EEG procesado).
-
Analgesia espinal
En 28 intervenciones se administró morfina intratecal, con una dosis media de 1,3 ± 0,3 pg-kg1, siendo 100 pg la cantidad más utilizada. En dos pacientes, la morfina se combinó con bupivacaína hiperbárica al 0,75% (5,25 mg y 3 mg, respectivamente). En un tercer caso se añadió fentanilo 20 pg junto con bupivacaína 0,75% y morfina intratecal.
-
Analgesia peridural
La analgesia peridural se empleó en 19 pacientes. En dos, se administró únicamente un bolo antes del despertar, sin infusión ni bolos posteriores. En 15, se aplicó un bolo inicial seguido de infusión continua o bolos programados en el posoperatorio, mientras que un caso recibió sólo un bolo programado tras el despertar.
Los bolos peridurales contenían bupivacaína a una concentración media de 0,125 ± 0,04% (rango 0,075%-0,2%), siendo la más utilizada el 0,1%, con un volumen promedio de 13,1 ± 3,7 mL (volumen más frecuente: 15 mL).
Para analgesia peridural posoperatoria se instauró infusión continua en 12 pacientes, siempre con bupivacaína 0,1 ± 0,02%, a una velocidad media de 5,25 ± 0,9 mL h-1 (la más habitual: 6 mL h–i). Además, se utilizó PCEA en cuatro casos: tres con bolos programados y uno con infusión continua más bolos. La duración de la analgesia peridural, hasta la retirada del catéter, osciló entre 24 y 48 h.
Los resultados en relación con el uso de analgesia neuroaxial se encuentran en Tabla 6.
-
Medicamentos utilizados en el intraoperatorio
Todos los procedimientos siguieron el protocolo del Departamento de Obstetricia y Ginecología local, que contempla sulfato de magnesio 5 g en bolo IV previo a la cirugía seguido de infusión continua a 1 g h–1 durante 24 h. Los fármacos coadyuvantes más frecuentes fueron dexametasona (70%), paracetamol (36%), metamizol (24%), ondansetrón (21%), sugammadex (15%) y ranitidina (15%). Otros medicamentos como metoclopramida, neostigmina, fenoterol, nitroglicerina y ketoprofeno se emplearon con menor frecuencia.
La fluidoterapia se basó en solución fisiológica al 0,9% en todos los casos. Adicionalmente, se administró ringer lactato en 2 pacientes, solución glucosalina isotónica en otros 2 y hidro- xietilalmidón al 6% (Voluven®) en 1. El volumen medio total fue de 1.959 ± 977 mL, equivalente a 7,8 ± 4,5 mL kg–1 h–1.
Todos los pacientes requirieron al menos un vasopresor. La fenilefrina se utilizó en 30 casos: goteo intermitente (“Feni- drip”) en 27 (dosis total 4.215 ± 2.852 pg) e infusión continua en 3 (0,1-0,6 pg kg–i min–i). La efedrina se empleó en 19 intervenciones (30 ± 18 mg) y la atropina en 3 (0,4 mg).
Analgesia posoperatoria
Analgesia no opioide
Durante las primeras 24 h, 26 pacientes (81%) recibieron analgésicos intravenosos. El esquema más habitual fue paracetamol 1 g cada 6-8 h (15 pacientes, 47%). Tres pacientes (9%) recibieron metamizol 1 g cada 6-8 h y seis (19%) una infusión continua de metamizol 4-6 g, sola o combinada con ketoprofeno 200-300 mg y/o tramadol 200 mg. Ocho pacientes (25%) no requirieron analgesia IV no opioide en ese intervalo inicial. A partir del primer día, cuatro pacientes (13%) iniciaron paracetamol oral 1 g cada 8-12 h; tras 24 h-, el número se elevó a 12 (38%).
Analgesia opioide
Tres pacientes recibieron morfina intravenosa en infusión continua (0,4-1,6 mg h-1). En otros dos casos se empleó tramadol 200 mg en infusión continua durante 24 h: uno mezclado con metamizol y ketoprofeno, y otro únicamente con metamizol.
Analgesia de rescate
Solo tres pacientes necesitaron rescate analgésico en las primeras 48 h. Una de ellas requirió 5 mg de morfina IV; las otras dos recibieron metamizol 1 g.
Signos vitales
Durante la intervención se registraron, para cada paciente, los valores máximos y mínimos de las principales variables he- modinámicas y ventilatorias, lo que permite apreciar la amplitud de sus oscilaciones. La presión arterial media se mantuvo entre un mínimo de 60 ± 6 mmHg y un máximo de 99 ± 9 mmHg; las presiones sistólica y diastólica oscilaron, respectivamente, entre 89 ± 7 y 138 ± 11 mmHg y entre 45 ± 6 y 79 ± 10 mmHg. La frecuencia cardíaca materna varió de 62 ± 5 a 100 ± 16 lpm, mientras que la saturación de oxígeno con mínimos de 97 ± 1% y máximos de 99 ± 1%. El ETCO2 se situó entre 30 ± 3 y 36 ± 3 mmHg y la temperatura corporal entre 36 °C y 37 °C. El Patient State Index (PSI) mostró valores de 28 ± 7 (mínimo) y 31 ± 18 (máximo), sin episodios de burst suppression registrados. Por último, la frecuencia cardíaca fetal se mantuvo con un rango de 115 ± 14 a 150 ± 9 lpm, sin bradicardia ni taquicardia sostenida.
Características de la cirugía
La duración total de la cirugía fue, en promedio, 210 ± 31 min. El tiempo específico neuroquirúrgico, registrado en 27 procedimientos, promedió 76 ± 24 min. En todos los casos se completó la reparación del defecto y no se observaron complicaciones intraoperatorias de índole gineco-obstétrica ni neuro- quirúrgica.
Tabla 6. Duración quirúrgica (n = 32)
| Parámetro | Valor |
| Duración total (min), media ± DE | 210 ± 31 |
| Duración fase neuroquirúrgica (min), media ± DE* | 76 ± 24 |
| Cierre del defecto completado | n = 32 (100%) |
| Complicaciones intraoperatorias (gineco-obstétricas o neuroquirúrgicas) | 0 |
*Registrado en 27 procedimientos (n con dato explícito).
-
Discusión
En esta serie descriptiva, que incluyó las reparaciones abiertas in útero de MMC realizadas entre 2014 y 2025 en el Hospital Carlos Van Buren, se identificaron 32 binomios maternofetales. La serie estuvo dominada por primigestas menores de 30 años, intervenidas entre las semanas 24 y 27 de gestación, perfil demográfico que reproduce lo comunicado por centros internacionales[5]. La particularidad local fue un IMC promedio mayor, hallazgo coherente con la elevada prevalencia de sobrepeso y obesidad en mujeres chilenas en edad fértil.
La técnica anestésica para la corrección in útero de mielomeningocele continúa siendo motivo de debate, dado que no se ha establecido un protocolo estandarizado que demuestre superioridad en términos de resultados materno-fetales. En nuestro centro, se ha observado una evolución hacia una técnica que integra la anestesia general con remifentanilo y sevoflurano, junto a anestesia neuroaxial combinada (espinal- peridural). Esta estrategia busca optimizar el plano anestésico tanto materno como fetal durante la intervención, además de mejorar el manejo del dolor posoperatorio.
El remifentanilo, administrado en infusión TCI, es el opioide preferido para la reparación fetal del mielomeningocele debido a su rápido paso placentario (relación feto/madre » 0,7-0,8) y semivida contexto-sensitiva < 5 min, lo que brinda analgesia e inmovilidad fetales con mínima acumulación materna[7],[8]. Centros de alto volumen, como el Texas Children’s Fetal Center, emplean sistemáticamente Ce 2-3 ng mL-1 en la inducción y Ce 5-6 ng mL-1 durante la fase neuroquirúrgica, junto a sevoflu- rano 0,8-1 MAC, reportando hemodinamia estable y escasos eventos adversos[9].
El sevoflurano continúa siendo el anestésico inhalatorio de elección en la reparación fetal del mielomeningocele por su bajo coeficiente sangre/gas (~0,7), que facilita una rápida titulación y una relajación uterina eficaz con 0,8-1,2 MAC[10]. Su rápida transferencia placentaria y eliminación aporta anestesia fetal complementaria y minimiza la exposición fetal respectiva- mente[1]. Centros de alto volumen, como el Texas Children’s Fetal Center, lo combinan sistemáticamente con remifentanilo, reportando estabilidad hemodinámica materna y escasos eventos adversos[9].
La analgesia peridural posoperatoria también fue más frecuente a partir de 2019. Estudios recientes en cirugía fetal han mostrado que la analgesia regional, incluida la epidural, y los protocolos multimodales se asocian con menor consumo de opioides y menor necesidad de rescates analgésicos durante la hospitalización[11],[12]. En cuanto a la analgesia espinal, la morfina intratecal se utilizó de forma rutinaria, en ocasiones a dosis superiores a las 100-150 pg. Si bien esta estrategia pretende proporcionar analgesia efectiva materno-fetal, la evidencia que respalda su eficacia en el contexto de la cirugía fetal sigue siendo limitada[13].
La morfina intratecal se utiliza en varios tipos de cirugía incluyendo las cesáreas donde ha demostrado varios beneficios. Las dosis habituales de morfina intratecal en mujeres embarazadas oscilan entre 100-150 pg, rango que proporciona analgesia por 12-24 h y disminuye tanto el consumo de opioides sistémicos como la necesidad de rescates durante la hospita- lización[14]. Por otro lado, el riesgo de depresión respiratoria, propia del uso de morfina intratecal, ha sido cuestionado en embarazadas debido al perfil protector de la progesterona en altos niveles en esta población[15]. En algunos centros de reparación de mielomeningocele se utiliza morfina epidural o de manera intravenosa, lo cual difiere de la técnica anestésica de nuestro centro. En el ámbito específico de la cirugía fetal, la evidencia sigue siendo limitada lo que subraya la necesidad de estudios prospectivos que evalúen la morfina neuroaxial o sisté- mica en la seguridad materno-fetal y su impacto en la recuperación postoperatoria.
Entre los fármacos vasoactivos administrados predominó la fenilefrina. Aunque sigue siendo el vasopresor de referencia
para prevenir o tratar la hipotensión asociada a anestesia neuroaxial en obstetricia, no existe consenso sobre el agente óptimo en gestantes sometidas a cirugía fetal. Metaanálisis recientes indican que la noradrenalina mantiene la presión arterial con eficacia similar, pero con menor incidencia de bradicardia materna, y sin diferencias en el estado ácido-base neonatal, presentándola como una alternativa válida[16],[17]. Sin embargo, la evidencia procede casi exclusivamente de cesáreas electivas y todavía no se ha evaluado de forma específica en la corrección in útero del mielomeningocele, por lo que su posible ventaja en este contexto requiere investigación prospectiva.
Entre las variables fisiológicas monitorizadas se constató, en la mayoría de los casos, una estabilidad hemodinámica mantenida gracias al uso protocolizado de vasopresores, en línea con las recomendaciones más recientes para cirugía fetal[6]. El índice de profundidad anestésica no mostró episodios de burstsuppression ni de superficialización, hallazgo concordante con series que describen baja incidencia de este patrón cuando se titulan los agentes mediante EEG procesado[18].
Un aspecto que merece investigación futura es la variabilidad de la frecuencia cardíaca fetal frente a los estímulos quirúrgicos y anestésicos. La formación de los circuitos nocicep- tivos fetales ocurre entre la semana 7 y 10 de gestación, no existiendo un método estandarizado para evaluar el dolor fetal de manera objetiva[19],[20]. Con base en esta incertidumbre, nuestro equipo considera que el inicio de la fase neuroquirúr- gica representa el estímulo nociceptivo más relevante para el feto; por ello, la dosis más alta de remifentanilo se administra en ese período, práctica descrita también por otros centros de referencia[9].
Nuestro estudio presenta las limitaciones propias de un diseño retrospectivo y descriptivo. En primer lugar, la recolección de datos se restringe a la información consignada en las fichas clínicas; en consecuencia, la técnica anestésica, las variables intraoperatorias y las dosis de fármacos (p. ej., remifentanilo, MAC de sevoflurano, vasopresores) no siempre se registraron de manera sistemática. En segundo lugar, la inexistencia de un protocolo quirúrgico-anestésico estandarizado hizo que la selección de la técnica y la dosificación de los agentes dependieran de la experiencia y preferencias del anestesiólogo a cargo, lo que introduce una variabilidad que dificulta la comparación entre casos.
Aun con sus limitaciones, este estudio evidencia la considerable variabilidad de las técnicas anestésicas empleadas en esta cirugía en este centro hospitalario. Nuestro propósito fue descriptivo; no pretendemos determinar la superioridad de un método específico. Demostrar diferencias reales entre técnicas requeriría un ensayo clínico aleatorizado, con un tamaño mues- tral mayor y una técnica anestésica estrictamente protocolizada.
Agradecimientos: Agradecemos al Departamento de Obstetricia-Ginecología y de Neurocirugía del Hospital Carlos Van Buren, por facilitar los protocolos locales del manejo perioperatorio.
Fuente de financiamiento: No se contó con fuentes de financiamiento.
Declaración conflicto de intereses: Autores declaran no tener conflicto de intereses.
Declaración de originalidad: El estudio no ha sido enviado a otra revista científica nacional o internacional.
Declaración de ética: Se establece que los autores respetaron durante su investigación los principios éticos de la Asociación Médica Mundial y la Declaración de Helsinki.
-
Referencias
1. Ferschl M, Ball R, Lee H, Rollins MD. Anesthesia for in utero repair of myelomeningocele. Anesthesiology. 2013 May;118(5):1211–23. https://doi.org/10.1097/ALN.0b013e31828ea597 PMID:23508219
2. Devoto G, Tapia M. Cirugía prenatal del mielomeningocele: un nuevo desafío. Revista Chilena Anestesiología. 2016;45:6–15.
3. Arroyo J, Campos D, Alarcón P, Suazo J, Aldana L, Solervicens A, et al. Aspectos clínicos y sociodemográficos de pacientes portadores de mielomeningocele. Andes Pediatr. 2025;96(1):74–82. https://doi.org/10.32641/andespediatr.v96i1.5327.
4. Heuer GG, Moldenhauer JS, Scott Adzick N. Prenatal surgery for myelomeningocele: review of the literature and future directions. Childs Nerv Syst. 2017 Jul;33(7):1149–55. https://doi.org/10.1007/s00381-017-3440-z PMID:28516217
5. Adzick NS, Thom EA, Spong CY, Brock JW 3rd, Burrows PK, Johnson MP, et al.; MOMS Investigators. A randomized trial of prenatal versus postnatal repair of myelomeningocele. N Engl J Med. 2011 Mar;364(11):993–1004. https://doi.org/10.1056/NEJMoa1014379 PMID:21306277
6. Chatterjee D, Arendt KW, Moldenhauer JS, Olutoye OA, Parikh JM, Tran KM, et al. Anesthesia for Maternal-Fetal Interventions: A Consensus Statement From the American Society of Anesthesiologists Committees on Obstetric and Pediatric Anesthesiology and the North American Fetal Therapy Network. Anesth Analg. 2021 Apr;132(4):1164–73. https://doi.org/10.1213/ANE.0000000000005177 PMID:33048913
7. Nelson O, Lin EE. Anesthesia for fetal interventions: caring for mother and fetus prior to birth. J Anesth Transl Med. 2025;4(1):18–24. https://doi.org/10.1016/j.jatmed.2025.02.004.
8. Smith JA, Donepudi RV, Argoti PS, Giezentanner AL, Jain R, Boring N, et al. Exploring the pharmacokinetic profile of remifentanil in mid-trimester gestations undergoing fetal intervention procedures. Front Pharmacol. 2017 Jan;8:11. https://doi.org/10.3389/fphar.2017.00011 PMID:28174536
9. Goonasekera C, Skelton VA. Fetal safety during fetoscopic spina-bifida repair: anesthetic concerns. J Fetal Med. 2021;8(2):97–104. https://doi.org/10.1007/s40556-021-00301-x.
10. Naus CA, Mann DG, Andropoulos DB, Belfort MA, Sanz-Cortes M, Whitehead WE, et al. “This is how we do it” Maternal and fetal anesthetic management for fetoscopic myelomeningocele repairs: the Texas Children’s Fetal Center protocol. Int J Obstet Anesth. 2025 Feb;61:104316. https://doi.org/10.1016/j.ijoa.2024.104316 PMID:39721283
11. American Society of Anesthesiologists Task Force on Obstetric AnesthesiaSociety for Obstetric Anesthesia and Perinatology. Practice guidelines for obstetric anesthesia: an updated report. Anesthesiology. 2013;118(2):449–73. https://doi.org/10.1097/ALN.0b013e31828ea597 PMID:23263014
12. Nulens K, Kunpalin Y, Nijs K, Carvalho JC, Pollard L, Abbasi N, et al. Enhanced recovery after fetal spina bifida surgery: global practice. Ultrasound Obstet Gynecol. 2024 Nov;64(5):669–77. https://doi.org/10.1002/uog.27701 PMID:38764196
13. Porter AC, Behrendt NJ, Zaretsky MV, Liechty KW, Wood C, Chow F, et al. Continuous local bupivacaine wound infusion reduces oral opioid use for acute postoperative pain control following myelomeningocele repair. Am J Obstet Gynecol MFM. 2021 Mar;3(2):100296. https://doi.org/10.1016/j.ajogmf.2020.100296 PMID:33485023
14. Duci M, Pulvirenti R, Fascetti Leon F, Capolupo I, Veronese P, Gamba P, et al. Anesthesia for fetal operative procedures: A systematic review. Front Pain Res (Lausanne). 2022 Sep;3:935427. https://doi.org/10.3389/fpain.2022.935427 PMID:36246050
15. Herrera-Gómez PJ, Garzón JF. Intrathecal opioids and respiratory depression: Is it myth in obstetrics? Opioides intratecales y depresión respiratoria: ¿un mito en obstetricia? Rev Colomb Anestesiol. 2015;43(1):101–3. https://doi.org/10.1016/j.rca.2014.09.009.
16. Song J, Xu X, Li Q, Lu B, Yu X, Mu G. Norepinephrine versus phenylephrine for managing maternal hypotension during cesarean delivery under spinal anesthesia: a meta-analysis of maternal and neonatal outcomes. Signa Vitae. 2024;20(4):1–14. https://doi.org/10.22514/sv.2024.036.
17. Kinsella SM, Carvalho B, Dyer RA, Fernando R, McDonnell N, Mercier FJ, et al.; Consensus Statement Collaborators. International consensus statement on the management of hypotension with vasopressors during caesarean section under spinal anaesthesia. Anaesthesia. 2018 Jan;73(1):71–92. https://doi.org/10.1111/anae.14080 PMID:29090733
18. Pawar N, Barreto Chang OL. Burst suppression during general anesthesia and postoperative outcomes: mini review. Front Syst Neurosci. 2022 Jan;15:767489. https://doi.org/10.3389/fnsys.2021.767489 PMID:35069132
19. Lee SJ, Ralston HJ, Drey EA, Partridge JC, Rosen MA. Fetal pain: a systematic multidisciplinary review of the evidence. JAMA. 2005 Aug;294(8):947–54. https://doi.org/10.1001/jama.294.8.947 PMID:16118385
20. Thill B. The fetal pain paradox. Front Pain Res (Lausanne). 2023 Mar;4:1128530. https://doi.org/10.3389/fpain.2023.1128530 PMID:37025166

 ORCID
ORCID