Iván Prieto Vicente1,*, Pilar Hernández Pinto1, María Isabel Villalobos Rico1, Manuel de Hera Madrazo1, Meri Terzyan Vardanyan1, Ana Cano Fernández1
Recibido: 20-11-2024
Aceptado: 28-12-2024
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 5 pp. 734-736|https://doi.org/10.25237/revchilanestv54n5-33
PDF|ePub|RIS
Neurogenic pulmonary edema: diagnostic challenge in pediatric anesthesia. Case report
Abstract
Endoscopic saline irrigation in neurosurgery, without adequate drainage, causes acute hydrocephalus with consequent increase in intracranial pressure. The hyperreactivity of the sympathetic nervous system to this stimulus causes cardiopulmonary complications that result in a diagnostic challenge in the intraoperative environment. This is the case of neurogenic pulmonary edema.
Resumen
La irrigación con suero salino del endoscopio en neurocirugía, sin un drenaje adecuado, ocasiona una hidrocefalia aguda con aumento de la presión intracraneal consecuente. Ante este estímulo, el sistema nervioso simpático se activa con complicaciones cardiopulmonares que resultan un reto diagnóstico en el ambiente intraoperatorio. Este es el caso del edema pulmonar neurogénico.
-
Introducción
La teoría de Monro-Kellie explica cómo varía el volumen de los componentes del cráneo (LCR, sangre y cerebro) para compensar los cambios de presión intracraneal (PIC) y mantenerla en rangos normales. Sin embargo, los aumentos bruscos en cualquier de los tres componentes da lugar a episodios de hipertensión intracraneal que no pueden ser regulados. Este aumento severo de la PIC activa el reflejo de Cushing con aumento de la presión arterial media para elevar la presión de perfusión cerebral y evitar la isquemia cerebral. No obstante, en raras ocasiones se llega a una hiperactividad del SNS que resulta contraproducente[1]-[3].
Se denomina edema pulmonar neurogénico a la aparición súbita de acúmulo de líquido en el alveolo e intersticio pulmonar tras una lesión del SNC[3].
Aunque la hidrocefalia aguda es una de las posibles causas del edema pulmonar neurogénico existen muy pocos casos descritos en la literatura cuyo origen sea evidenciado dentro del quirófano y aún menos debido al líquido de irrigación del endoscopio quirúrgico[4]. Así, describimos el caso de un edema pulmonar neurogénico en neurocirugía endoscópica de un paciente lactante.
-
Caso clínico
Lactante de 4 meses de edad, 6 kg de peso corporal, que acude a quirófano de manera programada para exéresis de quiste en IV ventrículo por vía endoscópica.
Se realiza inducción inhalatoria con sevofluorano bajo monitorización de ECG, PANI, SatO2, Ta y saturación de oxígeno tisular en abdomen (INVOS). Posteriormente, se canaliza vía periférica 24 g en miembro superior por donde se administra fentanilo 3 mcg/kg, rocuronio 0,6 mg/kg y propofol 3 mg/kg para intubación endotraqueal con videolaringoscopio c-mac pala recta n° 1 y tubo 3,5, sin incidencias. A continuación, se administra dosis profiláctica de cefazolina 40 mg/kg y levetiracetam 20 mg/kg ev. Antes del comienzo de la cirugía, se canaliza vena femoral izquierda ecoguiada con catéter de 13 cm y 4 Fr, arteria femoral izquierda y sondaje urinario. Se conecta fluidoterapia de mantenimiento con cristaloides balanceados a ritmo de 30 ml/h por calentador de fluidos y se inicia la cirugía. Para el mantenimiento de la cirugía se conecta al paciente a sevofluorano inhalado manteniendo CAM 0,8 y remifentanilo en perfusión continua a ritmo de 0,03 mcg/kg/min.
Tras unos minutos de cirugía se llega al umbral transfusional calculado con la pérdida de sangre permisiva (hemoglobina prequirúrgica 8,5) por lo que se trasfunden 40 ml de hemoderivados.
Siendo la situación estable, una vez comenzada la introducción del endoscopio y el suero de irrigación, a los 20 min se produce un episodio de hipertensión sistémica brusca (TA de 150/100), acompañada de bradicardia (FC de 100 lpm), desaturación (SpO2 en descenso desde 100 hasta 70), hipocapnia (ETCO2 de 24) y aumento de presión pico (35) en vía aérea. A la auscultación pulmonar aparecen crepitantes bilaterales y por la aspiración del tubo endobronquial se objetiva salida de líquido claro mezclado con moco. Se comunica al equipo neuroquirúrgico la necesidad de parar la cirugía para resolver la situación. Ante la sospecha de un edema agudo de pulmón, se suspende la infusión de líquidos y hemoderivados y se administra furosemida hasta un total de 6,5 mg/kg intravenoso. Para tratar de mejorar la ventilación, por posible broncoespasmo asociado, se administra salbutamol por cámara 6 puff, sulfato de magnesio 25 mg/kg, ketamina 2 mg/kg e hidrocortisona 1 mg/kg intravenoso acompañada de ventilación manual con FiO2 100%. Se producen recuperaciones parciales de SpO2 hasta 90-95%, pero con intervalos de caída de nuevo hasta 68%-70%. Se realiza placa de tórax intraquirúrgica (Figura 1) que aparenta de aumento de densidad del pulmón derecho con broncograma aéreo y pequeña cantidad de líquido en cisura menor. No se objetivan claros signos de cardiomegalia, aunque la proyección se encuentra ligeramente rotada y el borde cardíaco derecho no se define adecuadamente.
Tras el tratamiento, y la retirada del endoscopio, la clínica mejora y en la auscultación siendo algo mejor, persisten crepitantes en zonas declives pulmonares, consiguiendo SpO2 de 98%-100%, con FC de 120 lpm, TA de 55/35 mmHg que remontamos con un bolo de efedrina 0,2 mg/Kg ev hasta 70/40 mmHg.
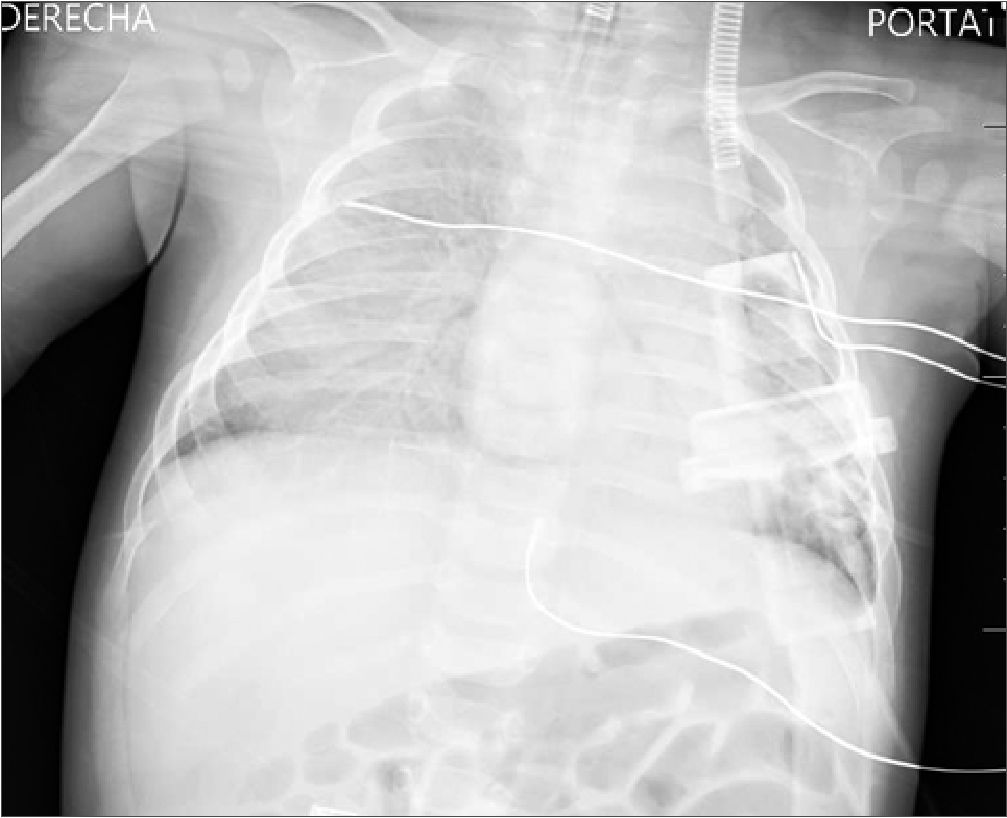
Figura 1. Radiografía anteroposterior de tórax que a pesar de la exploración subóptima técnicamente por la posición quirúrgica objetiva aumento de densidad del pulmón derecho.
En comunicación con equipo de neurocirugía, se llega a la conclusión de que el cuadro ha sido consecuencia de un episodio de hipertensión endocraneal con edema pulmonar neurogénico secundario. Decidimos suspender la cirugía programada, se coloca un drenaje ventricular externo para salida de LCR y se traslada al paciente a cuidados intensivos pediátricos intubado y conectado a ventilación mecánica.
-
Discusión
La lesión aguda del SNC aumenta el tono del SNS con la liberación masiva de catecolaminas. Consecuentemente se produce una vasoconstricción pulmonar y sistémica intensa que altera las fuerzas de Starling con aumento de la permeabilidad de los capilares pulmonares y extravasación de líquido al parénquima pulmonar. En este desequilibrio de la homeostasis vascular participan también las citoquinas inflamatorias consecuentes de la respuesta del daño cerebral, las cuales deteriorarán el endotelio vascular pulmonar y agravarán el edema agudo pulmonar[5]-[8].
La lesión cerebral aguda puede dar lugar a una enfermedad multisistémica por lesión de órganos importantes que incrementan de manera significativa la morbimortalidad. Entre estos órganos dañados puede encontrarse el pulmón y el corazón. La relación pulmón-corazón es ya sabida en la literatura y en el edema pulmonar neurogénico también adquiere importancia. La intensa vasoconstricción pulmonar como resultado de la activación adrenérgica simpática, favorece el aumento de presión hidrostática y la consecuente ruptura de la barrera alveolocapilar[1]-[3]. Por otro lado, está en entredicho si la función ventricular está afectada o no en este tipo de edema a diferencia del edema pulmonar cardiogéncio. Aunque antiguamente se pensaba que el edema pulmonar neurogénico respetaba la funcionalidad del miocardio hay estudios que señalan depresión de la función contráctil del ventrículo izquierdo y elevación de la presión vascular pulmonar[3],[4].
Entre las principales causas de edema pulmonar neurogénico se encuentran el estatus epiléptico, la hemorragia intracraneal y el traumatismo craneoencefálico. Otras menos frecuentes son el ictus isquémico, el síndrome de Guillén-Barre, la esclerosis múltiple, el embolismo gaseoso, la terapia electroconvulsiva, la lesión medular espinal, la hiponatremia y la hidrocefalia aguda[1],[2]-[7].
El edema pulmonar neurogénico resulta un reto diagnóstico y terapéutico, sobre todo en pediatría, por lo que en muchas ocasiones resulta un diagnóstico retrospectivo tras excluir otras causas de insuficiencia respiratoria aguda. Debe descartarse el broncoespasmo, la neumonía por aspiración, el edema pulmonar cardiogénico puro y la lesión pulmonar inducida por ventilación mecánica.
El desarrollo brusco de hipoxemia en un paciente con lesión aguda del SNC, que no puede atribuirse a otras causas de SDRA, debe hacernos sospechar.
La sintomatología descrita es similar a otros edemas pulmonares. La clínica de insuficiencia respiratoria con taquipnea y crepitantes bilateral en bases pulmonares se acompaña de secreciones de aspecto rosado. La radiografía muestra un infiltrado alveolar difuso bilateral. Hemodinámicamente aparece hipertensión pulmonar con presión de enclavamiento normal hasta que comienza el deterioro de la función del ventrículo izquierdo. El gasto e índice cardíaco caen hasta llegar al shock cardiogénico.
El edema pulmonar neurogénico tiene una alta tasa de mortalidad si no se reconoce y trata adecuadamente, estimándose una mortalidad entre el 7%-10%. Aunque con el tratamiento adecuado el edema pulmonar neurogénico se resuelve en las 48-72 h posteriores al evento que lo desencadenó[1]-[9]-[11].
En esta situación el anestesista debe prevenir la aparición de hipoxia y mantener la presión de perfusión cerebral en un paciente con presión intracraneal aumentada y alteración del intercambio gaseoso. Para ello lo primero es resolver la patología neurológica que desencadenó el cuadro, asegurar un adecuado intercambio gaseoso y dar soporte hemodinámico.
– La patología neurológica origen del problema debe resolverse con disminución de la presión intracraneal bien sea con un drenaje de líquido cefalorraquídeo o drenaje del hematoma intraparenquimatoso.
– Para asegurar un intercambio gaseoso adecuado es prioritario una ventilación de protección pulmonar con reclutamiento alveolar. Asegurar una oxigenación alveolar incrementando la FiO2 del respirador al 100% y eliminar el contenido de líquido en el parénquima pulmonar con diuréticos de asa.
– En cuanto al manejo hemodinámico: se debe mantener un índice cardíaco por encima de 2,2 l/min con drogas vasoactivas. Se propone en anestesiología pediátrica la milrinona como primera línea del tratamiento puesto que aumenta el gasto cardíaco y disminuye la presión de la arteria pulmonar. Como segunda línea aparecen agonistas beta 1 y alfa[3].
-
Conclusiones
El edema pulmonar neurogénico es una complicación rara, pero potencialmente mortal en el paciente neuroquirúrgico. La irrigación de suero por el endoscopio debe ser firmemente controlada por el equipo quirúrgico y debe haber una buena comunicación para solventar los posibles eventos críticos en el quirófano. Así, ante una hipoxemia súbita secundaria a un reflejo de Cushing (hipertensión sistémica con bradicardia) se debe alertar a los Neurocirujanos deteniendo la cirugía y dar soporte vasoactivo y diurético.
Conflicto de intereses: La presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
-
Referencias
1. Cruz A, Menezes S, Silva M. Neurogenic pulmonary edema due to ventriculo-atrial shunt dysfunction: a case report. Rev Bras Anestesiol. 2016;66(2):200—203 https://doi.org/10.1016/j.bjane.2013.10.009.
2. Urriza I, Sánchez I. Edema pulmonar neurogénico secundario a hipertensión intracraneal. Presentación de un caso pediátrico y revision bibliográfica. Bol. S Vasco-Nav Pediatr 2020; 52: 89-91
3. Carrillo R, Castro F, Leal P. Actualidades en terapia intensiva neurológica. Edema pulmonar neurogénico. Rev Asoc Mex Med Crit Ter Intensiva. 2010;24(2):59–65.
4. Dragan KE, Patten WD, Elzamzamy OM, Attaallah AF. Acute intraoperative neurogenic myocardial stunning during intracranial endoscopic fenestration and shunt revision in a pediatric patient. J Anesth. 2016 Feb;30(1):152–5. https://doi.org/10.1007/s00540-015-2071-3 PMID:26314948
5. Goyal A, Bharadwaj S. Neurogenic Pulmonary Edema and Stunned Myocardium in a Patient With Meningioma: A Heart-Brain Cross Talk. J Neurosurg Anesthesiol. 2018;0:1. https://doi.org/10.1097/00008506-900000000-99248 PMID:29432276
6. Milley JR, Nugent SK, Rogers MC. Neurogenic pulmonary edema in childhood. J Pediatr. 1979 May;94(5):706–9. https://doi.org/10.1016/S0022-3476(79)80134-1 PMID:376799
7. Takagi Y, Imamura T, Endo S, Hayashi K, Akiyama S, Ikuta Y, et al. Neurogenic pulmonary edema following febrile status epilepticus in a 22-month-old infant with multiple respiratory virus co-detection: a case report. BMC Infect Dis. 2020 Jun;20(1):388. https://doi.org/10.1186/s12879-020-05115-2 PMID:32487032
8. Šedý J, Kuneš J, Zicha J. Pathogenetic mechanisms of neurogenic pulmonary edema. J Neurotrauma. 2015 Aug;32(15):1135–45. https://doi.org/10.1089/neu.2014.3609 PMID:25496372
9. Baumann A, Audibert G, McDonnell J, Mertes PM. Neurogenic pulmonary edema. Acta Anaesthesiol Scand. 2007 Apr;51(4):447–55. https://doi.org/10.1111/j.1399-6576.2007.01276.x PMID:17378783
10. Lo-Cao E, Hall S, Parsell R, Dandie G, Fahlström A. Neurogenic pulmonary edema. Am J Emerg Med. 2020. PMID:33308892
11. Busl KM, Bleck TP. Neurogenic pulmonary edema. Crit Care Med. 2015 Aug;43(8):1710–5. https://doi.org/10.1097/CCM.0000000000001101 PMID:26066018

 ORCID
ORCID