Lucia Esteves1, Jennifer Larrarte2, Jimena Areco3*, Julio Trostchansky4, Noya B.5, Ana Rodríguez5
Recibido: 15-08-2023
Aceptado: 18-09-2023
©2025 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 54 Núm. 6 pp. 968-972|https://doi.org/10.25237/revchilanestv54n6-28
PDF|ePub|RIS
Innominate artery dissection and stroke during mediastinoscopy: case report
Abstract
We present the case of a 58 years old man scheduled for mediastinoscopy with lymph node biopsy for diagnosis of bronchopulmonary carcinoma. After anesthetic awakening, hemiplegia and left facial paralysis were observed. Angiotomography indicated the performance of an emergency arteriography, where the latter evidenced a dissection of the brachiocephalic arterial trunk extending to the origin of the common carotid and subclavian arteries. Successful mechanical thrombectomy was performed at the level of the ml and m2 segments of the middle cerebral artery. Reversal of symptoms was observed 15 days postoperatively.
Resumen
Presentamos el caso de un hombre de 58 años coordinado para mediastinoscopia con biopsia ganglionar para diagnóstico de carcinoma broncopulmonar. Luego del despertar anestésico se constató una hemiplejía izquierda y parálisis facial izquierda. La angiotomografía indicó la realización de una arteriografía de urgencia, donde esta última evidenció una disección del tronco arterial braquioefálico que se extiendía al origen de arterias carótida común y subclavia. Se realizó trombectomía mecánica exitosa a nivel de los segmentos Ml y M2 de arteria cerebral media. Se observó reversión de hemiplejia a los 15 días del posoperatorio.
-
Introducción
La videomediastinoscopía es una técnica segura que permite el diagnóstico y estadificación del carcinoma broncopulmonar. Las complicaciones vasculares como la hemorragia o la disección son las más serias, pudiendo comprometer el pronóstico funcional y la vida del paciente. Existen factores de riesgo relacionados a complicaciones vasculares, como mediastino
complejo, inflamación granulomatosa, que pueden dificultar la técnica. La disección de arteria carótida, puede ocasionar isquemia por estenosis luminal o por embolias distales.
La incidencia de ictus asociada a la mediastinoscopia es menor al 1%, pero es una de las causas de mayor morbimortalidad[1].
A continuación, presentaremos el caso de un hombre que durante el posoperatorio inmediato de una mediastinoscopia se diagnosticó un accidente cerebrovascular (ACV), y la arteriografía cerebral y de vasos de cuello permitió el diagnóstico de disección de tronco arterial braquiocefálico, extendiéndose a sublcavia y carótida común, que requirió una trombectomía mecánica de emergencia, que fue exitosa.
Detectar la disección vascular tanto como el ACV de forma oportuna durante o inmediatamente después de la cirugía puede ser un desafío. La monitorización neurológica no es estándar debido a la baja incidencia de complicaciones. Sin embargo, puede estar justificada en casos específicos, basándose en la evaluación individualizada.
-
Caso clínico
Hombre de 58 años coordinado para videomediastinoscopia por probable carcinoma broncopulmonar (CBP). Sin antecedentes quirúrgicos. Tabaquista intenso, bronquítico crónico. Niega otras patologías.
De la enfermedad actual se destaca disfonía, tos y expectoración, en algunas oportunidades serohemática, acompañado de omalgia derecha, de meses de evolución. Buena capacidad funcional, sin antecedentes cardiovasculares.
Respecto al examen físico general, destacamos en lo pleuropulmonar: tórax remodelado, con aumento del diámetro anteroposterior, murmullo alveolo vesicular (MAV) disminuido globalmente, sin estertores. Examen cardiovascular: sin alteraciones. Peso y talla: 60 kg y 1,60 m respectivamente. Sin particularidades en el examen de la vía aérea.
Se realizó tomografía (TC) de tórax; que informó una masa pulmonar redondeada de 50 mm de diámetro, en lóbulo pulmonar superior derecho, de contornos irregurales, que contactaba con pleura adyacente.
Además, imagen nodular de 3 mm en lóbulo pulmonar inferior derecho y adenomegalias paratraqueales derechas, en ventana aortopulmonar y en hilio pulmonar derecho.
Del resto de la valoración se destacan electrocardiograma (ECG) y ecocardiograma transtorácico normales, y exámenes paraclínicos normales.
Ingresó block quirúrgico lúcido, hemodinámicamente estable, saturación 97% ventilando al aire (VEA). Monitoreo estándar I y II de acuerdo a los lineamientos de la American Society of Anesthesiologist (ASA) donde se destacan colocación del pulsioxímetro en miembro superior derecho (MSD), y medición presión arterial no invasiva medida cada 5 minutos en miembro superior izquierdo (MSI).
Inducción anestésica con fentanyl, propofol y atracurio iv, e intubación traqueal sin incidentes. Colocación del paciente en decúbito dorsal, con cuello en hiperextensión, y almohadilla debajo de los hombros, cabeza en posición neutra, cuidando puntos de apoyo.
Se realizó incisión transversa en parte baja del cuello, a dos traveses de dedo por encima del hueco supraesternal. Incisión que compromete subcutáneo y músculo platisma de cuello, disección de planos musculares para lograr exposición del espacio pretraqueal retrosternal, y colocación de video mediastinoscopio. Se visualizó la tráquea, la vena cava y el tronco arterial braquiocefálico derecho. Se avanzó mediante disección roma sobre cara anterior de tráquea y se biopsiaron los ganglios la- tero-traqueales derechos (grupo 4 R), extrayendo 10 muestras
que se enviaron a anatomía extemporánea con diagnóstico positivo para carcinoma, hemostasis rigurosa en lecho ganglionar y cierre.
Del intraoperatorio se destaca durante obtención de muestras una caída de la saturometría arterial de hasta 80%, que dura escasos minutos, acompañado de episodio de hipotensión transitorio llegando a presión arterial media (PAM) de 50 mmHg que responde a carga de volumen. No se registraron cambios en la ventilación, ni aumento de presión en vía aérea.
Extubación en block, paciente con ventilación espontánea con adecuado esfuerzo inspiratorio, cumpliendo órdenes. Paciente con tendencia al sueño, es trasladado a sala de recuperación anestésica. Inmediatamente, se revalora constatándose, hemiplejia izquierda, y parálisis facial central izquierda. Se realizó angioTAC cerebral y de vasos de cuello. Del informe se destaca: ausencia de signos tempranos de isquemia, ni áreas configuradas, sin hematomas del parénquima, hemorragia subaracnoidea ni sangrado intraventricular. Se identificó defecto en el relleno de carótida primitiva que podría corresponder a disección, y a nivel de cerebral media derecha en su sector M1 se observó defecto compatible con trombo embólico por contexto clínico del paciente (Figura 1).
Valorado por equipo multidisciplinario, se decidió arteriografía de vasos de cuello y trombectomía mecánica. Se realiza en sala de hemodinamia, con paciente monitorizado, sedación con fentanyl iv, procedimiento bien tolerado.
La angiografía mostró disección de arteria carótida común izquierda y el origen de arteria subclavia ipsilateral. Se detectó una estenosis del 90% en el origen de la arteria carótida común, visualizando trombo en M1 y varios en M2. Se realizó trombectomía mecánica con aspiración, logrando extraer tres trombos grandes de M2. El control evidenció recanalización completa con reperfusión TICI 3. Paciente trasladado a cti monitorizado, donde permanece 48 h.
Control tomográfico a las 24 h evidencia hipodensidad subcortical y periventricular derecha que afecta la convexidad de la circunvolución parietal ipsilateral, lo cual sugiere una isquemia configurada (Figura 2). En la evolución paciente sin cambios clínicos, persistiendo con síndrome piramidal izquierdo proporcionado, con parálisis facial central y corticobulbar en etapa flexoespástica y Babinski a izquierda. El planteo diagnóstico fue infarto cerebral derecho de naturaleza tromboembólica. A los 15 días es dado de alta a domicilio.
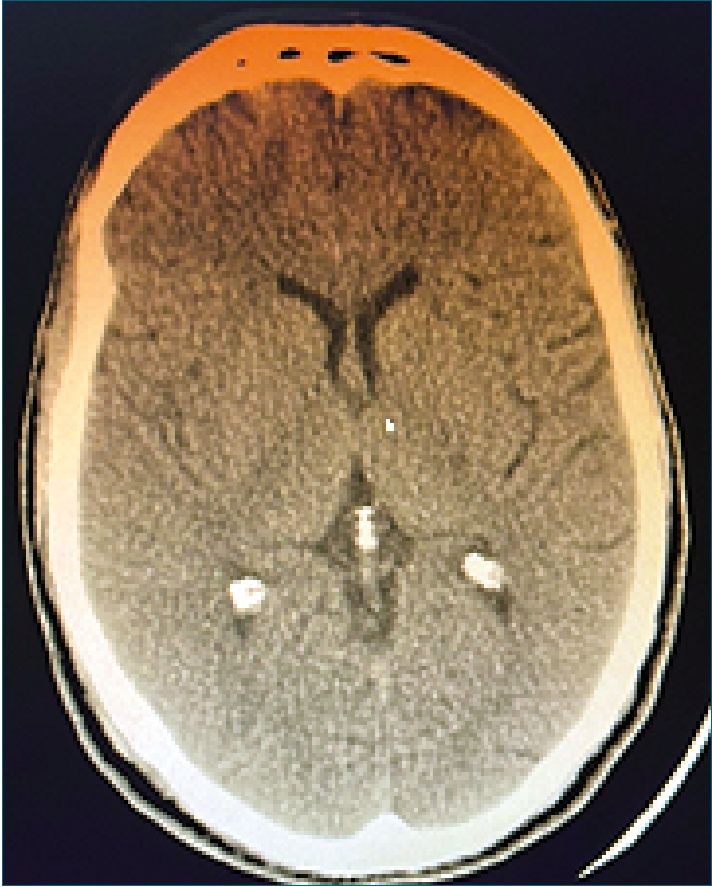
Figura 1. AngioTAC posoperatorio inmediato de mediastinoscopia.
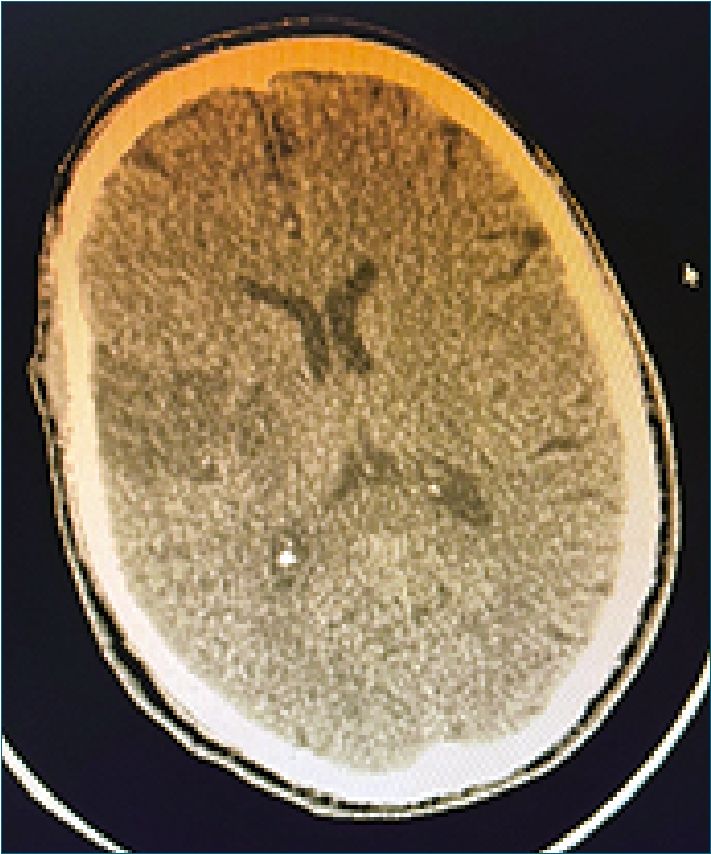
Figura 2. TAC control a las 24 h, muestra configuración del área de isquemia subcortical parietal derecha.
-
Discusión
La videomediastinoscopia permite biopsiar ganglios linfáticos, para diagnóstico y estadificación del CBP. También, existen otras indicaciones como sospecha de sarcoidosis, metástasis, linfomas y otros tumores de mediastino anterosuperior.
Varios estudios recalcan la seguridad y eficacia de la videomediastinoscopía cervical.
Las complicaciones relacionadas con este procedimiento según la literatura se pueden clasificar en seis categorías: sangrado, parálisis de nervio frénico izquierdo, infección, neumotórax, perforación traqueal y perforación esofágica[1],[2]. Las tres primeras son las más frecuentes. Según la tasa de morbilidad atribuida directamente al procedimiento varía entre 0,6% y 3,7%. Un estudio institucional que abarcó un periodo de 9 años y 2.145 pacientes informó una morbilidad global de 1,07% y una mortalidad del 0,05%[3].
La hemorragia es la complicación más seria y frecuente que abarca desde un sangrado mínimo hasta una hemorragia mayor si proviene de los grandes vasos mediastínicos como vena cava superior, vena ácigos, aorta ascendente, tronco arterial braquiocefálico (también llamado arteria innominada) y arteria pulmonar. En el mediastino anatómicamente normal, estas estructuras son identificables y el riesgo de lesionarlas es bajo.
Los sitios de sangrado más comunes son a nivel ganglionar y sus vasos. Debido al pequeño espacio de trabajo, un sangrado mínimo puede causar pérdida de visualización, por lo que durante la exploración es recomendable disecar y enuclear las adenopatías previo a la toma de biopsia, y aplicar una adecuada hemostasis antes de cerrar la herida. En caso de hemorragia proveniente de un vaso importante, es obligatorio taponear el mediastino y retirar con cuidado el instrumento, mientras un abordaje mediante esternotomía o toracotomía dará acceso a la reparación del vaso[4].
Algunos factores relacionados a complicaciones vasculares son: mediastino complejo, que se refiere a aquellos pacientes con esternotomía o toracotomía previa, o que hayan recibido tratamientos como quimioterapia o radioterapia, que puedan modificar la anatomía normal del mediastino, o generar adherencias. La inflamación granulomatosa, ganglios voluminosos, así como calcificación hiliar, podrían dificultar la técnica, aumentando el riesgo vascular[5]. En nuestro paciente destacamos ganglios calcificados, con adherencias a estructuras vecinas.
La ubicación anatómica del grupo ganglionar a biopsiar se relaciona con la estructura vascular potencialmente lesionada. Un estudio realizó una revisión retrospectiva de 3.391 me- diastinoscopias realizadas en una institución durante 12 años, identificando complicaciones hemorrágicas mayores. El sitio de biopsia más comúnmente asociado con hemorragia mayor fue, al igual que en nuestro paciente, la región paratraqueal inferior derecha: grupo 4 R, donde la lesión a nivel de la arteria innominada fue la segunda en frecuencia[6].
Con respecto a los factores de riesgo para disección arterial, la tensión parietal es el principal factor etiopatogénico[7]. Pensamos que la causa de disección en nuestro paciente pudo ser la tracción generada por el mediastinoscopio, asociado a la hiperextensión con ligera rotación de la cabeza provocando un aumento de las fuerzas de tensión por cizallamiento a nivel del tronco arterial braquiocefálico, cuya porción proximal está relativamente fija al arco aórtico.
La disección arterial comprende un desgarro a nivel de la íntima, con disminución del calibre del lumen, ocasionando síntomas isquémicos tanto por estenosis luminal severa como por embolias distales[6]. En nuestro caso se evidenció por arterio- grafía una estenosis del 90% de la arteria carótida común derecha y múltiples trombos en arteria cerebral media que revelan la etiopatogenia del stroke.
Debido a la posición del mediastinoscopio detrás de la arteria innominada, sugiere que en nuestro paciente la presión del instrumento sobre este vaso, sumado a la disección, causó una disminución del pulso con caída de la saturación, dado que el oxímetro estaba MSD. En cambio, la caída de la presión arterial monitorizada del lado izquierdo pudo deberse a la compresión de grandes vasos que mejoró al cambiar de posición el mediastinoscopio.
Si bien la incidencia de ictus perioperatorio asociado a mediastinoscopia es baja (menor al 1%), ha sido una de las causas de mayor morbimortalidad, siendo ejemplo de esto nuestro paciente donde persistieron los síntomas neurológicos pese al adecuado tratamiento.
Debido a esto podríamos considerar aquellas estrategias que nos permitan disminuir o detectar precozmente el ictus en el intraoperatorio. Destacamos la adecuada valoración preoperatoria, identificando factores de riesgo como mediastino complejo. Cuando esté disponible, utilizar la angio TAC para valorar la presencia de aneurismas de vasos mediastínicos, o placas de ateroma en la arteria innominada. Además, permite evaluar la permeabilidad de la arteria carótida común izquierda, dado que, en caso de estar comprometida, podría aumentar la incidencia de ictus, debido a que la compresión de la arteria innominada por el mediastinoscopio es frecuente.
Llevar a cabo una monitorización hemodinámica adecuada, prestando especial atención a parámetros como presión arterial y frecuencia cardíaca. El oxímetro de pulso colocado en miembro superior derecho puede detectar la compresión braquiocefálica significativa traducido por un déficit de pulso; mientras que la presión arterial no invasiva, medida en el miembro superior contralateral, permitirá la monitorización de la presión, incluso en estos casos[1].
Getma at al., presentaron un reporte de caso donde el paciente presentó un stroke durante la mediastinoscopia, donde el uso de la monitorización del índice biespectral (BIS) ayudó a identificar la reducción intraoperatorio del metabolismo cerebral e impulsó a finalizar el procedimiento abruptamente[8].
El BIS es el parámetro de monitorización de profundidad anestésica más utilizado hoy en día. Es una interpretación estadística basada en un logaritmo matemático sobre datos extraídos en el electroencefalograma (EEG) de individuos sanos sometidos a anestesia general. Calcula un valor que resulta de procesar una señal de electroencefalografía frontal. Se considera un valor adecuado de profundidad durante el mantenimiento de anestesia general el intervalo de valores comprendido entre 40 y 60. El valor de BIS está condicionado por la reducción del metabolismo cerebral secundario a la administración de los fármacos anestésicos. Sin embargo, ciertas circunstancias clínicas graves que provocan una reducción importante del metabolismo cerebral inducirán una disminución del BIS independiente de la profundidad anestésica, como puede ser la parada cardíaca, hipoglicemia, hipotermia o la isquemia cerebral[9].
La oximetría cerebral basada en la espectroscopia cercana al infrarrojo (NIRS) puede medir de manera no invasiva la saturación de oxígeno de la hemoglobina en la sangre mixta arterial, venosa y capilar de la corteza cerebral, área susceptible a cambios de aporte y demanda de O2. El principio físico en el que se fundamenta es la emisión de fotones de luz. El valor resultante es la saturación regional de oxígeno (sRO2) cuyo resultado surge de la diferencia entre los haces de luz emitidos, su absorción y reflectancia por parte de tejidos subyacentes. Cada sensor es colocado en ambos lados para registrar las sRO2 de las cortezas frontales. Un umbral recomendado en la práctica clínica como indicador de isquemia es una disminución del 20% de la rSO2 basal, o un valor absoluto del 50%.
Los valores deben interpretarse de acuerdo con el contexto clínico ya que son varios los factores que pueden alterar la sRO2, como caída del gasto cardíaco, la hipotensión, hipercapnia, anemia, embolia, enfermedad preexistente como infarto cerebral previo.
Uso predominante en cirugía cardíaca, poco a poco se ha extendido su uso a cirugías no cardiovasculares con alto riesgo de hipoperfusión cerebral[10],[11].
Estudios muestran que el uso del NIRS es una herramienta útil para la detección de isquemia cerebral en pacientes intervenidos de endarterectomía carotídea con anestesia general[12],[13]. Un descenso de la sRO2 persistente y particularmente si es unilateral, podría corresponder a isquemia por afectación de un territorio vascular determinado.
La baja frecuencia de eventos isquémicos durante la mediastinoscopia no justifica la monitorización neurológica de rutina.
Los costos de los equipos e insumos condicionan su disponibilidad en nuestro medio. Sin embargo, en aquellos pacientes con factores de riesgo para complicaciones neurológicas, dicha monitorización podría ser útil para tomar medidas precozmente.
-
Conclusiones
La mediastinoscopia es una técnica segura en manos experimentadas. Las complicaciones vasculares son las más frecuentes y algunas son potencialmente mortales. La incidencia de ictus perioperatorio es baja, pero ha sido la causa de mayor morbimortalidad. En pacientes con factores de riesgo para complicaciones vasculares, como mediastino complejo, enfermedad granulomatosa, ganglios calcificados adheridos a estructuras vecinas, podría justificar el uso de la neuromonitorización. El NIRSS puede ser una herramienta útil para la detección de isquemia cerebral, reconociendo sus limitaciones; por ejemplo: monitoriza solo la circulación cerebral anterior, varios factores pueden alterar la SRO2, y los falsos positivos por mala posición de los electrodos.
-
Referencias
1. Cata JP, Lasala J, Mena GE, Mehran JR. Anesthetic Considerations for Mediastinal Staging Procedures for Lung Cancer. J Cardiothorac Vasc Anesth. 2018 Apr;32(2):893–900. https://doi.org/10.1053/j.jvca.2017.08.041 PMID:29174661
2. Socci L, Sionis S, Shark A. Complications of mediastinoscopy.Shanghai Chest; Vol 5 (October 30, 2021). Disponible en: https://shc.amegroups.com/article/view/7007 https://doi.org/10.21037/shc-21-20.
3. Lemaire A, Nikolic I, Petersen T, Haney JC, Toloza EM, Harpole DH Jr, et al. Nine-year single center experience with cervical mediastinoscopy: complications and false negative rate. Ann Thorac Surg. 2006 Oct;82(4):1185–9. https://doi.org/10.1016/j.athoracsur.2006.05.023 PMID:16996905
4. Villa M, Sarkaria IS. Great Vessel Injury in Thoracic Surgery. Thorac Surg Clin. 2015 Aug;25(3):261–78. https://doi.org/10.1016/j.thorsurg.2015.04.001 PMID:26210923
5. Samson P, Guitron J, Reed MF, Hanseman DJ, Starnes SL. Predictors of conversion to thoracotomy for video-assisted thoracoscopic lobectomy: a retrospective analysis and the influence of computed tomography-based calcification assessment. J Thorac Cardiovasc Surg. 2013 Jun;145(6):1512–8. https://doi.org/10.1016/j.jtcvs.2012.05.028 PMID:22698554
6. Park BJ, Flores R, Downey RJ, Bains MS, Rusch VW. Management of major hemorrhage during mediastinoscopy. J Thorac Cardiovasc Surg. 2003 Sep;126(3):726–31. https://doi.org/10.1016/S0022-5223(03)00748-7 PMID:14502145
7. Thubrikar MJ, Agali P, Robicsek F; M. J. Thubrikar, P. Agali, F. Robic. Wall stress as a possible mechanism for the development of transverse intimal tears in aortic dissections. J Med Eng Technol. 1999;23(4):127–34. https://doi.org/10.1080/030919099294177 PMID:10561823
8. Muñoz Molina GM, Ovejero Díaz AP, Cabañero Sánchez A, Gorospe Sarasúa L, Pecharromán De Las Heras I, Carrasco Seral C, et al. Innominate Artery Dissection Caused by Video-Mediastinoscopy. Ann Thorac Surg. 2021 Jun;111(6):e399–401. https://doi.org/10.1016/j.athoracsur.2020.08.110 PMID:33253673
9. Mathur S, Patel J, Goldstein S, Jain A. Bispectral Index. StatPearls. StatPearls Publishing; 2023.
10. Bonatti G, Iannuzzi F, Amodio S, Mandelli M, Nogas S, Sottano M, et al. Neuromonitoring during general anesthesia in non-neurologic surgery. Best Pract Res Clin Anaesthesiol. 2021 Jul;35(2):255–66. https://doi.org/10.1016/j.bpa.2020.10.005 PMID:34030809
11. Ali J, Cody J, Maldonado Y, Ramakrishna H. Near-Infrared Spectroscopy (NIRS) for Cerebral and Tissue Oximetry: Analysis of Evolving Applications. J Cardiothorac Vasc Anesth. 2022 Aug;36(8 8 Pt A):2758–66. https://doi.org/10.1053/j.jvca.2021.07.015 PMID:34362641
12. Rein LC, Siqueira DE, Guillaumon AT, Avelar WM, Cendes F, Mesquita RC. Evaluation of the brain hemodynamic response by means of near-infrared spectroscopy (NIRS) monitoring in patients with atherosclerotic carotid disease undergoing endarterectomy. J Vasc Bras. 2020 Mar;19:e20190027. https://doi.org/10.1590/1677-5449.190027 PMID:34178049
13. Yücel C, Ketenciler S, Gürsoy M, Türkmen S, Kayalar N. The Effect of Hemodynamic Parameters on Cerebral Oxygenization During Carotid Endarterectomy. Braz J Cardiovasc Surg. 2022 Mar;37(1):80–7. https://doi.org/10.21470/1678-9741-2020-0398 PMID:34236796

 ORCID
ORCID