Luciano González J.*, Roberto Moreno E. * , Claudio Vargas R. ** , Mariana Varas R. * , Mauricio Ramos G. * , Renato Chacón A. * y Marcela Ávila A.***
Reve Chil Anest Vol. 41 Número 2 pp. 103-107|doi:
PDF|ePub|RIS
Resumen
Introducción: El objetivo de este estudio prospectivo, doble ciego y aleatorizado fue evaluar el impacto de la administración de ácido tranexámico (AT) después de cirugía cardiaca con circulación extracorpórea en el sangrado postoperatorio. Material y Método: Durante la inducción de la anestesia los pacientes recibieron un bolo de 10 mg·kg-1 de AT, más 50 mg en el cebado de la máquina de circulación extracorpórea, seguido de una infusión continua de 1 mg·kg-1·h-1 hasta el término de la cirugía. En ese momento los pacientes fueron aleatoriamente distribuidos en 2 grupos: el grupo control recibió 10 ml·h-1 de suero fisiológico, y el grupo de estudio una dosis de 1 mg·kg-1·h-1 de AT, en ambos casos durante el trascurso de 10 horas. El objetivo primario fue observar alguna diferencia en el sangrado durante el primer día de postoperatorio. El objetivo secundario fue observar alguna diferencia en la transfusión de sangre (glóbulos rojos, plaquetas) durante el primer día del postoperatorio y en la incidencia de reoperaciones. Tanto el anestesista como el cirujano fueron ciegos a la distribución de los pacientes en cada grupo. Se utilizó el t-test para el análisis de diferencias en las medias de las variables continuas y el z-test para las proporciones. Se consideró estadísticamente significativo un valor de p < 0,05. Se efectuó análisis de regresión múltiple para encontrar variables capaces de predecir sangrado durante el primer día postoperatorio. Resultados: Se estudiaron 273 pacientes, excluyéndose 15 pacientes de cada grupo, quedando definitivamente 125 en el grupo en que se administró AT y 118 en el grupo control. No hubo diferencia estadísticamente significativa entre ambos grupos en relación a sus características demográficas, patología agregada y estudios de laboratorio. Tampoco hubo diferencia en los objetivos primarios y secundarios planteados en el estudio. El análisis de regresión múltiple determinó que la variable minutos de circulación extracorpórea , era capaz de predecir sangrado durante el primer día del postoperatorio. Conclusiones: La infusión postoperatoria de AT no disminuye el sangrado, la cantidad de transfusiones ni las reoperaciones en cirugía cardiaca con circulación extracorpórea.
Abstract
Introduction: The objective of this prospective, double blind, randomized trial is to evaluate the impact of tranexamic acid (TA) administration after cardiac surgery with cardiopulmonary bypass in postoperative bleeding. Materials and Methods: During induction of general anesthesia, patients received a bolus of TA of 10 mg·kg-1 plus 50 mg in the CPB priming followed by a continuous infusion of 1 mg·kg-1·h-1 until the end of the surgery. Then, patients were randomly allocated into one of two groups: the isotonic saline (IS) group received 10 ml·h-1 of isotonic saline and the TA group received an infusion of 1 mg·kg-1·h-1 of TA. Both groups received their infusions for 10 hours. Primary outcome was bleeding during first postoperative day (POD1). Secondary outcomes were blood transfusion (PRBC, platelets) during POD1 and surgical re-exploration. Anesthesiologists and surgeons were blind to patient allocation. A t-test was used to analyze differences in means of continuous variables and z-test for proportions. A p value < 0.05 was considered statistically significant. Multiple regression analysis was performed to find variables able to predict bleeding in the POD1. Results: 273 patients were included, there were 15 lost per group. 125 patients in the TA group and 118 patients in the IS group were analyzed. Both groups were compared in their demographics characteristics, comorbidity and lab tests and no significant differences were found. No statistically significant differences between groups in the primary and secondary outcomes were found. Multiple regression analysis establishes the variable minutes in cardiopulmonary bypass was able to predict bleeding in the POD1. Conclusions: Postoperative infusion of TA does not decrease bleeding, transfusions and re-explorations during the POD1 of cardiac surgery with cardiopulmonary bypass.
Key words: Tranexamic acid, cardiac surgery and antifibrinolitic drugs.
INTRODUCCIÓN
Los antecedentes bibliográficos sobre la utilidad de infusiones de ácido tranexámico (AT) en el post operatorio (PO) de cirugía cardiaca (CC) con circulación extracorpórea (CEC) se limitan al trabajo de Casati et al 1 . En aquel estudio fueron aleatorizados 510 pacientes en 3 grupos: en el grupo control se administró una solución placebo, en el segundo grupo 1 mg·kg-1·h-1 de AT y en el tercero 2 mg·kg-1·h-1 de AT en infusiones continuas durante las primeras 12 horas del PO; el estudio concluyó que la infusión de AT no aportaba beneficios al ser administrada posterior a la cirugía con respecto a sangrado y necesidad de transfusiones de hemoderivados.
Con la actual imposibilidad de usar otros antifibrinolíticos 2 , ha crecido el interés en usar nuevas modalidades destinadas a disminuir y manejar el sangrado tras una CC, como las infusiones de AT en el PO. Es por esta razón que se diseñó este trabajo prospectivo, aleatorizado, doble ciego y placebo controlado, donde se evaluó: sangrado acumulado, reexploración por sangrado y transfusión de hemoderivados durante el primer día tras una CC con CEC, comparando un grupo que recibió una infusión de ácido tranexámico con otro grupo placebo, al cual se le administró solución fisiológica.
Como los antecedentes bibliográficos eran limitados se planteó como hipótesis que el uso de AT en infusión continua en el PO de una CC con CEC, es capaz de disminuir el sangrado postoperatorio, las reexploraciones por sangrado y la necesidad de transfusión de hemoderivados.
Se incluyeron en el estudio a todos los adultos sometidos a CC con CEC. Los criterios de exclusión fueron: coagulopatía previa (adquirida o congénita), alteraciones de las pruebas de coagulación preoperatorias (INR > 1,5, TTPa > 35 segundos y recuento de plaquetas < 100.000·mm3), paro circulatorio, hipotermia profunda durante la cirugía e insuficiencia renal crónica en hemodiálisis.
El objetivo primario fue la determinación de posibles diferencias en el sangrado durante el primer día PO. Los objetivos secundarios fueron la determinación de posibles diferencias en cuanto a la necesidad de transfusión de glóbulos rojos o plaquetas el primer día PO y la necesidad de reexploración quirúrgica por sangrado durante el primer día PO.
MATERIAL Y MÉTODOS
Con la aprobación del Instituto Nacional del Tórax y del Comité de Ética del Servicio de Salud Metropolitano Oriente se comenzaron a enrolar pacientes, previa firma del consentimiento informado por cada uno de los pacientes estudiados.
Los pacientes ingresados al protocolo fueron sometidos a anestesia general no estandarizada, pero consistente generalmente en 5-20 µ·kg-1 de fentanilo, 0,1 mg·/kg-1 de midazolam, inductor a elección del anestesiólogo tratante, pancuronio, rocuronio o vecuronio como relajante neuromuscular e isoflurano como agente inhalatorio. Durante la inducción de la anestesia, los pacientes recibieron un bolo de AT de 10 mg·kg-1, más 50 mg en el cebado del circuito de CEC e iniciando una infusión de 1 mg·kg-1·h-1 hasta el cierre de la piel. Todos los pacientes se monitorizaron con presión arterial invasiva y catéter venoso central; el uso de catéter de arteria pulmonar quedó a criterio del anestesiólogo tratante. Todos los pacientes fueron abordados por una esternotomía media, con preservación miocárdica. La anticoagulación se hizo con 300 U·kg-1 de heparina; el tiempo de coagulación activado (TCA) para iniciar CEC y de mantención debía ser > 480 segundos. En todos los pacientes se usó un oxigenador Terumo Capiox SX 18, con un flujo de 2,2 a 2,6 L·min-1·m2. El cebado del circuito de CEC se realizó con SF 0,9% 1.000 ml, manitol 15% 500 ml, heparina 5.000 U y 50 mg de AT. Durante la CEC el hematocrito se mantuvo > 20% y se adicionaron glóbulos rojos según necesidad. Todos los pacientes debieron tener > 37ºC al momento de discontinuar la CEC. Después de discontinuada la CEC se administró 2,4 mg·kg-1 de peso real de sulfato de protamina. La neutralización de la heparina se consideró adecuada si la diferencia entre el TCA post protamina y el TCA basal era < 10%); si esta meta no se conseguía, se administró un refuerzo de 0,5 mg·kg-1 de protamina, hasta conseguir dicho objetivo.
Al término del cierre de la piel los pacientes fueron aleatorizados según tabla de randomización en dos grupos, por una persona ajena al pabellón; el anestesiólogo y el cirujano tratante fueron ciegos al grupo sorteado. Los pacientes que entraron al grupo SF recibieron solución fisiológica 0,9% a 10 ml·h-1; los pacientes que entraron al grupo AT recibieron una infusión de 1 mg·kg-1·h-1 de ácido tranexámico, diluido en un volumen que pasaba a 10 ml·h-1. Ambos grupos se mantuvieron con esta infusión durante las 10 primeras horas del PO.
El manejo de las transfusiones durante el intraoperatorio se hizo de acuerdo al criterio del anestesiólogo tratante y tenía por objetivo finalizar la cirugía con un hematocrito de 30%. En caso de sangrado de causa no quirúrgica en el PO inmediato, antes de ser ingresados a la UCI, el uso de hemoderivados también fue de responsabilidad del anestesiólogo tratante y tuvo como metas un recuento plaquetario > 100.000 plaquetas, INR < 1,5 y fibrinógeno > 1 g·L-1.
Los pacientes fueron seguidos por un anestesiólogo ciego al grupo del paciente durante las primeras 24 h del PO.
La terapia transfusional durante el PO fue de responsabilidad del intensivista tratante, también ciego al estudio.
El tamaño muestral se calculó para obtener una potencia de un 80%, para una diferencia en el sangrado en las primeras 24 h de 150 ml. En base a estos cálculos, se obtuvo que se requería al menos 115 pacientes por grupo.
El análisis estadístico consistió en comparación de medias mediante t-test para muestras independientes en las variables continuas y test de comparación de proporciones para muestras independientes en las variables categóricas. Se consideró estadísticamente significativo un valor de p < 0,05. También se efectuó análisis de regresión múltiple para encontrar variables capaces de predecir sangrado durante el primer día postoperatorio.
Los autores declaran no poseer conflicto de interés de ningún tipo para el desarrollo y publicación de esta investigación.
RESULTADOS
Fueron aleatorizados 273 pacientes; en cada grupo hubo 15 pacientes considerados como pérdidas (error de infusión en UCI, fallecidos durante las primeras 10 h y error de registro), quedando 125 pacientes en el grupo AT y 118 pacientes en el grupo SF (Figura 1).
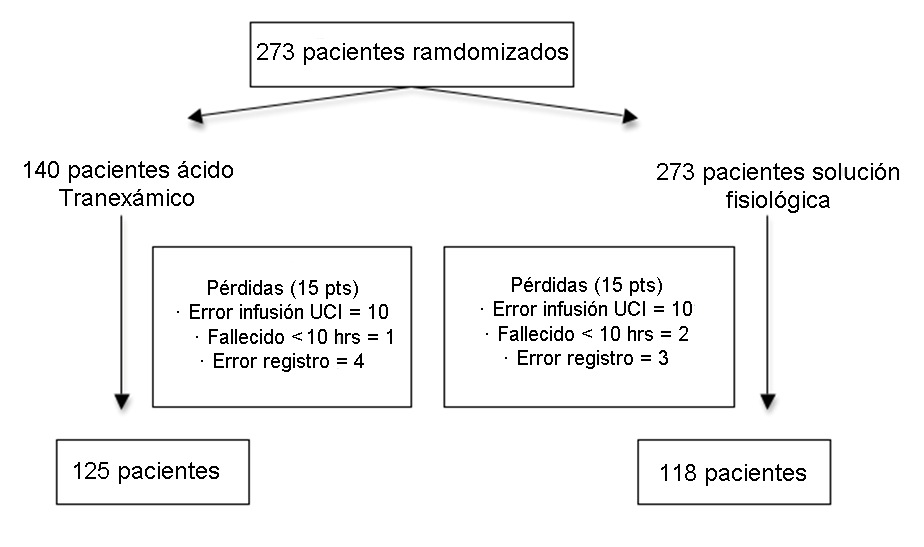
Figura 1 Grupo de estudio.
Tras la randomización, los pacientes de ambos grupos fueron comparados en múltiples parámetros (características demográficas y otras variables relevantes para la hemostasia), no encontrándose diferencias significativas entre ambos grupos, estableciéndose que ambos pueden ser comparados (Tabla 1).
Tabla 1 Características demográficas y otras variables comparadas
|
AT n = 125 |
SF n = 118 |
p |
|
|
Edad (años) |
56,6 |
57,7 |
0,57 |
|
Género (F/M) |
46/79 |
49/69 |
0,37 |
|
Reoperación (n) |
14 |
18 |
0,35 |
|
Urgencia (n) |
14 |
11 |
0,63 |
|
Peso (Kg) |
70,7 |
70,9 |
0,92 |
|
Talla (cms) |
158,4 |
162,3 |
0,18 |
|
Hto basal (%) |
40,4 |
39,9 |
0,45 |
|
Plaquetas basal |
245.600 |
239.101 |
0,45 |
|
AAS (n) |
38 |
35 |
0,78 |
|
Heparina x BIC (n) |
18 |
27 |
0,09 |
|
Antiagregantes plaq (n) |
2 |
3 |
0,61 |
|
TCA basal (seg) |
133,3 |
146,0 |
0,07 |
|
TCA pre CEC (seg) |
626,7 |
624,7 |
0,93 |
|
Hemodilución normovolémica aguda (n) |
42 |
34 |
0,42 |
|
Hto < en CEC (%) |
25,4 |
25,6 |
0,69 |
|
Heparina total (mg) |
338,4 |
337,5 |
0,94 |
|
Tiempo de CEC (min) |
103,0 |
103,5 |
0,91 |
|
Tipo de Cirugía (n) |
|||
|
Revascularización Miocárdica (CRM) |
36 |
28 |
0,36 |
|
Valvular Simple |
37 |
38 |
0,66 |
|
Bi-Valvular |
13 |
19 |
0,19 |
|
Tri-Valvular |
5 |
4 |
0,80 |
|
CRM + Valvular Simple |
9 |
10 |
0,71 |
|
Cirugía de Aorta |
12 |
10 |
0,76 |
|
Tumores |
2 |
2 |
0,96 |
|
Congénitos |
10 |
4 |
0,12 |
|
Miectomías VI |
1 |
3 |
0,29 |
Durante el primer día postoperatorio, un anestesiólogo ciego al grupo asignado al paciente, registró el sangrado acumulado, la necesidad de reexploración por sangrado, el uso de glóbulos rojos y plaquetas, además de un hematocrito al cumplir las 24 h de postoperatorio. El análisis de estos datos demostró que no hay diferencias estadísticamente significativas en los outcomes definidos para esta investigación (Tabla 2).
Tabla 2 Parámetros sometidos a análisis de regresión múltiple
|
Grupo AT n = 125 |
Grupo SF n = 118 |
p |
|
|
Reexploración n (%) |
4 (2,86%) |
3 (2,25%) |
0,45 |
|
GR primeras 24 h (U) |
0,99 |
1,05 |
0,74 |
|
Plaquetas primeras 24 h (U) |
1,28 |
1,04 |
0,51 |
|
Sangrado acumulado en drenajes 1as 24 h (ml) |
692,5 |
597,3 |
0,07 |
|
Convulsiones / Focalización (n) |
0 |
0 |
– |
El análisis de regresión múltiple para los outcomes cuantitativos tampoco arrojó diferencias significativas entre los grupos, excepto la variable minutos de CEC como significativa para explicar la cantidad de sangrado en las primeras 24 h.
DISCUSIÓN
La pérdida de pacientes durante el estudio fue de un 10,9%, existiendo 3 causas que se repiten en ambos grupos: el error de infusión de AT o SF durante las 10 h que duraba la intervención, que el paciente falleciera dentro de ese mismo período o que la recolección de datos hubiese estado alterada (falta de un dato en la hoja de enfermería, la falta de dicha hoja, etc.).
La potencia del estudio alcanzó un 83%, cumpliendo con los requerimientos definidos en la metodología.
Las tres muertes que ocurrieron en el período de intervención del estudio, no se relacionaron con un sangrado excesivo, sino que fueron causadas por arritmias que no se desarrollaron en el contexto de una hemorragia aguda.
El análisis de regresión múltiple identificó la variable minutos de CEC, como determinante en el sangrado por los drenajes durante las primeras 24 h del postoperatorio, lo cual es concordante con otras publicaciones internacionales 3 .
En nuestra institución no contamos con un algoritmo transfusional, lo que constituye una debilidad al momento de evaluar el outcome secundario que dice relación al uso de glóbulos rojos y plaquetas durante las primeras 24 de PO, ya que las indicaciones de estos productos sanguíneos dependen exclusivamente del médico tratante (anestesiólogo y/o intensivista).
Los resultados de esta investigación son concordantes con el estudio de Casati et al 1 , que tampoco encontró diferencias en el sangrado PO al agregar AT en infusión continua durante el PO en un estudio que aleatorizó 500 pacientes y donde se evaluaron los mismos parámetros, con una metodología similar.
Aunque este estudio no fue diseñado para estudiar las complicaciones neurológicas asociadas al uso de AT, como son los episodios convulsivos y las focalizaciones neurológicas, fue una variable pesquisada durante el seguimiento del PO, no encontrándose ningún caso en ambos grupos. Se ha postulado que estas complicaciones son favorecidas al usar altas dosis de AT. Con el fin de disminuir este riesgo potencial es que las actuales dosis ocupadas en nuestra institución son cercanas a un 10-15% de las que usábamos hace 4 años atrás. Estas dosis reducidas de AT actualmente son recomendadas en textos clásicos de anestesia cardiovascular 4 .
CONCLUSIONES
La infusión postoperatoria de ácido tranexámico no disminuye el sangrado acumulado, las transfusiones de glóbulos rojos y plaquetas ni las reexploraciones por sangrado, durante las primeras 24 h del postoperatorio.
REFERENCIAS
-
Casati V, Bellotti F, Gerli C, et al. Tranexamic acid administration after cardiac surgery. A prospective, randomized, double-blind, placebo controlled study. Anesthesiology 2001; 94: 8-14.
-
Resolución Instituto de Salud Pública de Chile. 30.11.2007. Número 009655.
-
Ferraris VA, Ferraris SP, Saha SP, et al. Perioperative Blood Transfusion and Blood Conservation in Cardiac Surgery: The Society of Thoracic Surgeons and The Society of Cardiovascular Anesthesiologists Clinical Practice Guideline. Ann Thorac Surg 2007; 83: S27-86.
-
Kaplan´s Cardiac Anesthesia. The Echo Era, 6ª Ed. 2011. Pág. 982 (Tabla 31-12).