Eugenio Sanhueza H.*
Reve Chil Anest Vol. 42 Número 1 pp. 67-76|doi:
PDF|ePub|RIS
INTRODUCCIÓN
El análisis de las valvulopatías de tipo insuficiencia y sus consideraciones anestésicas involucrará las válvulas que están en relación con el ventrículo izquierdo, es decir las válvulas aórtica y mitral. Las lesiones de las válvulas pulmonar y tricúspide en general se asocian a hipertensión pulmonar (HP), cardiopatías congénitas y endocarditis del corazón derecho y no serán parte de ésta revisión. Se debe recordar que las lesiones mitrálicas y aórticas coexisten en forma frecuente, en sus distintos tipos y etapas de evolución natural.
El análisis del tema examinará en forma individual cada insuficiencia valvular, considerando el perioperatorio como un todo. Esto incluye un adecuado diagnóstico preoperatorio, elección de la técnica anestésica y consideraciones del postoperatorio inmediato.
La enfermedad valvular clínica tiene una prevalencia en Estados Unidos estimada en 2,5% 1 . El mismo reporte, señala que la enfermedad valvular cardiaca significativa por sí sola es predictor de morbilidad perioperatoria 1 . La sola extrapolación de esta cifra hace pensar que en nuestro país debe existir un número importante de pacientes con esta patología, la mayoría sin diagnóstico y con escasa sintomatología.
La mayoría de las insuficiencias valvulares leves a moderadas, en capacidad funcional I a II de la New York Heart Association (NYHA), se manejan en forma exitosa con un plan anestésico basado en el control de la frecuencia cardiaca, la optimización de la volemia y la mantención de una presión arterial media estable 2 .
En cambio, las insuficiencias valvulares moderadas a severas en general son sintomáticas. En ellas, la historia clínica debe determinar la capacidad funcional, el examen físico debe orientar el tipo de valvulopatía existente y la ecocardiografía doppler-color debe completar en forma definitiva el estudio agregando información relevante como: cuantificación del defecto, estado de la función ventricular, tamaño de cavidades, existencia de cortocircuitos, presencia de masas endocavitarias y estimación de la existencia de HP 2 .
El objetivo de esta revisión es analizar en forma abreviada los aspectos claves del abordaje de un paciente portador de una valvulopatía de tipo insuficiencia a nivel mitral o aórtico, que requiera de anestesia para una cirugía no cardíaca. Especial énfasis debe hacerse en la el comportamiento fisiopatológico de cada lesión y su injerencia en la técnica anestésica, metas hemodinámicas y cuidados post anestésicos.
INSUFICIENCIA AÓRTICA (IA)
-
Epidemiología
La incidencia de IA en la población general es de un 10% siendo la mayoría leves a moderadas; menos de 0,5% son moderadas a severas, asociándose a mayor edad y sexo masculino1.
-
Mecanismo
La IA tiene como mecanismo causal la alteración de los velos o de la raíz aórtica, lo que se traduce en una alteración de la coaptación de dichos velos y por ende, regurgitación sanguínea hacia el ventrículo izquierdo en diástole 2 .
-
Clasificación de las IA
La clasificación de la IA se puede realizar de acuerdo múltiples formas:
-
Clasificación por etiología
-
Congénitas: – Aorta bicúspide.
-
Adquiridas: – Alteración de la raíz aórtica (principales causas: enfermedad del colágeno, hipertensión arterial).
– Alteración de los velos aórticos (principales causas: endocarditis bacteriana, enfermedad reumática).
-
Clasificación por tiempo de instalación
-
Aguda:
– Endocarditis bacteriana.
– Disección aórtica.
– Trauma torácico.
-
Crónica:
– Enfermedad reumática.
– Enfermedad del colágeno.
– Hipertensión arterial.
De esta clasificación vale la pena señalar que todas las IA de carácter agudo son de resolución quirúrgica de urgencia.
Un tercer método de clasificación es de acuerdo a si la lesión original se radica en la válvula propiamente tal o en la aorta ascendente proximal (Figura 1).
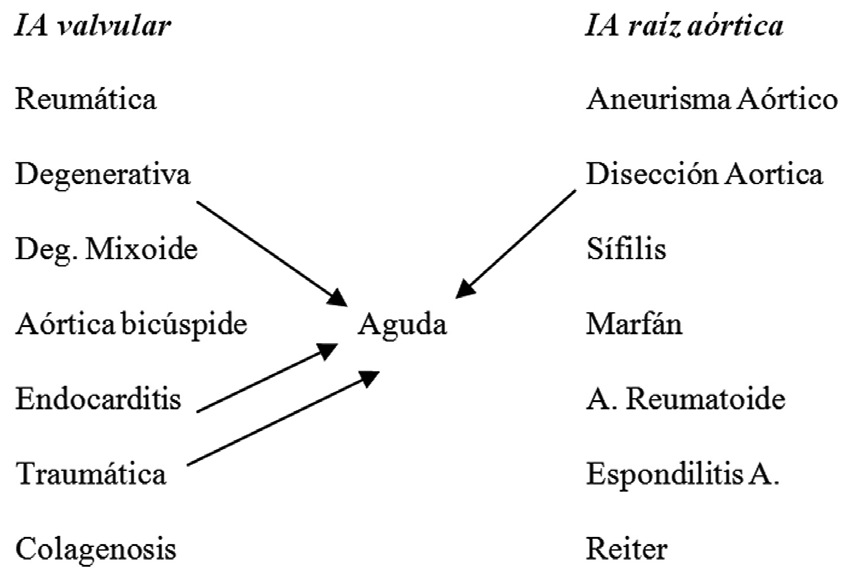
Figura 1 Clasificación de la insuficiencia aórtica de acuerdo a su origen en la válvula o en la raíz aórtica.
-
Fisiopatología
El trastorno fisiopatológico básico es la reducción del volumen sistólico anterógrado por la regurgitación de sangre desde la aorta hacia el ventrículo izquierdo (VI), lo que produce una sobrecarga de volumen de dicho ventrículo. La magnitud del volumen de sangre regurgitante depende de dos factores:
-
Tiempo de regurgitación, influido por la frecuencia cardiaca.
-
Gradiente de presión transvalvular, influido por la resistencia vascular sistémica.
La manera en que estos dos factores afectan el volumen regurgitante y, en consecuencia, comprometen la función ventricular varía de acuerdo a si la instalación del defecto ha sido progresiva (IA crónica) o repentina (IA aguda), razón por la cual adquiere tanta importancia la clasificación que considera el tiempo de instalación de la lesión.
En el caso de la insuficiencia aórtica crónica, existen mecanismos compensatorios que permiten el retardo de la aparición de los síntomas, hasta que se compromete la función ventricular (Figura 2). La respuesta a la sobrecarga de volumen en este caso se compensa para mantener flujo anterógrado mediante una serie de cambios adaptativos:
-
Dilatación del VI, que aumenta la precarga.
-
Hipertrofia del VI, que compensa el aumento de tensión de la pared.
-
Pérdida de la reserva de precarga, aumento de la postcarga y disminución de la fracción de eyección.
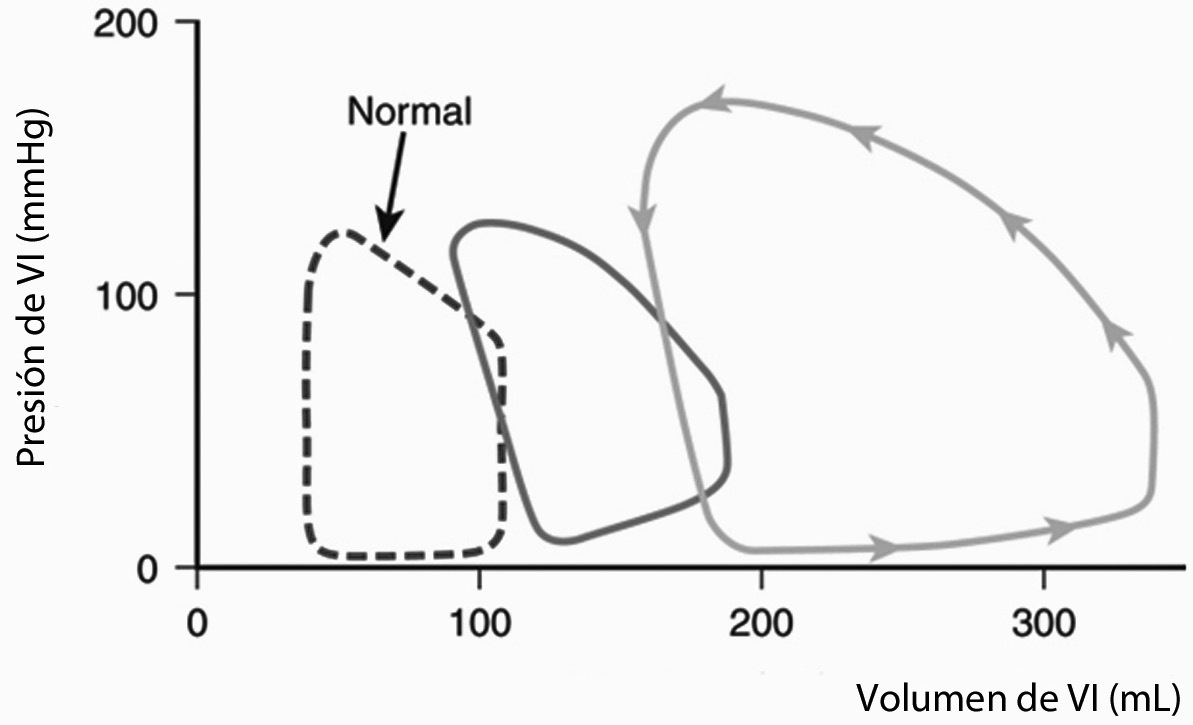
Figura 2 Cambios en la curva de presión/volumen ventricular izquierda en presencia de una insuficiencia aórtica.
En la insuficiencia aórtica aguda los mecanismos adaptativos no alcanzan a instalarse, por lo que existe aumento súbito de la precarga, edema pulmonar agudo y shock cardiogénico (Figura 3).
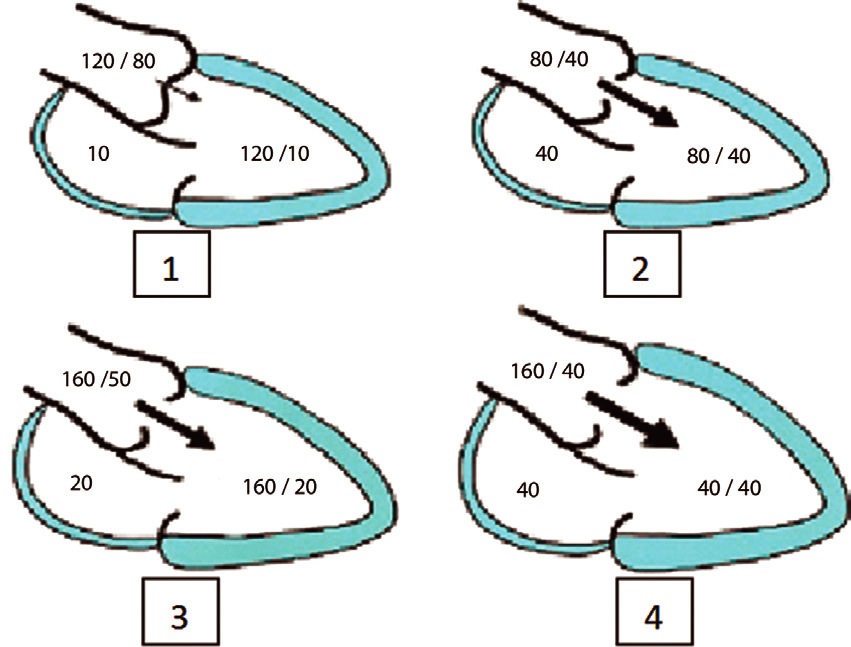
Figura 3 Relación de presiones en aorta y ventrículo izquierdo en presencia de una insuficiencia aórtica leve (1), aguda severa (2), crónica severa compensada (3) o crónica severa descompensada (4). (Modificado de Berkeredjian R, Grayburn PA. Valvular heart disease: aortic regurgitation. Circulation 2005; 112: 127).
-
Clínica
-
Sintomatología
Si el cuadro es de instalación aguda puede haber dolor torácico, disnea, insuficiencia cardiaca congestiva y shock cardiogénico. La forma crónica usualmente es asintomática en el inicio, apareciendo la sintomatología cuando la enfermedad avanza y compromete la función ventricular, momento en el cual se manifiesta con disnea, angina por ejercicio, taquicardia y palpitaciones.
-
Examen físico
Es característica la presencia de un soplo diastólico en foco aórtico, hiperdinamia, hipotensión diastólica con aumento de la presión diferencial.
-
Estudio de laboratorio
-
Al electrocardiograma el ritmo suele ser sinusal y existen signos de crecimiento de cavidades izquierdas.
-
La radiografía de tórax muestra cardiomegalia a expensas del ventrículo izquierdo y puede haber signos variables de congestión pulmonar.
-
El ecocardiograma doppler-color es el examen que determinará en forma precisa la cuantía de la lesión y de los efectos que ella ha producido sobre el funcionamiento global del corazón.
Respecto al primero de estos puntos, la ponderación de la insuficiencia requiere en primer lugar del análisis de la morfología valvular y luego, la integración de una serie de variables del doppler-color y espectrales, que cuantifican en forma precisa el grado de insuficiencia (Figuras 4 y 5). Entre ellos están:
-
Método de chorro proximal.
-
Extensión y área del chorro distal.
-
Diámetro de la vena contracta.
-
Convergencia de flujo proximal o PISA.
-
Determinación de inversión de flujo a nivel de la aorta.
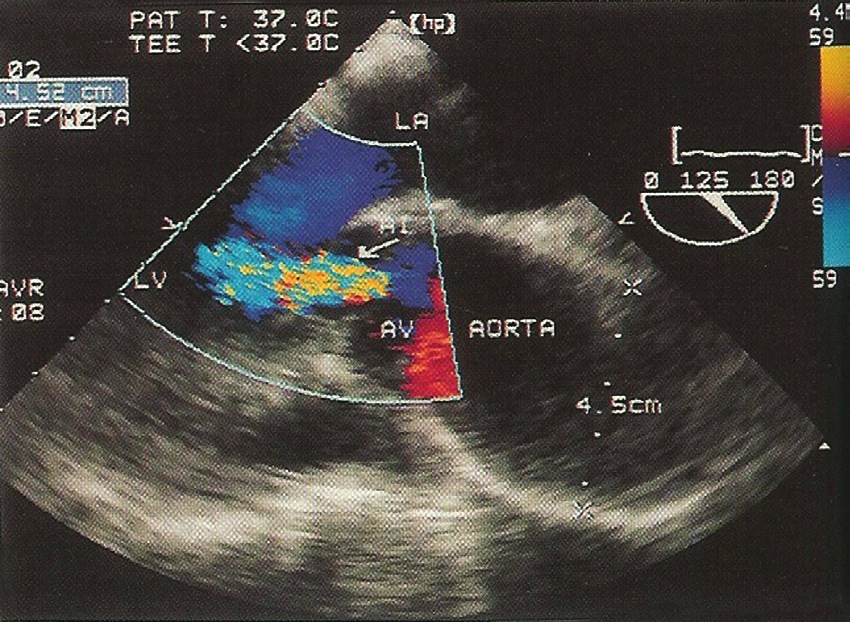
Figura 4 Insuficiencia aortica bajo ecocardiografía transesofágica – Jet de insuficiencia aórtica en una ecocardiografía transesofágica en visión medio-esofágica en 120º.
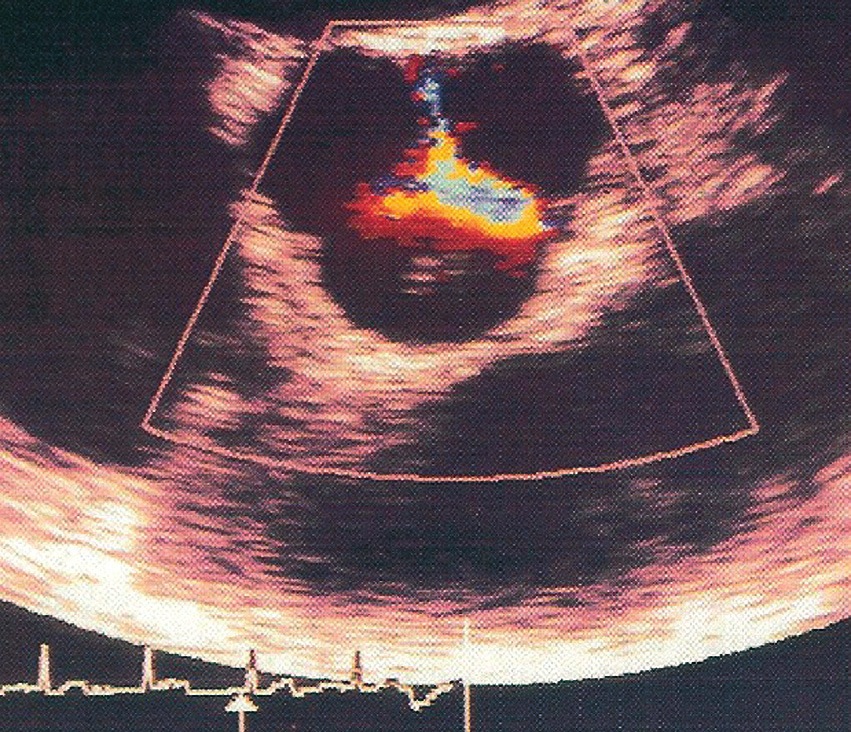
Figura 5 Insuficiencia aortica bajo ecocardiografía transesofágica – Área de insuficiencia aórtica en una ecocardiografía transesofágica en eje corto.
Respecto a las consecuencias que la insuficiencia aórtica ha producido sobre la función cardiaca, el ecocardiograma debe ponderar la dilatación de las cavidades (especialmente las izquierdas), la fracción de eyección del VI, la contractilidad global y segmentaria, la presión de arteria pulmonar y otras alteraciones coexistentes (como puede ser el compromiso de otras válvulas).
La Tabla 1 muestra varios de los datos obtenidos del estudio ecocardiográfico y su relación con la cuantía de la insuficiencia aórtica.
Tabla 1 Estimación de la severidad de una insuficiencia aórtica de acuerdo a los datos obtenidos mediante ecocardiografía transesofágica (De acuerdo a Asociación Española de Imagen Cardiaca)
|
Ligera |
Moderada |
Severa |
|
| Anchura jet/diámetro TSVI |
< 30% |
30-59% |
≥ 60% |
| Área jet/Área TSVI |
< 30% |
30-59% |
≥ 60% |
| Anchura jet modo M (mm) |
– |
– |
≥ 12 |
| THP jet (m seg) |
> 400 |
250-400 |
< 250 |
| Inversión de flujo en Ao descendente |
Protodiastólico |
– |
Holodiastólico |
| Señal doppler continuo |
Ligera |
Densa |
Densa |
| Fracción regurgitable |
< 30% |
30-55% |
> 55% |
| Volumen regurgitable (ml) |
– |
– |
> 60 |
| Orificio efectivo de regurgitación (cm2) |
< 0,10 |
0,10-0,29 |
≥ 0,30 |
| Diámetro diastólico V* (mm) |
< 60 |
60-75 |
> 75 |
| Vena contracta (mm) |
≥ 6 |
||
| Patrón de llenado mitral** |
Restrictivo |
||
| *Insuficiencias aórticas severas; **Insuficiencias aórticas agudas. | |||
La integración de los datos aportados por la historia clínica, el examen físico y los exámenes de laboratorio, en especial el ecocardiograma, ayudarán al anestesista a apreciar en qué lugar de la evolución natural de la enfermedad se encuentra el paciente y en consecuencia, cómo se debe enfocar el manejo anestésico.
-
Consideraciones anestésicas
En primer lugar, se debe considerar que la IA aguda siempre es una emergencia y su resolución es quirúrgica, por lo que es muy improbable enfrentar una cirugía no cardiaca en un paciente en tales condiciones.
En el paciente portador de una IA crónica que enfrenta una cirugía no cardiaca, se deben considerar los siguientes aspectos en la evaluación preoperatoria:
-
¿Se trata de una cirugía electiva o de urgencia?
-
Estado funcional del paciente.
-
Severidad de la IA.
-
Enfermedad de base y tipo de cirugía a realizar.
El manejo anestésico se basa en la modulación de 4 variables para disminuir el volumen regurgitante y maximizar el flujo anterógrado efectivo 4 : precarga, frecuencia cardiaca, contractilidad y postcarga.
El objetivo hemodinámico general es disminuir el flujo de regurgitación, favoreciendo el flujo anterogrado y, por ende, la mantención de un gasto cardiaco adecuado. Para esto hay que propender a:
-
Mantener una precarga adecuada (evitar la hipervolemia).
-
Mantener una frecuencia cardiaca normal alta (disminuye el reflujo).
-
Disminuir la postcarga (disminuye la gradiente aorto-ventricular, lo que a su vez disminuye el reflujo).
-
Técnica anestésica
Se debe considerar que los casos de IA leves a moderadas habitualmente serán asintomáticos, y no significarán un problema mayor dentro de nuestra práctica anestésica.
Son los casos moderados a severos donde el enfrentamiento debe perseguir con mayor rigurosidad los objetivos planteados previamente, evitando los cambios bruscos en la hemodinamia, independiente de la técnica anestésica 5 .
Tomando en cuenta la conveniencia de disminuir la postcarga, la anestesia regional, incluyendo los bloqueos neuroaxiales, no está contraindicada en pacientes portadores de IA.
El nivel de monitoreo necesario para controlar adecuadamente la estabilidad hemodinámica dependerá del paciente que se enfrenta en relación a su capacidad funcional, la severidad de su valvulopatía, la magnitud de la enfermedad de base y la cirugía a enfrentar. De este modo, pacientes sometidos a cirugía menor o de bajo riesgo, suelen requerir sólo el monitoreo no invasivo habitual de una anestesia normal.
En el caso de pacientes con lesiones moderadas a severas, el monitoreo invasivo indicado incluye línea arterial para medición de presión arterial invasiva y al menos una vía venosa central para medición de presión venosa central y especialmente para poder administrar drogas vasoactivas cuando así se requiere. El uso de catéter de arteria pulmonar debe ser reservado para aquellos pacientes que presentan disfunción ventricular izquierda o hipertensión pulmonar 5 .
Independiente del grado de la lesión, el enfrentamiento de una cirugía de larga duración y/o relacionada a pérdidas sanguíneas importantes o cambios bruscos del estado de la volemia, también hace necesario mayor monitoreo invasivo.
Según el reporte del año 2006 del American College of Cardiology/American Heart Association (ACC/AHA) 6 , la indicación de ecocardiografía transesofágica intraoperatoria como método de monitoreo, corresponde a una indicación categoría II, donde el objetivo es la mejoría del outcome clínico. Según esta recomendación, la categoría II la constituye el uso de la ecocardiografía como herramienta de monitorización preventiva frente a un eventual descalabro hemodinámico o como método de optimización de perfusión de órganos, en pacientes con elevado riesgo de trastorno hemodinámico.
La anestesia general balanceada con uso de halogenados o la anestesia total intravenosa deben considerar los efectos hemodinámicos de cada técnica. Es necesario evitar la hipovolemia haciendo un aporte juicioso de volumen previo a la cirugía. La inducción anestésica debe realizarse pausadamente, manteniendo las metas hemodinámicas y anticipando situaciones deletéreas como la bradicardia e hipertensión, que pueden aumentar el flujo de regurgitación y favorecer la dilatación ventricular, y evitando la hipotensión que puede comprometer la perfusión orgánica.
En el paciente portador de IA, el uso de vasoconstrictores puros como la fenilefrina o la norepinefrina no está indicado, puesto que aumentarán el reflujo y la dilatación ventricular. Por el contrario, el uso de efedrina, por su efecto inótropo y cronótropo positivo, mejora la contractilidad transitoriamente y aumenta levemente la frecuencia cardíaca y la precarga, normalizando la presión arterial al menos en parte debido a una mejoría del flujo anterógrado.
Si el paciente tiene una función miocárdica deprimida, la droga de elección es un inodilatador como la dobutamina en el caso de las aminas simpaticomiméticas o la milrinona en el caso de los inhibidores de la fosfodiesterasa III, que además de mejorar la contractilidad ventricular producen vasodilatación arterial y favorece el flujo anterógrado por dos vías complementarias.
La técnica mixta (general más bloqueo neuroaxial) no está contraindicada, si se tiene en consideración los objetivos hemodinámicos: precarga normal, frecuencia cardiaca normal alta, postcarga normal baja y contractilidad adecuada. Todo lo anterior se logra regulando la velocidad de instalación del bloqueo neuroaxial, considerando el bloqueo simpático y la vasodilatación secundaria 7 y teniendo en mente el efecto complementario que tendrán sobre la hemodinamia las drogas utilizadas para la anestesia general.
El manejo analgésico perioperatorio incluye todas las alternativas conocidas, tanto por vía parenteral como con bloqueos regionales.
-
Consideraciones postoperatorias
En la IA sintomática o moderada a severa, el cuidado postoperatorio debe efectuarse en una unidad de pacientes críticos. Los pacientes pueden presentar insuficiencia cardíaca congestiva de causa multifactorial, debido al aporte de volumen intraoperatorio y al aumento de la postcarga posterior al efecto anestésico. Es así que el manejo postquirúrgico debe considerar la obtención de los mismos objetivos hemodinámicos que los planteados para el intraoperatorio.
INSUFICIENCIA MITRAL (IM)
-
Epidemiología
La insuficiencia mitral es la valvulopatía más común en la población general. Su prevalencia como lesión moderada a severa o con significancia clínica es de un 1,7% en la población general, pero aumenta a un 9,3% en mayores de 75 años 8 .
-
Etiología
La etiología de la IM es múltiple. Dentro de las causas más habituales se encuentran: degeneración mixomatosa, enfermedad isquémica, endocarditis infecciosa y enfermedad reumática.
-
Fisiopatología
La IM puede presentarse en forma aguda o crónica. La forma aguda corresponde a un fenómeno súbito, habitualmente relacionado a rotura de un músculo papilar, una cuerda tendínea o endocarditis infecciosa con lesión de un velo. En tales casos, se desarrolla una IM severa con aumento de presión retrógrada, edema pulmonar agudo y shock cardiogénico, constituyendo una emergencia igual que en el caso de la insuficiencia aórtica aguda, cuya resolución es de carácter quirúrgico mediante la reparación de la lesión o el recambio por una válvula protésica.
La IM crónica, que es la lesión que con mayor frecuencia enfrentaremos en el contexto del perioperatorio de una cirugía no cardiaca, es la forma más frecuente de presentación y de acuerdo al mecanismo de origen se divide en dos grandes grupos:
-
Funcionales: en que la insuficiencia se presenta en una válvula estructuralmente normal, pero cuyos velos no coaptan adecuadamente debido a fenómenos de remodelación ventricular post isquemia o dilatación ventricular secundaria a otra valvulopatía, con dilatación del anillo de sustento de los velos y dilatación auricular secundaria.
-
Orgánicas: en que producto de un proceso patológico basal como enfermedad reumática o mixomatosis, los velos alteran su estructura, presentando fenómenos como engrosamiento, alteraciones de su excursión, retracción o prolapso.
El volumen de regurgitación causa aumento de presión en la aurícula izquierda y territorio vascular pulmonar, lo que asociado a una sobrecarga de volumen en el ventrículo izquierdo produce riesgo de disfunción ventricular. De este modo, una IM funcional puede contribuir a dilatación de las cavidades izquierdas y, por ende, a una mayor dilatación del anillo y mayor reflujo mitral.
En la IM orgánica, la función del ventrículo izquierdo es inicialmente normal y se adapta progresivamente a la sobrecarga de volumen. Esto se traduce en dilatación del ventrículo izquierdo con adelgazamiento de la pared, mecanismo que inicialmente mejora el flujo anterógrado, puesto que éste se encuentra determinado por la fracción de eyección (porcentual) de un volumen ventricular mayor. Este fenómeno compensa parcialmente la pérdida de parte de dicha fracción de eyección en sentido retrógrado.
La dilatación de la aurícula izquierda evita que el aumento retrógrado de las presiones repercuta mayormente a nivel de la vasculatura pulmonar y en las cavidades derechas. Este mecanismo funciona hasta que la distensibilidad de la aurícula izquierda no es capaz de amortiguar dicho aumento de presiones, momento en el cual aumenta el impacto del reflujo sobre la vasculatura pulmonar, produciendo congestión pulmonar, hipertensión pulmonar y dilatación de cavidades derechas.
-
Clínica
-
Sintomatología
En la insuficiencia mitral crónica los síntomas son tardíos. La disnea de esfuerzo y fatiga aparecen cuando los mecanismos compensatorios han sido sobrepasados y el volumen sistólico anterógrado se ve comprometido.
-
Examen físico
Los hallazgos del examen físico revelan sobrecarga de volumen con cardiomegalia (desplazamiento del ápex hacia lateral), latido hiperdinámico, soplo pansistólico en foco mitral y habitualmente pulso irregular, puesto que muchos de estos pacientes se encuentran en fibrilación auricular.
-
Estudio de laboratorio
-
Al electrocardiograma puede existir ritmo sinusal o fibrilación auricular y signos de crecimiento de cavidades izquierdas.
-
La radiografía de tórax puede mostrar cardiomegalia a expensas de crecimiento de la aurícula y el ventrículo izquierdo y grados variables de congestión pulmonar.
-
El ecocardiograma doppler-color también en este caso se constituye en el examen indicado para valorar la cuantía de la lesión y el impacto que ésta ha producido sobre la función cardiaca global.
Siendo la válvula mitral una estructura bastante más compleja que la aórtica, para evaluar el origen y la cuantía de la IM, se debe realizar un análisis morfológico de ella que considere una serie de factores que pudieran estar produciendo o contribuyendo al defecto, dentro de los cuales están:
-
El diámetro del anillo.
-
El grosor de los velos.
-
La movilidad de los velos.
-
El grado de coaptación de los velos.
-
La morfología de las cuerdas tendíneas.
-
La morfología de los músculos papilares.
Del mismo modo, la cuantificación del grado de reflujo mitral se puede realizar a través del análisis de una serie de variables (Figura 6):
-
Área del reflujo.
-
Diámetro de la vena contracta.
-
Área de convergencia de reflujo proximal o PISA.
-
Extensión del chorro de reflujo en la aurícula izquierda.
-
Inversión de flujo en la vena pulmonar superior izquierda.
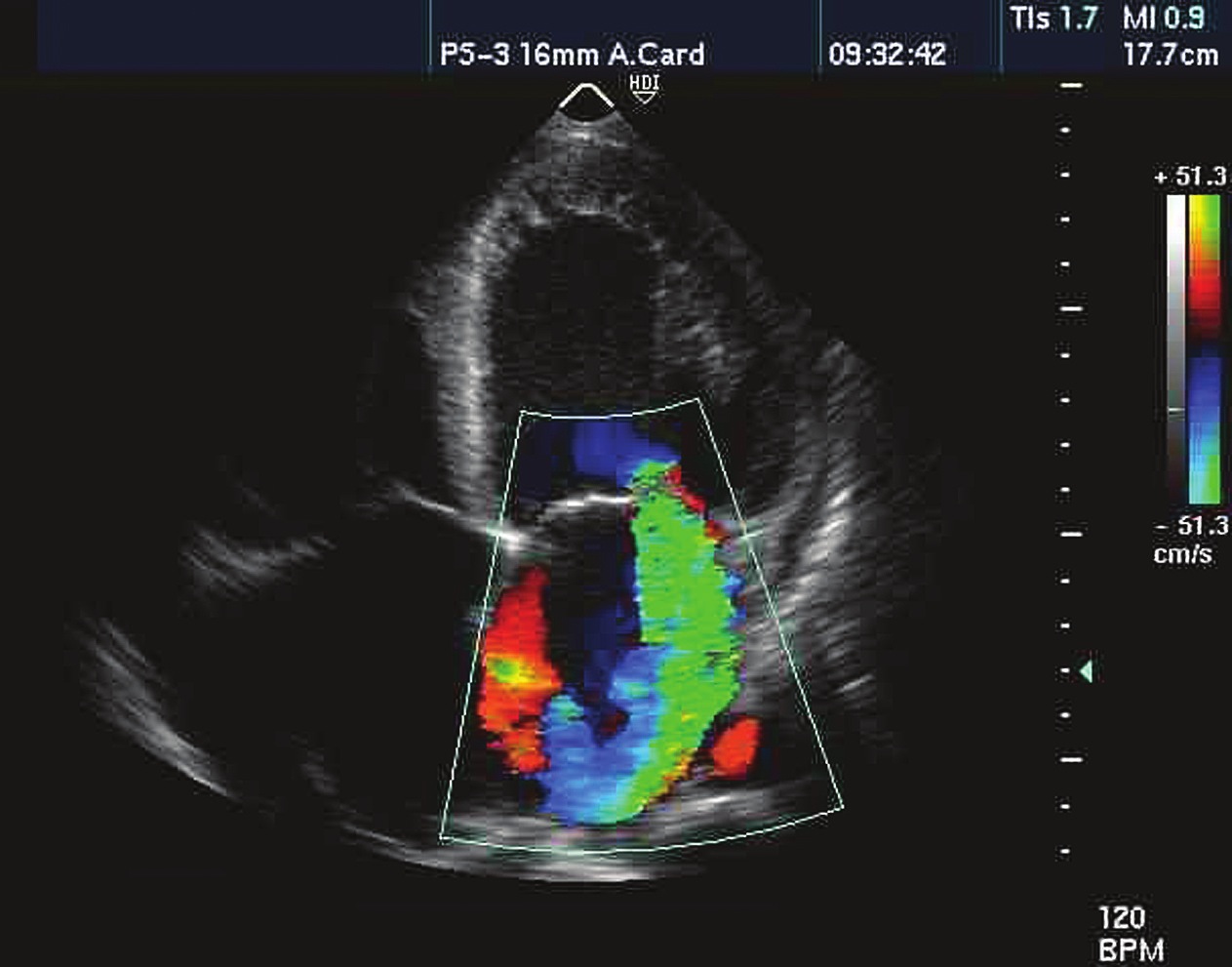
Figura 6 Insuficiencia mitral severa en ecocardiografía transtorácica.
Finalmente, la ponderación del impacto que la IM ha tenido en la función cardiaca global, al igual que en la insuficiencia aórtica, se realiza mediante la determinación del tamaño de las cavidades izquierdas y derechas, la medición de la presión de arteria pulmonar, la coexistencia de valvulopatías derivadas de la lesión original (como puede ser algún grado de insuficiencia tricuspídea), la fracción de eyección del VI y en caso de estar el paciente en fibrilación auricular, la eventual existencia de trombos intracavitarios 9 .
La Tabla 2 muestra varios de los datos obtenidos del estudio ecocardiográfico y su relación con el índice de severidad de la insuficiencia.
Tabla 2 Estimación de la severidad de una insuficiencia mitral de acuerdo a los datos obtenidos mediante ecocardiografía transesofágica (De acuerdo a Asociación Española de Imagen Cardiaca)
|
Ligera |
Moderada |
Severa |
|
| Área jet doppler color por ETT (cm2) |
< 4 |
4-8 |
> 9 |
| Área jet doppler color por ETE (cm2) |
< 6 |
6-9 |
> 9 |
| Área jet/área auricular izquierda |
< 20% |
20-40% |
> 40% |
| Fracción regurgitable |
> 30% |
30-55% |
≥ 55% |
| Volumen regurgitable (ml) |
≥ 60 |
||
| Diámetro de vena contracta (cm) |
≥ 0,5 |
||
| Orificio efectivo de regurgitación (cm2) |
≥ 0,3 |
||
| Inversión de flujo venas pulmonares |
NO |
NO |
SI |
| Velocidad máxima onda E (m/seg) |
≥ 1,5 |
||
| Diámetro telediastólico de VI (mm)* |
≥ 70 |
||
| Diámetro de aurícula izquierda (mm) |
≥ 60 |
||
| *En Insuficiencias Crónica. | |||
La función global, contractilidad y tamaño del ventrículo y aurícula izquierdos deben ser evaluados para definir la condición del paciente previo a una cirugía no cardiaca. Sin embargo, se debe recordar que el valor de la fracción de eyección como indicador de función ventricular es relativo en la IM, encontrándose habitualmente sobreestimada, puesto que la diferencia entre el volumen diastólico y el sistólico en estas condiciones se encuentra influenciado por dos flujos eyectivos que abandonan el VI en cada ciclo: uno hacia la aorta y otro hacia la aurícula izquierda.
-
Consideraciones anestésicas
Los pacientes portadores de IM leve a moderada suelen no presentan complicaciones relacionadas con su valvulopatía cuando son sometidos a cirugía no cardiaca.
Los pacientes portadores de IM moderada a severa que requieren cirugía no cardiaca son pacientes de alto riesgo, por lo tanto, requieren de un manejo multidisciplinario que permita la elaboración de un plan terapéutico que por un lado optimice las condiciones basales del paciente y por el otro logre las metas hemodinámicas definidas para esta valvulopatía 3 .
Los objetivos hemodinámicos para el manejo perioperatorio de un paciente en IM son los siguientes:
-
Minimizar el volumen regurgitado.
-
Optimizar el gasto cardiaco efectivo.
-
Controlar la presión de arteria pulmonar.
Para obtener estos objetivos hay que propender a:
-
Mantener una frecuencia cardíaca normal alta.
-
Mantener el ritmo sinusal en caso de estar en esta condición.
-
Mantener la frecuencia ventricular controlada en caso de estar en fibrilación auricular.
-
Mantener una precarga normal.
-
Mantener la contractilidad miocárdica normal.
-
Disminuir levemente la postcarga, actuando sobre la resistencia sistémica.
En el caso de que la IM sea de origen isquémico, la postcarga se debe mantener normal para evitar comprometer la presión de perfusión miocárdica, en tanto que la frecuencia cardiaca debe mantenerse normal baja para prolongar el diástole, favoreciendo también la perfusión miocárdica.
El manejo médico preoperatorio, incluyendo la optimización del ritmo cardiaco es complejo, puesto que se debe considerar que un 50% de los pacientes se encontrará en fibrilación auricular crónica 10 . Atendiendo a esto, el control de la frecuencia cardiaca en el preoperatorio es fundamental: los beta bloqueadores y antagonistas del calcio deben ser mantenidos.
El manejo de la anticoagulación perioperatoria no presenta cambios respecto a la conducta habitual. La vasodilatación debe manejarse con cautela para evitar la hipotensión intraoperatoria 11 .
La sedación preoperatoria no presenta riesgos, a menos que exista una hipertensión pulmonar severa que pueda verse agravada por una eventual hipoventilación con hipercapnia.
-
Técnica anestésica
El plan anestésico debe basarse en la condición del paciente y el tipo de cirugía, pudiéndose considerar tanto la anestesia regional como la general (inhalatoria o endovenosa total).
La anestesia regional es posible si el tipo de cirugía lo permite. Dentro de ellas, el bloqueo neuroaxial no está contraindicado, teniendo en consideración que el bloqueo simpático con sus efectos en el inotropismo y en el cronotropismo, no descompensen la condición hemodinámica del paciente. En casos de disfunción ventricular izquierda e hipertensión pulmonar severa, no parece recomendable optar por este tipo de anestesia.
La anestesia general inhalatoria o anestesia endovenosa total, asociadas a analgesia multimodal, deben considerar una serie de factores que sumados pueden ayudar a sostener la estabilidad hemodinámica. Entre ellos: una inducción lenta que permita manejar los cambios en las condiciones de carga ventricular e inotropismo, a través del uso de drogas vasoactivas; en caso de utilizar hipnóticos en bolo en la inducción debe considerarse el uso de drogas que no tengan efecto vasodilatador ni cardiodepresor directo, como el etomidato; recordar que incluso aquellas drogas que se denominan estables hemodinámicamente, tienen efecto sobre dichas variables por sólo el hecho de disminuir la actividad simpática del paciente; en caso de utilizar bloqueadores neuromusculares, preferir aquellos que no liberan histamina; evitar la hipoxia y la hipercapnia, puesto que ambas puede producir vasoconstricción pulmonar y agravar la hipertensión pulmonar 1 .
La monitorización intraoperatoria debe considerar además de la duración de la cirugía, la posibilidad de pérdidas sanguíneas importantes y la posición quirúrgica.
Independiente de estos factores, en la IM moderada a severa, además del monitoreo habitual utilizado en toda anestesia, puede ser necesario obtener otros parámetros que pudieran ser relevantes para complementar la información obtenida con la monitorización básica, entre ellos:
-
Electrocardioscopia: es conveniente utilizar un trazado de 5 electrodos, que permita el despliegue de dos derivadas simultáneas en el monitor. Salvo que la edad o la existencia de factores de riesgo coronario lo indiquen, la elección de dichas derivadas, más que detectar isquemia, debe ser dirigida al adecuado monitoreo del ritmo cardiaco. Se debe recordar que la mitad de estos pacientes accederá a pabellón en arritmia completa por FA y que la otra mitad, aunque llegue en ritmo sinusal, presentará un riesgo aumentado de caer en FA en el transcurso de la cirugía, lo cual puede desestabilizar su condición hemodinámica.
-
Temperatura: no es conveniente permitir que el paciente caiga en hipotermia iatrogénica, puesto que esta condición puede desestabilizar el estado hemodinámico del paciente sobre todo al despertar, producto de la vasoconstricción periférica y del aumento del consumo de oxígeno corporal relacionado con los calosfríos.
-
Presión arterial invasiva: el monitoreo continuo de la presión arterial es una condición imprescindible para poder corregir en forma oportuna las alteraciones hemodinámicas derivadas de la anestesia. Además, este tipo de monitoreo permite la interpretación de la forma de la curva de presión arterial, lo cual aporta indicios sobre la contractilidad miocárdica, el estado de volemia y la resistencia vascular sistémica.
-
Presión venosa central: La instalación de un catéter venoso central más que medir PVC, busca tener una vía disponible para la administración de drogas vasoactivas. Si disponiendo de él se mide dicho parámetro, se debe tener en cuenta que es muy improbable que la PVC refleje las condiciones de precarga del ventrículo izquierdo, sobre todo si el paciente ya presenta hipertensión pulmonar.
-
Presión de arteria pulmonar: la instalación de un catéter de arteria pulmonar permite la medición directa de la presión de arteria pulmonar, de la presión de capilar pulmonar, del débito cardiaco por termodilución y la estimación de las resistencias vasculares sistémica y pulmonar. Además, si fuese necesario, permite calcular las variables de transporte y consumo de oxígeno y de acuerdo a ellas adaptar la terapia. En consecuencia, su uso se encuentra indicado en aquellos casos más complejos que requieren un mayor nivel de monitoreo. En caso de ser utilizada, se debe tener en cuenta que las cifras de presión de capilar pulmonar suelen ser falsamente altas respecto a la presión de final de diástole del ventrículo izquierdo (PFDVI), puesto que se apreciará una amplia onda “v” en su trazado, producto del reflujo mitral, que falseará el dato. Del mismo modo, se debe tener en cuenta que la determinación de débito cardiaco por termodilución sobreestima el débito real, puesto que el volumen de sangre refluido puede producir un descenso menor en la temperatura que detecta el termistor del catéter.
-
Ecocardiografía transesofágica: Como método de monitorización intraoperatorio, permitirá realizar todas las evaluaciones previamente señaladas relacionadas con la morfología y función valvular y con el impacto de la insuficiencia valvular sobre la función ventricular. A ello se debe agregar que permitirá la estimación del débito cardiaco mediante la determinación del flujo a través del tracto de salida del ventrículo izquierdo, medición en este caso más representativa de la realidad que la medición por termodilución 12 , 13 .
-
Otros sistemas de monitoreo hemodinámico como PICCO, requieren aún de la validación necesaria para ser considerados útiles en este tipo de pacientes.
En el intraoperatorio existe un listado de prioridades que cumplir:
-
Realizar una valoración adecuada de las pérdidas y mantener al paciente euvolémico. La hipovolemia puede producir síndrome de bajo débito y la hipervolemia puede producir congestión pulmonar y falla cardiaca derecha.
-
Mantener al paciente normotérmico.
-
Programar una adecuada analgesia multimodal.
-
Prevenir y tratar los cambios hemodinámicos bruscos.
-
Evitar el uso de vasoconstrictores puros porque dificultan el flujo anterógrado y producen bradicardia refleja.
-
Si el paciente es portador de una IM de origen isquémico, mantener la presión de perfusión miocárdica.
-
Mantener la frecuencia cardiaca normal baja y la resistencia vascular sistémica normal alta.
-
Si los objetivos hemodinámicos no se consiguen con el uso de drogas vasoactivas en dosis adecuadas, eventualmente recurrir al uso de contrapulsación aórtica 14 .
La presión de arteria pulmonar es un parámetro útil, que debe mantenerse en niveles normales, para evitar la falla ventricular derecha. Las causas de aumento de la presión en arteria pulmonar en el intraoperatorio son:
-
Hipertensión (dolor, anestesia superficial).
-
Taquicardia (sobre todo si produce isquemia miocárdica).
-
Hipoxia.
-
Hipercapnia.
-
Broncoconstricción.
Si eventualmente se presenta esta complicación, se debe primero corregir la causa y evaluar el uso de inodilatadores (dobutamina o milrinona) que están indicados precozmente. No se debe olvidar que la nitroglicerina sirve en la etapa aguda para el manejo de la HP.
Al momento de la emergencia de la anestesia se deben evaluar los parámetros habituales: estabilidad hemodinámica, termorregulación, intercambio gaseoso, reología y condiciones quirúrgicas. Luego de lo cual, si se decide extubar al paciente, se debe nuevamente considerar las metas hemodinámicas señaladas y evitar los desencadenantes de HP.
-
Consideraciones postoperatorias
El postoperatorio de una IM moderada a severa de una cirugía mayor debe realizarse en una unidad de pacientes críticos con monitorización adecuada, que cuente a lo menos con módulo de gasto cardiaco e idealmente un ecocardiógrafo de superficie.
Las complicaciones más frecuentes de estos pacientes son las arritmias, la hipervolemia, el edema pulmonar agudo y la insuficiencia respiratoria. Dentro de los factores de riesgo de presentar eventos adversos en el postoperatorio, la existencia de cardiopatía coronaria y de hipertensión pulmonar son determinantes individuales.
En resumen, los pacientes portadores de IM moderada a severa requieren un manejo multidisciplinario, con un monitoreo adecuado y un manejo estricto de las metas hemodinámica. Los pacientes portadores de enfermedad isquémica, hipertensión pulmonar y disfunción ventricular izquierda requieren especial cuidado.
CONCLUSIONES
Las valvulopatías de tipo insuficiencia mitral y aórtica son muy frecuentes en sus formas leves y moderadas. La mayoría de las veces se trata de pacientes asintomáticos donde el hallazgo de la valvulopatía no conlleva mayores complicaciones desde el punto de vista anestesiológico.
Los pacientes de mayor edad con valvulopatías habitualmente degenerativas, con grados mayores de severidad y comorbilidades más complejas, requerirán de atención especial desde el preoperatorio, realizando un plan anestésico basado en metas hemodinámicas para todo el perioperatorio. La información entregada por la ecocardiografía es importante para entender en qué lugar de la evolución natural de la enfermedad valvular está nuestro paciente, lo que no siempre tiene una correlación clínica predecible.
El manejo anestésico debe ir dirigido a cumplir las metas hemodinámicas de forma tal de favorecer un gasto cardiaco adecuado. Los cuidados perioperatorios deben permitir mantener la estabilidad necesaria para evitar descompensaciones como el síndrome de bajo débito, la congestión pulmonar o la hipertensión pulmonar.
El monitoreo con ecocardiografía transesofágica, si es posible, es recomendado en pacientes de alto riesgo expuestos a trastornos hemodinámicos, como complemento al monitoreo habitual.
REFERENCIAS
- Frogel J, Galusca D. Anesthetic Considerations for Patients with Advanced Valvular Heart Disease Undergoing Non-cardiac Surgery. Anesthesiology Clin 2010; 28: 67-85.
- Le Corre, F, Marty J. Anestesia en pacientes cardiológicos excepto en cirugía cardíaca. Enciclopedia Médica Quirúrgica 2004; E-366-52-G 10: 1-12.
- Fleisher LA, Beckman JA, Brown KA, et al. ACC/AHA 2007 Guidelines on perioperative cardiovascular evaluation and care for noncardiac surgery. J Am Coll Cardiol 2007; 50: 59-242.
- Mittnacht AJ, Fanshawe M, Konstadt S. Anesthetic considerations in the patient with valvular heart disease undergoing noncardiac surgery. Semin Cardiothorac Vasc Anesth 2008; 12: 33-59.
- Cannesson M, Desebbe O, Lehot JJ. Anestesia y Reanimación en Cirugía Cardíaca. Enciclopedia Medico Quirúrgica 2008; E-36-585-A-10: 1-16.
- ACC/AHA 2006 Guidelines for the management of patients with valvular disease. Journal of The American College of Cardiologists 2006; 48: 1-148.
- Stoelting R. Anesthesia and co-existing disease. 4th edition. Philadelphia (PA): Churchill Livingstone Elsevier; 2002. p. 38-44 Anesthesia and valvular disease.
- Nkomo VT, Gardin JM, Skelton TM, et al. Burden of valvular heart diseases: a population based study. Lancet 2006; 368: 1005-1011.
- Grayburn P, Weissman N, Zamorano J. Quantitation of Mitral Regurgitation. Circulation 2012; 126: 2005-2017.
- Gillinov AM. Ablation of atrial fibrillation with mitral valve surgery. Curr Opin Cardiol 2005; 20: 107-114.
- Comfere T, Sprung J, Kumar MM, et al. Angiotensin system inhibitors in a general surgical population. Anesth Analg 2005; 100: 636-644.
- Mayer J, Boldt J, Poland R, et al. Continuous arterial pressure waveform based cardiac output using the FloTrac/Vigileo: a review and meta analysis. J Cardiothorac Vasc Anesth 2009; 23: 401-406.
- Schober P, Loer SA, Schwarte LA. Perioperative hemodynamic monitoring with transesophageal Doppler technology. Anesth Analg 2009; 109: 340-353.
- Siu SC, Kowalchuk GJ, Welty FK, et al. Intra-aortic balloon counterpulsation supporting the high-risk cardiac patient undergoing urgent non-cardiac surgery. Chest 1991; 99: 1342-1345.