Laura Illescas 1a , Eduardo Kohn 1b , Juan P. Bouchacourt 1c , Fiorella Cavalleri 1d , Javier Hurtado 1e , Juan Riva 1f
Recibido: 24-04-2019
Aceptado: 12-08-2019
©2019 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 48 Núm. 5 pp. 412-426|https://doi.org/10.25237/revchilanestv48n05.06
PDF|ePub|RIS
Exploratory systematic review: Usefulness of the measures derived from the partial pressure of CO2 in adult patients undergoing cardiac surgery with cardiopulmonary bypass
Abstract
Background: In critical patients, it has been proposed to measure the parameters derived from partial CO2 pressures as indicators of adequate peripheral perfusion and tissue oxygenation. Its use in cardiac surgery (CC) with extracorporeal circulation (CPB) is not yet elucidated. Primary objective: To determine the utility of ∆pv-aCO2 and the quotient ∆pv-aCO2/Ca-v O2 as indicators of cardiac output and anaerobic metabolism. As a secondary objective: to study the prognostic value of both, in adult patients undergoing CC with CPB. Methods: A literature search was carried out on: PubMed, EBSCOhost, LILACS, SciELO, COCHRANE and on the SCIENCE DIRECT website. 12 original articles were selected. Results: 7 studies analyzed the ∆pv-aCO2 and 2 the quotient ∆pv-aCO2/Ca-v O2. There was no relationship between these variables with the cardiac output, SvO2, SvCO2 and lactate or this was statistically very weak, so its clinical relevance was questionable. 7 studies analyzed the prognostic value ∆pv-aCO2 and/or ∆pv-aCO2/Ca-v O2 in terms of postoperative com-plications and/or mortality, finding contradictory results. The selected studies had a high risk of bias due to the types of studies and their methodological differences. Conclusion: There is not enough evidence to support that the ∆pv-aCO2 and/or the ∆pv-aCO2/Ca-v O2 are reliable indicators of cardiac output or tissue oxygenation as well as postoperative evolution in adult patients undergoing CC with CPB. It requires a better understanding of the pathophysiological events that occur in this type of surgery.
Resumen
Antecedentes: En pacientes críticos ha sido propuesta la medida de los parámetros derivados de las presiones parciales de CO2 como indicadores de una adecuada perfusión y oxigenación tisular. Su utilización en cirugía cardiaca (CC) con circulación extracorpórea (CEC) no está aún dilucidada. Objetivo primario: Determinar la utilidad del ∆pv-aCO2 y del cociente ∆pv-aCO2/C(a-v)O2 como indicadores de gasto cardíaco y metabolismo anaeróbico. Como objetivo secundario: el valor pronóstico de ambos, en pacientes adultos sometidos a CC con CEC. Métodos: Se realizó una búsqueda bibliográfica en: PubMed, EBSCOhost, LILACS, SciELO, CO-CHRANE y en el sitio Web de SCIENCE DIRECT. Fueron seleccionados 12 artículos originales. Resultados: En 7 estudios se analizó el ∆pv-aCO2 y en 2 el cociente ∆pv-aCO2/C(a-v)O2). No existió relación entre estos y el gasto cardíaco, SvO2, SvCO2 y el lactato o esta fue estadísticamente muy débil por lo que su relevancia clínica fue cuestionable. Siete estudios analizaron el valor pronóstico ∆pv-aCO2 y/o el ∆pv-aCO2/C(a-v)O2) en cuanto a complicaciones postoperatorios y/o mortalidad, encontrando resultados contradictorios. Los estudios seleccionados tuvieron un alto riesgo de sesgo por los tipos de estudios y por sus diferencias metodológicas. Conclusión: No existe evidencia suficiente que permita sostener que la ∆pv-aCO2 y/o el ∆pv-aCO2/C(a-v)O2) sean indicadores confiables de gasto cardiaco y/o de perfusión periférica así como de la evolución postoperatoria en pacientes adultos sometidos a CC con CEC. Se requiere una mejor comprensión de los acontecimientos fisiopatológicos que suceden en este tipo de cirugías.
-
Introducción
La cirugía cardíaca (CC) sigue siendo un procedimiento considerado mayor debido a su alta morbimortalidad[1]. Una diferencia sustancial con otras cirugías es la utilización de circulación extracorpórea (CEC) con sus consecuencias sobre diferentes sistemas[2] especialmente el cardiovascular[3]. Esto ha llevado a estudiar diferentes estrategias centradas en mejorar la disponibilidad de oxígeno (DO2) y su utilización en la periferia[4],[5]. Estas incluyen[6],[7] entonces la combinación de marcadores hemodinámicos sistémicos como el índice cardíaco (IC), presión arterial, presión venosa central junto a los de perfusión periférica como saturación de sangre venosa mezclada (SvO2), saturación de O2 de la vena cava superior (SvCO2) y lactato. Estos indicadores presentan limitaciones sea vinculadas al balance riesgo/beneficio, como sucede con el catéter en la arteria pulmonar y las medidas derivadas de él (IC, SvO2), o por el tipo de cirugía que afecta de diferente forma a estos marcadores (lactato, SvCO2)[8]-[11].
En el área de la medicina crítica se ha propuesto que la utilización de las medidas derivadas de las presiones parciales de CO2 (pCO2) son útiles para evaluar la perfusión sistémica y la utilización de oxígeno en la periferia, siendo incorporadas a las guías de resucitación en pacientes con sepsis y shock séptico[12]-[17]. Su aplicación en CC con CEC, presenta características especiales que afectan las variables que regulan la producción y transporte de CO2[18],[19] por lo que los hallazgos en pacientes críticos no son extrapolables. Las medidas propuestas son las siguientes: 1) la diferencia entre la pCO2 de la sangre venosa y la arterial (∆pv-aCO2) que permitiría detectar alteraciones del flujo sistémico y 2) el cociente entre ∆pv-aCO2 y la diferencia de contenido de oxígeno entre la sangre arterial y la venosa (C(a-v) O2) que podría estimar el estado de oxigenación tisular.
Determinantes de la PCO2
El CO2 se produce por la oxidación de lípidos y carbohidratos para la producción de compuestos de alta energía. A nivel del citosol, estos sustratos de energía en reacción con el O2 formarán compuestos de alta energía (ATP) y piruvato. Este último, dentro de la mitocondria, entrará en el ciclo de Krebs y será responsable de la VCO2 en forma aeróbica. Cuando existe una disminución crítica de la DO2 la glucólisis se realizará en forma anaeróbica por lo que el piruvato será desviado a la formación de lactato a nivel del citosol. El bicarbonato, principal amortiguador del lactato, será entonces el determinante de la formación de H2O y CO2 (producción anaeróbica). Situación que también puede ser causada por un aumento del VO2. Existe un acoplamiento entre VO2 y la VCO2 que se expresa en el cociente respiratorio CR = VCO2/VO2. Este puede verse afectado por alteraciones en la DO2 (anaerobiosis) como fue analizado previamente, pero también frente a aumentos del metabolismo basal (hipertiroidismo, por ejemplo) sin que esté afectada la DO2, pero provocando un aumento adicional de la producción de CO2.
Producido el CO2 este pasará desde la célula a la sangre capilar por difusión pasiva mediante un gradiente de concentración entre ambos compartimentos. El transporte del CO2 en la sangre se realiza a través de tres formas: 1) Disuelto en el plasma, por lo que depende de su solubilidad. Es el determinante de las presiones parciales (PCO2), siendo fundamental para la entrada o salida desde la sangre. Corresponde al 5-10% del total del CO2 en sangre arterial; 2) Unido a proteínas. La unión del CO2 a la cadena N-terminal de los aminoácidos es lo que constituye los compuestos carbamínicos, siendo el más importante el unido a la globina de la hemoglobina (Hb). La regulación está determinada fundamentalmente por la forma en que esté unida al O2, ya que la Hb reducida aumentará la capacidad de transporte. Corresponderá a un 5% del total; 3) Bajo forma de bicarbonato. El CO2 se combina con agua formando ácido carbónico que rápidamente se disocia en hidrogeniones e iones bicarbonato (CO2 + H2O ↔ H2CO3 ↔ H+ + HCO3). Esta reacción es catalizada por la anhidrasa carbónica la cual acelera 2.000 veces la conversión de CO2 en H2CO3. Esta enzima está presente fundamentalmente en los eritrocitos siendo la forma más importante cuantitativamente de transporte de CO2 en la sangre. Corresponde al 80 a 90%.
Existe una interacción entre el O2 y el CO2 que afectará el transporte de este último. A nivel periférico, en la medida que la Hb cede oxígeno, se reduce y aumenta la capacidad de transportar CO2. Cuando llega a los pulmones, ocurre lo inverso, la Hb se oxigena, aumenta su acidez y aumenta la capacidad de liberar el CO2 (efecto Haldane). Al igual que lo que ocurre con el O2, existe una relación entre el contenido total de CO2 (CCO2) y la PCO2 (curva de disociación del CO2 con la hemoglobina), la cual presenta la característica de que en condiciones fisiológicas es cercana a la linealidad. No obstante, puede afectarse de forma diferente por varios factores: concentración de Hb, equilibrio ácido base, efecto Haldane, temperatura, entre otras.
Por último, la eliminación de CO2 se realizará mediante un gradiente de concentración entre la sangre venosa y el alveolo. La cantidad de CO2 que llegue al alveolo dependerá de la producción y transporte ya analizados y de la capacidad de difusión a través de la membrana alveolo-capilar. La concentración alveolar de CO2 estará determinada fundamentalmente por la ventilación alveolar.
∆pv-aCO2 como indicador de gasto cardíaco (GC)
Esta interpretación se basa en el principio de Fick, donde la producción total de CO2 (VCO2) será igual al producto del GC por la diferencia del contenido veno-arterial de CO2. Asumiendo que, en condiciones estables, existe una relación casi lineal entre las pCO2 y el CCO2, sería posible sustituir la diferencia de CCO2 por la diferencia entre las pCO2. Por lo tanto, el GC = VCO2/ ∆pv-aCO2 es decir que, existirá una relación lineal inversa entre gasto cardíaco y ∆pv-aCO2. Su valor normal es de 6 mm Hg aproximadamente, valores superiores reflejarían un enlentecimiento del flujo sistémico que permitiría un mayor tiempo de tránsito de CO2 en los tejidos, provocando un aumento de la PCO2 en la sangre venosa (PvCO2).
∆pv-aCO2/(C(a-v) O2) para estimar el metabolismo anaerobio
El cociente respiratorio (CR) es la relación entre VCO2/VO2, mientras que la VCO2 será igual a GC x ∆pv-aCO2, el VO2 será igual al producto del GC por la diferencia arterio-venosa de oxígeno (C(a-v) O2). De esta forma el CR = GC x ∆pv-aCO2/GC xC(a-v)O2. Al suprimir el GC en ambas partes de la fórmula, el CR será igual ∆pv-aCO2/C(a-v)O2. Se ha sugerido que valores superiores a 1,4 mm Hg/ml indicarían metabolismo anaeróbico. Frente a una disminución de la disponibilidad de O2 caerán tanto el VO2 como la producción de CO2 por lo que, el CR se mantendría dentro de valores normales. Cuando la caída de la DO2 es “crítica”, el VO2 será dependiente de la DO2, y por lo tanto, disminuirá al igual que la VCO2 “aeróbica”, por lo que el cociente se mantendrá. Sin embargo, progresivamente existirá un aumento de la VCO2 desde las vías “anaeróbicas” aumentando entonces la PvCO2, la ∆pv-aCO2 y por consiguiente el cociente ∆pv-aCO2/(C(a-v) O2). Un valor superior a 1,4 sería entonces indicador de hipoxia tisular.
La cirugía cardíaca con CEC presenta características especiales que afectan la producción y transporte del CO2 de diferente forma, que incluso persisten una vez finalizada la CEC[18],[20]. Esto plantea dudas con respecto a su aplicación ya que cuestiona los principales supuestos en los que se apoyan estos indicadores. Basados en estas consideraciones nos planteamos como objetivo principal analizar la utilidad de la ∆pv-aCO2 y el ∆pv-aCO2/C(a-v)O2 como indicadores de gasto cardíaco y metabolismo anaeróbico. Como objetivo secundario analizamos el valor pronóstico de la ∆pv-aCO2 y el ∆pv-aCO2/C(a-v)O2, en pacientes adultos sometidos a cirugía cardíaca con circulación extracorpórea.
-
Material y Métodos
Se realizó una revisión sistemática exploratoria[21], siguiendo las directrices de la declaración PRISMA-ScR[22].
Se realizó una búsqueda bibliográfica en las siguientes bases de datos: PubMed, EBSCOhost, LILACS, SciELO, COCHRANE y en el sitio Web de SCIENCE DIRECT. La búsqueda de los autores se complementó con otra realizada por un especialista en documentación de la Biblioteca Virtual en Salud del Sindicato Médico del Uruguay.
No hallamos revisiones bibliográficas previas en pacientes sometidos a cirugía cardíaca. Seleccionamos revisiones con igual objetivo en pacientes críticos, las cuales fueron analizadas como fuente de información.
Fueron seleccionados artículos originales que correspondieran a procedimientos de cirugía cardíaca con circulación extracorpórea, en pacientes adultos, que evaluarán la ∆pv-aCO2 y el ∆pv-aCO2/(C(a-v) O2) y las relacionaran con variables hemodinámicas utilizadas habitualmente en la práctica clínica: índice cardíaco, SvO2, SvCO2, lactato y evolución, incluyendo complicaciones postoperatorias y mortalidad.
No hubo limitaciones con respecto al idioma ni al año de la publicación.
Fueron excluidos los estudios en pacientes pediátricos y/o con cardiopatías congénitas, así como otros tipos de procedimientos quirúrgicos diferentes a la cirugía cardíaca.
Las palabras claves utilizadas fueron las siguientes: cardiac surgical procedures, carbon dioxide, postoperative complications/mortality, cardiopulmonary bypass, central venous oxygen saturation, central venous-to-arterial carbon dioxide difference, mixed venous to arterial carbón dioxide difference, cardiac index. En una primera etapa se utilizaron múltiples términos combinados por el operador OR.
La selección de los artículos fue realizada por dos autores en primera instancia en forma independiente. En caso de discrepancias se consultó a un tercer revisor y se decidió su inclusión o no por consenso. El procedimiento se realizó de la siguiente forma: en primer lugar, se analizaron los títulos y resúmenes de los artículos que correspondieron a la búsqueda seleccionando aquellos que cumplieran los criterios antes señalados. Se procedió a obtener los artículos completos. Luego se realizó una búsqueda manual de las referencias bibliográficas de los artículos seleccionados.
La obtención de datos se realizó mediante un formulario pre establecido en el que constaba: año, objetivo y tipo de estudio (prospectivo/retrospectivo, descriptivo/analítico), análisis estadístico realizado, número de pacientes, lugar de extracción de la muestra de sangre, tipo de cirugía cardíaca, resultados y conclusiones en cuanto a asociación con valores gasométricos, hemodinámicos, complicaciones postoperatorias y mortalidad.
-
Resultados
Se hallaron 200 resúmenes de estudios de acuerdo a las palabras claves establecidas. Luego de revisados se seleccionaron 33 para su lectura completa. De ellos se excluyeron 18 artículos que incluían diferentes tipos de pacientes (sepsis, cirugía general, etc.). Por consenso entre 3 autores se excluyó el estudio de Cavaliere[20] dado que su objetivo fue evaluar cómo se afecta la capacidad de transporte de CO2 durante la CEC, pero no cumplía con los objetivos de la revisión. Dos estudios que cumplían los principales objetivos fueron descartados ya que estudiaban pacientes pediátricos[23],[24].
Por consenso se decidió incluir el estudio de Pölönen[5]. Si bien su objetivo principal no fue el análisis del ∆pv-aCO2, en sus resultados lo describe frente a modificaciones del IC (Figura 1).
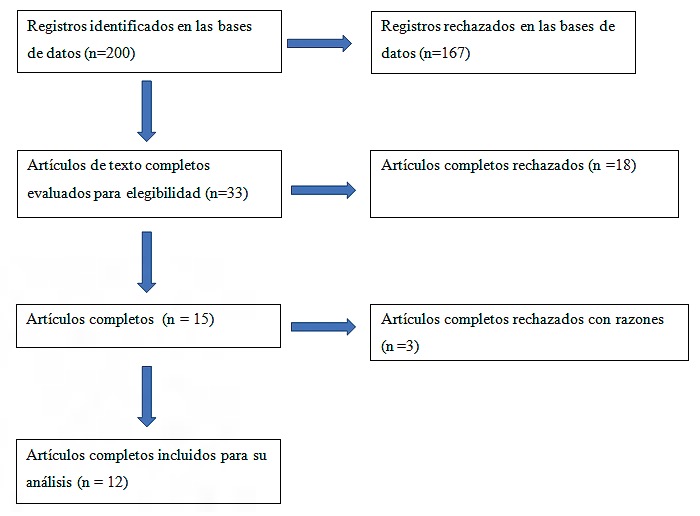
Figura 1. Diagrama de flujo de trabajos incluidos.
Luego de la lectura completa fueron seleccionados 12 artículos que se presentan en la Tabla 1.
Utilidad de la ∆pv-aCO2 y del ∆pv-aCO2 /(C(a-v) O2 ) como indicadores de gasto cardíaco y/o metabolismo anaeróbico
De los estudios seleccionados, 8 analizaron la utilidad de éstos como indicadores de gasto cardíaco y/o metabolismo anaeróbico [5],[25]-[31]. En otros 5 se investigó la correlación del ∆pv-aCO2 con las medidas utilizadas habitualmente para evaluar gasto cardíaco y perfusión periférica (IC, SvO2, SvCO2 y lactato). Ariza y cols.[25], hallaron correlación significativa entre ∆pv-aCO2 y gasto cardiaco r = -0,37, p ≤ 0,01 y lactato r = -0,3 p ≤ 0,05. Esto coincidió con otros autores donde ∆pv-aCO2 mostró correlación significativa positiva con lactato (r = 0,26) y negativa con SvO2 (r = -0,35) e IC (r = -0,27[26]. Los resultados de Guinot y cols.[27 ], mostraron que el ∆pv-aCO2 se correlacionó significativamente con el lactato (r = 0,22) y SatvCO2 (r = -0,43). Por el contrario Heinze y cols. (28) informan una correlación no significativa entre ∆pv-aCO2 e IC (r2 = 0,03), SvO2 (r2 = 0,007) y lactato (r2 = 0,000). En su análisis agregan un estudio de concordancia entre ∆pv-aCO2 obtenido de la sangre venosa mezclada y la de la vena cava superior cuyos resultados muestran una correlación significativa pero con límites de concordancia de 6,7 mm Hg y un porcentaje de error de 115%. En igual sentido Cavaliere y cols.[29], encuentran que el ∆pv-aCO2 no se correlacionó significativamente con: IC (r = 0,24), SvO2 (r = 0,19), ni el lactato (r = 0,30). Habicher y cols.[30] estudiaron 4 pacientes que asocian Svc ≥ 70% con ∆pv-aCO2 mayor a 8 mm Hg, considerándolos inadecuadamente reanimados durante el postoperatorio, y los compara con 21 pacientes que presentan ∆pv-aCO2 menor a 8 mm Hg. Los primeros presentaron valores significativamente mayores de lactato (p ≤ 0,01) y más bajos de SvO2 (p = 0,01). El IC no mostró diferencias estadísticamente significativas entre los grupos (p = 0,06). Por último Pölönen[5] informa que en un grupo de pacientes donde se realizó tratamiento guiado por objetivos, hubo un incremento significativo del IC, menores valores de lactato y mayores de SvO2. Sin embargo, ∆pv-aCO2 se incrementó significativamente en el mismo período.
En 2 estudios se analiza el gradiente ∆pv-aCO2/C (a-v) O2 con resultados diferentes. Wei Du[31] valora si este es capaz de predecir la respuesta de aumento del VO2 frente al aumento de la DO2, y por tanto, estimar la situación del metabolismo anaerobio. Durante el postoperatoria inmediato (6 horas), a aquellos pacientes considerados como subreanimados por poseer hiperlactacidemia (lactato > 2 mmol/L) con SvCO2 normal (> 60,8%), se les realizó un tratamiento con el objetivo de aumentar la DO2. Este consistió en diferentes estrategias de reanimación en base a fluidos y/o sangre, y/o drogas, considerando a aquellos en que la DO2 cambió más de un 10%, como respondedores al tratamiento. A este grupo de respondedores a su vez se los dividió en 2 grupos de acuerdo a como se modificaba el VO2 1) en los que aumentaba y 2) en los que se mantenía incambiado. Finalmente, analiza los valores de varias variables en los registros basales para identificar cuál de ellos fue capaz de predecir este grupo de pacientes que respondió al tratamiento con un aumento del VO2. De todos ellos el cociente ∆pv-aCO2/C(a-v)O2 ≥ a 1,6 mm Hg/ml fue capaz de hacerlo con una sensibilidad de 68,8%, una especificidad de 87,5% y un área bajo la curva de 0,77 ± 0,10 (p = 0,032). El resto de las variables incluyendo ∆pv-aCO2 no fueron capaces de hacerlo. De esta forma concluye que el cociente ∆pv-aCO2/C(a-v)O2 es un indicador de metabolismo anaeróbico y que será capaz de responder a un tratamiento dirigido con una mejor utilización del O2. Abou-Arab O[32] evalúa el cociente ∆pv-aCO2/(C(a-v) O2) como un indicador predictivo de modificaciones del VO2 frente al desafío de volumen. No encuentran correlación estadísticamente significativa con el lactato (r = 0,052 p = 0,587), ni que sea predictor de las modificaciones del VO2 frente al desafío de volumen, con un área bajo la curva de 0,53 (0,4-0,65) y p = 0,71.
Valor pronóstico ∆pv-aCO2 y/o el ∆pv-aCO2 /(C(a-v) O2 )
Para Cavaliere y cols[29] los pacientes con ∆pv-aCO2 mayor a 7 mm Hg durante el postoperatorio inmediato presentaron mayor frecuencia de complicaciones (52% versus 11% p ≤ 0,05). Estas incluyeron: falla cardíaca, arritmias cardíacas, elevación de la creatininemia, ictericia y prolongación de la ventilación mecánica. Otros autores[33] encuentran, mediante análisis de multivariante, que ∆pv-aCO2 a las 2 horas de ingreso a la Unidad de Cuidados Intensivos (UCI) fue el único biomarcador independientemente asociado a complicaciones mayores, no así para el resto de los tiempos de medida dentro del primer día de postoperatorio. El cociente ∆pv-aCO2/C(a-v)O2 fue similar entre grupos y no se asoció a complicaciones postoperatorias. Los 4 pacientes analizados por Habicher[30] que asociaban Svc ≥ 70% con ∆pv-aCO2 mayor a 8 mm Hg presentaron mayores complicaciones cardiovasculares (p = 0,02).
En un enfoque diferente Denault y cols[34] evalúan la incidencia de valores elevados de ∆pv-aCO2 (mayores a 4-6 mm Hg) y su relación con las dificultades en la separación del paciente de la CEC. En el análisis multivariado identifican la ∆pv-aCO2 pre bypass elevada como predictor de separación dificultosa (p =0,03). A su vez este grupo presentó mayor estadía en UCI, mayor estadía hospitalaria y mayor mortalidad (p = 0,022, p = 0,04 y p = 0,036 respectivamente).
Por el contrario, otros estudios no confirman estos resultados. Guinot y cols.[27], concluyen que el ∆pv-aCO2 no se asocia con: complicaciones postoperatorias, mortalidad, score de SOFA ni estadía en la UCI. Morel y cols.[35], comparan, durante el postoperatorio, pacientes con ∆pv-aCO2 menor a 6 mm Hg contra los que presentaban valores mayores o iguales a 6 mm Hg. Sorpresivamente los primeros presentaron peor pronóstico, con índice de SOFA a las 24 horas más alto (p = 0,01) y mayor mortalidad hospitalaria y a los 6 meses (p = 0,004 y p = 0,05 respectivamente). Por último Pölönen[5] encuentra que en un grupo de pacientes bajo tratamiento guiado por objetivos, la morbilidad fue menor así como la estadía hospitalaria (p ≤ 00,1 y ≤ 00,5 respectivamente), sin embargo, el ∆pvaCO2 no mostró diferencias significativas entre los grupos.
La mayoría de los estudios fueron prospectivos y observacionales destacándose un ensayo clínico. Todos correspondieron a CC con CEC, el tipo de cirugía fue variable, en 7 incluyeron todo tipo de cirugía cardíaca con CEC, 3 corresponden a revascularización miocárdica (RVM) y 2 no informan el tipo de cirugía. La temperatura utilizada para los procedimientos no fue uniforme incluyéndose desde hipotermia moderada a profunda.
En cuanto a los métodos el tamaño muestral mostró una amplia dispersión, entre 10 y 396 pacientes. El punto de corte para considerar un valor normal de ∆pv-aCO2 también fue variable (entre 4 mm Hg y 8 mm Hg), así como el sitio de extracción de la muestra de sangre venosa para su cálculo (SvCO2 y/o SvO2).
El tipo de complicaciones postoperatorias fue informado, aunque varió en cada estudio desde las preestablecidas a las registradas de acuerdo a su aparición.
La extensión en el tiempo de los estudios fue desde el análisis durante el intraoperatorio hasta 48 horas de postoperatorio.
-
Discusión
De acuerdo a la bibliografía analizada tanto la ∆pv-aCO2 como el cociente de ∆pv-aCO2/C(a-cv) O2 no deben ser utilizados como indicadores de gasto cardíaco y/o metabolismo anaeróbico en pacientes sometidos a cirugía cardíaca. Los estudios no encuentran correlación estadísticamente significativa o, en aquellos que sí la encuentran, las correlaciones fueron débiles para justificar su aplicación clínica y con alto riesgo de sesgo en sus resultados.
Estos hallazgos difieren con lo descritos para otros escenarios clínicos como en los pacientes sépticos[16],[36],[37]. Las causas de esta diferencia pueden ser varias. Durante la CC con CEC existen varios factores que afectan de diferente forma la producción y transporte de CO2, y por lo tanto, la linealidad entre pCO2 y CCO2, requerimiento necesario en el principio de Fick y para la aplicación clínica de la ∆pv-aCO2 y el ∆pv-aCO2/C(a-v)O2. Durante la CEC, la curva de disociación del CO2 con la hemoglobina se aplana, tanto en la sangre arterial como en la venosa[20]. Mientras que en la primera esta modificación se corrige al cesar la CEC, en la sangre venosa esto persiste durante el postoperatorio. La principal causa sería la hemodilución provocada por el cebado, donde se estima una reducción del transporte del CO2 en un 30%. Sin embargo, una vez corregida la hemoglobina, esto no se acompaña de una corrección completa de la curva de disociación, lo que hace pensar que existen otros factores y especialmente la disminución del pH, como responsable de la persistencia de esta alteración. Otro aspecto presente y vinculado a este tipo de cirugía es la necesidad de diferentes grados de enfriamiento y posterior recalentamiento activo. Estos cambios bruscos y por períodos cortos de la temperatura afectan el VO2 así como la solubilidad y la producción de CO2 varias horas después de finalizada la cirugía[38].
La CEC, pero también la cirugía en sí misma, son determinantes mayores de una respuesta inflamatoria prácticamente constante que se asocia a un síndrome de bajas resistencias[2],[39]. Esto determina alteraciones hemodinámicas de diferentes grados que afectarán la microcirculación y, por tanto, el lavado de CO2 en la periferia[3].
Por otra parte, el paciente transcurre por diferentes etapas de profundidad anestésica que provocarán diferencias en cuanto a la extracción de oxígeno[40]. Los propios cambios de la PaCO2 durante las diferentes formas de ventilación pueden afectar la ∆pv-aCO2. Ha sido propuesto que la hipocapnia provoca un aumento del ∆pv-aCO2 a pesar de mantenerse estable el IC y la perfusión periférica. Esto sería consecuencia de la vasoconstricción provocada por la hipocapnia, la cual provoca un mayor estancamiento del CO2 en la periferia au-mentando el ∆pv-aCO2 [35].
En cuanto a la metodología utilizada en los estudios analizados: uno de los aspectos importantes es la variabilidad en cuanto al lugar de extracción de la muestra de sangre, vena cava superior y/o arteria pulmonar. No es razonable desde el punto de vista clínico la sustitución de los valores obtenidos de la primera (pvcCO2), por los de la arteria pulmonar (pvCO2) para su cálculo. Heinze y cols.[28], encuentran una correlación significativa entre ambos valores para la ∆pv-aCO2, pero con límites de concordancia muy amplios (6,7 mm Hg), inaceptables para tomar decisiones diagnósticas y terapéuticas. Si bien en pacientes críticos algunos autores[13] han encontrado una razonable concordancia entre estos valores, otros cuestionan estos resultados. Dubin y cols.[41], encuentran pobre concordancia cuando la relación veno-arterial de CO2/diferencia arteriovenosa de contenido de O2 se calculó con muestras de arteria pulmonar o de vena central. En función de ello plantean que estas medidas no son intercambiables. Además, la relación ∆pv-aCO2/C(a-v)O2 se modifica significativamente por varios factores, entre los que destaca la concentración de hemoglobina, con la que guarda una correlación significativa (r2 = 0,48 p < 0,01).
Durante la CC se producen cambios importantes y en períodos breves de tiempo que afectan en forma diferente los territorios correspondientes a la parte superior del cuerpo, especialmente el sistema nervioso central comparado con el esplácnico[8],[9],[40]. La sangre de la vena cava superior refleja la PCO2 proveniente fundamentalmente del metabolismo cerebral, que será diferente de acuerdo al momento del procedimiento según el grado de sedación/anestesia y al tipo de ventilación. Por otro lado, la sangre venosa mezclada incluye la PCO2 proveniente del territorio esplácnico que tendrá diferencias en la producción y transporte del CO2 como consecuencia de una redistribución del flujo regional determinada por la hipoperfusión/reperfusión, enfriamiento/recalentamiento, etc. Por lo tanto, las respuestas de cada territorio serán diferentes y muchas veces en sentido opuesto.
A esto debe agregarse que en los estudios analizados se considera dentro de los grupos con reanimación adecuada valores de SvcO2 superiores a 70% en algunos casos e incluso mayores a 60% en otros. En pacientes sometidos a cirugía cardíaca valores “supranormales“ de SvCO2(> 75%) se asocian a mayor mortalidad por lo que la incorporación de ese rango de valores de SvCO2 como “normales” puede estar generando un sesgo importante[42].
Con respecto al objetivo secundario, es decir, la capacidad de predecir la evolución de complicaciones postoperatorias, los resultados son contradictorios. Quienes no encuentran asociación la atribuyen a los mismos motivos analizados anteriormente, es decir, a las características de la cirugía que determinan que la ∆pv-aCO2 y/o el ∆pv-aCO2/C(a-v)O2 no sean indicadores de perfusión sistémica ni de oxigenación tisular, por lo que difícilmente puedan serlo de evolución. Morel y cols.[43], no sólo no encuentran que ∆pv-aCO2 tenga un valor predictivo en la evolución de los pacientes sino que los pacientes con menor ∆pv-aCO2 presentaron mayor mortalidad a los 6 meses y mayor score de SOFA. Guinot y cols.[27], realizan una variante en el análisis en un número mayor de pacientes que desarrollaron complicaciones (n = 238). Los que presentaron complicaciones fueron diferentes en el sentido que correspondieron a cirugías de mayor complejidad, con mayor tiempo de clampeo aórtico y de CEC y mayor Euroscore. No obstante lo cual, el ∆pv-aCO2 no difirió significativamente. Posteriormente, analiza las modificaciones del ∆pv-aCO2 en el tiempo buscando si estas son las que se asocian o no y divide los pacientes en 1) los que mantuvieron valores menores a 6 mm Hg de ∆pv-aCO2; 2) aquellos en los que se incrementó durante la evolución postoperatoria; 3) en los que disminuyó y 4) en los que lo mantuvieron persistentemente alto. La mortalidad y complicaciones postoperatorias no mostraron diferencias significativas en los 4 grupos. Desde otro punto de vista Pölönen[5] encuentra que los pacientes bajo tratamiento guiado por objetivos presentan una mejor evolución postoperatorio que no se refleja en el ∆pv-aCO2.
En sentido opuesto Habicher y cols.[30], encuentran una mayor incidencia de complicaciones, mayor estadía en UCI, ventilación mecánica y complicaciones cardiovasculares en pacientes con ∆pvaCO2 mayor a 7 mm Hg. La principal limitación de este estudio es que sus conclusiones se basan en 4 pacientes de un estudio retrospectivo donde no fija un límite superior de normalidad para la SvCO2. Un importante estudio en más de 300 pacientes[33] encuentra que la ∆pvaCO2 se asoció a complicaciones postoperatorias. No obstante, este hallazgo presenta algunas limitaciones. De los 174 pacientes que presentaron complicaciones, ∆pv-aCO2 fue predictor de complicaciones solamente a las 2 horas del postoperatorio. El ∆pv-aCO2/C(a-v)O2 fue similar en ambos grupos. El área bajo la curva para el ∆pv-aCO fue de 0,64 (IC 0,57 a 0,79, p < 0,001) por lo que los autores lo consideran como un desempeño limitado para su utilización en la clínica.
La presente revisión presenta limitaciones que deben ser consideradas. Prácticamente todos los estudios son observacionales y con diferencias metodológicas importantes, que determinan un alto riesgo de sesgo. Los estudios incluyen un amplio grupo de cirugías cardiacas que implican diferencias importantes (por ejemplo, en la temperatura y drogas utilizadas), que determina que los resultados entre ellos no sean comparables. Los valores fijados como “normales”, fundamentalmente para ∆pv-aCO2, están basados para condiciones clínicas estables que no son extrapolables a un paciente con patología cardiovascular previa, que será sometido a un procedimiento específico.
Como conclusión podemos afirmar que no existe evidencia suficiente que permita sostener que la ∆pvaCO2 y/o el ∆pv-aCO2/C(a-cv)O2 sean indicadores confiables de gasto cardiaco o de oxigenación tisular, así como de la evolución postoperatoria en pacientes adultos sometidos a CC con CEC.
Referencias
1. Jacobs JP, Shahian DM, Prager RL, Edwards FH, McDonald D, Han JM, et al. The Society of Thoracic Surgeons National Database 2016 Annual Report. Ann Thorac Surg. 2016 Dec;102(6):1790–7. https://doi.org/10.1016/j.athoracsur.2016.10.015 PMID:27847042
2. Laffey JG, Boylan JF, Cheng DC, Sc B, Boylan JF. The systemic inflammatory response to cardiac surgery: implications for the anesthesiologist. Anesthesiology. 2002 Jul;97(1):215–52. https://doi.org/10.1097/00000542-200207000-00030 PMID:12131125
3. Tripodaki ES, Tasoulis A, Koliopoulou A, Vasileiadis I, Vastardis L, Giannis G, et al. Microcirculation and macrocirculation in cardiac surgical patients. Crit Care Res Pract. 2012;2012:654381. https://doi.org/10.1155/2012/654381 PMID:22720146
4. Hamilton MA, Cecconi M, Rhodes A. A systematic review and meta-analysis on the use of preemptive hemodynamic intervention to improve postoperative outcomes in moderate and high-risk surgical patients. Anesth Analg. 2011 Jun;112(6):1392–402. https://doi.org/10.1213/ANE.0b013e3181eeaae5 PMID:20966436
5. Pölönen P, Ruokonen E, Hippeläinen M, Pöyhönen M, Takala J. A prospective, randomized study of goal-oriented hemodynamic therapy in cardiac surgical patients. Anesth Analg. 2000 May;90(5):1052–9. https://doi.org/10.1097/00000539-200005000-00010 PMID:10781452
6. Ranucci M, De Toffol B, Isgrò G, Romitti F, Conti D, Vicentini M. Hyperlactatemia during cardiopulmonary bypass: determinants and impact on postoperative outcome. Crit Care. 2006;10(6):R167. https://doi.org/10.1186/cc5113 PMID:17134504
7. Inoue S, Kuro M, Furuya H. What factors are associated with hyperlactatemia after cardiac surgery characterized by well-maintained oxygen delivery and a normal postoperative course? A retrospective study. Eur J Anaesthesiol. 2001 Sep;18(9):576–84. https://doi.org/10.1097/00003643-200109000-00004 PMID:11553252
8. Riva JA, Bouchacourt JP, Kohn WE, Hurtado FJ. [The changes in the oxygen saturations in the superior vena cava and the pulmonary artery are not the same during cardiac surgery]. Rev Esp Anestesiol Reanim. 2015 Mar;62(3):140–4. https://doi.org/10.1016/j.redar.2014.03.012 PMID:25064414
9. Bouchacourt JP, Kohn E, Riva J, Hurtado FJ. Contribution of the coronary sinus blood to the pulmonary artery oxygen saturation gradient in cardiac surgery patients. Minerva Anestesiol. 2011 Jun;77(6):579–84. PMID:21617620
10. Vincent JL, Pelosi P, Pearse R, Payen D, Perel A, Hoeft A, et al. Perioperative cardiovascular monitoring of high-risk patients: a consensus of 12. Crit Care. 2015 May;19(1):224. https://doi.org/10.1186/s13054-015-0932-7 PMID:25953531
11. Levy B. Lactate and shock state: the metabolic view. Curr Opin Crit Care. 2006 Aug;12(4):315–21. https://doi.org/10.1097/01.ccx.0000235208.77450.15 PMID:16810041
12. Mallat J, Pepy F, Lemyze M, Gasan G, Vangrunderbeeck N, Tronchon L, et al. Central venous-to-arterial carbon dioxide partial pressure difference in early resuscitation from septic shock: a prospective observational study. Eur J Anaesthesiol. 2014 Jul;31(7):371–80. https://doi.org/10.1097/EJA.0000000000000064 PMID:24625464
13. Cuschieri J, Rivers EP, Donnino MW, Katilius M, Jacobsen G, Nguyen HB, et al. Central venous-arterial carbon dioxide difference as an indicator of cardiac index. Intensive Care Med. 2005 Jun;31(6):818–22. https://doi.org/10.1007/s00134-005-2602-8 PMID:15803301
14. He HW, Liu DW, Long Y, Wang XT. High central venous-to-arterial CO2 difference/arterial-central venous O2 difference ratio is associated with poor lactate clearance in septic patients after resuscitation. J Crit Care. 2016 Feb;31(1):76–81. https://doi.org/10.1016/j.jcrc.2015.10.017 PMID:26640138
15. Mesquida J, Saludes P, Gruartmoner G, Espinal C, Torrents E, Baigorri F, et al. Central venous-to-arterial carbon dioxide difference combined with arterial-to-venous oxygen content difference is associated with lactate evolution in the hemodynamic resuscitation process in early septic shock. Crit Care. 2015 Mar;19(1):126. https://doi.org/10.1186/s13054-015-0858-0 PMID:25888382
16. Lamsfus-Prieto J, de Castro-Fernández R, Hernández-García AM, Marcano-Rodriguez G. Valor pronóstico de los parámetros gasométricos del dióxido de carbono en pacientes con sepsis. Una revisión bibliográfica. Rev Esp Anestesiol Reanim. 2016;63(4):220–30. https://doi.org/10.1016/j.redar.2015.11.005 PMID:26775123
17. Mallat J, Lemyze M, Tronchon L, Vallet B, Thevenin D. Use of venous-to-arterial carbon dioxide tension difference to guide resuscitation therapy in septic shock. World J Crit Care Med. 2016 Feb;5(1):47–56. https://doi.org/10.5492/wjccm.v5.i1.47 PMID:26855893
18. Ranucci M, Carboni G, Cotza M, de Somer F. Carbon dioxide production during cardiopulmonary bypass: pathophysiology, measure and clinical relevance. Perfusion. 2017 Jan;32(1):4–12. https://doi.org/10.1177/0267659116659919 PMID:27435871
19. Fischer MO, Bonnet V, Lorne E, Lefrant JY, Rebet O, Courteille B, et al.; French Hemodynamic Team. Assessment of macro- and micro-oxygenation parameters during fractional fluid infusion: A pilot study. J Crit Care. 2017 Aug;40:91–8. https://doi.org/10.1016/j.jcrc.2017.03.021 PMID:28364680
20. Cavaliere F. Impaired carbon dioxide transport during and after cardiopulmonary bypass. Perfusion. 2000 Sep;15(5):433–9. https://doi.org/10.1177/026765910001500505 PMID:11001166
21. Machado R, Tamamaes S, Lopez M, Mohedano L DM and VJ. Revisiones sistemáticas exploratorias. [Internet]. Med Segur Trab (Madr). 2018;55(216):12–9. Available from: http://scielo.isciii.es
22. Tricco AC, Lillie E, Zarin W, O’Brien KK, Colquhoun H, Levac D, et al. PRISMA extension for scoping reviews (PRISMA-ScR): checklist and explanation. Ann Intern Med. 2018 Oct;169(7):467–73. https://doi.org/10.7326/M18-0850 PMID:30178033
23. Rhodes LA, Erwin WC, Borasino S, Cleveland DC, Alten JA. Central Venous to Arterial CO2 Difference After Cardiac Surgery in Infants and Neonates. Pediatr Crit Care Med. 2017 Mar;18(3):228–33. https://doi.org/10.1097/PCC.0000000000001085 PMID:28121832
24. Akamatsu T, Inata Y, Tachibana K, Hatachi T, Takeuchi M. Elevated Central Venous to Arterial CO2 Difference Is Not Associated With Poor Clinical Outcomes After Cardiac Surgery With Cardiopulmonary Bypass in Children. Pediatr Crit Care Med. 2017 Sep;18(9):859–62. https://doi.org/10.1097/PCC.0000000000001229 PMID:28622280
25. Ariza M, Gothard JWW, Macnaughton P, Hooper J, Morgan CJ, Evans TW. Intensive Care Medicine Blood lactate and mixed venous-arterial PCO2 gradient as indices of poor peripheral perfusion following cardiopulmonary bypass surgery. 1991;17:320–4.
26. Takami Y, Masumoto H. Mixed venous-arterial CO2 tension gradient after cardiopulmonary bypass. Asian Cardiovasc Thorac Ann. 2005 Sep;13(3):255–60. https://doi.org/10.1177/021849230501300314 PMID:16113000
27. Guinot P-G, Badoux L, Abou-arab O, Lorne E, Bernard E, Dupont H. Central venous-to-arterial carbon dioxide partial pressure difference in patients undergoing cardiac surgery is not related to postoperative outcomes. J Cardiothorac Vasc Anesth 2017. 2017;J Cardioth(4):1190–6.
28. Heinze H, Paarmann H, Heringlake M, Groesdonk HV. Measurement of central and mixed venous-to-arterial carbon dioxide differences in cardiac surgery patients. Appl Cardiopulm Pathophysiol. 2011;15:29–37.
29. Cavaliere F, Rossi M. Arterial-venous gradient in early postoperative hours following myocardial revascularization. J Cardio Vasc Surg. 1996;3 7(5):499–503.
30. Habicher M, von Heymann C, Spies CD, Wernecke KD, Sander M. Central Venous-Arterial pCO2 Difference Identifies Microcirculatory Hypoperfusion in Cardiac Surgical Patients With Normal Central Venous Oxygen Saturation: A Retrospective Analysis. J Cardiothorac Vasc Anesth. 2015;29(3):646–55. https://doi.org/10.1053/j.jvca.2014.09.006 PMID:25575410
31. Du W, Long Y, Wang XT, Liu DW. The Use of the Ratio between the Veno-arterial Carbon Dioxide Difference and the Arterial-venous Oxygen Difference to Guide Resuscitation in Cardiac Surgery Patients with Hyperlactatemia and Normal Central Venous Oxygen Saturation. Chin Med J (Engl). 2015 May;128(10):1306–13. https://doi.org/10.4103/0366-6999.156770 PMID:25963349
32. Abou-Arab O, Braik R, Huette P, Bouhemad B, Lorne E, Guinot PG. The ratios of central venous to arterial carbon dioxide content and tension to arteriovenous oxygen content are not associated with overall anaerobic metabolism in postoperative cardiac surgery patients. PLoS One. 2018 Oct;13(10):e0205950. https://doi.org/10.1371/journal.pone.0205950 PMID:30365515
33. Moussa MD, Durand A, Leroy G, Vincent L, Lamer A, Gantois G, et al. Central venous-to-arterial PCO2 difference, arteriovenous oxygen content and outcome after adult cardiac surgery with cardiopulmonary bypass: A prospective observational study. Eur J Anaesthesiol. 2019 Apr;36(4):279–89. https://doi.org/10.1097/EJA.0000000000000949 PMID:30664011
34. Denault A, Bélisle S, Babin D, Hardy JF. Difficult separation from cardiopulmonary bypass and deltaPCO2. Can J Anaesth. 2001 Feb;48(2):196–9. https://doi.org/10.1007/BF03019735 PMID:11220431
35. Morel J, Gergele L, Verveche D, Costes F, Auboyer C, Molliex S. Do fluctuations of PaCO2 impact on the venous-arterial carbon dioxide gradient? Crit Care. 2011;15(6):456. https://doi.org/10.1186/cc10528 PMID:22115122
36. Mesquida J, Saludes P, Gruartmoner G, Espinal C, Torrents E, Baigorri F, et al. Central venous-to-arterial carbon dioxide difference combined with arterial-to-venous oxygen content difference is associated with lactate evolution in the hemodynamic resuscitation process in early septic shock. Crit Care. 2015 Mar;19(1):126. https://doi.org/10.1186/s13054-015-0858-0 PMID:25888382
37. Mallat J, Lemyze M, Tronchon L, Vallet B, Thevenin D, Mallat J, et al. Wj ccm. World J Crit Care Med. 2016;5(1):47–57. https://doi.org/10.5492/wjccm.v5.i1.47 PMID:26855893
38. Ralley FE, Wynands JE, Ramsay JG, Carli F, MacSullivan R. The effects of shivering on oxygen consumption and carbon dioxide production in patients rewarming from hypothermic cardiopulmonary bypass. Can J Anaesth. 1988 Jul;35(4):332–7. https://doi.org/10.1007/BF03010851 PMID:3135952
39. Johnson MR. Low systemic vascular resistance after cardiopulmonary bypass: are we any closer to understanding the enigma? Crit Care Med. 1999 Jun;27(6):1048–50. https://doi.org/10.1097/00003246-199906000-00008 PMID:10397196
40. Williams J, McLean A, Ahari J, Jose A, Al-Helou G, Ibi I, et al. Decreases in Mixed Venous Blood O2 Saturation in Cardiac Surgery Patients Following Extubation. J Intensive Care Med. 2017 Jan;•••:885066617741435. https://doi.org/10.1177/0885066617741435 PMID:29141527
41. Dubin A, Pozo MO, Kanoore Edul VS, Risso Vazquez A, Enrico C. Poor agreement in the calculation of venoarterial PCO2 to arteriovenous O2 content difference ratio using central and mixed venous blood samples in septic patients. J Crit Care. 2018 Dec;48:445–50. https://doi.org/10.1016/j.jcrc.2018.07.010 PMID:30409351
42. Perz S, Uhlig T, Kohl M, Bredle DL, Reinhart K, Bauer M, et al. Low and “supranormal” central venous oxygen saturation and markers of tissue hypoxia in cardiac surgery patients: a prospective observational study. Intensive Care Med. 2011 Jan;37(1):52–9. https://doi.org/10.1007/s00134-010-1980-8 PMID:20689932
43. Morel J, Grand N, Axiotis G, Bouchet JB, Faure M, Auboyer C, et al. High veno-arterial carbon dioxide gradient is not predictive of worst outcome after an elective cardiac surgery: a retrospective cohort study. J Clin Monit Comput. 2016 Dec;30(6):783–9. https://doi.org/10.1007/s10877-016-9855-3 PMID:26939694

 ORCID
ORCID

 Creative Commons Attribution
Creative Commons Attribution