Alfonso Martínez Visbal 1 , Alberto Fernández Delgado 2 , Merlys Zarza Zúñiga 2
Recibido: 21-07-2019
Aceptado: 12-08-2019
©2020 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 49 Núm. 5 pp. 632-639|https://doi.org/10.25237/revchilanestv49n05-07
PDF|ePub|RIS
NMDA receptors: foundations and therapeutic implications in the management of pain
Abstract
The NMDA receptors has been described in the development of acute pain and maintenance of chronic pain; the knowledge of physiological processes has led to the growing interest in NMDA receptors antagonists, demonstrating optimal analgesic results. Inhibition of NMDA receptors is an effective therapeutic alternative in the management of pain; with beneficial results in the management of acute postoperative pain, chronic and neuropathic pain. The current scientific challenge is to identify antagonists that perform a selective inhibition of receptor subunits, achieving optimal analgesic results. For this non-systemic review, a search of the available scientific evidence was made in databases (Pubmed/Medline, Science Direct, OVID, SciELO) through the use of keywords (Pain, NMDA receptors, antagonists, ketamine).
Resumen
Los receptores NMDA han sido descritos en el desarrollo del dolor agudo y mantenimiento del dolor crónico; el conocimiento de los procesos fisiológicos ha llevado al creciente interés en los antagonistas de los receptores NMDA, demostrando resultados analgésicos óptimos. La inhibición de los receptores NMDA es una alternativa terapéutica eficaz en el manejo del dolor; con resultados benéficos en el manejo del dolor agudo postoperatorio, dolor crónico y neuropático. El reto científico actual es identificar antagonistas que realicen una inhibición selectiva de las subunidades del receptor, logrando óptimos resultados analgésicos. Para esta revisión no sistemática se realizó una búsqueda de la evidencia científica disponible en bases de datos (Pubmed/Medline, Science Direct, OVID, SciELO) mediante el uso de palabras clave (dolor, receptores NMDA, antagonistas, ketamina).
-
Introducción
Los receptores NMDA (N-metil-D-aspartato) juegan un papel importante en el desarrollo del dolor, en particular del dolor neuropático[1]. Este es un receptor ionotrópico del glutamato, el cual tiene funciones en la neuroplasticidad, pero también en la excitotoxicidad[2].
El glutamato (Glu) es el principal aminoácido excitatorio del sistema nervioso central[3 ]. Su liberación se da mediante exocitosis, promovida por la propagación del impulso nervioso hacia la terminal sináptica por un proceso dependiente de la concentración de Ca++ intracelular[4].
Los receptores de glutamato se han clasificado en dos grupos principales: receptores ionotrópicos y metabotrópicos. En los primeros, la unión del glutamato a su receptor resulta en un cambio conformacional que permite el paso de cationes de calcio y sodio a través de un poro. Los receptores metabotrópicos, por otro lado, no son permeables a iones; al contrario, estos receptores están acoplados por medio de proteínas G a segundos mensajeros intracelulares, los cuales pueden regular actividades celulares como trascripción de genes y fosforilación de canales iónicos dependientes de voltaje o dependientes de ligandos[5].
Los receptores ionotrópicos se dividen de acuerdo a la afinidad de sus agonistas específicos en: N-metil-D-aspartato (NMDA), ácido -amino-3-hidroxi-5-metil-4-isoxazol (AMPA) y ácido kaínico (KA). Los receptores NMDA se han convertido en un foco de atención debido a sus implicaciones en procesos, fisiológicos y patológicos importantes como lo son la plasticidad sináptica, la excitoxicidad, así como en los mecanismos de la génesis y mantenimiento del dolor[6].
-
Composición del receptor NMDA
Los receptores NMDA son canales iónicos en forma de complejos heteroméricos con diferentes subunidades, las cuales pueden ser de tres subtipos: NR1, codificada por un gen que puede generar al menos 8 isoformas[3]; NR2, con 4 isoformas: A, B, C, D y NR3 con isoformas A y B codificadas cada una por un gen diferente. Estudios han demostrado que son estructuras tetraméricas, las cuales para ser funcionales deben estar constituidas por una subunidad del tipo NR1, esencial para formar el canal, y al menos una subunidad del tipo NR2[7].
Cada subunidad de receptores ionotrópicos posee una estructura molecular muy semejante, la cual se organiza en cuatro dominios funcionales: un dominio extracelular con el amino (N) terminal (DNT), un dominio de unión para el ligando (DBL), una región transmembrana, formado por cuatro segmentos hidrofóbicos (M1 a M4) en donde el segmento M2 ingresa parcialmente a la membrana conformando el canal iónico y, finalmente, un dominio carboxilo (C) en la región intracelular (DCT). Los sitios de unión de los agonistas están localizados en regiones homólogas de las subunidades NR1 y NR2 para la glicina y el glutamato, respectivamente. La activación del receptor requiere la unión simultánea de los dos ligandos (dos moléculas de glutamato y 2 moléculas de glicina). La subunidad NR2 en el dominio N- terminal (DNT), posee un sitio de unión para moduladores como el Zn++ y el ifenprodil ( Figura 1 ).
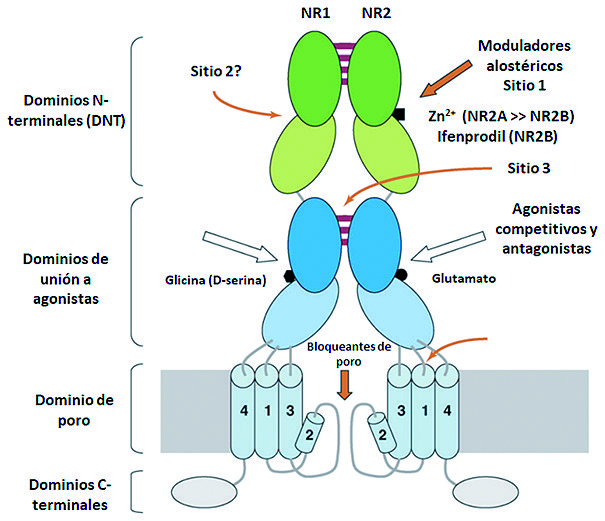
Figura 1. Estructura del receptor NMDA.
La activación del receptor NMDA lleva a la apertura del canal iónico, resultando en la entrada de Na+ y Ca++ y la salida de K+. La entrada de Ca++ permite la transducción de la actividad sináptica eléctrica a una señal bioquímica, por activación de enzimas Ca++ dependientes. La conductancia de Ca++ a través del canal iónico del receptor NMDA es mayor en comparación a otros receptores iónicos para el glutamato.
Contrario a lo que sucede con el receptor NMDA convencional NR1/NR2, aquellos ensamblados con subunidades tipo NR3A o 3B forman receptores excitatorios para la glicina sin respuesta al glutamato, además, son impermeables al Ca++ y no son bloqueados por el Mg++[8].
-
Localización de los receptores NMDA
La indispensable subunidad NR1 se encuentra ampliamente distribuida en todo el SNC, desde la etapa embrionaria hasta la edad adulta, siendo el receptor más abundante el NR1/NR2A (Receptor de NMDA tipo 1/Receptor de NMDA tipo 2A), el cual se ha encontrado en tejido cerebral y medular. Sin embargo, para el manejo del dolor el receptor más estudiado ha sido el NR1/NR2B, ya que está restringido a áreas involucradas en la transmisión de esta señal, tales como los ganglios dorsales, astas dorsales de la médula espinal, tálamo, hipocampo y corteza[9].
Estudios morfológicos en animales identificaron receptores NMDA en axones mielinizados y desmielinizados periféricos[10],[11]; estudios de inmunohistoquímica han demostrado la expresión de estos receptores en tendones humanos asociados a concentraciones elevadas de glutamato[9]. Con la administración de agonistas a nivel periférico se ha inducido nocicepción, respuesta atenuada por la inyección posterior de antagonistas[4],[12],[13]. Por otro lado, se ha demostrado que las fibras nociceptivas periféricas expresan subunidades NR2B y NR2D, mientras que las subunidades NR2A parecen estar ausentes de las terminales aferentes periféricas[14],[15].
A nivel central, la activación de los receptores NMDA ubicados en la médula espinal ha demostrado tener efecto en los mecanismos de hiperalgesia. También existe evidencia que sugiere la presencia de estos a nivel supraespinal, encontrándose un aumento en la actividad de los receptores en estados de hiperexcitabilidad neuronal a nivel del tallo cerebral; análisis por reacción en cadena de la polimerasa demostraron una sobrerregulación de subunidades NR1, NR2A y NR2B a ese mismo nivel después de inflamación[16],[17].
-
Antagonistas de receptores NMDA
Los antagonistas de los receptores NMDA pueden ser clasificados de acuerdo a su sitio de acción: competitivos (si actúan en el sitio de acción del agonista), bloqueantes de canal (actúan en el poro del canal iónico) y no competitivos (acción en sitios de modulación específicos). El bloqueo selectivo de los sitios de unión a ligando es complejo, debido a la alta homología entre las diferentes subunidades del receptor[18]. Por su parte, los bloqueantes del canal iónico, entre estos la ketamina, son dependiente de voltaje y de uso[19], por lo tanto, requieren la activación del receptor y apertura del canal iónico para realizar el bloqueo.
La activación excesiva de los receptores NMDA conlleva a efectos excitotóxicos y a muerte celular, lo que juega un papel importante en las enfermedades neurológicas[20]. El reto científico actual es encontrar sustancias que realicen una modulación diferencial del receptor, reduciendo la excitotoxicidad y neurodegeneración causada por altos niveles de glutamato, dejando indemne la transmisión sináptica normal[21].
Rol de los receptores NMDA en la transmisión del dolor
El área implicada en la transmisión del dolor que más ha sido estudiada son los cordones espinales, donde ocurre la primera sinapsis sensorial a nivel del sistema nervioso central, lugar en el cual se ha demostrado la presencia en mayor parte de subunidades NR1/NR2B en las fibras C y A del dolor[22]. La plasticidad a largo plazo de la vía nociceptiva, mediada también por los receptores NMDA, ha sido implicada en el desarrollo del dolor neuropático tanto en la vía espinal como en la región cortical[23].
Estudios recientes han demostrado que áreas superiores sufren cambios conformacionales asociados al dolor, pudiendo ser ese el origen de las señales nociceptivas[24],[25]. También, han sido implicadas la corteza anterior del cíngulo, corteza insular, corteza prefrontal y la corteza primaria y secundaria somatosensorial[26] ( Figura 2 ).
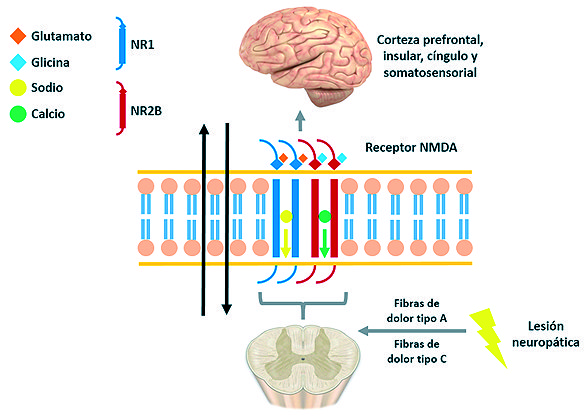
Figura 2. Modelo de fisiología del receptor NMDA.
Los receptores ionotrópicos han sido identificados en las áreas relacionadas con el dolor en estudios genéticos y farmacológicos. Los ratones con sobrexpresión de receptores NMDA en la corteza frontal muestran respuestas comportamentales más marcadas al dolor inflamatorio[27]. La administración farmacológica de antagonistas de estos receptores en la corteza del cíngulo e insular produce efectos analgésicos[28].
La inflamación periférica incrementa la expresión de receptores NMDA y la actividad eléctrica en la corteza del cíngulo e insular[29]. Las vías de activación de estos receptores han sido implicadas en el dolor neuropático y en animales con dolor asociado al cáncer, con resultados analgésicos logrados a través de la inhibición de dichas vías[30]. La evidencia reciente ha comprobado la presencia de receptores NMDA pre-sinápticos en las sinapsis corticales, pero aún su rol está por determinar[31]-[33].
-
Inhibición de los receptores NMDA y su evidencia en el manejo del dolor
El manejo del dolor neuropático está basado en el uso de antidepresivos, antiepilépticos, opioides de liberación prolongada y manejo local con anestésicos locales como lidocaína y parches de capsaicina[34]; en general solo el 30% de los pacientes responderán a alguno de estos[35]. Teniendo en cuenta el rol que tienen los receptores de NMDA en el desarrollo del dolor, se han propuesto a los antagonistas de este receptor para el tratamiento del dolor neuropático[36].
El medicamento más potente y mejor estudiado es la ketamina, la cual en dosis subanestésicas (0,35 mg/kg) produce analgesia en el dolor agudo y crónico[37], cuyo primer ensayo clínico aleatorizado que evaluó este uso data de 1995[38]. Otros inhibidores de los receptores de NMDA que han sido estudiado para el alivio del dolor neuropático incluyen el magnesio, memantina, amantadina, dextrometorfano y algunos experimentales como el CNS5161 y GV196771[39],[40].
La ketamina actúa en los receptores NR1/NR2A y NR1/NR2B lo que produce bloqueo del canal ionotrópico e inhibición del dolor agudo y crónico[41],[42]. Los mecanismos más importantes incluyen el bloqueo de receptores NMDA sensibilizados en la médula espinal lo que disminuirá el estímulo aferente proveniente de las áreas lesionadas, a través de la disminución de la transmisión glutamatérgica, además, de restaurar los circuitos cerebrales[43],[44].
En tres revisiones sistemáticas, los antagonistas NMDA han mostrado su eficacia analgésica. Este efecto se ha logrado con el uso de ketamina en infusiones prolongadas (mayores de 10 horas) y en infusiones cortas en el caso del dolor posamputación del miembro fantasma[36],[39],[45]. Además, de su uso en el dolor neuropático, la ketamina es usada como medicación adyuvante en el tratamiento del dolor oncológico y postoperatorio, con una consecuente disminución en el consumo de opioides[44],[45]. Informes de pacientes que han recibido dosis anestésicas de ketamina, han reportado alivio de dolor prolongado durante varios meses[46]. La evidencia para las otras moléculas aún no es completa ante la falta de ensayos clínicos bien diseñados y la ausencia de grupos de pacientes homogéneos.
Sin embargo, los efectos positivos mencionados también vienen acompañados de efectos adversos, que van desde náuseas, sedación, visión borrosa, euforia hasta disfunción cognitiva, defectos de la memoria y comportamiento esquizotípico (con alucinaciones y ataques de pánico)[39],[41]. Estas manifestaciones ocurren después de la inhibición de los receptores NR1/NR2A, las cuales son abolidas cuando se inhibe selectivamente la subunidad NR2B[15],[36],[47],[48]. La ketamina también puede activar receptores nicotínicos, muscarínicos, colinérgicos, monoaminérgicos y opioides, lo cual puede influir en la aparición de dichos efectos.
Es de interés en los actuales protocolos analgésicos el efecto diferencial que tiene la duración e intervalos de administración del inhibidor, ya sea la administración prolongada o la dosificación repetitiva. Se ha evidenciado que la analgesia neuropática es más duradera cuando la infusión de ketamina se administra durante mayor tiempo[38],[49], demostrando un efecto analgésico dependiente de la dosis y la duración, lo que indica que la inhibición de los receptores NMDA es un paso inicial para la desensibilización y analgesia prolongada, lo cual podría revertir los cambios plásticos asociados al dolor a nivel espinal y supraespinal[36] ( Figura 3 ).
Figura 3. Esquema de respuesta al dolor de los receptores NMDA.
La ketamina produce analgesia en concentraciones plasmáticas entre 100 y 200 ng/mL, lo cual representa una pequeña fracción de las concentraciones plasmática de las dosis anestésicas (9.000-25.000 ng/mL). La dosis subanestésica usada en la práctica clínica para manejo de dolor agudo es de 0,3-0,5 mg/kg, la cual puede asociarse al uso de infusiones de ketamina (usualmente iniciada a 0,1-0,2 mg/kg) dependiendo de los requerimientos analgésicos del paciente. Actualmente, se recomienda no exceder la dosis bolo subanestésica por encima de 0,35 mg/kg y la dosis de infusión para manejo de dolor agudo por encima de 1 mg/kg/h. Los efectos adversos pueden causar la no tolerabilidad de altas dosis en el contexto del dolor agudo, por lo cual las dosis deben programarse teniendo en cuenta un balance entre analgesia y efectos adversos.
-
Conclusiones
Los receptores NMDA han sido descritos en el desarrollo del dolor agudo y mantenimiento del dolor crónico. La inhibición de los receptores NMDA es una alternativa terapéutica eficaz en el manejo del dolor; se evidencian óptimos resultados en el manejo del dolor agudo postoperatorio, dolor crónico y neuropático. El reto científico actual es identificar antagonistas que realicen una inhibición selectiva de las subunidades del receptor, logrando resultados analgésicos y la prevención de la excitotoxicidad y neurodegeneración causada por altos niveles de glutamato. Además, se requiere continuar realizando ensayos clínicos con el fin de establecer el esquema terapéutico óptimo con los diferentes antagonistas del receptor NMDA.
Referencias
1. Petrenko AB, Yamakura T, Baba H, Shimoji K. The role of N-methyl-D-aspartate (NMDA) receptors in pain: a review. Anesthesia and analgesia. 2003;97(4):1108-16. https://doi.org/10.1213/01.ANE.0000081061.12235.55
2. Furukawa H, Singh SK, Mancusso R, Gouaux E. Subunit arrangement and function in NMDA receptors. Nature. 2005;438(7065):185-92. https://doi.org/10.1038/nature04089
3. Flores-Soto, M.E., et al., [Structure and function of NMDA-type glutamate receptor subunits]. Neurologia, 2012. 27(5): p. 301-10. https://doi.org/10.1016/j.nrl.2011.10.014
4. Douglass L. Jackson a, C.B.G.a., Jennelle Durnett Richardson b, Kenneth M. Hargreaves, Glutamate participates in the peripheral modulation of thermal hyperalgesia in rats. European Journal of Pharmacology, 1995. 284: p. 321-325. https://doi.org/10.1016/0014-2999(95)00449-U
5. C Fouillioux, F.C., M Rivera, A Terán, M Velasco, Receptores de glutamato implicaciones terapeúticas. Archivos Venezolanos de Farmacología y Terapéutica, 2004. 23(2).
6. Paoletti, P., Molecular basis of NMDA receptor functional diversity. Eur J Neurosci, 2011. 33(8): p. 1351-65. https://doi.org/10.1111/j.1460-9568.2011.07628.x
7. Paoletti, P. and J. Neyton, NMDA receptor subunits: function and pharmacology. Curr Opin Pharmacol, 2007. 7(1): p. 39-47. https://doi.org/10.1016/j.coph.2006.08.011
8. Mayumi Nishi, H.H., Hai-Ping Lu, Mitsuhiro Kawata, and Yasunori Hayashi, Motoneuron-specific expression of NR3B, a novel NMDA-type glutamate receptor subunit that works in a dominant-negative manner. The Journal of Neuroscience, 2001. 21: p. 1-6. https://doi.org/10.1523/JNEUROSCI.21-23-j0003.2001
9. Wu LJ, Zhuo M. Targeting the NMDA receptor subunit NR2B for the treatment of neuropathic pain. Neurotherapeutics : the journal of the American Society for Experimental NeuroTherapeutics. 2009;6(4):693-702. https://doi.org/10.1016/j.nurt.2009.07.008
10. Carlton SM, H.G., Coggeshall RE, Localization and activation of glutamate receptors in unmyelinated axons of rat glabrous skin. Neurosci Lett, 1995. 195: p. 25-28. https://doi.org/10.1016/0304-3940(95)11889-5
11. Coggeshall RE, C.S., Ultrastructural analysis of NMDA,AMPA, and kainate receptors on unmyelinated and myelinated axons in the periphery. J Comp Neurol, 1998. 391: p. 78-86. https://doi.org/10.1002/(SICI)1096-9861(19980202)391:1<78::AID-CNE7>3.0.CO;2-O
12. Lawand N, W.W., Westlund K, . Eur J Pharmacol 1997. 324(169-77). https://doi.org/10.1016/S0014-2999(97)00072-1
13. Ushida T, T.T., Kawasaki M, Iwatsu O, Yamamoto H, https://doi.org/10.1016/S0304-3940(98)00968-9
14. MA Q-P, H.R.J., . Neuroscience, 2000. 101(3): p. 699-707. https://doi.org/10.1016/S0306-4522(00)00419-X
15. Marvizon, J.C., et al., Two N-methyl-D-aspartate receptors in rat dorsal root ganglia with different subunit composition and localization. J Comp Neurol, 2002. 446(4): p. 325-41. https://doi.org/10.1002/cne.10202
16. Terayama R, G.Y., Dubner R, Ren K, . NeuroReport, 2000. 11(9): p. 1915-19. https://doi.org/10.1097/00001756-200006260-00022
17. Miki K, Z.Q.Q., Guo W, Guan Y, Terayama R, Dubner R, Ren K, . J Neurophysiol, 2002. 87: p. 750-60. https://doi.org/10.1152/jn.00534.2001
18. Kinarsky L, Feng B, Skifter DA, Morley RM, Sherman S, Jane DE, et al. Identification of subunit- and antagonist-specific amino acid residues in the N-Methyl-D-aspartate receptor glutamate-binding pocket. The Journal of pharmacology and experimental therapeutics. 2005;313(3):1066-74. https://doi.org/10.1124/jpet.104.082990
19. Muir WW. NMDA receptor antagonists and pain: ketamine. The Veterinary clinics of North America Equine practice. 2010;26(3):565-78. https://doi.org/10.1016/j.cveq.2010.07.009
20. Mattson MP. Excitotoxic and excitoprotective mechanisms: abundant targets for the prevention and treatment of neurodegenerative disorders. Neuromolecular medicine. 2003;3(2):65-94. https://doi.org/10.1385/NMM:3:2:65
21. Vyklicky V, Korinek M, Smejkalova T, Balik A, Krausova B, Kaniakova M, et al. Structure, function, and pharmacology of NMDA receptor channels. Physiological research. 2014;63 Suppl 1:S191-203. https://doi.org/10.33549/physiolres.932678
22. Marvizon JC, McRoberts JA, Ennes HS, Song B, Wang X, Jinton L, et al. Two N-methyl-D-aspartate receptors in rat dorsal root ganglia with different subunit composition and localization. The Journal of comparative neurology. 2002;446(4):325-41. https://doi.org/10.1002/cne.10202
23. Kuner R. Central mechanisms of pathological pain. Nature medicine. 2010;16(11):1258-66. https://doi.org/10.1038/nm.2231
24. Ruscheweyh R, Wilder-Smith O, Drdla R, Liu XG, Sandkuhler J. Long-term potentiation in spinal nociceptive pathways as a novel target for pain therapy. Molecular pain. 2011;7:20. https://doi.org/10.1186/1744-8069-7-20
25. Zhuo M. Neural Mechanisms Underlying Anxiety-Chronic Pain Interactions. Trends in neurosciences. 2016;39(3):136-45. https://doi.org/10.1016/j.tins.2016.01.006
26. Zhuo M. Cortical excitation and chronic pain. Trends in neurosciences. 2008;31(4):199-207. https://doi.org/10.1016/j.tins.2008.01.003
27. Wei F, Wang GD, Kerchner GA, Kim SJ, Xu HM, Chen ZF, et al. Genetic enhancement of inflammatory pain by forebrain NR2B overexpression. Nature neuroscience. 2001;4(2):164-9. https://doi.org/10.1038/83993
28. Qiu S, Chen T, Koga K, Guo YY, Xu H, Song Q, et al. An increase in synaptic NMDA receptors in the insular cortex contributes to neuropathic pain. Science signaling. 2013;6(275):ra34. https://doi.org/10.1126/scisignal.2003778
29. Xu H, Wu LJ, Wang H, Zhang X, Vadakkan KI, Kim SS, et al. Presynaptic and postsynaptic amplifications of neuropathic pain in the anterior cingulate cortex. The Journal of neuroscience : the official journal of the Society for Neuroscience. 2008;28(29):7445-53. https://doi.org/10.1523/JNEUROSCI.1812-08.2008
30. Zhang R, Liu Y, Zhang J, Zheng Y, Gu X, Ma Z. Intrathecal administration of roscovitine attenuates cancer pain and inhibits the expression of NMDA receptor 2B subunit mRNA. Pharmacology, biochemistry, and behavior. 2012;102(1):139-45. https://doi.org/10.1016/j.pbb.2012.03.025
31. Larsen RS, Sjostrom PJ. Synapse-type-specific plasticity in local circuits. Current opinion in neurobiology. 2015;35:127-35. https://doi.org/10.1016/j.conb.2015.08.001
32. Larsen RS, Smith IT, Miriyala J, Han JE, Corlew RJ, Smith SL, et al. Synapse-specific control of experience-dependent plasticity by presynaptic NMDA receptors. Neuron. 2014;83(4):879-93. https://doi.org/10.1016/j.neuron.2014.07.039
33. Buchanan KA, Blackman AV, Moreau AW, Elgar D, Costa RP, Lalanne T, et al. Target-specific expression of presynaptic NMDA receptors in neocortical microcircuits. Neuron. 2012;75(3):451-66. https://doi.org/10.1016/j.neuron.2012.06.017
34. Dworkin RH, O’Connor AB, Audette J, Baron R, Gourlay GK, Haanpaa ML, et al. Recommendations for the pharmacological management of neuropathic pain: an overview and literature update. Mayo Clinic proceedings. 2010;85(3 Suppl):S3-14. https://doi.org/10.4065/mcp.2009.0649
35. Namaka M, Leong C, Grossberndt A, Klowak M, Turcotte D, Esfahani F, et al. A treatment algorithm for neuropathic pain: an update. The Consultant pharmacist: the journal of the American Society of Consultant Pharmacists. 2009;24(12):885-902. https://doi.org/10.4140/TCP.n.2009.885
36. Sigtermans MJ, van Hilten JJ, Bauer MC, Arbous MS, Marinus J, Sarton EY, et al. Ketamine produces effective and long-term pain relief in patients with Complex Regional Pain Syndrome Type 1. Pain. 2009;145(3):304-11. https://doi.org/10.1016/j.pain.2009.06.023
37. Chizh BA. Low dose ketamine: a therapeutic and research tool to explore N-methyl-D-aspartate (NMDA) receptor-mediated plasticity in pain pathways. Journal of psychopharmacology. 2007;21(3):259-71. https://doi.rg/10.1177/0269881105062484
38. Max MB, Byas-Smith MG, Gracely RH, Bennett GJ. Intravenous infusion of the NMDA antagonist, ketamine, in chronic posttraumatic pain with allodynia: a double-blind comparison to alfentanil and placebo. Clinical neuropharmacology. 1995;18(4):360-8. https://doi.org/10.1097/00002826-199508000-00008
39. Collins S, Sigtermans MJ, Dahan A, Zuurmond WW, Perez RS. NMDA receptor antagonists for the treatment of neuropathic pain. Pain medicine. 2010;11(11):1726-42. https://doi.org/10.1111/j.1526-4637.2010.00981.x
40. Kundrotiene J, Cebers G, Wagner A, Liljequist S. The NMDA NR2B subunit-selective receptor antagonist, CP-101,606, enhances the functional recovery the NMDA NR2B subunit-selective receptor and reduces brain damage after cortical compression-induced brain ischemia. Journal of neurotrauma. 2004;21(1):83-93. https://doi.1089/089771504772695977
41. Swartjes M, Morariu A, Niesters M, Aarts L, Dahan A. Nonselective and NR2B-selective N-methyl-D-aspartic acid receptor antagonists produce antinociception and long-term relief of allodynia in acute and neuropathic pain. Anesthesiology. 2011;115(1):165-74. https://doi.org/10.1097/ALN.0b013e31821bdb9b
42. Qu XX, Cai J, Li MJ, Chi YN, Liao FF, Liu FY, et al. Role of the spinal cord NR2B-containing NMDA receptors in the development of neuropathic pain. Experimental neurology. 2009;215(2):298-307. https://doi.org/10.1016/j.expneurol.2008.10.018
43. Borsook D. Ketamine and chronic pain–going the distance. Pain. 2009;145(3):271-2. https://doi.org/10.1016/j.pain.2009.05.021
44. Hirota K, Lambert DG. Ketamine: new uses for an old drug? British journal of anaesthesia. 2011;107(2):123-6. https://doi.org/10.1093/bja/aer221
45. Amr YM. Multi-day low dose ketamine infusion as adjuvant to oral gabapentin in spinal cord injury related chronic pain: a prospective, randomized, double blind trial. Pain physician. 2010;13(3):245-9.
46. Bell RF, Eccleston C, Kalso EA. Ketamine as an adjuvant to opioids for cancer pain. The Cochrane database of systematic reviews. 2012;11:CD003351. https://doi.org/10.1002/14651858.CD003351.pub2
47. Bell RF, Dahl JB, Moore RA, Kalso E. Perioperative ketamine for acute postoperative pain. The Cochrane database of systematic reviews. 2006(1):CD004603. https://doi.org/10.1002/14651858.CD004603.pub2
48. Swartjes M, Morariu A, Niesters M, Aarts L, Dahan A. Nonselective and NR2B-selective N-methyl-D-aspartic acid receptor antagonists produce antinociception and long-term relief of allodynia in acute and neuropathic pain. Anesthesiology. 2011;115(1):165-74. https://doi.org/10.1097/ALN.0b013e31821bdb9b
49. Qu XX, Cai J, Li MJ, Chi YN, Liao FF, Liu FY, et al. Role of the spinal cord NR2B-containing NMDA receptors in the development of neuropathic pain. Experimental neurology. 2009;215(2):298-307. https://doi.org/10.1016/j.expneurol.2008.10.018

 ORCID
ORCID