Silvina Longo 1 ,2,*, Pablo Merlo 3 , Juan E. Siri 1 , Matías Brizuela 3 , Martín Isa 3 , Cecilia Acosta 2
Recibido: 02-04-2021
Aceptado: 22-06-2021
©2021 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 50 Núm. 6 pp. 865-874|https://doi.org/10.25237/revchilanestv5006101134
PDF|ePub|RIS
Usefulness of intraoperative cardiopulmonary evaluation with transesophageal ultrasound
Abstract
Transesophageal ultrasound (TEE) is a valuable monitor in the operating room for both cardiac and non-cardiac surgery. And it is the monitor of choice in the event of cardiac arrest. The routine use of TEE during the intraoperative period is generally limited to echocardiography, there are few studies that examine the clinical results in relation to the ultrasound lung (UP) examination in surgical patients. This narrative review presents clinical evidence regarding the use of UP associated with intraoperative transesophageal echocardiography. And it aims to highlight the importance of relating both examinations to improve the perioperative care of the surgical patient.
Resumen
La ecografía transesofágica (ETE) es un monitor de gran valor en el quirófano tanto para cirugía cardíaca como no cardíaca. Y es el monitor de elección en caso de paro cardíaco. El uso rutinario de ETE durante el intraoperatorio generalmente se limita a la ecocardiografía, existen pocos estudios que examinen los resultados clínicos en relación con el examen pulmonar ecográfico en pacientes quirúrgicos. Esta revisión narrativa presenta evidencia clínica con respecto al uso de ecografía pulmonar (EP) asociado con ecocardiografía transesofágica durante el intraoperatorio. Y tiene como objetivo poner en evidencia la importancia de relacionar ambos exámenes para mejorar el cuidado perioperatorio del paciente quirúrgico.
-
Introducción
La ETE intraoperatoria es una herramienta estándar de diagnóstico y monitorización empleada en el tratamiento de pacientes sometidos a procedimientos quirúrgicos cardíacos, que van desde la revascularización coronaria hasta la reparación valvular compleja, procedimientos combinados y trasplantes de órganos[1][2]. También en cirugía no cardíaca como monitor desde el inicio en cirugías de alta complejidad o en aquellos pacientes con alto riesgo de complicaciones cardiopulmonares[3].
ETE ha sido propuesta para evaluar a los pacientes en el contexto de un paro cardíaco, tanto durante la reanimación como luego del retorno de la circulación espontánea (ROSC)[4],[5]. La ETE durante la reanimación permite la caracterización del tipo de actividad cardíaca, la identificación de las causas reversibles de paro, la optimización de la calidad de las compresiones torácicas durante la reanimación y permite guiar los procedimientos invasivos para establecer soporte vital extracorpóreo[6]. La ETE ofrece la ventaja potencial sobre la ecografía transtorácica (ETT) que minimiza las interrupciones de la compresión torácica, generando retroalimentación en tiempo real sobre la efectividad de las compresiones cardíacas. Además permite distinguir entre un ritmo de fibrilación ventricular fina o pseudo actividad eléctrica sin pulso[7].
En los últimos años, la ecografía en el punto de atención se ha convertido en una herramienta de gran valor en la atención de pacientes críticos durante el intraoperatorio y en las unidades de cuidados intensivos, en los cuales muchas veces la evaluación a través de ETT no es posible durante el período perioperatorio[8].
La ETE intraoperatoria es una herramienta de monitorización mínimamente invasiva que proporciona información visual en tiempo real no solo sobre la función ventricular y el estado hemodinámico, sino también permite evaluar los pulmones y los espacios pleurales. Sin embargo, hay evidencia científica limitada relacionada con este último uso[9].
El objetivo de esta serie de casos es describir nuestra experiencia en el uso de ETE en quirófano destacando su valiosa utilidad como herramienta integrada de monitoreo cardíaco y pulmonar en la evaluación de pacientes bajo anestesia general. La principal ventaja de ETE reside en la capacidad de integrar evaluaciones cardíacas y pulmonares en un solo examen.
Conocemos el enorme valor que la ecocardiografía aporta durante cirugía a través de las imágenes propuestas en las guías[1],[2][3].
El uso del ETEP es menos explorado. Se han publicado pocos informes que aborden los aspectos específicos de esta herramienta diagnóstica[9],[10].
La sonda transesofágica se coloca muy cerca de las regiones posteriores de los pulmones donde se observan con mayor frecuencia la consolidación pulmonar y los derrames pleurales; sin embargo, la mayoría de los artefactos en los que se basa la ETT aún no se han validado con ETEP[11]. Durante la anestesia para cirugía cardíaca y de trasplantes la sonda ya está colocada. También en algunas cirugías no cardíacas y es el monitor de elección en caso de paro cardíaco en quirófano.
Las ventanas transesofágicas se pueden usar para obtener imágenes del pulmón de una manera análoga a los enfoques transtorácicos directos.
-
Indicaciones y contraindicaciones
Utilizamos ETE en cirugía cardíaca, no cardíaca, de trasplantes y ante paro cardíaco siguiendo las guías publicadas[1],[2],[3] (Tabla 1).
Las contraindicaciones y complicaciones de la ETE que ya se han informado ampliamente[12] (Tabla 2).
Cavayas y colaboradores recientemente han descripto diferentes reparos anatómicos para la evaluación sonográfica del pulmón con ETE. Los autores dividen cada pulmón a lo largo del eje craneocaudal en regiones apical, media y basal. El origen de la arteria subclavia izquierda se utiliza como punto de referencia para identificar las regiones apicales. Las venas pulmonares superiores se utilizan para marcar las regiones medias. Finalmente, la aurícula derecha en la unión con la vena cava inferior se utiliza para identificar las regiones basales. Desde cada uno de estos puntos de referencia identificados a 0° en la sonda multiplano, una rotación electrónica de 90 ° del plano del transductor permite escanear los pulmones en un eje longitudinal[9] (Figura A).
-
Presentación de casos
A continuación presentamos diferentes casos en distintos escenarios donde analizamos el uso de ETECP.
-
Casos de paro cardíaco
Presentamos 2 casos de parada circulatoria ocurridas en quirófano donde se guio la reanimación con ETE, primero las imágenes cardíacas y luego su asociación con el estudio pulmonar nos permitió determinar la causa reversible del paro cardíaco rápidamente.
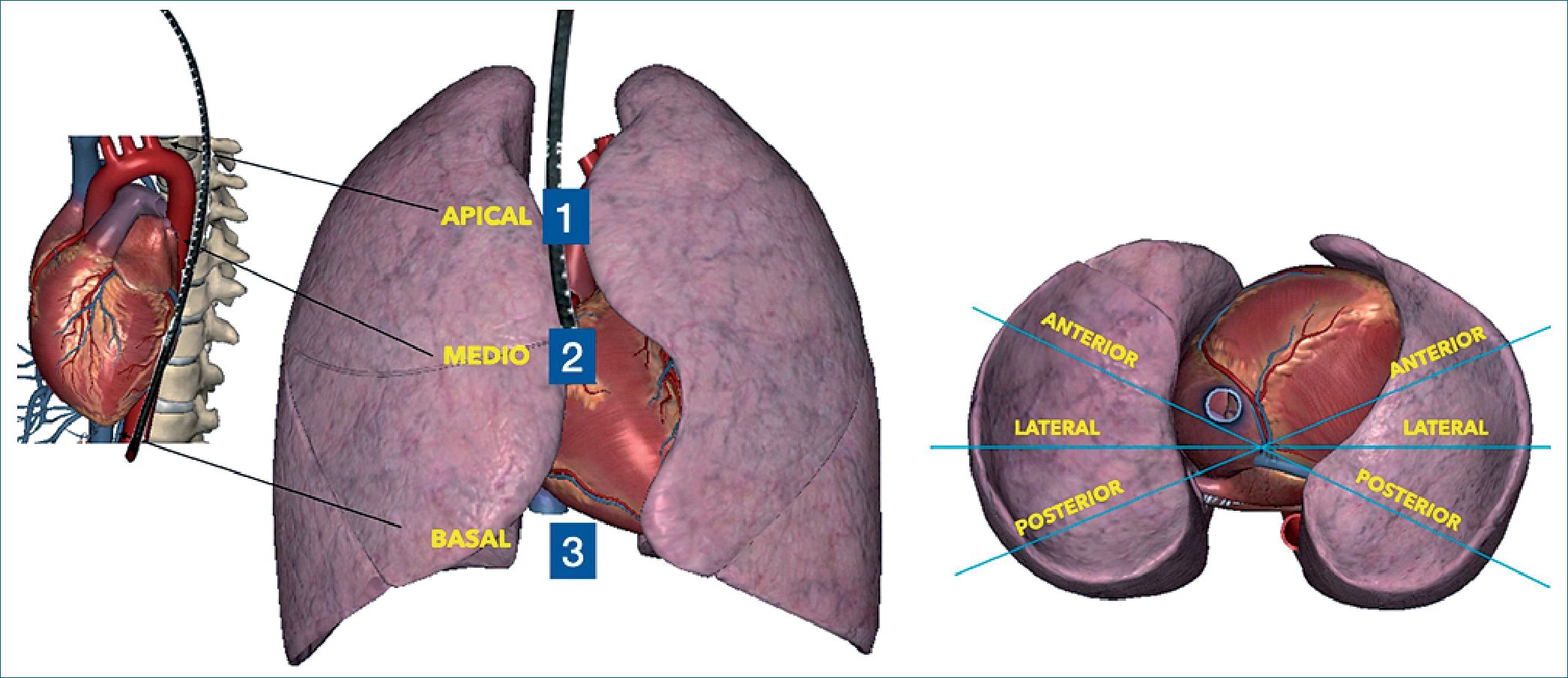 |
| Figura A. Esquema de ETEP y los distintos cortes pulmonares. |
Tabla 1. ETE intraoperatoria
Cirugía cardíaca:
Valvular
Bypass aorto-coronario
Procedimientos transcatéter intracardíaco:
Implante transcatéter de válvula aórtica (TAVI), clip mitral, tricuspídeo, cierre de orejuela, cierre de comunicación interauricular e interventricular Colocación de soporte hemodinámico: Balón de contrapulsación Intra aórtico y membrana de oxigenación extracorpórea (ECMO). Dispositivos de asistencia ventricular externa
Cirugía de la miocardiopatía hipertrófica
Enfermedades del pericardio (taponamiento, pericarditis constrictiva)
Tumores y masas intracardiacas
Trasplantes:
Cardíaco
Pulmonar
Hepático
Cirugía de la aorta torácica
Cirugía no cardíaca:
La ETE se puede utilizar cuando la naturaleza de la cirugía planificada o la patología cardiovascular conocida o sospechada del paciente puede resultar en un compromiso hemodinámico, pulmonar o neurológico severo. Si se dispone de equipo y experiencia, se debe utilizar ETE cuando persista una inestabilidad circulatoria inexplicable que ponga en peligro la vida a pesar de la terapia correctiva
Paro cardíaco intraoperatorio
| Tabla 2. Contraindicaciones | |
| Absolutas
Cirugía esofágica Divertículos esofágicos Estenosis esofágica Tumores esofágicos Várices esofágicas sangrantes |
Relativas
Várices esofágicas Coagulopatías y trombocitopenia Hernia hiatal/esofagitis Limitación de la movilidad cervical Cirugía baríátrica no complicada |
Existe evidencia que avala el uso de ETE en caso de paro cardíaco, pero ninguno abarca las imágenes pulmonares. Si bien durante el proceso de reanimación 4 o 5 imágenes cardíacas son suficientes para guiar la reanimación, es necesario observar el pulmón como parte integral del exámen para poder entender y guiar un tratamiento post reanimación inmediata[13],[14].
Caso 1: Paciente de 30 años que sufre paro cardíaco post inducción de anestesia para osteosíntesis de fémur. Portadora de cáncer de mama con metástasis óseas. Inmediatamente después de la reanimación exitosa se advierte una fracción de eyección deteriorada y ventrículo izquierdo (VI) dilatado sin alteración evidente del ventrículo derecho (VD). ETEP fue determinante para identificar la causa del paro, un gran derrame pleural. Se drenan 2.500 ml de líquido setrino (Figuras 1 a,b y 2).
Caso 2: Paciente de 24 años que durante la resección laparoscópica de quiste de ovario tiene paro cardíaco con diagnóstico de síndrome de Takotsubo (diagnóstico que se completó luego de una angiografía a los 2 días del posoperatorio). Luego de la reanimación exitosa el estudio del ETEC demostró: aquinesia de la punta del corazón con bases hipercontráctiles, insuficiencia mitral aguda y dilatación de aurícula izquierda (AI), e hipertensión pulmonar y finalmente al observar el pulmón izquierdo con ETEP detectamos la presencia de líneas B coalescentes. El tratamiento fue soporte hemodinámico con inotrópicos y la administración de diuréticos para evitar edema agudo de pulmón (Figuras 3 a, b, c, d y 4).
-
Cirugía cardíaca
Utilizamos ETE como monitor de rutina en distintos tipos de cirugía cardíaca.
La anestesia general y circulación extracorpórea (CEC) especialmente, generan atelectasias y producen zonas pulmonares no ventiladas. Estas sufren el fenómeno de vasoconstricción pulmonar hipóxica, lo que genera un aumento de la impedancia vascular al ventrículo derecho, pudiendo llevar a la disfunción del mismo. Al reabrir estas áreas y ventilarlas, con maniobras de reclutamiento alveolar (MRA) este efecto se revierte generando menor resistencia a la circulación pulmonar, disminuye la presión de arteria pulmonar y mejora la poscarga del ventrículo derecho. Esto optimiza la función cardíaca derecha y debido a la interdependencia ventricular esa mejoría se ve reflejada en la función cardíaca izquierda, mejorando el gasto cardíaco y la función sistólica. La MRA sobredistiende áreas pulmonares generando disminución del retorno venoso. Pero si la maniobra se realiza con una precarga optimizada, se puede realizar con una mínima repercusión hemodinámica[15].
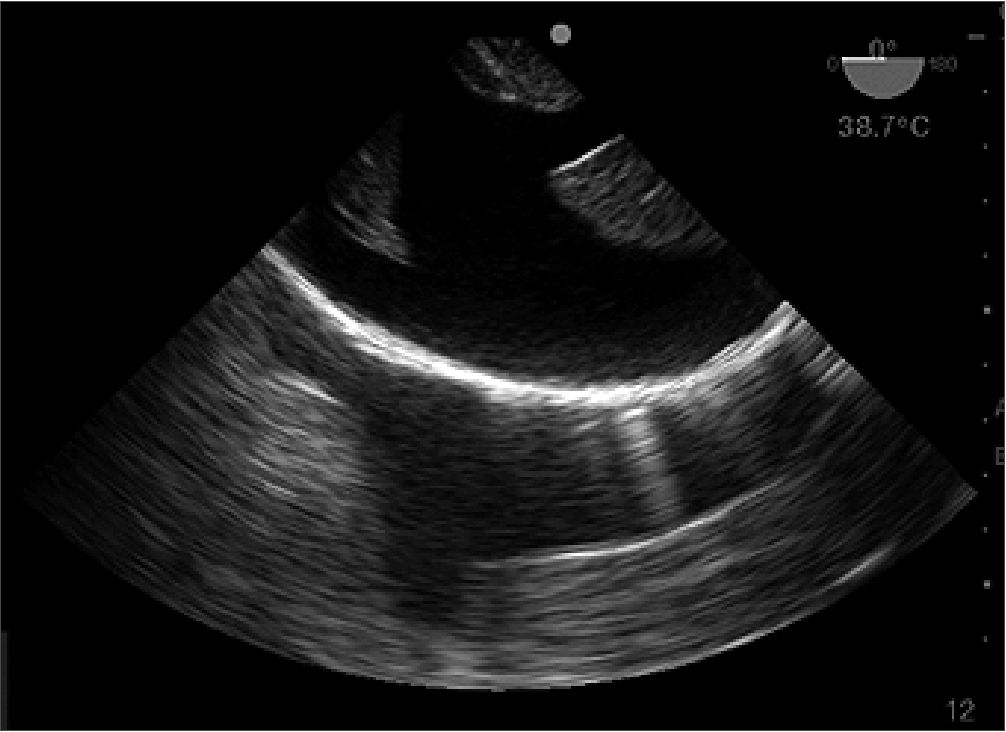
Figura 2. Derrame pleural imagen a 0 grado ETEP.
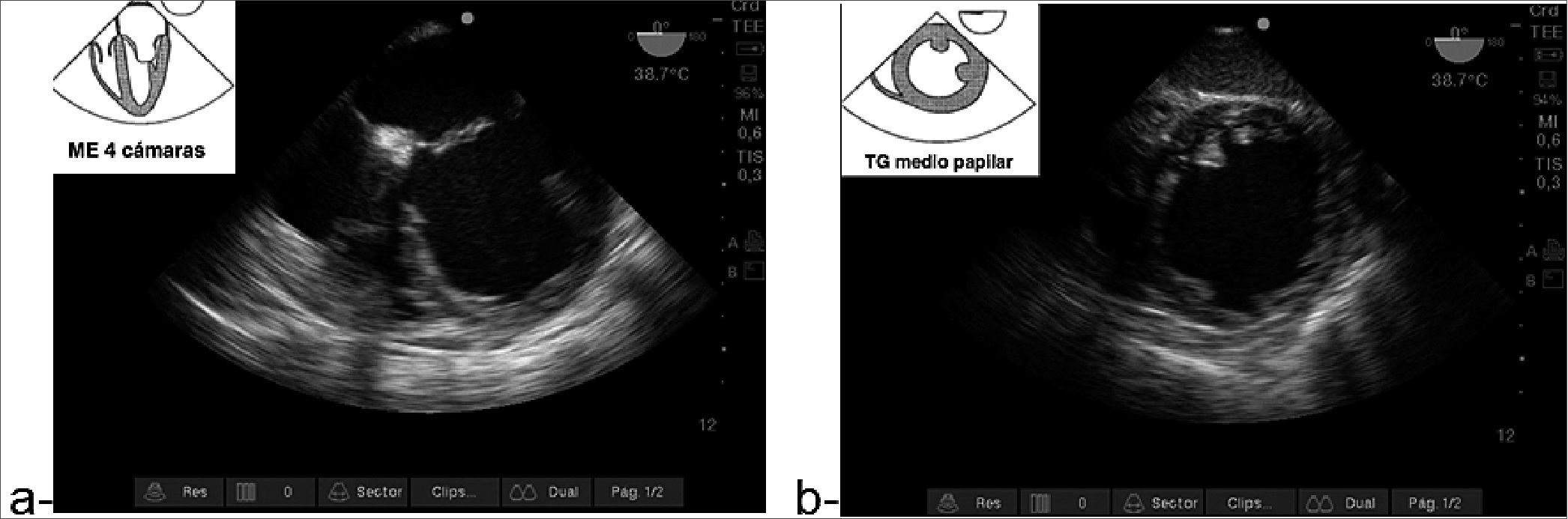
Figura 1. a: imagen medio esofágica (ME) 4 cámaras; b: transgástrico (TG) medio papilar, dilatación de VI.
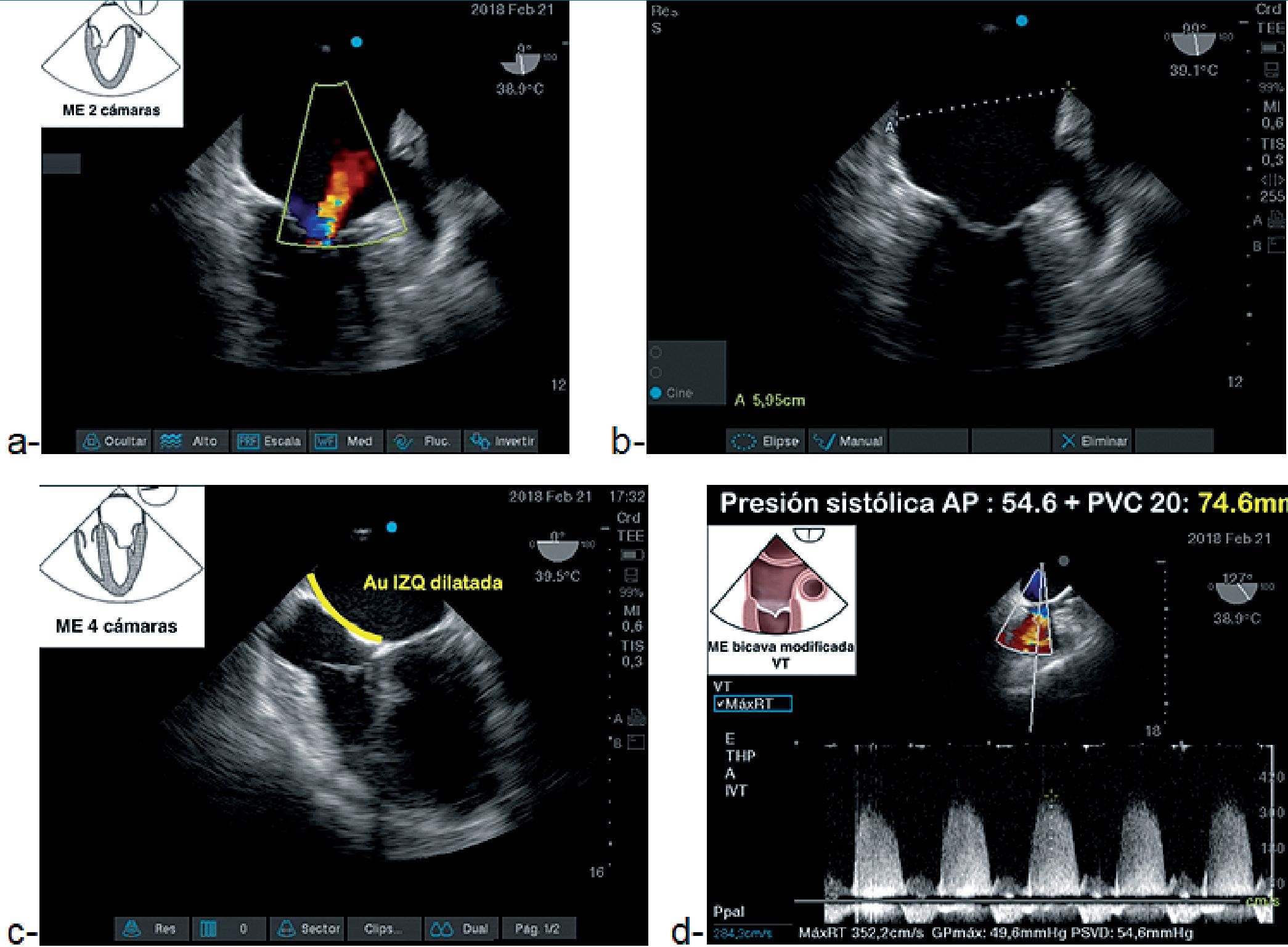
Figura 3. a: imagen ME de 2 cámaras Insuficiencia mitral aguda; b: ME 2 cámaras dilatación de aurícula izquierda; c: ME 4 cámaras VD tamaño normal con dilatación de AI y VI; d: ME bicava modificada cálculo de la presión sistólica de la arteria pulmonar desde el reflujo tricúspideo (74,6 mmHg).
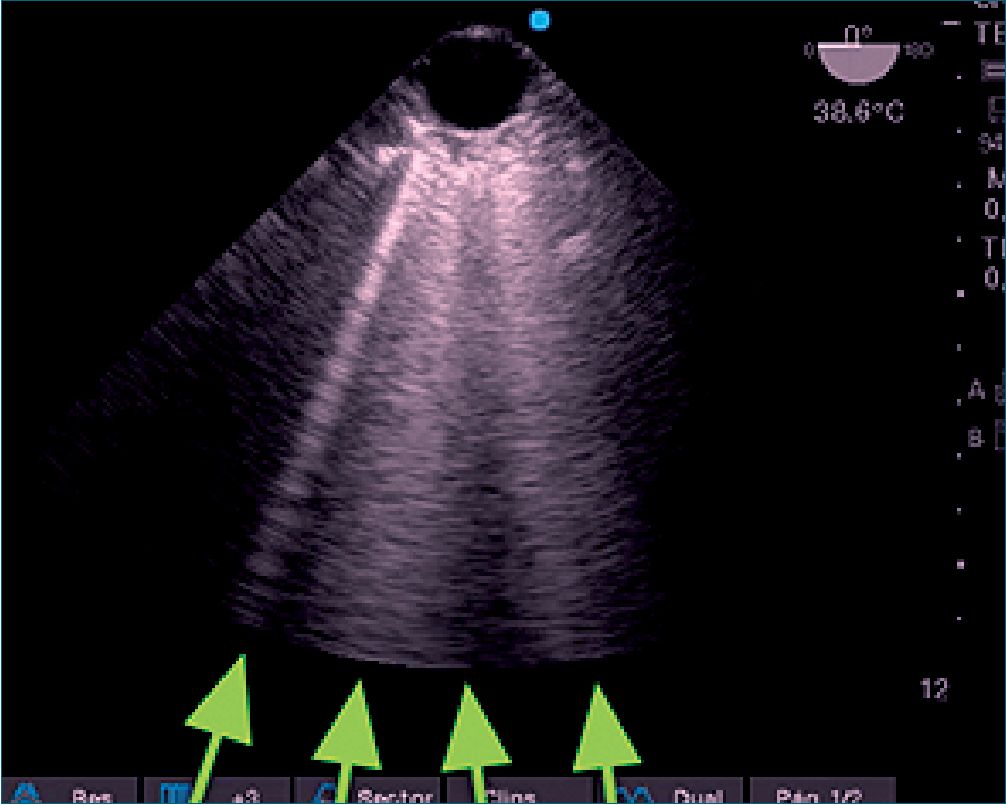
Figura 4. Flechas indican: Líneas verticales B en ETEP a 0 grado.
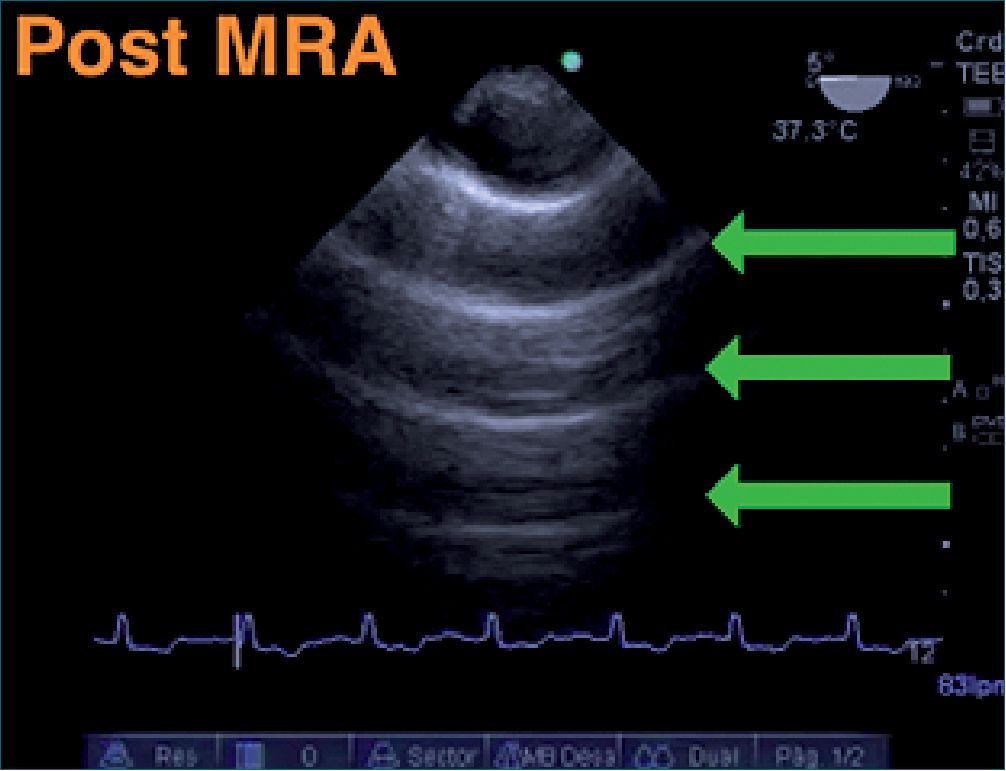
Figura 6. ETEP 0°: flechas: Líneas A luego de la MRA.
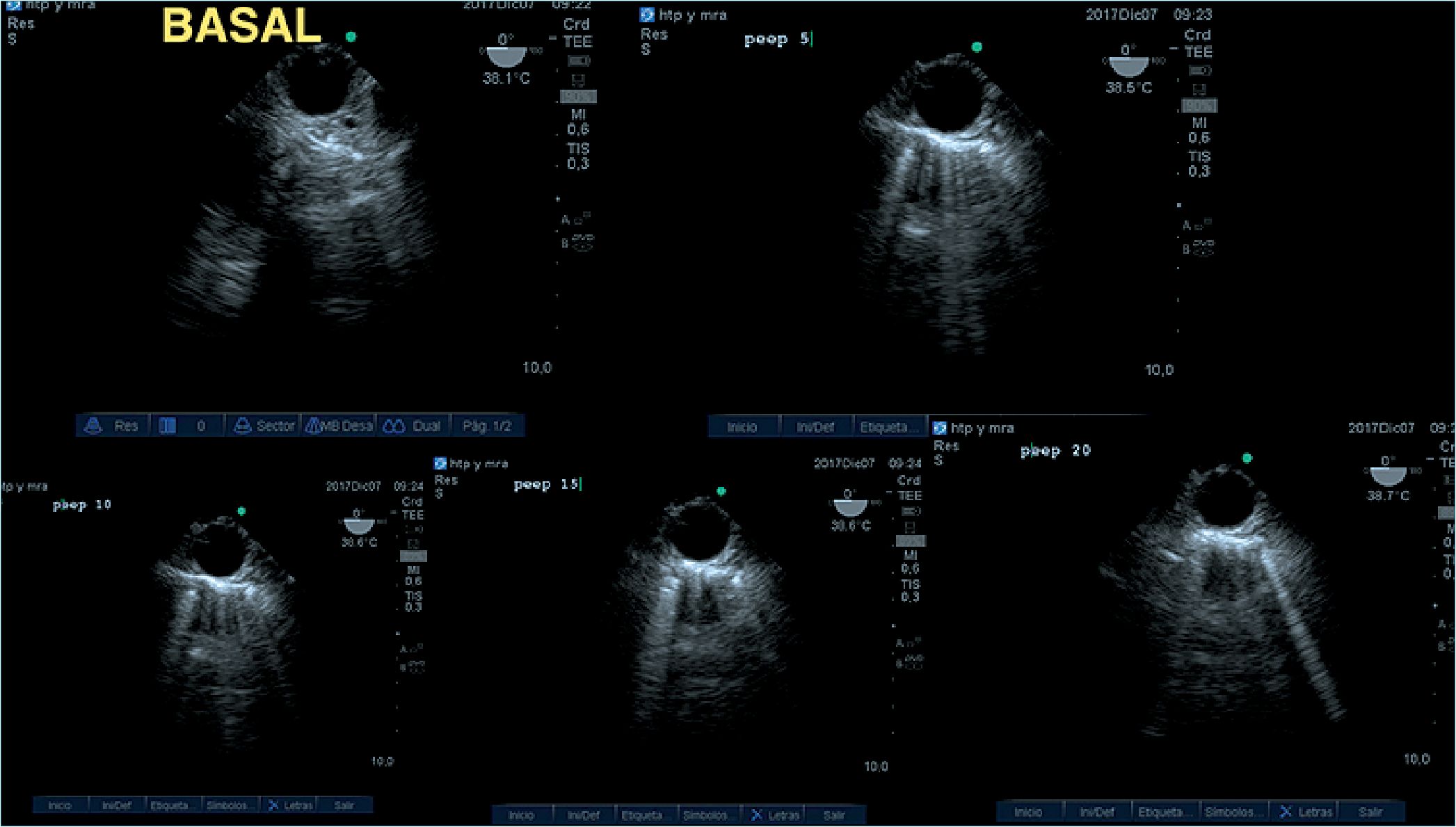
Figura 5. ETEP a 0°: Condensación pulmonar izquierda, aplicación de MRA escalonado desde 5, 10, 15 hasta 20 de PEEP.
En las siguientes imágenes se observa atelectasia en pulmón izquierdo post CEC. La aplicación de una MRA, incrementando la presión pico de manera escalonada, como así también el nivel de la presión positiva al final de la espiración (PEEP) hasta alcanzar la presión de apertura que permite revertir las áreas de colapso alveolar, mejorando la aireación pulmonar y obteniendo un patrón sonográfico con líneas A (Figuras 5 y 6).
Estos beneficios los observamos en pacientes sin hipertensión pulmonar (HTP) y buena fracción de eyección, pero también en pacientes con HTP y deterioro de la función cardíaca. Estos pacientes son los que más pueden beneficiarse con las MRA, debido al deterioro en la capacidad funcional y condición de paciente crónicamente enfermo, factores indiscutibles de riesgo para hipoxemia perioperatoria.
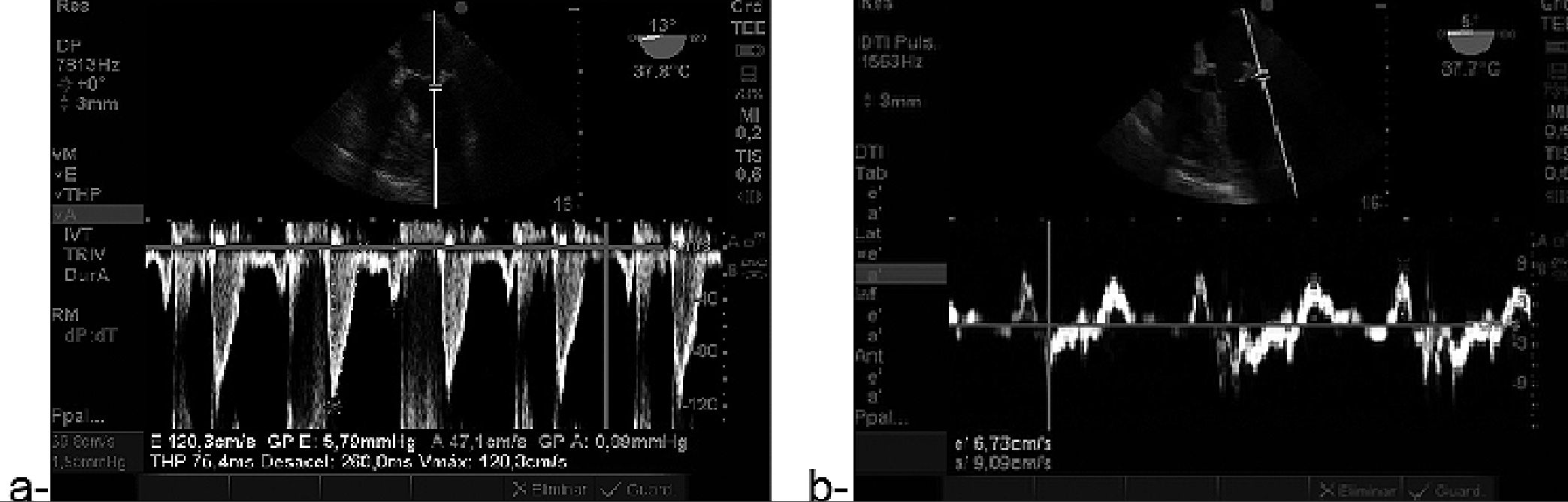
Figura 7. a- Doppler pulsado en ME 4 cámaras flujo diastólico mitral E/A mayor de 2 (2,55); b-Doppler tisular en el borde lateral del anillo mitral: e’ 6,7. Relación E/e’: 120/6,7: 17,9. Función diastólica grado 3.
Entonces cuando en la evaluación post CEC observamos disminución de la compliance pulmonar y con ETECP detectamos un aumento de la presión sistólica de arteria pulmonar y/o aumento de la resistencia vascular pulmonar, así como también áreas de consolidación pulmonar es imperioso determinar la necesidad de aplicar MRA, con el objetivo de revertir el colapso pulmonar y disminuir la postcarga del VD. El examen pulmonar con ETE determina el punto de partida y la efectividad del tratamiento.
Las complicaciones pulmonares son comunes después de la cirugía cardíaca y están estrechamente asociadas con insuficiencia cardíaca posoperatoria y resultados adversos[16]. Y contribuyen de manera importante a la morbimortalidad durante y después de la cirugía cardíaca. Estas complicaciones representan aproximadamente el 40% de los reingresos en la unidad de cuidados intensivos cardiovasculares[17].
Además, durante la cirugía cardíaca con CEC observamos cómo un importante número de pacientes, cambia el grado de función diastólica post CEC. Presentamos el caso de un paciente con estenosis aórtica para reemplazo valvular, que durante cirugía cardíaca experimenta un empeoramiento de la función diastólica post CEC. Paciente con fracción de eyección normal y que post inducción se registró disfunción diastólica (DD) grado 1 que luego de CEC (mayor a 2 h), constatamos DD grado 3 con hipertensión pulmonar (Figuras 7 a,b, 8 y 9).
Descartada la hipertensión pulmonar primaria, cuando detectamos disfunción diastólica severa y observamos hipertensión pulmonar junto a relación S/D menor a 1 en las venas pulmonares debemos observar la repercusión de la enfermedad hacia atrás y analizar el patrón pulmonar. Es en ese contexto, dónde la ETEP cobra gran relevancia al informarnos sobre la presencia de líneas B. Lo cual nos conduce a la utilización de diuréticos y restricción hídrica, hasta lograr un patron de líneas A (Figura 10).
La patogenia de la congestión pulmonar implica la acumulación de agua extravascular que aparece como múltiples líneas B durante el edema pulmonar. El número de líneas B es directamente proporcional al grado de acumulación de agua extravascular[18]. Esto ha sido validado por múltiples trabajos con ETT[19],[20].
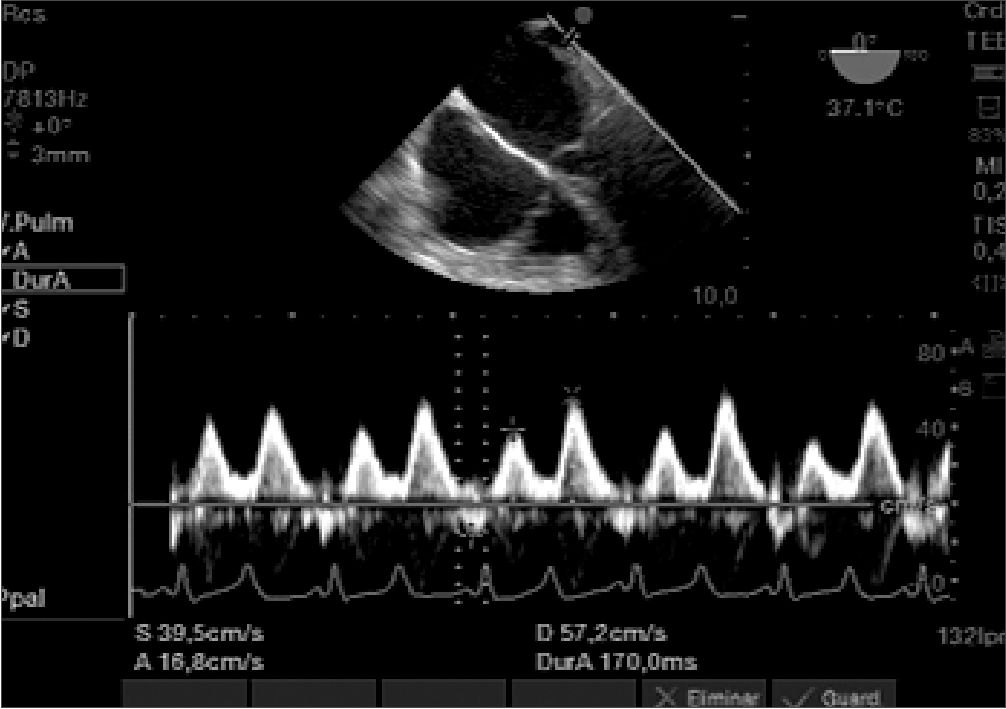
Figura 8. Relación S/D 39,5%/57,2: menor a 1 (0,69).
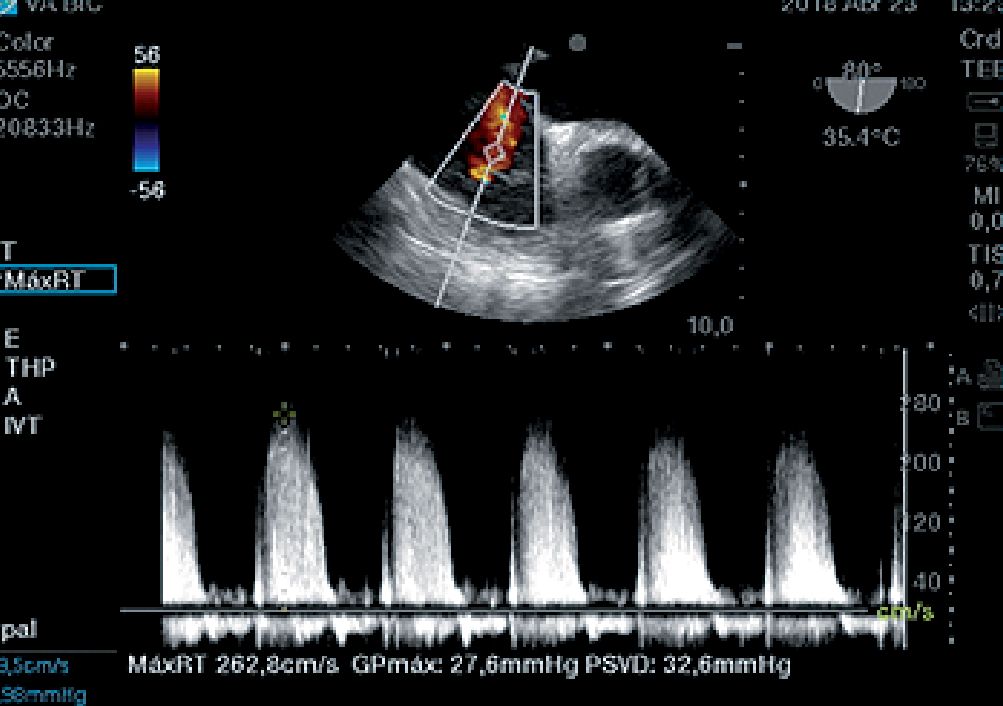
Figura 9. Hipertensión pulmonar desde ME reflujo tricúspideo: 32,6 + presión venosa central (PVC) 15 = 47,6 mmHg presión sistólica pulmonar.
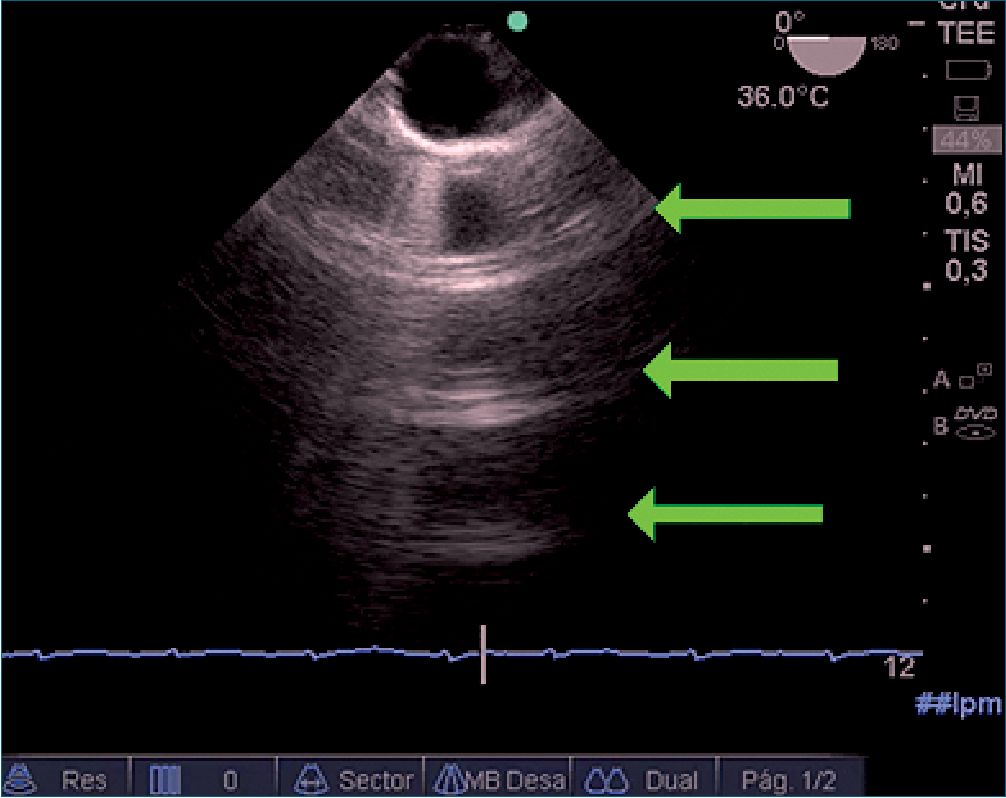
Figura 10. ETEP imagen a 0°, flechas: líneas A en pulmón izquierdo.
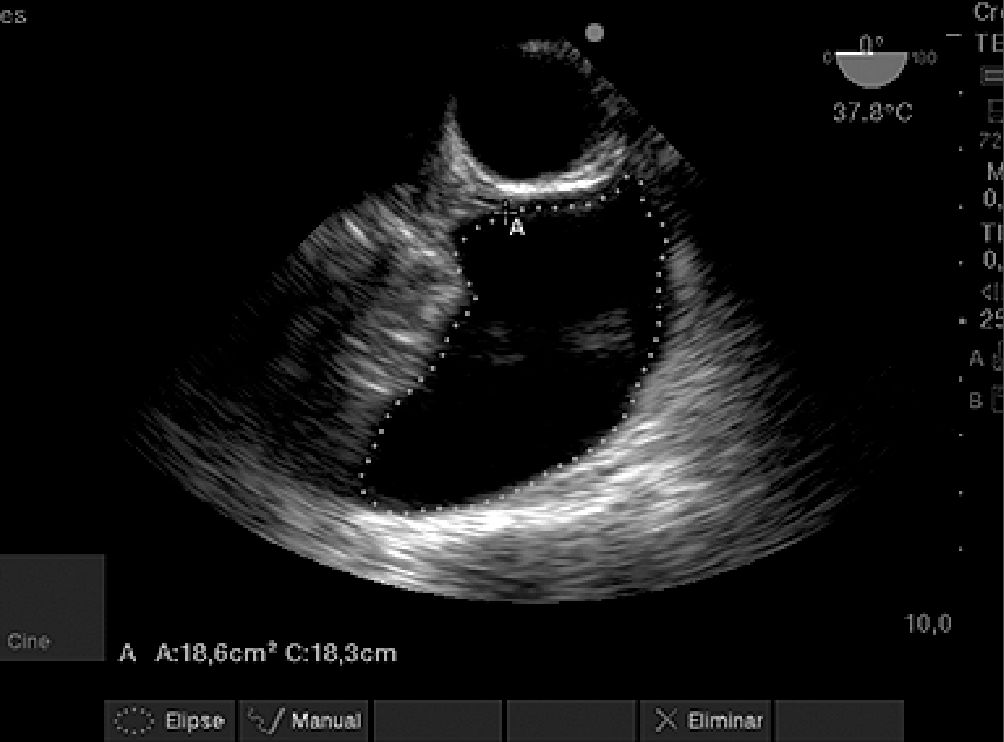
Figura 11. Derrame pleural izquierdo en paciente que tiene indicación de ventana pericárdica.
La ecografía es más sensible para diagnosticar la congestión pulmonar que la radiografía simple de tórax (sensibilidad: 91%- 96% versus 33%-65%)[21]. Aunque las líneas B son un signo inespecífico de acumulación de líquido extravascular, deben combinarse con ecocardiografía y pruebas de biomarcadores para determinar claramente la causa de la insuficiencia cardíaca y evaluar la gravedad del edema[22]. La congestión en los pulmones puede provocar un derrame pleural y eventualmente resultar en atelectasia pulmonar.
-
Derrame pleural
El derrame pleural es una complicación común después de la cirugía cardíaca con una incidencia reportada de hasta el 95%[23]. Esta complicación puede estar relacionada con congestión pulmonar, neumonía, sangrado o quilotórax. Grandes cantidades de derrame pleural pueden conducir a atelectasia compresiva[24]. Un pulmón comprimido está involucrado en la consolidación, aunque el drenaje del líquido puede resultar en recuperación de la aireación y puede usarse para diferenciar entre atelectasia por compresión y neumonía[25].
Cuando los pacientes ingresan al quirófano para drenaje de derrame pericárdico es imperioso estudiar la posible asociación con derrame pleural. Sobre todo, en aquellos pacientes que tienen insuficiencia cardíaca ya que con frecuencia desarrollan también derrame pleural. Su diagnóstico y drenaje forman parte del tratamiento integral (Figuras 11 y 12).
-
Embolia pulmonar
La embolia pulmonar (EP) es un evento perioperatorio que puede asociarse con hipoxemia grave.
La visualización de un trombo en la arteria pulmonar durante la ecocardiografía confirma el diagnóstico de EP. La ETE tiene una sensibilidad del 80% y una especificidad del 100% para diagnosticar de trombos[26].
En las imágenes de la Figura 13 se ve trombo en ventrículo derecho y en la Figura 14 aire en arteria pulmonar. Su diagnóstico conduce a un tratamiento temprano. En el primer caso
intentar anticoagulación o trombólisis inmediata, en el segundo caso lograr desaireación del corazón derecho, en aquellos pacientes que en el intra o post operatorio inmediato sufren hipoxemia y fallo cardíaco por embolia pulmonar.
-
Discusión
-
Enfoque cardiopulmonar integrado en el quirófano
Analizamos cómo el uso rutinario de ETECP puede modificar la práctica actual en anestesia; y puede potencialmente afectar los resultados clínicos al tener datos precisos y en tiempo real.
La mayoría de los episodios cardiovasculares que ocurren durante cirugía tienen repercusión pulmonar. Las atelectasias que ocurren durante anestesia general son frecuentes, necesitan su diagnóstico y maniobras ventilatorias que mejoren la oxigenación.
Es importante un enfoque integrado por ultrasonido que combine el pulmón y el corazón para mejorar la ventilación mecánica que protege al corazón derecho[27].
Con ETEP podemos evaluar las zonas pulmonares posteriores y realizar un diagnóstico rápido de derrame pleural y consolidaciones pulmonares. Además, se logra diagnosticar y controlar las atelectasias inducida por la anestesia durante el período intraoperatorio. Aunque la evaluación del puntaje de aireación pulmonar ha sido validada solo con abordaje transtorácico, estos principios podrían aplicarse en las áreas posteriores examinadas por ETEP.
Por lo tanto, ETEP conduce a los anestesiólogos a decidir la mejor estrategia ventilatoria en el quirófano, individualizando a aquellos pacientes que requieren maniobra de reclutamiento y optimizando el ajuste de PEEP. La ecografía cardiopulmonar combinada no solo permite evaluar el estado hemodinámico antes de aplicar una maniobra de reclutamiento sino también, evaluar la disminución de la poscarga en la función ventricular derecha. Las reducciones de las atelectasias y la resistencia vascular pulmonar, mejora la relación ventilación-perfusión y
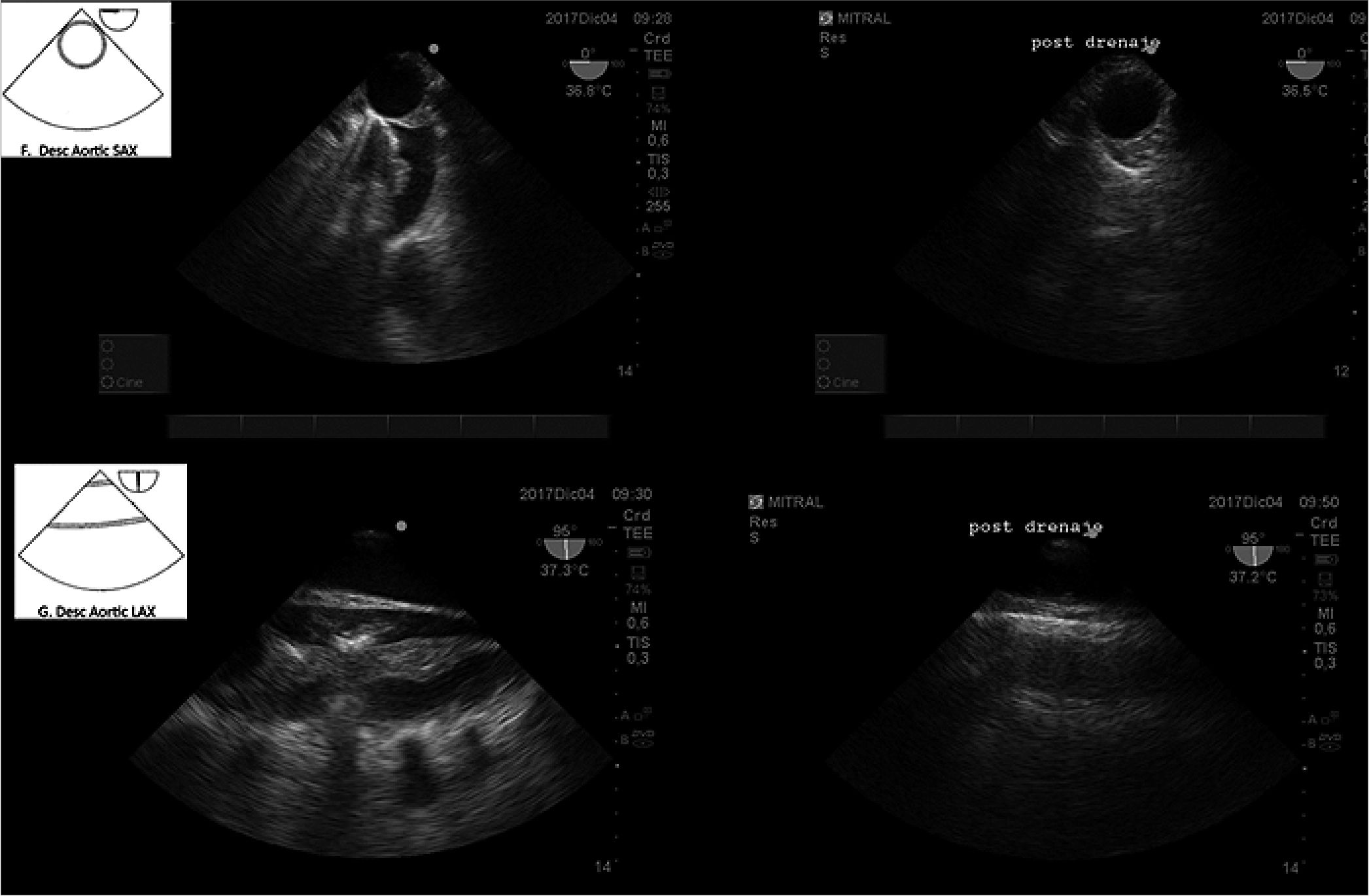
Figura 12. Drenaje pleural valorado en eje corto y largo del derrame pleural izquierdo.
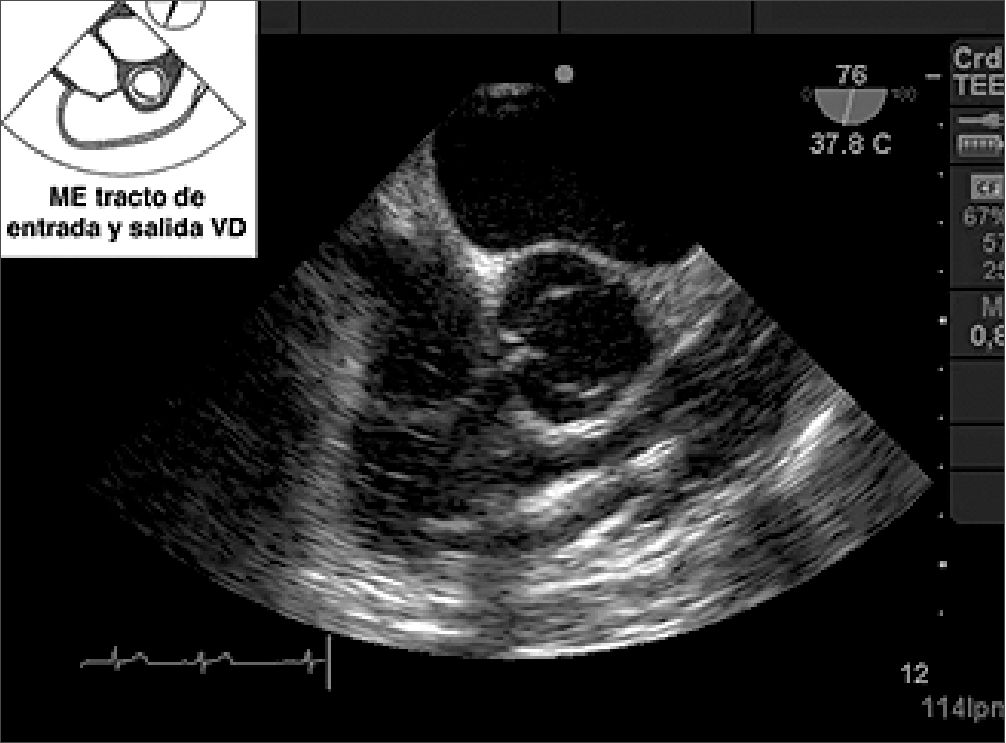
Figura 13. Imagen ME tracto de entrada y salida del VD: trombo en ventrículo derecho.
la oxigenación arterial. La optimización de los ajustes de ventilación es obligatoria en pacientes con disfunción ventricular derecha manifiesta para aumentar la precarga y disminuir la poscarga. De esta manera la optimización de la interacción corazón-pulmón guiada por ultrasonografía mejora el efecto de la ventilación mecánica en el quirófano.
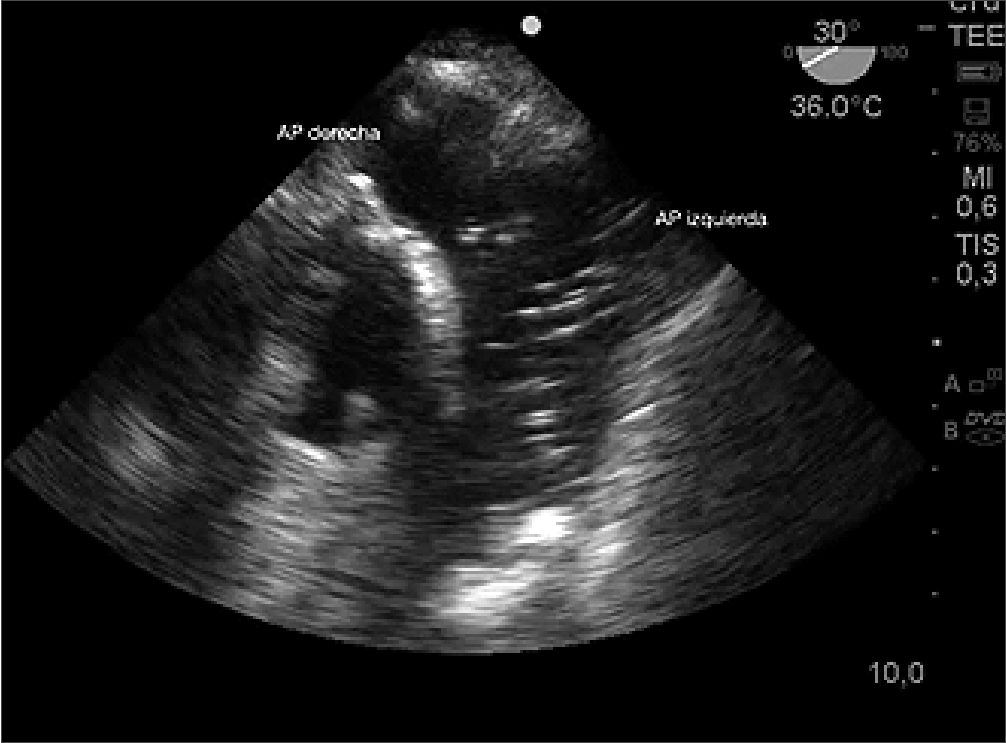
Figura 14. Imagen esofágica superior eje corto de aorta ascendente: conglomerado de aire en arteria pulmonar.
Además, se puede realizar un seguimiento del efecto de las MRA específicas aplicadas sobre la aireación pulmonar y al mismo tiempo observar el impacto hemodinámico de esta estrategia, en tiempo real[28].
La integración cuidadosa de los datos de aireación pulmonar con los indicadores de rendimiento del VD y del ventrículo izquierdo puede ayudar a encontrar el “punto óptimo” en términos de configuración de PEEP. En la evaluación de la aireación pulmonar por ETEP se pueden aplicar los mismos principios que ya han sido validado con EP transtorácica, aunque limitado a las zonas pulmonares posteriores.
La ecografía cardíaca y pulmonar integrada pueden optimizar la fluidoterapia en pacientes hemodinámicamente inestables. La llegada de los indicadores dinámicos ha contribuido a mejorar la capacidad de predecir la capacidad de respuesta de los fluidos. No obstante, incluso los parámetros ecocardiográficos más avanzados, como la variación integral del tiempo de la velocidad del tracto de salida del ventrículo izquierdo con la respiración o con la elevación pasiva de la pierna, no son perfectos[29]. Se ha demostrado que la ausencia de líneas B en la cavidad torácica anterior evaluada con un abordaje transtorácico, está asociado con una presión de oclusión normal de la arteria pulmonar[30]. En el contexto de la carga de líquidos, se cree que un aumento dinámico en el número de líneas B representa agua pulmonar extravascular y podría agregarse como una medida de seguridad para limitar la expansión del volumen antes que el edema pulmonar se vuelva clínicamente evidente[31].
Diversas patologías cardíacas pueden producir edema pulmonar cardiogénico, secundario a insuficiencia ventricular izquierda o valvulopatía, o shunt intracardiaco o intrapulmonar.
Durante el examen con ETE, la adición de la información recopilada por EP a los elementos proporcionados por la ecocardiografía, permiten un abordaje integrado en el punto de atención del paciente, ante un evento hemodinámico agudo.
-
Ventajas y limitaciones
Las principales ventajas de ETE incluye la capacidad de realizar el procedimiento que en tiempo real proporciona imágenes de alta calidad. Una vez realizado el estudio del corazón, el examen pulmonar implica la rotación de la sonda hacia atrás, desde las vistas cardíacas, para encontrar las áreas pulmonares posteriores[32].
La integración cardiopulmonar nos puede orientar hacia la causa de hipoxemia o inestabilidad hemodinámica y la necesidad de realizar drenaje de derrames, orientar el manejo de líquidos y optimizar la ventilación. La sonda está muy cerca de las regiones posteriores de los pulmones donde ocurren principalmente derrames pleurales, consolidaciones y líneas B. Este abordaje permite acceder a las zonas posterosuperiores, consideradas los puntos ciegos de la ecografía transtorácica creados por la escápula[33].
La principal limitación de ETEP es que aún no ha sido suficientemente validada, tiene mucha menos evidencia de apoyo. Además, es menos sensible a las patologías del lado derecho, y las caras anterior y lateral de los pulmones son en gran parte inaccesibles. Finalmente, ETEP comparte las principales limitaciones de la ETT, ya que a menudo se basa en la interpretación de artefactos para obtener información sobre el pulmón y es claramente algo dependiente del operador[34].
-
Conclusión
El examen cardiovascular con ETE tiene el gran beneficio de proporcionar información sobre el estado del corazón izquierdo y derecho, la ETECP posee la ventaja de proporcionar en un mismo examen un abordaje integrado del corazón y pulmón evidenciando diferentes patologías respiratorias como consolidación pulmonar, derrames pleurales y edema pulmonar. Los anestesiólogos e intensivistas que ya utilizan ETE de forma habitual deberían incorporar definitivamente la combinación de esta poderosa herramienta a su valoración clínica. Aunque una gran cantidad de trabajos respaldan la ecografía pulmonar transtorácica, unos pocos artículos resaltan la utilidad de la ETEP. Esto requiere estudios más amplios que validen aspectos específicos de esta valiosa herramienta, en diferentes escenarios.
Referencias
1. Nicoara A, Skubas N, Ad N, et al. Guidelines for the Use of Transesophageal Echocardiography to Assist with Surgical Decision-Making in the Operating Room: A Surgery-Based Approach From the American Society of Echocardiography in Collaboration with the Society of Cardiovascular Anesthesiologists and the Society of Thoracic Surgeons. J Am Soc Echocardiogr 2020; 33:692-734 https://doi.org/10.1016/j.echo.2020.03.002
2. Carmona García P, García Fusterb R, Mateoc E, et al Ecocardiografía transesofágica intraoperatoria en cirugía cardiovascular. Documento de consenso de la Sociedad Española de Anestesiología y Reanimación (SEDAR) y Sociedad Española de Cirugía Cardiovascular y Endovascular (SECCE). Rev Esp Anestesiol Reanim. 2020;67(8):446-480 https://doi.org/10.1016/j.redar.2020.06.001
3. Thys D M, Brooker R F, Cahalan M K, et al. Practice guidelines for perioperative transesophageal echocardiography. An updated report by the American Society of Anesthesiologists and the Society of Cardiovascular Anesthesiologists Task Force on Transeso-phageal Echocardiography. Anesthesiology 2010; 112:1084-96. https://doi.org/10.1097/ALN.0b013e3181c51e90
4. Moitra V.K., Einav S., Thies K-C., et al. Cardiac Arrest in the Operating Room: Resuscitation and Management for the Anesthesiologist: Part 1. Anesth Analg 2018; 126: 876-88 https://doi.org/10.1213/ANE.0000000000002596
5- McEvoy MD, Thies K-C, Einav S., Cardiac Arrest in the Operating Room: Part 2- Special Situations in the Perioperative Period. Anesth Analg 2018; 126: 889-903 https://doi.org/10.1213/ANE.0000000000002595
6. Teran F, Dean AJ, Centeno C, et al Evaluation of out-of-hospital cardiac arrest using transesophageal echocardiography in the emergency department Resuscitation (2019)140-147 https://doi.org/10.1016/j.resuscitation.2019.02.013
7. Fair J, Mallin MP, Adler A, Ockerse P, Steenblick J, Tonna J, et al. Transesophageal Echocardiography During Cardiopulmonary Resuscitation Is Associated With Shorter Compression Pauses Compared With Transthoracic Echocardiography. Annals of emergency medicine. 2019; 73(6):610-616. https://doi.org/10.1016/j.annemergmed.2019.01.018
8. Hahn RT, Abraham T, Adams MS, Bruce CJ, Glas KE, Lang RM, et al. Guidelines for performing a comprehensive transesophageal echocardio- graphic examination: recommendations from the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. J Am Soc Echocardiogr 2013; 26:921-64. https://doi.org/10.1016/j.echo.2013.07.009
9. Cavayas YA, Girard M, Desjardins G, Denault AY. Transesophageal lung ultrasonography: a novel technique for investigating hypoxemia. Can J Anesth 2016 ; 63:1266-1276. https://doi.org/10.1007/s12630-016-0702-2
10. Tsubo T, Sakai I, Suzuki A, Okawa H, Ishihara H, Matsuki A. Density detection in dependent left lung region using transesophageal echocardiography. Anesthesiology 2001; 94: 793-8. https://doi.org/10.1097/00000542-200105000-00017
11. Rehfeldt KH, Bruggink SM, Pulido JN. Transesophageal echocardiographic imaging of ultrasound lung rockets. Anesthesiology 2014; 121: 1335. https://doi.org/10.1097/ALN.0000000000000098
12. Hilberath JN, Oakes DA, Shernan SK, Bulwer BE, D’Ambra MN, Eltzschig HK. Safety of transesophageal echocardiography. J Am Soc Echocardiogr 2010; 23: 1115-27; quiz 1220-1. https://doi.org/10.1016/j.echo.2010.08.013
13. Arntfield R, Pace J, McLeod S, Granton J, Hegazy A, Lingard L. Focused transesophageal echocardiography for emergency physicians-description and results from simulation training of a structured four-view examination. Crit Ultrasound J 2015; 7:27. https://doi.org/10.1186/s13089-015-0027-3
14. Staudt G and Shelton K; Development of a Rescue Echocardiography Protocol for Noncardiac Surgery Patients. Anesth Analg 2019;129: e37-40. https://doi.org/10.1213/ANE.0000000000003569
15. Longo S, Siri J, Acosta C, et al . Lung recruitment improves right ventricular performance after cardiopulmonary bypass. Eur J Anaesthesiol 2016; 33:1-10
16. Badenes R, Lozano A, Belda FJ. Postoperative pulmonary dysfunction and mechanical ventilation in cardiac surgery. Crit Care Res Pract 2015. https://doi.org/10.1155/2015/420513
2015:1-8. 17- Litwinowicz R, Bartus K, Drwila R, et al. In-hospital mortality in cardiac surgery patients after readmission to the intensive care unit: A single-cen- ter experience with 10,992 patients. J Cardiothorac Vasc Anesth 2015;29: 570-5. https://doi.org/10.1053/j.jvca.2015.01.029
18. Saad MM, Kamal J, Moussaly E, et al. Relevance of B-lines on lung ultrasound in volume overload and pulmonary congestion: Clinical correlations and outcomes in patients on hemodialysis. Cardiorenal Med 2018; 8:83-91. https://doi.org/10.1159/000476000
19. Picano E, Pellikka PA. Ultrasound of extravascular lung water: A new standard for pulmonary congestion. Eur Heart J 2016; 37:2097-104. https://doi.org/10.1093/eurheartj/ehw164
20. Platz E, Jhund PS, Girerd N, et al. Expert consensus document: Reporting checklist for quantification of pulmonary congestion by lung ultrasound in heart failure. Eur J Heart Fail 2019; 21:844-51. https://doi.org/10.1002/ejhf.1499
21. Wooten WM, Shaffer LET, Hamilton LA. Bedside ultrasound versus chest radiography for detection of pulmonary edema: A prospective cohort study. J Ultrasound Med 2019;38:967-73. https://doi.org/10.1002/jum.14781
22. Palazzuoli A, Ruocco G, Beltrami M, et al. Combined use of lung ultrasound, B-type natriuretic peptide, and echocardiography for outcome prediction in patients with acute HFrEF and HFpEF. Clin Res Cardiol 2018; 107:586-96. https://doi.org/10.1007/s00392-018-1221-7
23. Tsubo T, Yatsu Y, Okawa H, Ishihara H, Matsuki A. Transesophageal echocardiography is a sensitive method to evaluate pleural effusion. Anesthesiology 2002; 96: A322. https://doi.org/10.1097/00000542-200209002-00322
24. Caltabeloti F, Monsel A, Arbelot C, et al. Early fluid loading in acute respiratory distress syndrome with septic shock deteriorates lung aeration without impairing arterial oxygenation: a lung ultrasound observational study. Crit Care 2014; 18: R91. https://doi.org/10.1186/cc13859
25. Lichtenstein D. Lung ultrasound in the critically ill. Curr Opin Crit Care 2014; 20:315-22. https://doi.org/10.1097/MCC.0000000000000096
26. Dalia AA, Khan H, Flores AS. Intraoperative diagnosis of intracardiac thrombus during orthotopic liver transplantation with transesophageal echocardiography: A case series and Literature review. Seminars in Cardiothorac and Vasc Anesth. 2017;21(3):245-251. https://doi.org/10.1177/1089253216677966
27. Tusman G, Bohm SH, Suarez-Sipmann F. Alveolar recruitment during mechanical ventilation: where are we in 2013? Trends Anaesth Crit Care 2013; 3:238-245. https://doi.org/10.1016/j.tacc.2013.06.003
28. Laursen CB, Sloth E, Lassen AT, et al. Point-of-care ultrasonography in patients admitted with respiratory symptoms: A single-blind, randomised controlled trial. Lancet Respir Med 2014; 2:638-46. https://doi.org/10.1016/S2213-2600(14)70135-3
29. Bouhemad B, Brisson H, Le-Guen M, et al. Bedside ultrasound assessment of positive end-expiratory pressure-induced lung recruitment. Am J Respir Crit Care Med 2011; 183:341-7. https://doi.org/10.1164/rccm.201003-0369OC
30. Lichtenstein DA. Lung ultrasound in the critically ill. Ann Intensive Care 2014; 4:1. https://doi.org/10.1186/2110-5820-4-1
31. Caltabeloti F, Monsel A, Arbelot C, et al. Early fluid loading in acute respiratory distress syndrome with septic shock deteriorates lung aeration without impairing arterial oxygenation: a lung ultrasound observational study. Crit Care 2014; 18: R91. https://doi.org/10.1186/cc13859
32. Verhaeghen D, Poelaert J, Ama R, Roosens C, Tempe DK, Chaney MA. Case 2-2005: evaluation of the lungs via transesophageal echocardiography. J Cardiothorac Vasc Anesth 2005; 19: 242-9. https://doi.org/10.1053/j.jvca.2005.01.007
33. Bouhemad B, Mongodi S, Via G, et al. Ultrasound for “lung monitoring” of ventilated patients. Anesthesiology 2015; 122:437-47. https://doi.org/10.1097/ALN.0000000000000558
34. Volpicelli G, Elbarbary M, Blaivas M, et al. International evidence-based recommendations for point-of-care lung ultrasound. Intensive Care Med 2012; 38: 577-91. https://doi.org/10.1007/s00134-012-2513-4

 ORCID
ORCID