Cristóbal López 1 , Macarena Kutscher 1 , Juan C. Pedemonte 2 , Francisca Elgueta 2
Recibido: 03-08-2020
Aceptado: 24-08-2020
©2021 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 50 Núm. 3 pp. 423-429|https://doi.org/10.25237/revchilanestv50n03-2
PDF|ePub|RIS
Intraoperative methadone for the management of postsurgical pain a review
Abstract
Pain management associated with surgery is a constant concern of the health team as well as the patient. Multiple proposals for analgesia have been made in the perioperative context. The use of opioids with rapid effect and easy titration in the intraoperative period are currently frequent; to then perform a postoperative analgesic control with drugs with a longer half-life, usually achieving adequate pain management. However, sometimes the standard analgesic scheme is not enough. The problems associated with this situation have led to the need for high doses of opioids in the postoperative period, with the requirement for monitoring, health personnel, and the adverse effects that these involve. Methadone is a long-acting, rapid-onset opioid, the latter secondary to its long elimination half-life. It is presumed that these characteristics have led patients to report adequate pain management, which has been related to a decrease in the need and dose of rescue opioids, in addition to delaying the requirement of these if necessary during the postoperative. These properties allow methadone to be a potential solution to perioperative pain management.
Resumen
El manejo del dolor asociado a la cirugía es una preocupación constante del equipo de salud al igual que del paciente. Se han planteado múltiples propuestas de analgesia en el contexto perioperatorio, siendo actualmente frecuente el uso de opioides de rápido efecto y fácil titulación en el intraoperatorio; para luego realizar un control analgésico postoperatorio con fármacos de mayor vida media, logrando habitualmente un manejo adecuado del dolor. Sin embargo, a veces el esquema analgésico estándar no es suficiente. La problemática asociada a esta situación ha llevado a la necesidad de altas dosis de opioides en el posoperatorio, con el requerimiento de monitorización, personal de salud y efectos adversos que estos involucran. La metadona es un opioide de inicio de acción rápido y larga duración, este último secundario a su vida media de eliminación prolongada. Se presume que estas características han logrado que los pacientes reporten un adecuado manejo de su dolor, lo que se ha relacionado a una disminución en la necesidad y dosis de opioides de rescate, además de retrasar el requerimiento de éstos en el caso de ser necesarios durante el postoperatorio. Estas propiedades permiten que la metadona pueda ser una potencial solución al manejo del dolor perioperatorio.
-
Introducción ¿por qué buscar alternativas analgésicas?
La práctica de la anestesia general actual se basa en el uso analgésico intraoperatorio de opioides de duración intermedia o corta, por ejemplo fentanyl o remifentanyl. Esto permite una adecuada titulación de la droga durante la cirugía. Sin embargo, su utilización puede significar que la transición entre la analgesia del intraoperatorio y postoperatorio sea deficiente, lo que es éticamente inaceptable para el paciente[1].
En cirugías consideradas como poco dolorosas, llegar a la recuperación tras haber usado dosis bajas de opioide de duración intermedia o corta intraoperatoria, en espera de la administración y efecto de la morfina, puede generar ventanas de tiempo sin analgesia no deseadas. Más del 40% de los pacientes refieren un manejo inadecuado del dolor posoperatorio, de moderado a severo, es decir, escala visual análoga (EVA) 5 o mayor[2]. Además, parece deseable buscar alternativas en cuanto al manejo del dolor que puedan ser más estables y económicas, ya que probablemente la analgesia controlada por el paciente (PCA), a pesar de tener múltiples ventajas, es costosa, se necesita tener un nivel basal bajo de dolor y un equipo que la prepare y controle[3].
La metadona, opioide desarrollado en el siglo XX, pareciera tener características que permitirían lograr cumplir con múltiples necesidades de lo que se espera en el manejo ideal del dolor relacionado a la cirugía. Por una parte, permitiría un adecuado manejo de dolor propiamente tal, como también la disminución del uso de opioides durante el período posoperatorio. El objetivo de este trabajo es revisar las propiedades de la metadona y la evidencia que existe en relación a su uso como analgesia postoperatoria en el contexto de pacientes quirúrgicos.
Se realizó una revisión en las bases de datos PubMed, The Cochrane Library, Embase y Google Scholar en búsqueda de revisiones narrativas, revisiones sistemáticas, estudios clínicos randomizados y estudios clínicos no randomizados con los términos “metadona”, “analgesia perioperatoria” y “dolor postoperatorio”. Se incluyeron artículos de farmacocinética y farmacodinamia junto a estudios en que se comparó metadona con otras alternativas farmacológicas utilizadas para el manejo del dolor perioperatorio. Se incluyeron todos los estudios en inglés y español.
-
Metadona y su farmacología
La metadona es una droga de larga data, fue desarrollada en Alemania el año 1946[4]. Es una de las drogas con más publicaciones disponibles, con más de 15.000 artículos en la base de datos MEDLINE mediante el buscador PubMed, pero no en un contexto de población quirúrgica, sino que asociado al tratamiento de la adicción a heroína.
Tiene un inicio de acción rápido, entre 6 y 8 minutos. Probablemente, su característica farmacológica más destacable es su vida media de eliminación prolongada, que dependiendo del estudio varía entre 24 y 36 h[5]. Es una droga lipofílica y básica, tiene una pKa de 9,2. Es posible administrar vía oral, rectal o parenteral. Corresponde a una mezcla racémica de dos enantiómeros, la S-metadona que produce un antagonismo ácido N-metil-D-aspártico (NMDA) e inhibición de recaptura de serotonina (5HT-3) y noradrenalina (NAd). Por otro lado, la R-metadona es un agonista opioide con propiedades tanto mu como delta[4]. No tiene metabolito activo, pero sí tiene metabolitos medibles, y también posee una alta biodisponibilidad, siendo esto lo que permite sus diversos tipos de administración. La biodisponibilidad oral de la metadona es reportada alrededor del 80%, con un rango entre el 40% y 99%, comparado con la morfina oral que es de 30%[4]. Esto quiere decir que, de una dosis de morfina oral después del primer paso hepático, habrá llegado solo el 30% al torrente sanguíneo, en cambio en la metadona sería de 80%.
Al ser un agonista mu opioide muy potente, otorga un buen control analgésico, y al ser antagonista NMDA, sería lógico pensar que tiene propiedades antihiperalgésicas, antialodinia, y permite disminuir la tolerancia[5]. También es efectiva en el tratamiento del dolor neuropático[6]. Inhibe la recaptación de 5HT-3 y NAd a nivel cerebral, por lo que podría mejorar el ánimo e influir en espectros afectivos del dolor. En cuanto a sus posibles efectos adversos, teóricamente podría llevar a un síndrome serotoninérgico en pacientes usuarios de inhibidores de recaptación de 5HT-3 de manera conjunta. Además, en pacientes con alteración del ritmo cardiaco podría prolongar el QT e inducir arritmias potencialmente malignas, aunque en monodosis no se ha estudiado lo suficiente[4].
Tiene un metabolismo vía enzimas del citocromo P450 y están descritos 3 citocromos responsables de su metabolización: CYP3A4, CYP1A2 y CYP2D6. Produce un metabolito inactivo, EDDP (2- thylidene – 1,5 dimethyl – 3,3 diphenylpyrrolidine), el cual es utilizado como medida de metabolización en distintos trabajos[4]. Se recomienda tener precaución, como con todas las drogas que se metabolizan por el P450, por ejemplo, en caso de utilizar otra droga en forma crónica que tenga inducido este sistema de metabolización, ya que puede existir interacción y modificar los niveles plasmáticos de metadona cuando se usan en conjunto. Por lo tanto, habría una alta variabilidad interindividual dependiendo de la población estudiada[4]. Por ejemplo, un paciente con adicción a los opioides, tendrá inducido el sistema de metabolización y podría tener alteración de la depuración, lo que es distinto en el escenario de un paciente quirúrgico, probablemente sano, quien no estará inducido.
-
Farmacología comparada
En farmacología comparada, se puede evaluar y comparar el tiempo de inicio de efecto y eliminación de los opioides. Los que actúan más rápidamente son el alfentanil, remifentanil y sufentanil. En los opioides de acción más lenta y prolongada, la metadona actúa más rápido y tiene mayor vida media de eliminación que la morfina (Tabla 1) [7].
| Tabla 1. Inicio de efecto y eliminación de opioides | ||
| t1/2 ke0a | t1/2 eliminación | |
| Remifentanil | 1 min | 0,5 |
| Alfentanil | 1 min | 1 h |
| Sufentanil | 6 min | 8 h |
| Fentanyl | 5 min | 8-10 h |
| Morfina | 2-4 h | 2-3 h |
| Metadona | 8 min | 24-36 h |
| Fuente: Lötsch J. Pharmacokinetic-pharmacodynamic modeling of opioids[7]. | ||
Kharasch et al., estudió la relación entre la concentración plasmática del opioide y el inicio de su efecto. Se compararon las concentraciones de cuatro opioides distintos, alfentanil, fentanyl, metadona y morfina, con un efecto de acción comparable, en este caso miosis. El alfentanil resultó bastante rápido, casi no tuvo histéresis, fentanyl presentó un poco más de histéresis, similar a metadona, mientras que la morfina presentó un efecto más tardío, horas después del peak de concentración plasmática[5].
-
Lógica en uso de opioides
Cuando se indican opioides a un paciente, el objetivo es que su efecto clínico se mantenga estable sin episodios de descontrol de dolor o riesgo de toxicidad (por ejemplo, depresión respiratoria).
En una línea de tiempo en relación a concentración plasmática hay 3 intervalos: inferior o subterapéutico, donde no hay suficiente manejo analgésico por estar bajo concentración mínima terapéutica; central o margen terapéutico, zona objetivo, donde hay adecuada analgesia y bajo riesgo de complicaciones; y la zona superior, sobredosificación o dosis tóxica, en la cual habrá efectos adversos intensificados de los opioides. Se busca evitar la depresión respiratoria, tolerancia, constipación o dependencia física, ya que a medida que se alcanzan los peaks de concentración plasmática de los opioides se produce la sensación de euforia que genera dependencia. Lo ideal es tener una droga que se mantenga el mayor tiempo posible en la zona de margen terapéutico, evitando los peaks en rangos de toxicidad para disminuir los efectos adversos y la euforia. Se analiza esto en otros trabajos comparando la vía de administración de estos (Figura 1)[8].
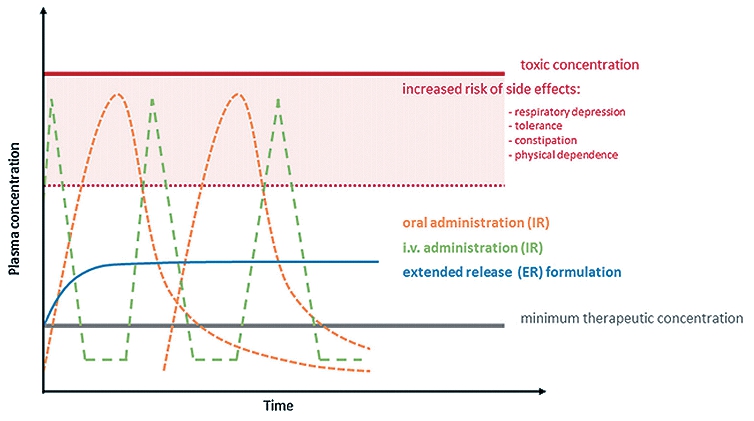
Figura 1. Representación esquemática de concentración plasmática de opioides en función de la vía de administración. Fuente: Martin C, et al. Controlled-release of opioids for improved pain management[8].
¿Qué pasa por ejemplo con las PCA y los bolos intermitentes administrados por enfermeras? En el caso de los bolos intermitentes, los pacientes reciben la administración de analgesia intramuscular llegando a un peak de control del dolor por sobre lo deseado, generando una sedación excesiva con los efectos adversos que involucra, y luego cae hasta niveles donde el paciente presenta alto dolor en espera de recibir el siguiente bolo, generando un control inestable[9]. La PCA logra una mejora en relación a la administración anterior, sin embargo, implica, costos, capacitación en manejo y un equipo de enfermeras que lo pueda monitorear. A pesar de lo anterior, aunque se acota un poco más el margen en que se maneja la analgesia al estar sujeto a la percepción del paciente, él debe esperar a tener dolor para sentir la necesidad de administrar el analgésico[9]. También se presentan inconvenientes en los pacientes que se quedan dormidos ya que no pueden realizar control del dolor a menos que despierten a raíz de que se esté interrumpiendo el sueño.
-
Evidencia sobre metadona perioperatoria
En el año 1982, Gourlay realizó un estudio en el cual se administró a una población quirúrgica dosis de metadona y se correlacionó las concentraciones plasmáticas en microgramos por mililitros en relación al tiempo[10]. Se observó que hay dos fases bien delimitadas, una primera de distribución y, posteriormente, una de eliminación. La vida media de distribución fue en promedio de 6 minutos, muy rápido, y el volumen de distribución alfa de 76 litros. En cambio, la vida media de eliminación en este trabajo fue de 35 h, con un volumen de distribución de 410 litros aproximadamente, probablemente por su alto nivel de lipofilicidad[10].
Con la administración de 20 mg de metadona, 39% de los pacientes no requirieron analgesia suplementaria en el postoperatorio, 26% requirieron uso de fármacos no opioides y 35% opioides. Los efectos adversos reportados fueron sedación sin signos de depresión respiratoria y náuseas en 11 de los 23 pacientes.
El clearance de la estudiado fue de 2,7 ml/kg/min (DS ± 1,7 ml/kg/min), si se compara con el de la morfina que es 27 ml/kg/min, 10 veces mayor, lo que explica su prolongada vida media. Es dicha propiedad la que permite su uso como droga de manejo casi único. En el trabajo mencionado anteriormente, el paciente en particular tuvo 26 h sin necesidad de analgesia postoperatoria[10].
Se realizó medición de concentración plasmática de metadona al momento en que los pacientes solicitaban analgesia suplementaria, concluyendo una concentración mínima efectiva de 30 ng/ml (DS ± 11 ng/ml)[10].
Al analizar la concentración plasmática en relación al tiempo, hay 3 intervalos según el nivel de concentración plasmática ya mencionados previamente. Lo ideal sería administrar en el intraoperatorio una dosis alta de metadona que, aunque lleve a niveles plasmáticos en la zona de sobredosificación, el paciente estará en control con ventilación mecánica y anestesiado lo que evitaría o permitiría el control de los efectos adversos. Luego comenzará en una hora aproximadamente la fase de eliminación, y lo que se busca con una dosis alta al inicio es que dicha fase comience con una concentración plasmática que coincida con el límite superior del intervalo de margen terapéutico, para que su efecto analgésico sea lo más estable posible a lo largo del tiempo[10].
La metadona es un opioide eficiente, de vida media prolongada entre 24 y 36 h, con inicio de acción rápido. Además, actúa en los receptores NMDA, que podría tener un rol en el dolor neuropático, incluso disminuir el dolor crónico postquirúrgico. Es comparable en precio con la morfina y a diferencia de ésta, no tiene un metabolito activo. Es de metabolización hepática, por lo tanto, se podría usar en pacientes con falla renal. La vía de administración puede ser oral, subcutánea o endovenosa. Hay trabajos que han mostrado su utilidad tanto en adultos, niños y neonatos[5]. Una desventaja es que no está ampliamente disponible por su estigmatización relacionada con el uso en pacientes con adicciones[11].
En Australia, el año 1982, Gourlay realizó una serie de estudios clínicos en relación al uso de metadona. En el primer trabajo en 1982, usó 20 mg de metadona para 23 pacientes sanos que se sometieron a cirugías abdominales, principalmente colecistectomía abierta, y pacientes sometidos a cirugía de columna. Aproximadamente, un tercio de los pacientes no requirieron analgesia posoperatoria, 6 pacientes solicitaron analgésicos no opioides (ibuprofeno y paracetamol) y 8 pacientes requirieron un agente opioide postoperatorio, pero lo requirieron de forma tardía, con un promedio de requerimiento a las 18 h. Con esto, los autores concluyeron que la metadona es una alternativa razonable para obtener una analgesia postoperatoria prolongada[10].
En el año 1984, realizó un estudio con 16 pacientes sometidos a cirugía de columna o abdominal alta. Nuevamente se usaron 20 mg de metadona en la inducción. Luego, en la sala de recuperación, recibieron 5 mg de metadona adicional siempre y cuando se cumplieran 3 condiciones: si los pacientes manifestaron dolor de forma espontánea, si tenían una FR mayor a 10 por minutos y si no tenían alteración de conciencia. Se administraron en la recuperación entre una a tres dosis, con una dosis total promedio de 11,5 mg (DS ± 4,7). La duración posterior de la analgesia fue de 21 h, con puntuaciones medias de dolor de 1,5 en escala EVA. De esta forma se observó que la metadona produce una analgesia postoperatoria prolongada y los EVA reportados por los pacientes son bajos[12].
En 1986, Gourlay evaluó a 20 pacientes sometidos a procedimientos quirúrgicos abdominales altos comparando metadona con morfina. Se realizó asignación de intervención y control mediante doble ciego. Un grupo recibió 20 mg de metadona y el otro 20 mg de morfina, ambos vía endovenosa. Se administró 5 mg de analgesia en la recuperación según los criterios utilizados en su trabajo anterior[12], indicando metadona o morfina según el grupo asignado previamente. En los pacientes del grupo que recibió metadona, la duración media de la analgesia fue mayor, con una duración media de analgesia de 21 h en comparación al grupo en el que se utilizó morfina donde fue de 6 h. El promedio acumulado de opioides en el postoperatorio para el grupo de metadona fue de 12 mg comparado con el grupo de morfina que fue de 21 mg[13].
En este último trabajo[13] y en los dos anteriores[10],[12], no se vio ningún efecto adverso, no hubo depresión respiratoria y no aumentaron las náuseas ni vómitos postoperatorios.
Existe un estudio en pacientes pediátricos entre 3 y 7 años sometidos a cirugía mayor, laparotomía abierta o cirugías de columna por escoliosis en el año 1991 por Berde et al.[14]. Se incluyeron 35 pacientes en los que se administró ciegamente 0,2 mg/kg de metadona o morfina endovenoso en la inducción, y se ajustaron las dosis suplementarias para lograr control analgésico en la sala de recuperación según EVA. Los pacientes que recibieron metadona requirieron menos opioides durante las siguientes 36 h, y reportaron puntuaciones más bajas de dolor en comparación al grupo que recibió morfina. Los autores recomiendan el uso de metadona ya que es una alternativa económica y disponible en lugares donde no se encuentra o no es factible tener una PCA, permitiendo una analgesia prolongada en pacientes pediátricos[14].
En 1991, Richlin et al., estudiaron a 40 pacientes de sexo femenino sometidas a histerectomía abdominal[15]. Las pacientes fueron randomizadas a dos grupos. Recibieron metadona (Grupo 1) o morfina (Grupo 2), 20 mg endovenosa en la inducción, más un opioide endovenoso adicional en la sala de recuperación en caso de dolor y opioide de rescate posteriormente según fuese necesario en sala. El opioide adicional recibido fue el mismo que se utilizó para la inducción. Los pacientes que estaban en el grupo de metadona requirieron menos dosis en la recuperación, 2 mg (DS ± 2,9 mg) en promedio en comparación a 4,4 mg (DS ± 2,9 mg) promedio en el Grupo 2. Los pacientes del Grupo 1 solicitaron menos opioide en sala, 4,5 mg en comparación a 42 mg en el grupo de morfina, y reportaron menor intensidad de dolor[16]. Otro estudio en 30 pacientes sometidos a histerectomía abdominal, realizó la misma comparación obteniendo resultados similares[16]. Los resultados obtenidos en ambos estudios fueron significativos, p < 0,01 y p < 0,001 respectivamente.
En el año 2011, en el estudio de Gottschalk et al., se reclutaron 29 pacientes que se sometieron a una cirugía espinal compleja, se randomizaron a un grupo que recibiría metadona (0,2 mg/kg en la inducción) y un grupo que recibiría sufentanil (un bolo e infusión continua durante la cirugía), ambas vía endovenosa[17]. Se evaluó que a las 48 h la metadona nuevamente redujo los requerimientos de opioides (p < 0,024) y los valores en EVA (p < 0,026) en el posoperatorio hasta en 50% en comparación al grupo que recibió sufentanil[17].
Andelsmann et al., en 2011, reclutaron 55 pacientes programados para cirugía cardiaca abierta[18]. Se hicieron 3 grupos que recibieron durante la inducción anestésica 20 mg de metadona, 20 mg de morfina o placebo vía endovenosa. Los resultados entre la duración de la anestesia y el tiempo a la extubación fueron los mismos para los 3 grupos. La primera dosis de analgésicos para el grupo que recibió metadona fue más tardía y la necesidad de analgésicos para el mismo grupo fue menor (p < 0,025), la calidad de analgesia mejor evaluada (p < 0,01) y hubo menor presencia de náuseas y vómitos en el posoperatorio (p < 0,013), probablemente asociado al menor uso de opioides[18].
En 2016, Murphy et al., estudiaron 156 pacientes sometidos a cirugía cardiaca en un estudio randomizado con doble ciego[19]. Se hizo dos grupos en esta oportunidad, se usó una mayor dosis de metadona (0,3 mg/kg) y se comparó con fentanil (12 microg/kg al inicio de la cirugía) vía endovenosa. Midieron el uso de morfina en el posoperatorio, y en el grupo que recibió metadona se redujo el consumo de morfina en 40% durante las primeras 24 h (p < 0,001), disminuyendo también los puntajes de EVA entre 30% y 40% (p < 0,001)[19].
Murphy et al., el año 2017 randomizaron con doble ciego 120 pacientes sometidos a cirugías de columna abierta multinivel en dos grupos[20]. Un grupo recibió metadona (0,2 mg/kg) y el otro hidromorfona (0,2 mg/kg), ambos al inicio de la cirugía vía endovenosa. Se evaluó cuánto requerimiento postoperatorio de hidromorfona tuvieron los pacientes. El grupo que recibió metadona requirió menos opioides, la analgesia fue mejor evaluada y la primera dosis de analgesia de rescate fue solicitada de forma más tardía, todos resultados estadísticamente significativos (p ≤ 0,001)[20].
Dentro de lo más reciente publicado en relación a este tópico se encuentra un metaanálisis de Mechado et al., en 2019, donde se incluyeron 13 trabajos para evaluar si el uso intraoperatorio de metadona en comparación a otras drogas lograba disminuir el dolor y consumo de opioides en el posoperatorio. Como resultado obtuvieron que el uso de metadona intraoperatorio reducía de forma significativa el uso de opioides en el manejo posquirúrgico del dolor, asociado a disminución de los puntajes de dolor por parte de los pacientes junto a una mayor satisfacción en lo que respecta a las 24, 48 y 72 h posoperatorio en comparación a otros opioides[21].
-
Conclusión
Si bien en algunos de los trabajos mencionados previamente pueden haber ciertas limitaciones, asociados a falta de ciego o aleatorización y el número de pacientes incluidos, existe una línea de evidencia en común. En la mayoría de los trabajos los resultados son similares, sea en adultos o pacientes pediátricos, en distintas cirugías, en todos se observa que cuando se usó metadona, los requerimientos de la primera dosis de analgesia fueron más tardíos, se usaron menos opioides en el posoperatorios y los pacientes reportaron menor dolor.
En suma, parece ser que la metadona es un opioide eficaz y seguro para su uso en el período perioperatorio, siendo una alternativa frente al uso de otros opioides. Sin embargo, aún quedan varias preguntas por responder y es necesario generar evidencia para lograr una correcta implementación, por lo que debieran ser abordadas en futuras investigaciones. Algunas de las preguntas a plantear son, por ejemplo, ¿cuál es la dosis más efectiva al usar metadona? ¿qué pacientes corren riesgo de complicaciones asociadas al uso de metadona?, ¿habrá prolongación del QT en uso no-crónico de metadona? ¿puede el uso de metadona intraoperatoria reducir el riesgo del desarrollo de dolor posquirúrgico crónico? ¿cómo debería ser el tratamiento en caso de caer un paciente en depresión respiratoria por metadona dada su larga vida media de eliminación?
Como uno de los autores señala en los trabajos mencionados previamente, se debe redescubrir la metadona, es una droga interesante con gran potencial, hay que evaluarla y desestigmatizar su uso, porque puede tener una cabida definitiva en el dolor posoperatorio[5].
Referencias
1. Brennan F, Carr DB, Cousins M. Pain management: a fundamental human right. Anesth Analg. 2007 Jul;105(1):205–21. https://doi.org/10.1213/01.ane.0000268145.52345.55 PMID:17578977
2. Moss E, Taverner T, Norton P, Lesser P, Cole P. A survey of postoperative pain management in fourteen hospitals in the UK. Acute Pain. 2005;7(1):13–20. https://doi.org/10.1016/j.acpain.2005.02.001.
3. Taylor A, Stanbury L. A review of postoperative pain management and the challenges. Curr Anaesth Crit Care. 2009;20(4):188–94. https://doi.org/10.1016/j.cacc.2009.02.003.
4. Fishman SM, Wilsey B, Mahajan G, Molina P. Methadone reincarnated: novel clinical applications with related concerns. Pain Med. 2002 Dec;3(4):339–48. https://doi.org/10.1046/j.1526-4637.2002.02047.x PMID:15099239
5. Kharasch ED. Intraoperative methadone: rediscovery, reappraisal, and reinvigoration? Anesth Analg. 2011 Jan;112(1):13–6. https://doi.org/10.1213/ANE.0b013e3181fec9a3 PMID:21173206
6. Davis AM, Inturrisi CE. d-Methadone blocks morphine tolerance and N-methyl-D-aspartate-induced hyperalgesia. J Pharmacol Exp Ther. 1999 May;289(2):1048–53. PMID:10215686
7. Lötsch J. Pharmacokinetic-pharmacodynamic modeling of opioids. J Pain Symptom Manage. 2005 May;29(5 Suppl):S90–103. https://doi.org/10.1016/j.jpainsymman.2005.01.012 PMID:15907650
8. Martin C, De Baerdemaeker A, Poelaert J, Madder A, Hoogenboom R, Ballet S. Controlled-release of opioids for improved pain management. Mater Today. 2016;19(9):491–502. https://doi.org/10.1016/j.mattod.2016.01.016.
9. Grass JA. Patient-controlled analgesia. Anesth Analg. 2005 Nov;101(5 Suppl):S44–61. https://doi.org/10.1213/01.ANE.0000177102.11682.20 PMID:16334492
10. Gourlay GK, Wilson PR, Glynn CJ. Pharmacodynamics and pharmacokinetics of methadone during the perioperative period. Anesthesiology. 1982 Dec;57(6):458–67. https://doi.org/10.1097/00000542-198212000-00005 PMID:6128949
11. Salsitz E, Wiegand T. Pharmacotherapy of Opioid Addiction: “Putting a Real Face on a False Demon”. J Med Toxicol. 2016 Mar;12(1):58–63. https://doi.org/10.1007/s13181-015-0517-5 PMID:26567033
12. Gourlay GK, Willis RJ, Wilson PR. Postoperative pain control with methadone: influence of supplementary methadone doses and blood concentration—response relationships. Anesthesiology. 1984 Jul;61(1):19–26. https://doi.org/10.1097/00000542-198407000-00005 PMID:6742480
13. Gourlay GK, Willis RJ, Lamberty J. A double-blind comparison of the efficacy of methadone and morphine in postoperative pain control. Anesthesiology. 1986 Mar;64(3):322–7. https://doi.org/10.1097/00000542-198603000-00004 PMID:3954126
14. Berde CB, Beyer JE, Bournaki MC, Levin CR, Sethna NF. Comparison of morphine and methadone for prevention of Postoperative pain in 3- to 7-year-old children. The Journal of Pediatrics. 1991;119(1p1):136-41.
15. Richlin DM, Reuben SS. Postoperative pain control with methadone following lower abdominal surgery. J Clin Anesth. 1991 Mar-Apr;3(2):112–6. https://doi.org/10.1016/0952-8180(91)90007-A PMID:2039637
16. Chui PT, Gin T. A double-blind randomised trial comparing postoperative analgesia after perioperative loading doses of methadone or morphine. Anaesth Intensive Care. 1992 Feb;20(1):46–51. https://doi.org/10.1177/0310057X9202000109 PMID:1609941
17. Gottschalk A, Durieux ME, Nemergut EC. Intraoperative methadone improves postoperative pain control in patients undergoing complex spine surgery. Anesth Analg. 2011 Jan;112(1):218–23. https://doi.org/10.1213/ANE.0b013e3181d8a095 PMID:20418538
18. Udelsmann A, Maciel FG, Servian DC, Reis E, de Azevedo TM, Melo MS. Methadone and morphine during anesthesia induction for cardiac surgery. Repercussion in postoperative analgesia and prevalence of nausea and vomiting. Rev Bras Anestesiol. 2011 Nov-Dec;61(6):695–701. https://doi.org/10.1016/S0034-7094(11)70078-2 PMID:22063370
19. Murphy GS, Szokol JW, Avram MJ, Greenberg SB, Marymont JH, Shear TD, et al. Intraoperative Methadone for the Prevention of Postoperative Pain: A Randomized, Double-blinded Clinical Trial in Cardiac Surgical Patients. Surv Anesthesiol. 2016;60(4):140–1. https://doi.org/10.1097/01.sa.0000484583.65548.09.
20. Murphy GS, Szokol JW, Avram MJ, Greenberg SB, Shear TD, Deshur MA, et al. Clinical Effectiveness and Safety of Intraoperative Methadone in Patients Undergoing Posterior Spinal Fusion Surgery: A Randomized, Double-blinded, Controlled Trial. Anesthesiology. 2017 May;126(5):822–33. https://doi.org/10.1097/ALN.0000000000001609 PMID:28418966
21. Machado FC, Vieira JE, de Orange FA, Ashmawi HA. Intraoperative Methadone Reduces Pain and Opioid Consumption in Acute Postoperative Pain: A Systematic Review and Meta-analysis. Anesth Analg. 2019 Dec;129(6):1723–32. https://doi.org/10.1213/ANE.0000000000004404 PMID:31743194

 ORCID
ORCID


 Creative Commons Attribution
Creative Commons Attribution