Liliana Ramos R. MD. 1 , Isabel Pérez D. MD. 2
Recibido: 25-05-2022
Aceptado: 27-05-2022
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 4 pp. 435-444|https://doi.org/10.25237/revchilanestv5102061507
PDF|ePub|RIS
Analgesic strategies for children’s ambulatory surgery
Abstract
During the last decades, there has been a significant growth in ambulatory surgeries. Literature, unfortunately, tells us that more than 75% of children have pain during the postoperative period, when they have been discharged, and 40% of these children have mild to severe pain. Caregivers turn to the surgeon, pediatrician or the clinic, places where usually there is no pain management specialist. Frequently, even when pain is evident, children get inadequate treatment. It is inadequate to say that children don’t remember or don’t respond to a painful experience at the same level as adults do. Many of the transmission and perception nerve tracts are developed in early life, being present and in function since week 24 of intrauterine gestation. The mistreated pain has immediate and long-term consequences. For clinicians, it is of utmost importance the knowledge of these consequences, summarizing, lifestyle deterioration, extended usage of (analgesics) painkillers and onset of persistent or chronic pain. Toddlers are not able to describe their pain or their subjective experience, due to this, the caregiver must learn how to eva- luate properly. This evaluation is intended for every pediatric patient who meets the criteria for an ambulatory surgery. The main objective is to highlight the importance of a safe and effective analgesic management. The most appropriate method to treat postoperative severe pain is multimodal, which involves nonpharmacological, pharmacological, and local anesthetic techniques. The patients’ selection, the early anesthetic strategy planning and caregivers’ education are the keys for success.
Resumen
La cirugía ambulatoria ha aumentado de manera importante durante las últimas décadas. La literatura refiere que más del 75% de los niños tiene dolor en el período posoperatorio, cuando ya han sido dados de alta a sus casas, y de estos, el 40% tienen dolor moderado a severo[],[],[]. Los cuidadores recurren al cirujano o al pediatra de cabecera, donde no existe un especialista en manejo de dolor. La creencia obsoleta de que los niños no recuerdan o no responden a la experiencia dolorosa en el mismo grado que los adultos es inadecuada. Muchas de las vías nerviosas de la transmisión y percepción del dolor se desarrollan a temprana edad, estando presentes y funcionales desde las 24 semanas de gestación intrauterina. El dolor mal tratado tiene consecuencias inmediatas y a largo plazo como empeoramiento de la calidad de vida, uso prolongado de analgésicos y aparición de dolor persistente o crónico[],[]. Los niños en etapa preverbal no son capaces de describir su dolor o su experiencia subjetiva y debe ser el cuidador el que aprenda a evaluarlo de manera correcta. Esta revisión está orientada a todo paciente pediátrico que cumpla criterios de selección para ser sometido a una cirugía ambulatoria. El objetivo principal es resaltar la importancia del manejo analgésico efectivo y seguro. El manejo multimodal del dolor es la estrategia más adecuada involucrando técnicas no farmacológicas, farmacológicas y técnicas de anestesia regional[],[],[],[],[]. La selección de pacientes, planificación precoz de la estrategia analgesica y educación de los cuidadores son las claves para el éxito[].
-
Introducción
Las cirugías ambulatorias pediátricas son generalmente procedimientos cortos, de menos de 2 h de duración, con riesgo de sangrado escaso y sin involucrar órganos vitales ni apertura de cavidades. Los pacientes son niños desde recién nacidos de más de 60 semanas de edad posconcepcional en adelante, ASA 1 o 2, sin enfermedades intercurrentes no compensadas.
Actualmente, las cirugías más frecuentes son la miringotomía, tonsilectomía, adenoidectomía, procedimientos ortopédicos, urológicos y herniorrafia. Algunas de estas cirugías también son consideradas las más dolorosas: amigdalectomía, apendicectomía, cirugías urológicas, cirugías ortopédicas[12].
Abordaremos las causas más frecuentes del fracaso en el manejo del dolor y propuestas de cómo solucionarlas; el manejo multimodal del dolor agudo posoperatorio incluyendo técnicas no farmacológicas, farmacológicas y de anestesia regional; por último, mencionaremos sugerencias para el período posoperatorio.
-
I .- Factores provocan un manejo analgésico ineficaz y cómo mejorar
En el artículo de revisión de M. Dorkham[10] se presenta una clasificación de los factores que podrían obstaculizar el manejo analgésico de los pacientes que se operan de manera ambulatoria de amígdalas, aplicable a otras cirugías ambulatorias.
Esta clasificación describe dos grupos principales de errores; inadecuada prescripción o administración de analgésicos. Estos dos grupos a su vez se subdividen en factores dependientes de los padres, del niño, del medicamento mismo o del sistema.
Cuando se desglosan las posibles causas de un manejo analgésico ineficaz, se pueden hacer propuestas adaptables a cada realidad local para ir solucionando cada una de estas dificultades. Lo recomendado es analizar cada una de estas causas de manera individualizada para cada paciente y planificar una estrategia analgesica en el período preoperatorio.
Por ejemplo:
• Inadecuada prescripción de analgésicos:
– Factores asociados al medicamento: ¿La potencia del medicamento es adecuada al nivel de dolor esperado?, ¿la presentación es adecuada para mi paciente?, ¿qué efectos adversos puede esperar la familia?
– Factores asociados al sistema: ¿Hemos entregado las instrucciones adecuadas?, ¿tengo buena comunicación con los cuidadores?, ¿tienen la posibilidad de adquirir los medicamentos que estoy indicando?
• Inadecuada administración de analgésicos:
– Factores asociados a los padres: Actitudes y creencias personales erradas respecto a la analgesia, falla en la educación del dolor, factores culturales.
– Factores asociados al niño: Rechazo a recibir el medicamento, dolor al tragar el medicamento, expresiones de dolor muy variables, alto nivel de ansiedad.
Los siguientes puntos describen las mejores propuestas para llevar a la práctica:
-
1 .- Elegibilidad del paciente pediátrico ambulatorio:
No todos los pacientes son candidatos para cirugía ambula- toria[10]. El saber identificar a los pacientes que van a requerir hospitalización ayuda a no crear falsas expectativas a la familia o frustración en los equipos de trabajo.
El equipo de salud de cirugía ambulatoria debe tener un protocolo con criterios de elegibilidad según su realidad local. Idealmente tener una entrevista preoperatoria para planificar y educar respecto a las expectativas, al dolor y su manejo. Cuando por cualquier motivo se detecta que los cuidadores o el paciente no podrá seguir el plan analgésico requerido, se debe plantear la hospitalización del paciente.
-
2 .- Educación preoperatoria a la familia y planificación de la analgesia:
Una vez elegido el paciente candidato a cirugía ambulatoria, el paso siguiente es realizar educación en dolor y planificación del manejo analgésico en conjunto con los padres o cuidadores. En esta recomendación la literatura es amplia. El momento para entregar esta información es relevante, se necesita de la atención y comprensión de parte de los cuidadores. Esta educación puede ser realizada por enfermería del equipo.
-
3 .- Evaluación del dolor:
La evaluación del dolor de una manera objetiva en un paciente es esencial[11]. Se debe educar al paciente y cuidadores sobre cómo evaluar el dolor de manera objetiva con alguna escala que nos permita tomar decisiones de manera ordenada, ejecutar una acción y evaluar el resultado de dichas decisiones.
En la literatura existen muchas escalas de evaluación de dolor, se puede elegir cualquiera de ellas que sea apta para el niño en particular, lo importante es tener una escala.
Existen escalas de autoevaluación, donde el paciente es quien refiere el nivel de dolor que siente y son el estándar de oro. Existen también escalas para niños que se encuentran en etapa preverbal o no son capaces de comprender una escala de evaluación y es el observador quien asigna un puntaje al dolor del niño basándose en la observación de parámetros definidos.
Lo más recomendable es tener una escala de autoevalua- ción para niños mayores de 4 años o que logran entender la escala y otra para niños en etapa preverbal, las más conocidas son la “escala de caritas de Wong Baker” y la “escala de FLACC” respectivamente (por su sigla en inglés face, legs, activity, cry, consolability) (Figuras 1 y 2).
Ambas escalas tienen un puntaje de 0 a 10; clasificando el dolor en rangos de 0 a 3 como leve o tolerable, 4 a 6 como dolor moderado y 7 a 10 como dolor severo.
La escala analgésica de la Organización Mundial de la Salud (OMS) es útil para tener un pensamiento ordenado de escalada y desescalada de analgésicos, pero siempre está sujeta a criterio y variabilidad individual de cada paciente.
-
II .- Manejo multimodal del dolor agudo perioperatorio: técnicas no farmacológicas, farmacológicas y anestesia regional
Las recomendaciones apuntan siempre a un manejo multi- modal que incluya técnicas no farmacológicas, farmacológicas y de anestesia regional.
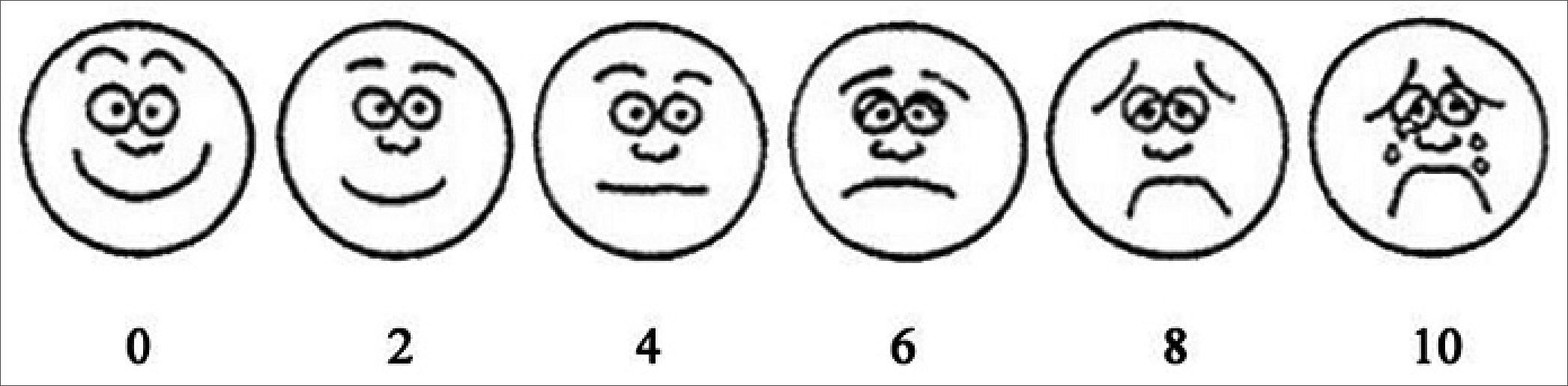
Figura 1. Escala de Caritas de Wong Baker.
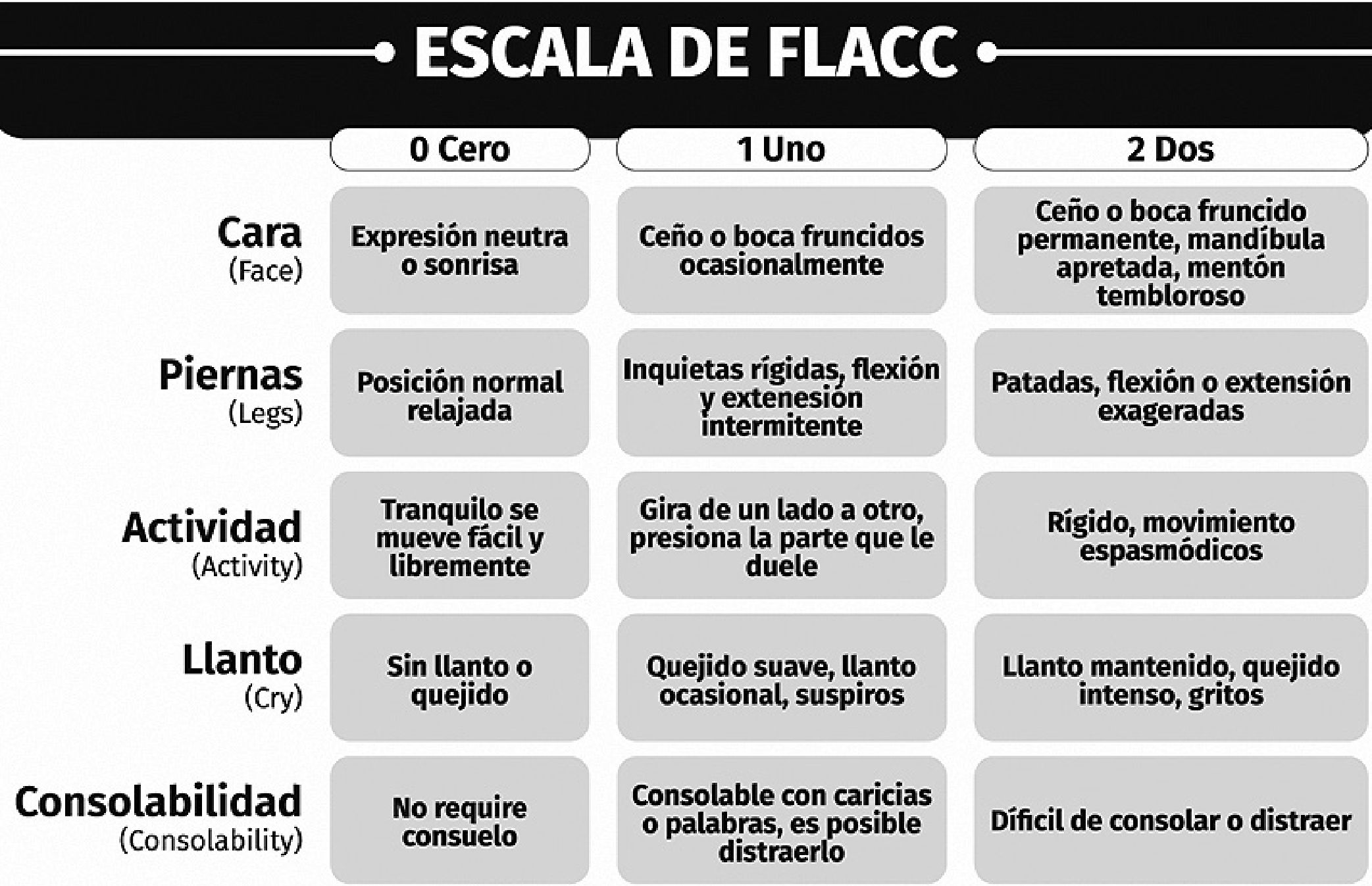
Figura 2. Escala de FLACC (Face, Legs, Activity, Cry, Consolability).
El manejo farmacológico en sí mismo también debe ser multimodal, aprovechando el efecto sinérgico analgésico de algunos medicamentos y disminuyendo la aparición de efectos adversos asociados al uso de altas dosis de un medicamento único.
-
1 .- Técnicas no farmacológicas
El objetivo principal de las técnicas no farmacológicas es disminuir el nivel de ansiedad perioperatoria[1],[17]. La influencia de la interacción entre la ansiedad de los padres y el dolor del niño está bien documentada. La inducción anestésica con disminución de estímulos sensitivos, presencia de los padres,
música en pabellón, personal de salud disfrazado, videos explicativos y padres informados de los procedimientos disminuyen la ansiedad en el paciente y los padres.
Para el posoperatorio se han descrito técnicas de distracción, dar alimentos fríos y suaves (amigdalectomía), técnicas de relajación, respiración y musicoterapia; todas ampliamente recomendadas en la literatura, pero faltan estudios que evalúen cada una de estas técnicas de manera aislada y sus resultados.
El dolor es difícil de estudiar, los investigadores intentan transformar una experiencia subjetiva en algo cuantificable, lo que provoca inevitablemente sesgos de investigación.
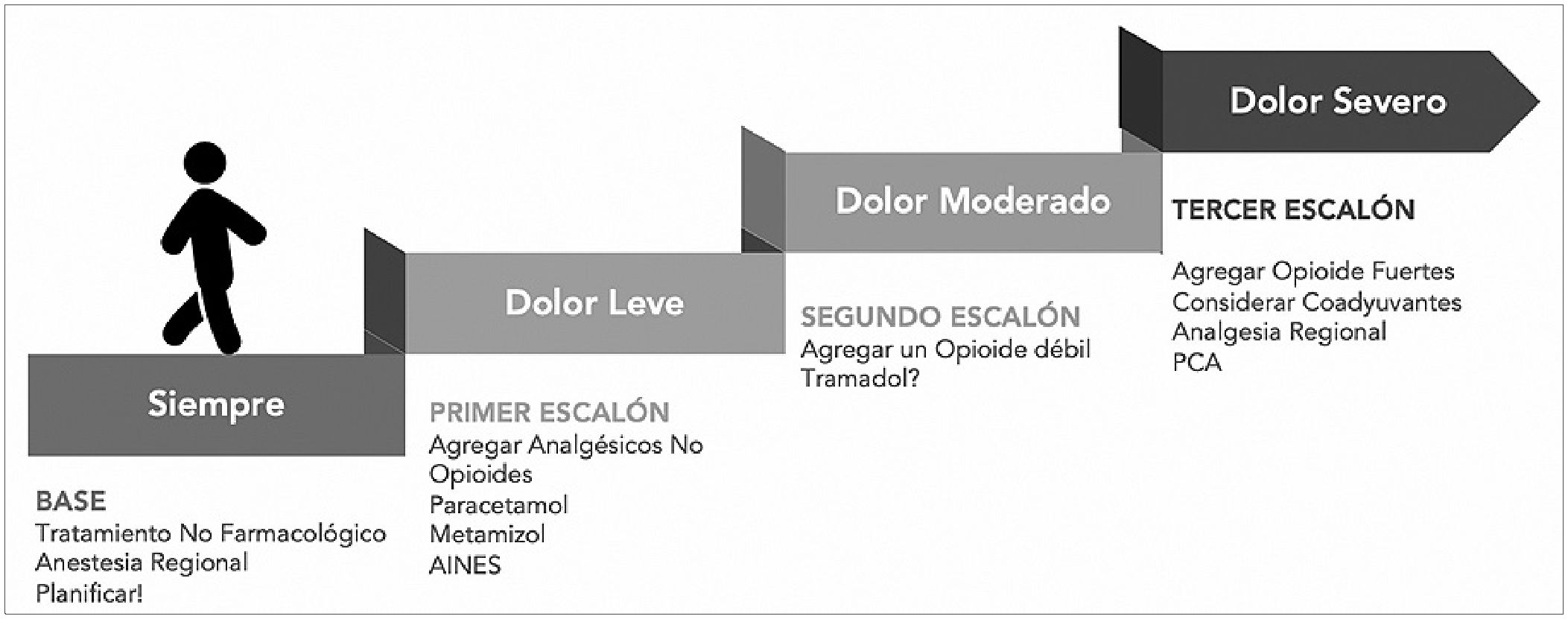
Figura 3. Escala analgésica de la Organización Mundial de la Salud (OMS).
-
2 .- Técnicas farmacológicas
Es importante mencionar que la mayoría de los fármacos analgésicos utilizados en niños, no siempre cuentan con los permisos de las instituciones reguladoras locales. Su uso generalmente es extrapolado de estudios realizados en población adulta y no siempre están disponibles las presentaciones más adecuadas[4],[5],[7],[11],[14],[16],[18].
Basándonos en la escala analgésica de la OMS, describiremos brevemente los puntos más relevantes de los analgésicos no opioides, antiinflamatorios no esteroidales (AINES), opioides débiles, opioides fuertes y algunos coadyuvantes y luego mencionaremos las combinaciones analgésicas sugeridas según el tipo de cirugía (Figura 3).
-
Analgésicos no opioides
a. Paracetamol: Es el analgésico no opioide de uso más frecuente en pediatría a nivel mundial. Su mecanismo de acción es variado, a través de la inhibición de la producción de prostaglandinas y sustancia P a nivel central y la modulación de la producción de óxido nítrico. Su más temido efecto adverso es la hepatotoxicidad, cuando se sobrepasa la dosis sugerida y se asocian otros factores de riesgo. Se recomienda su uso como fármaco de primera línea en dolor leve a moderado y como coadyuvante en dolor severo ya que actúa disminuyendo los requerimientos de opioides en el posoperatorio. Se debe ajustar la dosis según el peso ideal. Tiene buena biodisponibilidad por vía endovenosa, oral y rectal.
b. Metamizol: Analgésico, antiinflamatorio y antipirético, con menos riesgo de lesiones gastrointestinales que los AINES. Su mecanismo de acción es a través de la inhibición de la síntesis de prostaglandinas a nivel periférico y central, además estimula las vías descendentes moduladoras del dolor y activa la vía de óxido nítrico-GMPc-canales de potasio que inhibe la despolarización neuronal de nociceptores y produce relajación de la musculatura lisa. La reacción adversa más temida es la agranulocitosis, muy poco frecuente, solo casos aislados y generalmente asociada a dosis, duración, uso de medicamentos concomitantes. Buena biodisponibi- lidad por vía endovenosa, oral, rectal e intramuscular. No recomendado en recién nacidos o menores de 5 kg.
c. AINES: Analgésicos, antiinflamatorios y antipiréticos. Inhiben la síntesis de prostaglandinas a través de la inhibición de la ciclooxigenasa-1 y 2 (COX-1, COX-2). Se recomienda su uso en dolor leve a moderado y como coadyuvante en dolor severo, por periodos cortos de tiempo y en mayores de 6 meses. Se podrían usar en dosis única entre los 3 y 6 meses. Los efectos adversos son dosis dependiente y tienen efecto analgésico techo. Pueden provocar sangrado gastrointestinal, asma, daño renal. El ácido acetil salicílico no se debe usar en niños. Los inhibidores selectivos COX-2 no están aprobados para uso en pediatría, aún así, se recomienda su uso en casos especiales, ya que tiene menos riesgo de lesión gastrointestinal y de alteración en la función plaque- taria. Los AINE de uso más frecuente son Ibuprofeno, Keto- profeno, Ketorolaco, Diclofenaco, Naproxeno, Parecoxib, Celecoxib. Se pueden alternar con Paracetamol, acortando los intervalos de espera entre dosis, lo que demostrado ser altamente efectivo. Por ejemplo; se puede indicar Paraceta- mol cada 8 h (7-15-23 h ) + Ibuprofeno cada 8 hrs (11-19-3 h).
-
Opioides débiles
d. Codeína: Opioide débil, profármaco de morfina. No se recomienda su uso para el dolor postoperatorio. Requiere la conversión a su metabolito activo que es la morfina. Existen modificaciones genéticas en la población en el sistema me- tabólico que la convierte en morfina (CYP2D6), existiendo metabolizadores lentos y rápidos, los que se arriesgan a no efecto o efecto abrupto con efectos no deseados. Actualmente en desuso.
e. Tramadol: Dada la advertencia de la Food and Drug Admi- nistration (FDA) el 2017, no se recomienda su uso en ambiente extrahospitalario, ya que puede presentar un comportamiento similar a codeína en convertidores rápidos. Tiene efecto opioide débil y además inhibe la recaptación de Noradrenalina (NA) y Serotonina (SE). Su principal efecto adverso son las náuseas y vómitos.
f. Tapentadol: Fármaco relativamente nuevo, efecto similar a tramadol, pero al no ser un profármaco, no depende de sistemas metabólicos para tener efecto; y no tiene el riesgo asociado. Tiene efecto opioide débil y es inhibidor de la recaptación de NA y SE, pero mayoritariamente de NA, por lo tanto, con menor riesgo de síndrome serotoninérgico. Existe su presentación en jarabe, que aun no llega a nuestro país, y ya cuenta con estudios en población pediátrica. Promisorio.
-
Opioides Fuertes
a. Fentanil: Indicado para manejo del dolor moderado a severo. Es el opioide fuerte usado con más frecuencia como rescate analgésico en el postoperatorio inmediato, en dosis de 0,5-1 mcg/kg alcanza efecto máximo en 1-3 minutos debido a su alta liposolubilidad, y de corta duración por su rápida redistribución. Se metaboliza por vía hepática, no tiene metabolitos activos y no libera histamina. Como todos los opioides, su más temida complicación es la depresión respiratoria, por lo que su uso está restringido a unidades de alta vigilancia.
b. Morfina: Junto al Fentanil, es el opioide más usado en niños en el contexto perioperatorio. Además de las complicaciones generales de los opioides, la morfina tiene un metabolito activo (MG6) que puede acumularse en casos de insuficiencia renal. Es de uso restringido al ámbito in- trahospitalario. En la revisión sistemática de TH Duedhal se concluye que su uso en el dolor agudo posoperatorio no sería más eficaz que el uso de Paracetamol + AINES y Bloqueo regional.
c. Metadona: Efecto opioide de larga duración, pero de concentraciones plasmáticas un poco irregulares. Está recomendado su uso en niños mayores de 1 año. Tiene la ventaja de no tener el metabolito activo de la morfina y además tiene efecto antagonista de receptores NMDA. Se debe usar con precaución en pacientes con riesgo de prolongación de QT, por condiciones clínicas o interacción farmacológica.
-
Coadyuvantes
a. Ketamina: Analgésico-hipnótico, inhibe selectivamente las vías de asociación cerebral. Tiene actividad simpaticomimé- tica. Al igual que la metadona, es antagonista del receptor NMDA. Uso restringido intrahospitalario. Se puede usar en bolo o infusión intraoperatoria o dosis subcutánea. La literatura apoya su efecto coadyuvante analgésico para el posoperatorio inmediato y hasta 12 h. También es de uso restringido al ámbito intrahospitalario.
b. Dexametasona: Coadyuvante analgésico ampliamente utilizado en niños. Es un corticoide sin efecto mineralocorti- coide, tiene efecto antiinflamatorio y efecto antináuseas y vómitos posoperatorios. En dosis única no se ha asociado a efectos no deseados de corticoides.
c. Dexmedetomidina: Agonista alfa-2 con efecto hipnótico y analgésico con amplia bibliografía de respaldo en población
pediátrica. Recomendado como coadyuvante en infusión endovenosa intraoperatoria para cirugías de alto riesgo de dolor posoperatorio. Tiene además efecto antináuseas y vómitos y disminuye el requerimiento de opioides en el postoperatorio.
d. Neuromoduladores: Pregabalina y Gabapentina. Análogos GABA, inhiben canales de Calcio voltaje dependientes a nivel central. Tienen efecto analgésico, anticonvulsivante y a nivel de las vías descendentes de modulación del dolor. Tienen efecto coadyuvante analgésico publicado incluso con dosis única preoperatoria, pero los trabajos son heterogéneos.
Resumen de dosis de analgésicos y coadyuvantes (Tabla 1).
En cada especialidad quirúrgica, existen también combinaciones de técnicas analgésicas que han demostrado ser las más efectivas. En el artículo de JA Oliver[1], recientemente publicado se recomienda lo siguiente:
-
3.- Técnicas de Anestesia regional en pediatría
La Anestesia regional en pediatría ha ido en aumento en los últimos 10 años, mayormente, debido a la incorporación de bloqueos de nervio periférico más que en el bloqueo neuroaxial. En el ambiente ambulatorio reduce los factores que demoran el alta
– Náuseas y vómitos posoperatorios (PONV).
– Retención urinaria.
– Recuperación prolongada.
– Retardo en la ambulatoriedad.
La mayoría de los estudios demuestran que la anestesia regional comparada con la analgesia sistémica es superior en reducir el dolor postoperatorio[17].
Se recomienda siempre que sea posible el uso de técnicas de anestesia regional como parte de la analgesia multimodal en niños[11].
-
¿Es segura la Anestesia regional pediátrica?
Uno de los estudios de ADARPEF 2010 con 48 centros y más de 100.000 bloqueos de nervio periférico con anestesia general ha demostrado que no aumentan las complicaciones cuando la técnica de anestesia regional se realiza bajo anestesia general [15].
El registro realizado por PRAN (Pediatric Regional Anesthesia Network) con más de 100.000 bloqueos regionales incluyendo neuroaxiales y periféricos concluyeron que el uso de anestesia regional en niños es seguro, con mínimas fallas en relación con el uso de catéteres y esta ha sido el efecto adverso más común 4%[18],[21] que es más seguro con anestesia general o sedado que despierto. Los niños despiertos tienen 7 veces más probabilidad de complicaciones[21].
Por lo tanto, la anestesia regional bajo anestesia general es un estándar de cuidado
-
1. Coadyuvantes en anestesia regional en pediatría:
La sociedad europea de anestesia regional y manejo del dolor (ESRA) recomienda usar coadyuvantes en anestesia regional, en anestesia neuroaxial y periférica.
Las ventajas asociadas con el uso de coadyuvantes son: a) prolongan la duración del efecto analgésico; b) reducen los requerimientos de anestésicos; c) permiten un despertar de la anestesia tranquilo y una estadía en la sala de recuperación con más calma; d) reducen la incidencia de delirio y escalofríos; e) proveen un período posoperatorio temprano confortable y en el contexto de la cirugía ambulatoria, un alta temprana y un traslado a casa sin dolor[19].
Tabla 1. Dosis de analgésicos y coadyuvantes de uso frecuente
| Fármaco | Dosis | Dosis máxima |
| Paracetamol oral/rectal | (< 50 kg) 15-20 mg/kg c/4-6 h | 90 mg/kg/día |
| (>12 años o > 50 kg) 1 g c/4-6 h | 4 g/día | |
| Paracetamol ev | (< 50 kg) 15 mg/kg c/6 h | 60 mg/kg/día |
| (> 12 años o > 50 kg) 15 mg/kg c/6 h | 4 g/día | |
| Metamizol | 10-20 mg/kg c/8 h ev, vo | 4 g/día o 100 mg c/6 h en < 1 año |
| Ketorolaco | 0,5 mg/kg c/8h ev | 120 mg/día |
| 10 mg c/8 h vo | 40 mg/día | |
| Ketoprofeno | 0,5-2 mg/kg c/8-12 h ev, vo | 5 mg/kg/día |
| Ibuprofeno | (< 3 m) 5 mg c/8 h vo
(> 3 m) 10 mg c/8 h vo |
400 mg c/8 h o 30 mg/kg/día |
| Diclofenaco | (> 6 m) 1 mg/kg c/8h vo | 50 mg c/8h |
| Naproxeno | (> 6 m) 5 mg/kg c/12h vo | 1 g/día |
| Celecoxib | (< 25 kg) 50 mg c/12 h vo (> 25 kg) 100 mgc/12h vo | |
| Parecoxib | 0,5-1 mg/kg c/12 h ev | 40 mg/dosis |
| Tramadol | 0,5-1 mg/kg c/8-12 h ev | Intrahospitalario |
| Tapentadol | 1 mg/kg c/4-6 h vo (max 50 mg/dosis) | 500 mg/día |
| Fentanil | Bolo ev de rescate postop 0,5-1 mcg/kg hasta 50 mcg/dosis | Intrahospitalario |
| Morfina | Carga intraop 100 mcg/kg hasta 10 mg
Bolo ev de rescate postop 10-30 mcg/kg hasta 3 mg/dosis |
Intrahospitalario |
| Metadona | Carga intraop 100 mcg/kg hasta 10 mg
Bolo ev de rescate postop 10-30 mcg/kg hasta 3 mg/dosis |
Intrahospitalario |
| Ketamina | Infusión intraop 0,25 mg/kg/h
Bolo ev 0,1-0,2 mg/kg |
Intrahospitalario |
| Dexametasona | 100-150 mcg/kg ev | Intrahospitalario |
| Dexmedetomidina | 0,1-0,7 mcg/kg/h ev | Intrahospitalario |
| Pregabalina | 1-6 mg/kg c/12 h vo
Dolor postop > 12 años: 75-300 mg vo en dosis única 2 h previo a la cirugía |
450 mg/día |
| Gabapentina | 5 mg c/8 h vo | 35 mg/kg/día |
| Tabla 2. Dosis de medicamentos útiles frente a reacciones adversas | |
| Fármaco | Dosis |
| Ondansetrón | 0,1-0,2 mg/kg ev c/8 h |
| Droperidol | (> 2años) 10-15 mcg/kg/dosis ev (se puede repetir c/6 h) Dosis max 1,25 mg/dosis o 5 mg/día |
| Naloxona | 1 mcg/kg ev titulada c/3 min |
| Esomeprazol Midazolam | 0,5-1 mg/kg/día vo
(> 6 m) 0,05-0,1 mg/kg dosis ev |
| Clonazepam | 30 mcg/kg/dosis ev |
a. Clonidina:
En dosis de 1-2 mcg/kg puede ser usada intratecal prolongando la duración del bloqueo espinal. Tiene características
440
| Tabla 3. Técnicas analgésicas recomendadas según tipo de cirugía | |
| Especialidad
Otorrino |
Técnica recomendada
Paracetamol + AINES + Dexametasona |
| Traumatología
Urología |
Paracetamol + AINES + Bloqueo nervio periférico único o continuo + coadyuvante (dexametasona o dexmedetomidina)
Paracetamol + AINES + Dexmedetomidina + Bloqueo Nervio periférico o Neuroaxial + coadyuvante (Bloqueo caudal + clonidina o dexmedetomidina) |
| Cirugía abdominal
Cirugía torácica |
Paracetamol + AINES + Bloqueo nervio periférico
Paracetamol + Bloqueo nervio periférico o Neuroaxial (epidural) |
ideales para la cirugía ambulatoria debido a su favorable perfil de efectos.
En un metaanálisis donde se revisaron 20 trabajos, muestran que clonidina neuroaxial tiene un aumento significativo en la duración de la analgesia.
En bloqueo de nervio periférico (BNP) aún no puede realizarse la recomendación por falta de estudios con mayor potencia[19].
b. Morfina:
Usada principalmente en anestesia caudal en pacientes durante cirugía cardíaca en dosis de 150 mcg[13], disminuyendo el tiempo de extubación y los requerimientos de fentanil intraoperatorio.
Morfina libre de preservantes es el otro coadyuvante con evidencia suficiente que avala su uso a nivel neuroaxial. En dosis de 10-15 mcg/kg usada en intratecal, también aumenta la duración del bloqueo espinal[19].
c. Ketamina:
Ambas, ketamina racémica (0,5 mg/kg) y S-ketamina han sido usadas como coadyuvante neuroaxial en niños. Sin embargo, no está recomendada para uso intratecal en neonatos e infantes por el potencial riesgo de apoptosis en la médula espinal[19].
d. Dexmedetomidina:
También muestra aumento de la analgesia usada en bloqueo caudal, pero aún los estudios tienen poco poder y falta por definir concentración vs efecto adverso. Los expertos recomiendan usar la mínima dosis necesaria para obtener el efecto beneficioso[19].
e. Dexametasona:
En dosis de 0,5 mg/kg e.v ha demostrado que aumenta la intensidad y duración de la analgesia caudal[13], se ha demostrado esto en escasos estudios en anestesia regional pediátrica, por lo que su uso aún no es validado.
f. Sulfato de Magnesio:
Hay aún escasa evidencia pero que muestra beneficio vs anestésico local solo[13].
-
2. Anestesia neuroaxial:
a. Caudal:
Es el estándar de oro en anestesia regional en niños. Compromete más del 50% de todos los bloqueos regionales pe- diátricos[21]. Es una técnica fácil de dominar y provee una buena analgesia infraumbilical.
En neonatos e infantes el cono medular termina aproximadamente en L3 y al año se sitúa en L1 como en los adultos. Así como en niños más pequeños, el hiato sacro se localiza más cefálico que en niños más grandes, pero el saco dural
puede terminar más caudal, cerca de S4 en niños menores de 1 año. Se debe tener mayor precaución en realizar caudal en lactantes por mayor riesgo de punción dural.
La ecografía se puede utilizar para evaluar la anatomía neu- roaxial y el abordaje del espacio caudal.
Los signos de una correcta ubicación de la aguja son: ausencia de abultamiento y falta de resistencia y al aspirar la aguja debe estar limpia de sangre y de líquido cefalorraquídeo (LCR).
Se recomienda no usar altas concentraciones de anestésico local, como bupivacaína 0,5%, debido a que la mieliniza- ción no está del todo completa, bajas concentraciones de amino amidas como levobupivacaína 0,125% son efectivas. Debemos tener presente que la anestesia caudal es directamente proporcional el volumen de anestésico local (AL) con la altura del dermátomo alcanzado. Que es inversamente proporcional la edad y estatura con la extensión craneal. Que el peso provee mejor correlación que la edad en predecir la difusión del anestésico local.
Una regla simple para una inyección única caudal en menores de 20 Kg es usar bupivacaina 0,125% – 0,175% o levobupivacaina 0,2% y dar un bolo para lo siguiente:
– 0,5 ml/kg para conseguir un nivel sacro a lumbar bajo.
– 1,0 ml/kg para conseguir un nivel lumbar alto.
– 1,25 ml/kg para conseguir un nivel torácico bajo.
b. Anestesia espinal:
Principalmente usada en recién nacidos con riesgo de apnea posoperatoria y tiene las siguientes indicaciones:
– Herniorrafia.
– Reparación mielomeningocele.
– Cirugía de extremidades inferiores.
Las consideraciones especiales incluyen:
– La expertis del que proveerá la anestesia.
– La motivación y habilidad del cirujano.
– Deben ser cirugías con tiempo máximo estimado de 90 min.
– Se administra bupivacaína isobara 0,5% 0,2 ml/kg con un trócar 25 G de 25 mm.
-
3. Bloqueo de nervio periférico (BNP):
Tiene una excelente tasa riesgo/beneficio, y en general es bien aceptado por padres y niños.
Hoy en día la práctica clínica va en camino de establecer el estándar de oro de la caudal a las técnicas periféricas. Nuevamente el estudio de ADARPEF muestra que hay una disminución del uso de bloqueo neuraxial de 60% a 34%; y de 60% a 43% en menores de 3 años[13],[15].
Los niños con contraindicación de bloqueo neuroaxial se benefician de BNP como: coagulopatías; disrafia espinal; síndromes como VATER/VACTERL; fusión espinal por instrumentación.
En lactantes menores de 6 meses, la tasa de complicaciones fue 4 veces mayor que en los mayores de 6 meses[21].
Todas las técnicas de anestesia regional de adultos son posibles en niños. Se asume que para todos los bloqueos debe existir: monitorización, vía venosa, asistente entrenado, equipo de resucitación, y manejo de técnicas de asepsia.
En la Tabla 4 se muestran los volúmenes a usar en los BNP más usados en cirugías ambulatorias.
-
Ultrasonido
El uso de ultrasonido ha permitido disminuir las dosis de AL. Esto es importante en la población neonatal y lactantes con lo que además se aumenta la efectividad del bloqueo debido a la precisión de la localización, lo que se asocia a un menor riesgo de daño del nervio.
En el caso del uso de estimulador de nervio, el mínimo aceptado es 0,4 a 0,2 mA, pero algunos últimos estudios han demostrado que el estimulador de nervio no es un determinante específico de la distancia nervio aguja, es posible que la aguja esté intraneural y no tener respuesta motora[13].
-
Complicaciones de la anestesia regional
Las intoxicaciones por anestésicos locales en niños incluyen toxicidad cardiovascular y del sistema nervioso central y reacciones alérgicas a anestésicos locales de la familia ésteres.
La anestesia local en niños siempre debe ser calculada en mg/kg (Tabla 5)[13].
Tener presente que los neonatos y lactantes tienen un ma
yor riesgo de intoxicación por AL por: la metabolización de los AL en lactantes de 1 mes es 1/3 en relación a la del adulto y a los 6 meses es recién de 2/3, ya que el citocromo P450 (CYP) no está completamente maduro hasta los 3 años; la baja concentración de Alfa-1 glicoproteína hasta el año de edad, lo que aumenta la fracción libre de AL a nivel plasmático y el gasto cardiaco aumentado lo que acelera la absorción de la droga desde el tejido. Lo único que favorece disminuir este riesgo es por el volumen de distribución de los neonatos y lactantes que es mayor, disminuyendo la concentración plasmática de AL después de una inyección única, pero no así en administraciones repetidas o continuas de AL.
Se recomienda en caso de sospecha de un síndrome com- partimental tomar medidas para reducir el retraso en el diagnóstico. Para esto se debe realizar:
– Dilución del A local en ambos; single shot (0,1% – 0,25%) y en infusión continua 0,1%.
– Uso de coadyuvantes además de ultrasonido y así disminuir la concentración y el volumen.
| Tabla 5. Dosis máximas de anestésicos locales | ||
| Anestésico local | Clase | Dosis máxima (mg/kg) |
| Procaina | Ester | 10 |
| 2-cloroprocaina | Ester | 20 |
| Tetracaina | Ester | 1,5 |
| Lidocaina | Amida | 5 |
| Bupivacaina | Amida | 2,5 |
| Ropivacaina | Amida | 2,5 |
| levobupivacaina | Amida | 2,5 |
Tabla 4. Bloqueos regionales para CMA, sugerencia de volumen de anestésico local
| Bloqueo | Indicación | Volumen AL (ml/kg) |
| Plexo cervical superficial | Otoplastia, timpanoplastia, implante coclear | 1,0 – 3,0 |
| Interescalénico | Cirugía de hombro | 0,3 – 0,5 |
| Supra e infraclavicular | Cirugía sup de brazo | 0,3 – 0,5 |
| Axilar | Codo y antebrazo | 0,3 – 0,5 |
| Mediano, ulnar y radial | Sindactilia | 0,1 – 0,3 |
| TAP | Apendicectomía ab, herniorrafia inguinal, colostomía, laparotomía infraumbilical | 0,3 – 0,5 por lado |
| Vaina de los rectos | Herniorafia umbilical, pilorotimia | 0,2 – 0,3 por lado |
| Ilioinguinal | Herniorrafia inguinal | 0,2 – 0,3 por lado |
| Pene | Circuncisión, hipospadia distal | 0,1 por lado |
| Cuadrado lumbar | Cirugía abdominal infraumbilical | 0,2 – 0,3 |
| ESP | cirugía toracica y abdominal | 0,2 – 0,3 |
| Femoral | Fx fémur | 0,2 – 0,4 |
| Fascia iliaca | Fx fémur, epífisis femoral | 0,5 |
| Cutáneo femoral lateral | Bp de muslo | 0,1 |
| Ciático proximal | Lig cruzado | 0,3 – 0,5 |
| Canal aductor | Fx fémur | 0,2 – 0,4 |
| Poplíteo | Alargamiento; pierna | 0,3 – 0,5 |
| Tobillo | Sindactilia | 0,1 – 0,2 |
-
Recomendaciones para una práctica segura de anestesia regional:
– Niños menores de 6 meses, debe realizarse la técnica de anestesia regional solo por anestesiólogo con experiencia en anestesia regional pediátrica.
– Siempre usar el bloqueo más periférico posible.
– Cuando se esté iniciando en técnicas ecoguiadas y sobre todo en niños pequeños, iniciar la identificación con suero fisiológico para identificar correctamente la aguja y así prevenir una sobredosis de AL.
– La dosis de AL debe ser en mg/kg y no basarse en el volumen usado.
– Idealmente elegir el AL de la familia amino amida más moderno levobupivacaina o ropivacaina, particularmente en neonatos y lactantes, y cuando se está programando una infusión. De estos anestésicos se recomienda concentraciones hasta 0,25%, y usar 0,125% en pacientes de CMA, neonatos o cuando se sospecha riesgo de síndrome com- partimental.
– Se recomienda la utilización de ultrasonido en los procedimientos de anestesia regional, así como la preparación técnica de los especialistas en esta área[11].
– Siempre usar una técnica aséptica, especialmente en caso de analgesia continua.
– Descartar desórdenes de coagulación, en particular en bloqueos neuroaxial o bloqueos más centrales.
– Analgesia epidural y espinal pueden bloquear la autorregulación simpática de la presión arterial, por lo que se debe realizar el bloqueo con una adecuada monitorización de signos vitales.
– Monitorizar la recuperación del bloqueo motor y de la función vesical después de una anestesia neuroaxial, sobre todo en este tipo de casos ambulatorios.
– En caso de intoxicación por anestésicos locales. Tener protocolo local de reanimación y manejo, además de disponibilidad de lípidos.
-
III.- Período posoperatorio
A partir de encuestas hechas a los padres y cuidadores de niños sometidos a cirugía ambulatoria se han creado listas de recomendaciones para el período posoperatorio. El 2020, en Journal of Pediatric Health Care resume estas propuestas en los siguientes puntos[2]:
1. Respecto al contenido de la información entregada al alta:
– Entregar el tratamiento analgésico escrito en un calendario detallado con los horarios de administración de medicamentos para las primeras 24-48 h.
– Entregar más información respecto al proceso de recuperación después de la cirugía.
– Incluir imágenes junto a las instrucciones escritas.
– Entregar detalles cotidianos que puedan ayudar al tratamiento, por ejemplo, qué alimentos pueden ser consumidos con los medicamentos, adecuados a la estación del año que corresponda.
2. Respecto a tipo de recursos a utilizar:
– Entregar un instructivo adecuado al manejo del dolor individualizado para el paciente y su cirugía.
– Enviar instrucciones al correo electrónico.
– Enviar información en mensajes de audio.
– Enviar recordatorios a los cuidadores para seguir las instrucciones escritas entregadas.
– Usar la tecnología para programar recordatorios de los horarios de los medicamentos.
3. Respecto al formato de las instrucciones:
– Combinar las instrucciones médicas y de enfermería en un solo instructivo.
– Considerar la sensibilidad del momento en el cual es apropiado entregar las instrucciones.
– Evaluar la necesidad de traductor/traducir las instrucciones.
– Entregar los medicamentos requeridos para las primeras 24 h.
-
Conclusión
A modo de conclusión queremos resaltar los siguientes puntos a recordar para lograr una analgesia eficaz y segura: – Idealmente tenga una entrevista selectiva y educativa preoperatoria.
– Utilice escalas de evaluación de dolor adecuadas, eduque.
– Planifique siempre una técnica analgésica multimodal.
– Calcule las dosis de analgésicos por peso ideal.
– Recuerde la posibilidad de alergias y tenga protocolo de anafilaxia.
– Para bloqueos regionales, realice siempre pausa de seguridad del bloqueo, tenga protocolo e insumos para posible intoxicación por anestésicos locales, recuerde posibilidad de síndrome compartimental y esté atento a signos y síntomas.
– Entregue instructivos claros para el periodo postoperatorio y haga seguimiento de sus pacientes.
Fuente de financiamiento: Ninguna.
Conflictos de interés: Ninguno.
Referencias
1. Oliver JA, Oliver LA, Aggarwal N, Baldev K, Wood M, Makusha L, et al. Ambulatory Pain Management in the Pediatric Patient Population. Curr Pain Headache Rep. 2022 Jan;26(1):15–23. https://doi.org/10.1007/s11916-022-00999-y PMID:35129824
2. Tam MT, Wu JM, Page PM, Lamb EA, Jordan I, Chambers CT, et al. Barriers and Facilitators to Effective Pain Management by Parents After Pediatric Outpatient Surgery. J Pediatr Health Care. 2020 Nov – Dec;34(6):560–7. https://doi.org/10.1016/j.pedhc.2020.06.008 PMID:32868162
3. Lejus-Bourdeau C, Bernardon R, Vissac C, Jacqmarcq O. Persistent postoperative pain after ambulatory paediatric surgery. Eur J Anaesthesiol. 2019 Oct;36(10):797–8. https://doi.org/10.1097/EJA.0000000000001011 PMID:31483345
4. Nafiu OO, Thompson A, Chiravuri SD, Cloyd B, Reynolds PI. Factors Associated With Recovery Room Intravenous Opiate Requirement After Pediatric Outpatient Operations. Anesth Analg. 2019 Jun;128(6):1225–33. https://doi.org/10.1213/ANE.0000000000003701 PMID:31094792
5. Donohoe GC, Zhang B, Mensinger JL, Litman RS. Trends in Postoperative Opioid Prescribing in Outpatient Pediatric Surgery. Pain Med. 2019 Sep;20(9):1789–95. https://doi.org/10.1093/pm/pny284 PMID:30657976
6. Schröder A, Campbell FA, Farhat WA, Salle JL, Bägli DJ, Lorenzo AJ, et al. Postoperative pain and analgesia administration in children after urological outpatient procedures. J Pediatr Urol. 2018 Apr;14(2):171.e1–6. https://doi.org/10.1016/j.jpurol.2017.11.014 PMID:29454629
7. Van Cleve WC, Grigg EB. Variability in opioid prescribing for children undergoing ambulatory surgery in the United States. J Clin Anesth. 2017 Sep;41:16–20. https://doi.org/10.1016/j.jclinane.2017.05.014 PMID:28802595
8. Stein AL, Baumgard D, Del Rio I, Tutiven JL. Updates in Pediatric Regional Anesthesia and Its Role in the Treatment of Acute Pain in the Ambulatory Setting. Curr Pain Headache Rep. 2017 Feb;21(2):11. https://doi.org/10.1007/s11916-017-0614-z PMID:28251525
9. Walther-Larsen S, Aagaard GB, Friis SM, Petersen T, Møller-Sonnergaard J, Rømsing J. Structured intervention for management of pain following day surgeryin children. Paediatr Anaesth. 2016 Feb;26(2):151-7. https://doi.org/10.1111/pan.12811
10. Dorkham MC, Chalkiadis GA, von Ungern Sternberg BS, Davidson AJ. Effective postoperative pain management in children after ambulatory surgery, with a focus on tonsillectomy: barriers and possible solutions. Paediatr Anaesth. 2014 Mar;24(3):239–48. https://doi.org/10.1111/pan.12327 PMID:24330523
11. Campos T, Eulufi S, Fajardo M, Guerra K, Pérez I, Merino W, et al. Recomendación clínica “Manejo del dolor agudo perioperatorio en niños”. Rev Chil Anest 2018;Vol. 47 Núm. 1 pp. 46-63. https://doi.org/10.25237/revchilanestv47s01.20
12. August DA, Everett LL. Pediatric ambulatory anesthesia. Anesthesiol Clin. 2014 Jun;32(2):411–29. https://doi.org/10.1016/j.anclin.2014.02.002 PMID:24882128
13. Hadzic´s textbook of Regional Anesthesia and Acute Pain Management, second edition. Capítulos 42, 43, 44, 45
14. Asociación Española de pediatría, AEP. https://www.aeped.es/comite-medicamentos/pediamecum
15. Ecoffey C, Lacroix F, Giaufré E, Orliaguet G, Courrèges P; Association des Anesthésistes Réanimateurs Pédiatriques d’Expression Française (ADARPEF). Epidemiology and morbidity of regional anesthesia in children: a follow-up one-year prospective survey of the French-Language Society of Paediatric Anaesthesiologists (ADARPEF). Paediatr Anaesth. 2010 Dec;20(12):1061–9. https://doi.org/10.1111/j.1460-9592.2010.03448.x PMID:21199114
16. Duedahl TH, Hansen EH. A qualitative systematic review of morphine treatment in children with postoperative pain. Paediatr Anaesth. 2007 Aug;17(8):756–74. https://doi.org/10.1111/j.1460-9592.2007.02213.x PMID:17596221
17. Brasher C, Gafsous B, Dugue S, Thiollier A, Kinderf J, Nivoche Y, et al. Postoperative pain management in children and infants: an update. Paediatr Drugs. 2014 Apr;16(2):129–40. https://doi.org/10.1007/s40272-013-0062-0 PMID:24407716
18. Eizaga Rebollar R, García Palacios MV, Del Carmen Fernández Riobó M, Torres Morera LM. Dexmedetomidina y analgesia perioperatoria en niños. Rev Esp Anestesiol Reanim (Ed. Eng). 2021 25 de mayo: S0034-9356(21)00144-4. Ingles Español. https://doi.org/10.1016/j.redar.2021.03.013.
19. Suresh S, Ecoffey C, Bosenberg A, Lonnqvist PA, de Oliveira GS Jr, de Leon Casasola O, et al. The European Society of Regional Anaesthesia and Pain Therapy/American Society of Regional Anesthesia and Pain Medicine Recommendations on Local Anesthetics and Adjuvants Dosage in Pediatric Regional Anesthesia. Reg Anesth Pain Med. 2018 Feb;43(2):211–6. https://doi.org/10.1097/AAP.0000000000000702 PMID:29319604
20. Pinto N, Sawardekar A, Suresh S. Anestesia regional: opciones para el paciente pediátrico. Anesthesiol Clin. 2020 septiembre;38(3):559-575. https://doi.org/10.1016/j.anclin.2020.05.005.
21. Benjamin J. Walker, Justin B. Long, Madhankumar Sathyamoorthy, Jennifer Birstler, Christine Wolf, Adrian T. Bosenberg, Sean H. Flack, Elliot J. Krane, Navil F. Sethna, Santhanam Suresh, Andreas H. Taenzer, David M. Polaner, en representación de los Investigadores de la Red de Anestesia Regional Pediátrica; Complicaciones en Anestesia Regional Pediátrica: Un análisis de más de 100.000 bloques de la Red de Anestesia Regional Pediátrica. Anestesiología. 2018;129:721–3

 ORCID
ORCID

 Creative Commons Attribution
Creative Commons Attribution