Macarena Gilbert C.1,2,3, Macarena Monsalve R.2,3,4,5
Recibido: 27-05-2022
Aceptado: 31-05-2022
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 4 pp. 445-454|https://doi.org/10.25237/revchilanestv5103061042
PDF|ePub|RIS
Elective surgery in patients with upper respiratory infection
Abstract
A significant number of children presenting for surgery will arrive with an upper respiratory infection (URI). As a result of this infection, the airway may remain hyperreactive to stimuli for up to 6 weeks. Patients who require anesthesia during active URI or during the 6 weeks post active infection are at increased risk of perioperative respiratory complications, such as cough, post-intubation croup, desaturation, atelectasis, pneumonia, laryngospasm, and bronchospasm. These complications, although mostly of routine management, can precipitate more serious episodes that require an extension of hospital stay, hospitalization in intensive care units, respiratory arrest, and even death. For this reason, it is extremely important to analyze the risk of presenting an adverse respiratory event and the need to defer scheduled surgery. This decision can be associated with significant costs for the patient and the family, and can place a great burden on health systems and should be made as objectively as possible, see- king to balance risks and benefits. Along with the identification of risk factors for patients, surgeries and anesthesia, we show the COLDS scale, designed to determine respiratory risks in the perioperative period. The use of this scale might generate valuable information for joint decision-making between parents and physicians. Considering the frequency with which we are faced with children with URI, we briefly review the management of laryngospasm and bronchospasm, as well as certain aspects concerning the status of COVID-19, the need for surgery and pediatric patients.
Resumen
Un porcentaje importante de los niños que se presentan para una cirugía electiva tienen una infección respiratoria alta (IRA). Como consecuencia de estas infecciones las vías respiratorias pueden permanecer hiperreactivas ante estímulos por un período de hasta 6 semanas. Los pacientes que requieren anestesia durante una IRA activa o en las 6 semanas posteriores tienen un mayor riesgo de complicaciones respiratorias perioperatorias, tales como tos, crup post intubación, episodios de desaturación, atelectasia, neumonía, laringoespasmo y broncoespasmo. Estas complicaciones, si bien son en su mayoría de baja complejidad y manejo habitual, pueden precipitar episodios de mayor gravedad que requieran una extensión de su estadía hospitalaria, hospitalización en unidades de cuidados intensivos, paro respiratorio e incluso muerte. Por esta razón es de suma importancia analizar el riesgo de presentar un evento adverso respiratorio y decidir la necesidad de deferir una cirugía programada. La decisión de suspender una cirugía programada se asocia a importantes costos, tanto para el paciente como la familia, y puede significar una gran carga sobre los sistemas de salud. La decisión de suspender una cirugía en un niño con IRA debe realizarse de la manera más objetiva posible, buscando balancear riesgos y beneficios. Junto con la identificación de factores de riesgo de los pacientes, de las cirugías y de la anestesia, mostramos la escala COLDS, diseñada para determinar riesgos respiratorios en el perioperatorio, generando información valiosa para la toma de decisión conjunta entre padres y tratantes. Considerando la frecuencia con la cual nos vemos enfrentados a niños con IRA, revisamos brevemente el manejo del laringoespasmo y broncoespasmo, y mostramos además una aproximación hacia las conductas que debemos tener en el contexto actual del COVID-19, cirugías y los pacientes pediátricos.
-
Introducción
Las infecciones respiratorias altas (IRAs) se sitúan dentro de los principales motivos de consulta al servicio de urgencia y consultas ambulatorias no programadas de la población general[1]. Existen alrededor de 200 virus que pueden causar una infección respiratoria, típicamente caracterizada por tos, odinofagia, estornudos, congestión y descarga nasal; son responsable del 95% de las IRAs, siendo el rinovirus el causante de 30% – 40% de los casos[2],[3],[4].
En promedio, un adulto puede presentar entre 2 a 4 IRAs en un año y en niños el número de episodios puede aumentar hasta 6 – 8 por año[5]. Dado que los niños presentan este gran número de cuadros respiratorios, no es de sorprender que cerca de la mitad de los niños que se presentan a una cirugía electiva tengan antecedentes de una infección del tracto respiratorio superior dentro de las 6 semanas previas a la cirugía[6]. No existe consenso sobre el manejo anestésico óptimo de los niños con IRA que requieren cirugía electiva. Aun cuando múltiples estudios han abordado este tema, ha sido difícil desarrollar pautas de prácticas basadas en la evidencia dadas las diferencias que existen en los diseños de los estudios, los criterios de IRA y los resultados.
-
¿Cuáles son las implicancias de una infección respiratoria alta?
Alrededor de 30% de los niños tienen una infección respiratoria activa al momento de presentarse para una cirugía electiva[7]. Como consecuencia de la infección y de la invasión viral en el epitelio, se produce inflamación y edema de la mucosa respiratoria. Esto favorece la posibilidad de broncoconstricción, y sensibiliza a las vías respiratorias a las secreciones y agentes volátiles[8]. La infección viral además puede actuar sobre el sistema nervioso autónomo: neuraminidasa virales pueden inhibir los receptores colinérgicos muscarínicos M2, con lo que puede haber mayor liberación de acetilcolina y, en consecuencia, broncoconstricción[9].
La mayoría de las IRAs virales son autolimitadas, pero después de un episodio agudo la hiperreactividad bronquial puede durar en promedio hasta 6 semanas (mucho más incluso que la duración de los signos y síntomas clínicos)[10]. Los pacientes que requieren anestesia durante este tiempo tienen un mayor riesgo de complicaciones perioperatorias, tales como tos, crup posintubación, episodios de desaturación, atelectasia y neumonía. Todas estas complicaciones ocurre con la misma incidencia en niños que se encuentran en la fase aguda de una infección como en aquellos que se están recuperando de ella[11],[12].
A pesar del aumento general en la incidencia de complicaciones respiratorias perioperatorias la mayoría de estos eventos son manejables y parecen dejar muy poca morbilidad resi- dual[13]. Cabe señalar que también se pueden ver eventos de obstrucción funcional de la vía aérea alta (laringoespasmo) y/o baja (broncoespasmo), que pueden conducir a episodios incluso fatales de hipoxemia, si bien este tipo de complicaciones son menos frecuentes[10].
Se ha visto que junto con el aumento del riesgo de presentar un evento adverso respiratorio en el perioperatorio, existe una carga financiera asociada muy significativa. Cuando se han revisado datos norteamericanos de pacientes pediátricos que se presentan a una cirugía con IRA, se ha podido establecer una asociación con un mayor número de días de hospitalización y, en consecuencia, un mayor costo por episodio quirúrgico[14].
-
Factores de riesgo de complicaciones respiratorias perioperatorias
Dada la altísima frecuencia con la cual los niños se presentan a una cirugía con una cuadro respiratorio activo, los eventos adversos respiratorios son frecuentes, si bien, en su mayoría, de escasa gravedad. No por ello se debe minimizar su importancia ya que al revisar las causas de paro perioperatorio de los pacientes pediátricos, las complicaciones respiratorias son responsable del 30% de estos eventos[15].
Cuando evaluamos a un niño con IRA que se presenta a una cirugía electiva, es necesario indagar por factores de riesgo que se sabe se asocian con mayor frecuencia a eventos adversos respiratorios en el perioperatorio[13],[16].
Dentro de estos, hay factores de riesgo que son propios de los pacientes. Sin duda, los niños con signos de una infección grave, sobreinfección bacteriana o compromiso de la vía aérea baja tienen mayor riesgo de presentar eventos adversos; entre los signos de infección grave o sistémica se incluye fiebre > 38,5 °C, disnea, sibilancias, tos productiva y secreciones purulentas. En el caso de un paciente con IRA leve, un importante predictor de eventos adversos es que los cuidadores reconozcan que el niño “está resfriado”. El antecedentes de tabaquismo pasivo, el ronquido, la prematurez (RN < 37 semanas), la historia de hiperreactividad de la vía aérea u otra comorbilidad pulmonar son también factores de riesgo a tener en cuenta.
Hay factores de riesgo que tienen que ver con la anestesia misma, entre los cuales destacan los agentes usados durante la inducción y mantención anestésica, la forma con la cual se maneja la vía aérea durante la cirugía (intubación versus máscara laríngea versus mascarilla facial) y la experiencia del anestesió- logo que maneja la vía aérea pediátrica.
Por último, existen factores de riesgo dados por la misma cirugía. Cualquier manipulación de la vía aérea superior del niño resulta en un aumento significativo del riesgo de un evento adverso[17],[18]. Dicha manipulación puede incluir la instrumentalización de la vía aérea (por ejemplo, la intubación endotraqueal o una broncoscopia). La cirugía cerca de la vía aérea (cirugía otorrinolaringológica o la cirugía ocular) y la cirugía con deterioro de la función respiratoria (cirugía abdominal superior o la cirugía cardíaca) también se asocia con un mayor riesgo[19].
-
Manejo anestésico
La necesidad de anestesiar a niños resfriado de la manera más segura posible implica una evaluación cuidadosa de los potenciales riesgos y beneficios para el niño. En general, un niño que se presenta a una cirugía con síntomas de IRA no complicada (afebril, con secreciones claras, buen ánimo y aspecto sano) o aquel paciente con patología respiratoria leve, no infecciosas (rinitis alérgica) debiera poder someterse sin problemas a una cirugía, ya que los problemas que presentan son generalmente fáciles de manejar y no dejarían secuelas a largo plazo[20].
La evaluación preanestésica constituye un pilar fundamental en toda anestesia y es parte esencial del manejo. Como complemento, el estudio de laboratorio muchas veces es considerado como algo necesario en estos pacientes. Pero es necesario recalcar que, aun cuando existen exámenes disponibles para confirmar el diagnóstico de IRA (panel viral), estos carecen de beneficio práctico y económico: el hisopado o aspirado nasofaríngeo para el aislamiento viral son exámenes de alto costo y el resultado depende mucho de la forma en que se recolecta la muestra y la fase de la infección[16]. Así mismo, los exámenes de sangre y radiológicos en general carecen de utilidad a menos que el diagnóstico de IRA sea cuestionable y solo contribuyen a un aumento de los costos.
La elección del agente usado para la inducción y mantención anestésica es algo relevante en niños con IRAs. En el pasado, el halotano fue considerado el anestésico volátil de elección para estos niños; sin embargo, en muchos hospitales hoy en día, el halotano ha sido reemplazado por sevoflurano. Este ha demostrado gran superioridad sobre otros halogenados al momento de la inducción (isoflurano, desflurano) por su escaso efecto irritante y menor impacto sobre la resistencia de la vía aérea[21]. El propofol es el inductor endovenoso más utilizado en anestesia pediátrica. Entre sus efectos beneficiosos se incluye la rapidez de la inducción, la calidad del despertar post anestesia y su reconocido efecto antiemético. Se ha demostrado que también posee efectos broncodilatadores, similares a los de los anestésicos volátiles, pero para poder ser empleado es necesaria la presencia de una vía venosa[22].
Independiente de la forma usado para la inducción (inhalatoria versus endovenosa), la profundidad de la anestesia debe ser la suficiente para abolir los reflejos de la vía aérea, en especial al momento de intubar a los paciente. La profundidad a la cual se debe realizar la extubación es menos clara. Algunos anestesiólogos prefieren extubar bajo anestesia profunda para evitar la constricción refleja de la vía aérea, mientras que otros prefieren extubar cuando el paciente está bien despierto, creyendo que un paciente con reflejos intactos está en una mejor posición para eliminar las secreciones y responder a los estímulos.
En términos de disminuir la estimulación de una vía aérea “irritable”, se sabe que el uso de una mascarilla facial se asocia con la menor incidencia de complicaciones respiratorias en el perioperatorio, pero pudiera no ser apropiada para muchas cirugías. La máscara laríngea (LMA) proporciona una alternativa segura para algunos procedimientos y su uso ha demostrado menor asociación con complicaciones respiratorias como broncoespasmo y desaturación[23]. El tubo endotraqueal es el dispositivo de elección para manejar la vía aérea en cirugías de orofaringe y cuello, cirugía torácica y abdominal mayor o cirugías que duran más de un par de horas. Pero en la medida que se pueda, se recomienda evitar su uso, particularmente en niños más pequeños, dado que se ha visto que aumenta significativamente el riesgo de complicaciones respiratorias[24].
Como último factor de riesgo a mencionar, son varios los autores que han demostrado que la experiencia del anestesiólogo a cargo tiene un efecto importante en la disminución de la incidencia de eventos adversos respiratorios.
-
¿Suspender o no suspender?
Tradicionalmente a los niños con una infección del tracto respiratorio superior que se presentan a una cirugía electiva se les ha suspendido el procedimiento al menos hasta que estén asintomáticos, pero basados fundamentalmente en datos em- píricos[25]. Aunque la suspensión de la cirugía evita la posibilidad de complicaciones, puede imponer importantes cargas emocionales y económicas a los niños y padres (como períodos de ansiedad y ayuno innecesario, permisos del colegio y los lugares de trabajo, traslado y alojamiento en otra ciudad para los días de la cirugía, etc.)[26],[27]. Además, es posible que la suspensión general no siempre sea práctico en el contexto de atención de la salud de hoy en día, con un número creciente de casos en lista de espera y presiones para acelerar la cirugía. Teniendo esto en cuenta, aparecen encuestas en años más recientes donde se ve que los anestesiólogos con mayor experiencia son cada vez menos propensos a cancelar la cirugía debido a una IRA[28]. En estas encuestas, el 40% de los anestesiólo- gos con menos de 10 años de práctica refiere cancelar “alguna vez” una cirugía por IRA, en comparación con el 27% de los que tienen más de 10 años de experiencia.
La decisión de cuánto tiempo esperar para reagendar la cirugía se basa sobre la necesidad de lograr un equilibrio entre el tiempo requerido para la resolución de los síntomas, la necesidad de continuar con el procedimiento y la disminución del riesgo. Desafortunadamente, no hay consenso sobre el tiempo óptimo de espera después de una IRA antes de reprogramar la cirugía. Hay estudios que han reportado que, al permanecer aumentado el riesgo durante 4-6 semanas después de una IRA, este sería el período prudente para posponerlos[13]. Otros trabajos sugiere que un retraso de 1 a 2 semanas puede ser todo lo que se requiera esperar para los niños con nasofaringitis no complicada[29]. La decisión de diferir una cirugía no solo corresponde al tiempo de inicio de una infección respiratoria. Debemos tener claro que es una decisión conjunta, entre el equipo médico y la familia del paciente, basado en un análisis informado. Se debe tener en consideración otras variables, como la presencia o no de comorbilidades, el tipo de cirugía (electiva o tiempo sensible), además de la infección respiratoria actual con sus características y el tipo de anestesia a administrar.
En estudios de regresión logística se observa que no hay diferencias en eventos adversos respiratorios en niños comparando niños sin infección respiratoria y aquél que tuvo una infección respiratoria con inicio de síntomas hace más de 6 se- manas[13],[30].
Se observa que aquellos que han tenido infección respiratoria con inicio de síntomas hace menos de 2 semanas tienen riesgo moderado de presentar eventos adversos respiratorios y que aquellos con inicio de síntomas entre 2 y 4 semanas son los que presentan mayor riesgo de presentar complicaciones respiratorias en el perioperatorio[13],[30].
Por lo tanto, parece prudente esperar 6 o 7 semanas posterior a una infección respiratoria para proceder con una cirugía completamente electiva; pero considerando que cada niño tiene entre 6 a 8 infecciones respiratorias al año, no nos quedaría una ventana para poder realizar la cirugía, por lo que puede ser impracticable.
Es por esto, que si consideramos que el mayor riesgo de eventos adversos respiratorios ocurren entre las 2 y 4 semanas posterior al inicio de una infección respiratoria, se deba esperar al menos estas 4 semanas desde el inicio de los síntomas.
-
¿Existe alguna forma objetiva de decidir diferir una cirugía electiva frente al paciente pediátrico con IRA?
La realización de una evaluación preanestésica precisa – enfocada hacia el riesgo de eventos adversos respiratorios – podría permitir una estratificación que contribuya a orientarnos hacia la planificación anestésica y de esta manera reducir la posibilidad de complicaciones.
El 2014 Lee et al., propuso el “COLDS score”, una escala aplicable durante la evaluación preoperatoria[7]. El objetivo de esta escala es analizar el riesgo de una infección respiratoria y determinar la incidencia general de eventos respiratorios. De manera secundaria, el uso de la escala permitiría predecir estadías prolongadas en la unidad de recuperación, un factor reconocido como uno de los elementos que contribuye a la ineficiencia de los sistemas de salud. El 2017 esta escala fue implementada y posteriormente validada por la Universidad de California, en particular para pacientes menores de 6 años[30].
La escala incluye los elementos previamente identificado como factores de riesgo para eventos respiratorios periopera- torios (Tabla 1). De acuerdo a la severidad y puntaje de 5 variables se obtiene un valor que busca sugerir la posibilidad de un evento adverso respiratorio perioperatorio, así como predecir estadías prolongadas de hospitalización en unidades de recuperación.
A través de los estudios de validación realizados se ha podido ver que esta escala es útil para predecir complicaciones como bronconcoespasmo, desaturación de oxígeno, necesidad de uso de beta agonista y tos prolongada pero es menos útil para predecir el riesgo de laringoespasmo. Así mismo, con su uso se ha podido corroborar que las complicaciones respiratorias son más frecuentas en los pacientes más pequeños, específicamente entre 0 y 2 años. En el siguiente gráfico se puede observar el porcentaje de pacientes con complicaciones respiratorias de acuerdo a score de COLDS (Gráfico 1). Se grafica la tendencia que a mayor puntaje COLDS, mayor porcentaje de complicaciones respiratorias; sobre 8 puntos en este score, las complicaciones respiratorias llegan al 20%.
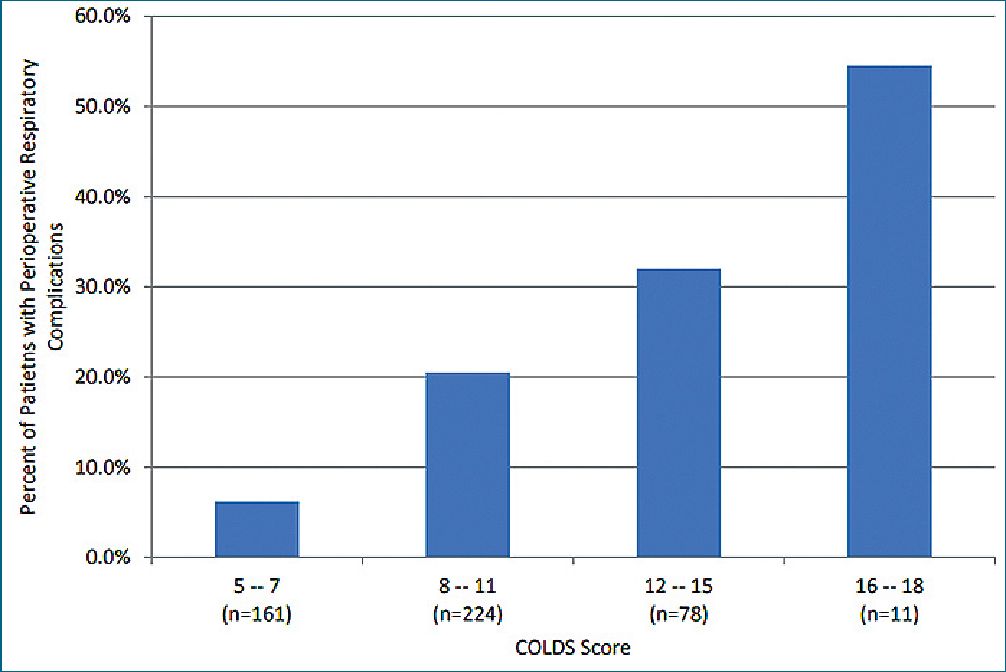
Gráfico 1. COLDS CORE.
Por su simplicidad y facilidad de uso, esta escala podría ayudar a cuantificar el riesgo de presentar una complicación respiratoria, en especial en lugares donde existe menos experiencia en anestesia pediátrica. La posibilidad de aplicarla por personal no médico e incluso antes de la fecha programada para la cirugía, podría aportar con la eficiencia de los sistemas de salud, pero siempre teniendo presente que por sí sola no pretende ser un instrumento que decida la suspensión de una cirugía.
-
Manejo de eventos adversos asociados a IRA y anestesia
De las complicaciones observadas en los pacientes quirúrgicos con IRA, el laringoespasmo y el broncoespasmo son dos de los eventos respiratorios más temidas por la mayoría de los anestesiólogos.
El laringoespasmo ocurre con mayor frecuencia al despertar de la anestesia (47% de los casos), y con menor frecuencia en la inducción (28%) y mantención (23%). Clínicamente, se caracteriza por una obstrucción de la vía aérea que puede ser parcial (permite escasa entrada de aire a los pulmones) o completa (no existe entrada de aire a los pulmones). Anatómicamente, puede ocurrir por el cierre de las cuerdas falsas, junto a la incli-
Tabla 1. COLDS Score propuesta por Lee et al
| 1 | 2 | 5 | |
| C: Current
Síntomas y signos actuales |
Ninguno | Leve: Padres confirman infección respiratoria y/o congestión, rinorrea, odinofagia, estornudos, fiebre baja, tos seca | Moderado/Severo: Mucosidad purulenta, tos húmeda, ruidos respiratorios anormales, letargia, aspecto letárgico o fiebre alta |
| O: Onset
Inicio síntomas |
> 4 semanas | 2 – 4 semanas | < 2 semanas |
| L: Lung disease Enfermedad pulmonar | No | Leve:
Historia clínica de VRS, Asma leve intermitente, Displasia broncopulmonar en > 1 año, roncador, fumador pasivo |
Moderado/severo:
Asma moderado persistente, lactante con displasia broncopulmonar, apnea obstructiva del sueño o hipertensión pulmonar |
| D: Device
Manejo de vía aérea |
Nada o mascarilla facial | LMA o dispositivo supraglótico | Tubo endotraqueal |
| S: Surgery
Tipo de cirugía |
Otro: incluye cirugía de colleras | Vía aérea menor: sondaje vía lagrimal, broncoscopía flexible, tratamiento dental | Vía aérea mayor: fisura palatina, broncoscopia rígida, cirugía maxilofacial |
Figura 1a. Imagen de vía aérea normal.
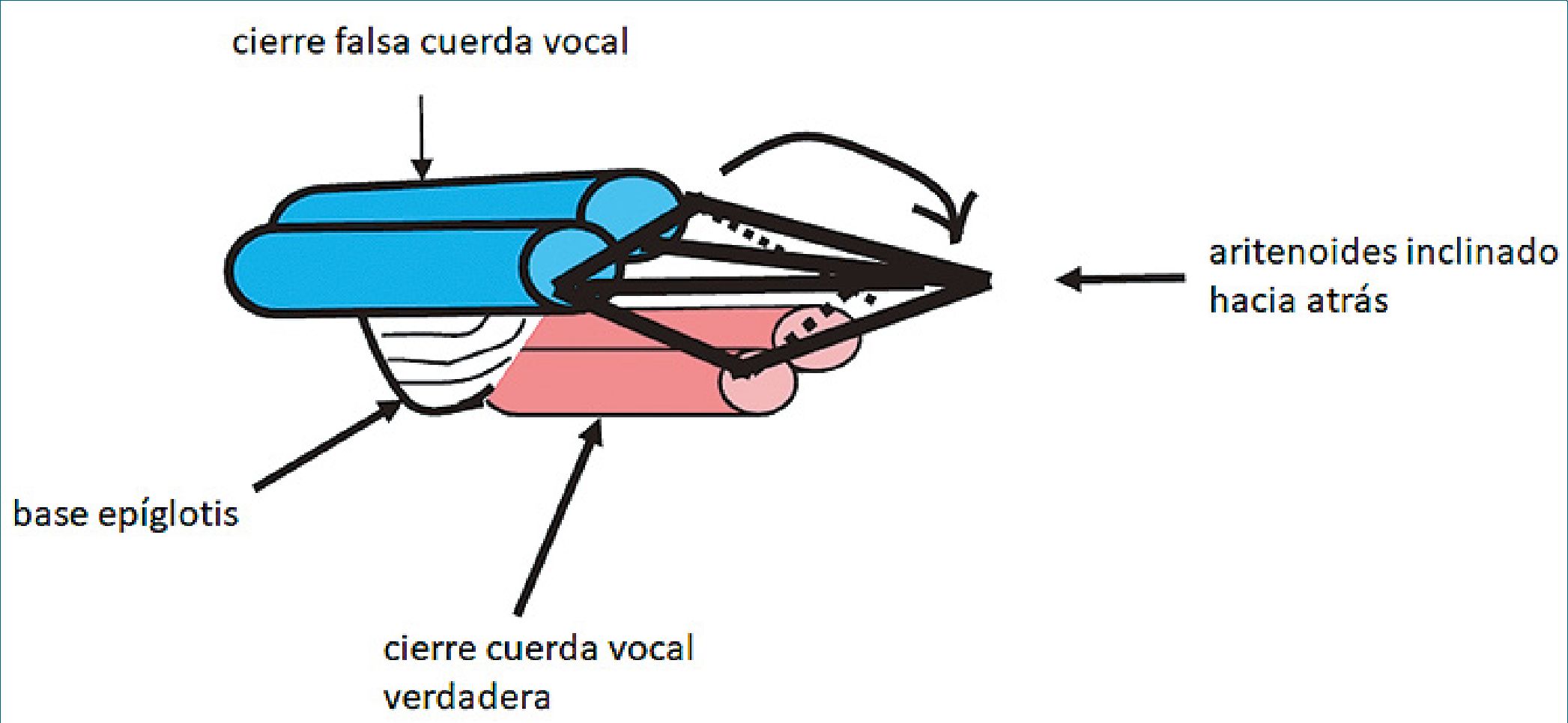
Figura 1b. Esquema donde se observan las cuerdas vocales falsas.
nación hacia atrás de los aritenoides. Este cierre es sumamente “efectivo” y da cuenta de un laringoespasmo completo e intenso. A este mecanismo se suma el cierre de las cuerdas vocales verdaderas[31]. En la Figura 1 se puede visualizar las distintas estructura anatómicas implicadas.
El diagnóstico de un laringoespasmo es netamente clínico; junto con reconocerlo de manera precoz, requiere de un pronto manejo para evitar la progresión a hipoxemia, bradicardia y paro cardiorrespiratorio. Una vez establecido, el tratamiento consiste en:
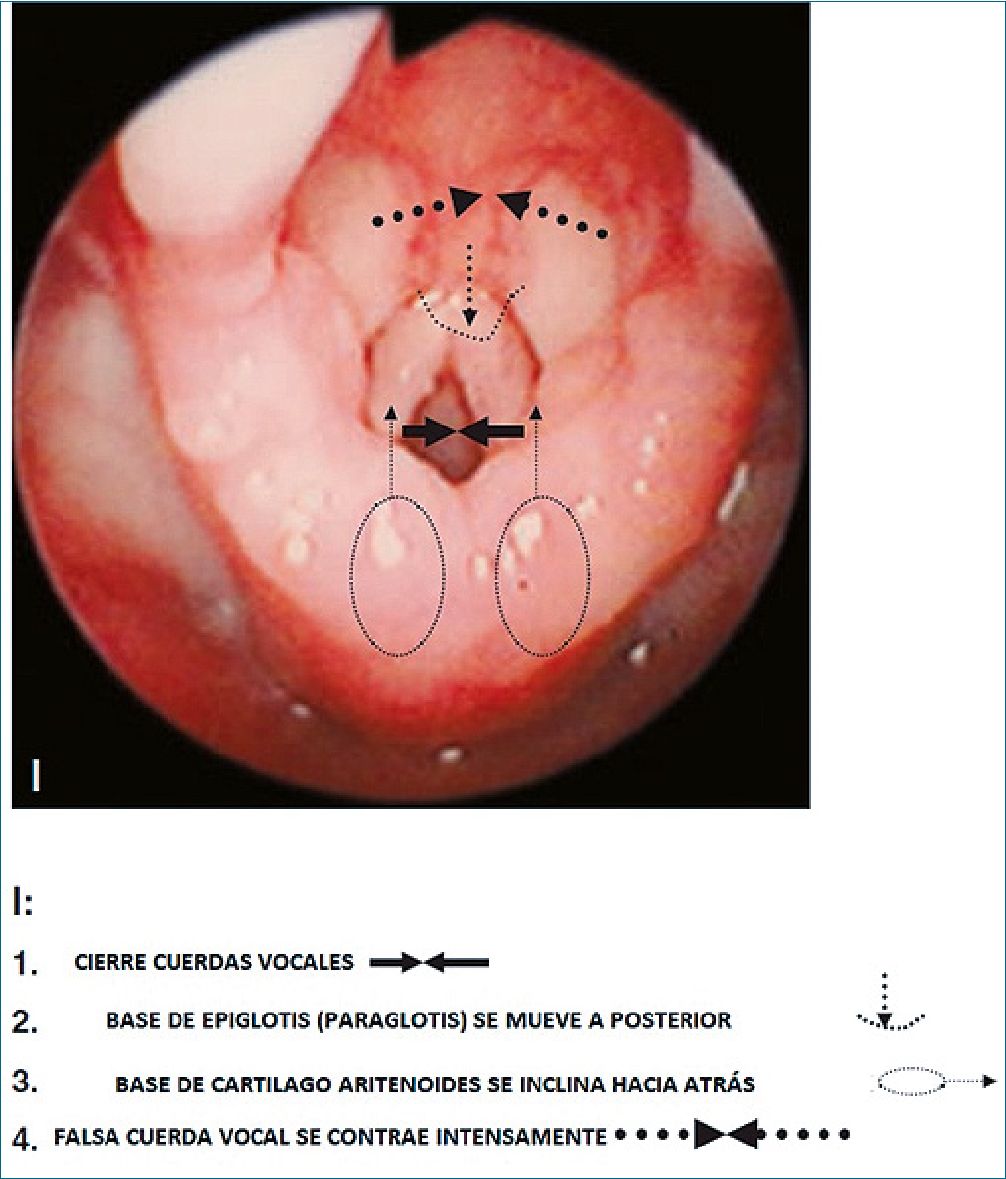
Figura 1c. Estructuras anatómicas en el laringoespasmo: en la imagen C se observa el cierre de las cuerdas vocales, la base de la epiglotis desplazada hacia posterior, la base del cartílago aritenoides inclinado hacia atrás, y las falsas cuerdas vocales contraídas[31].
1) Eliminar el estímulo que lo provoca. Se puede aspirar si hay contenido en la faringe (mucosidad, saliva o sangre), siempre teniendo en cuenta que la superficialidad anestésica puede contribuir a empeorar la situación[32],[33].
2) Administración de oxígeno al 100%.
3) Subluxación de la articulación temporomandibular (maniobra de Esmarch Heiberg). La movilización vigorosa de la mandíbula hacia delante junto con la extensión del cuello es la primera maniobra a realizar. Esto desplaza la lengua y favorece la permeabilidad de la laringe. Si hay un dispositivo supraglótico, retírelo.
4) Inserción de una cánula orofaríngea (Guedel) acorde a la edad. Si no es posible abrir la boca se puede insertar una cánula nasofaríngea.
5) De manera simultánea, aplicar CPAP (20 – 30 cmH2O). En casos crítico se puede presionar la máscara facial con 2 manos, en lo posible tratando de evitar la entrada de aire al estómago.
6) Profundización de la anestesia mediante administración de Propofol EV. Una dosis de 0,5 mg/kg parece ser segura y resuelve un altísimo porcentaje de los laringoespasmos (cerca del 77%). Apoyar ventilación frente a la presencia de apnea.
7) Si no responde, administrar un relajante neuromuscular. Se puede utilizar succinilcolina en dosis de 0,1 a 2 mg/kg EV; si no se cuenta con una vía venosa, se puede administrar de manera intramuscular (4 mg/kg en el deltoides o cuádri- ceps) o intralingual (2 mg/kg). Como alternativa endovenosa se puede utilizar rocuronio (1,2 mg/kg). En caso de apnea se debe apoyar la ventilación.
8) Administrar atropina si la frecuencia cardíaca va en descenso y se administrará Propofol, antes de la administración de succinilcolina o frente a una bradicardia franca.
9) Otras maniobras con menor evidencia reportada:
a) Presión gentil en línea media del tórax para generar presión en las cuerdas vocales hasta 30 mmHg y abrir las cuerdas. Esto puede, además, estimular el reflejo vagal de Hering-Breuer, el que inhibe el reflejo del cierre de las cuerdas vocales[34].
b) Aplicar presión intensa entre la mastoides, el proceso estiloide y la mandíbula, provocando dolor y como reflejo relajación de las cuerdas vocales. Esto, a la vez, puede elevar la mandíbula como se describió en el paso 1 (maniobra de Larson). En la Figura 2 se precisa el punto de presión[32].
10) El último paso corresponde a la intubación orotraqueal (incluso frente a cuerdas vocales cerradas).
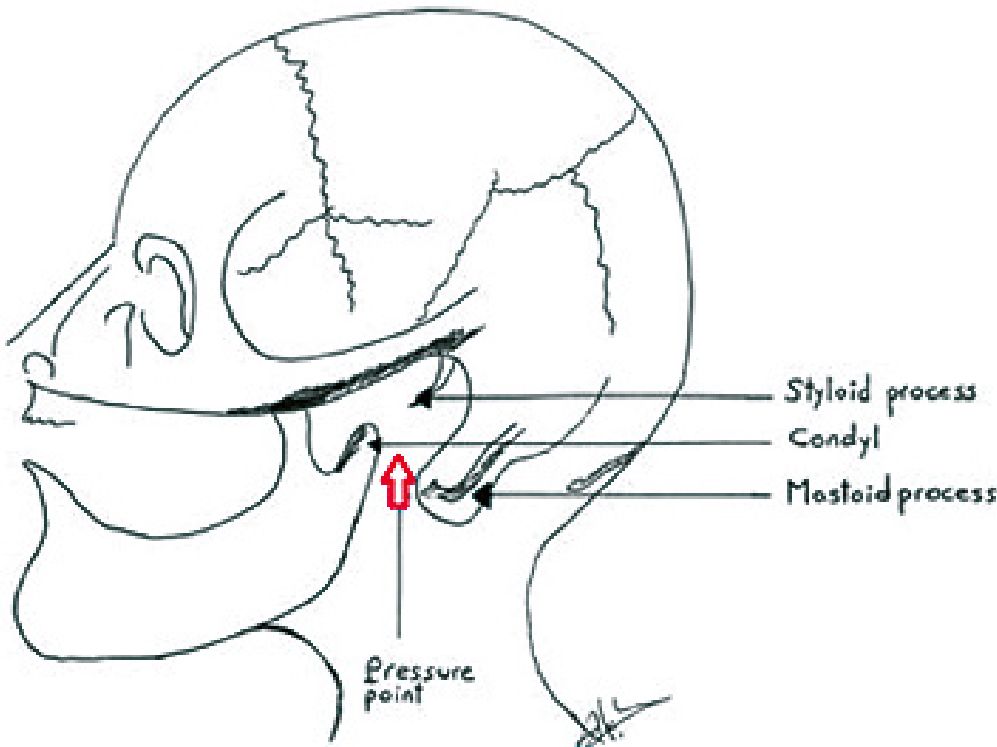
Figura 2. Maniobra de Larson.
Nunca olvidar pedir ayuda prontamente durante este proceso. Ante la eventualidad de un laringoespasmo perioperatorio, es recomendable dejar al paciente en una unidad de recuperación para observación por 2 a 3 horas posterior al evento. Esto debido a la posibilidad de aparición de edema pulmonar “ex vacuo”, el que se produce por la generación de presión negativa en el tórax al tratar de respirar contra una glotis cerrada. La presión negativa produce un transudado en los alvéolos, que sumado a hipoxemia y la estimulación simpática, puede producir vasoconstricción sistémica y pulmonar.
El broncoespasmo es un reflejo reversible del músculo liso a nivel de los bronquios. Es causado por liberación de histamina y mediado por el nervio vago. Entre los estímulos que lo pueden gatillar están el aire frío, los agentes inhalados irritantes y la instrumentación de la vía aérea (presencia de un tubo orotra- queal, fibrobroncoscopio, cuerpo extraño, etc).
Clínicamente, se puede manifestar por sibilancias o ausencia de ruidos pulmonares y desaturación. Los parámetros observados en el ventilador mecánico incluyen un rápido ascenso de la presión inspiratoria máxima (presión plateau sin cambios), un lento ascenso en la curva de capnografía (Figura 3) y una disminución del volumen pulmonar espiratorio. Puede aparecer como una entidad única o asociado a anafilaxia. Usualmente se desencadena asociado a alguna maniobra en vía aérea en pacientes con antecedentes enfermedad respiratoria previa como asma[33],[35].
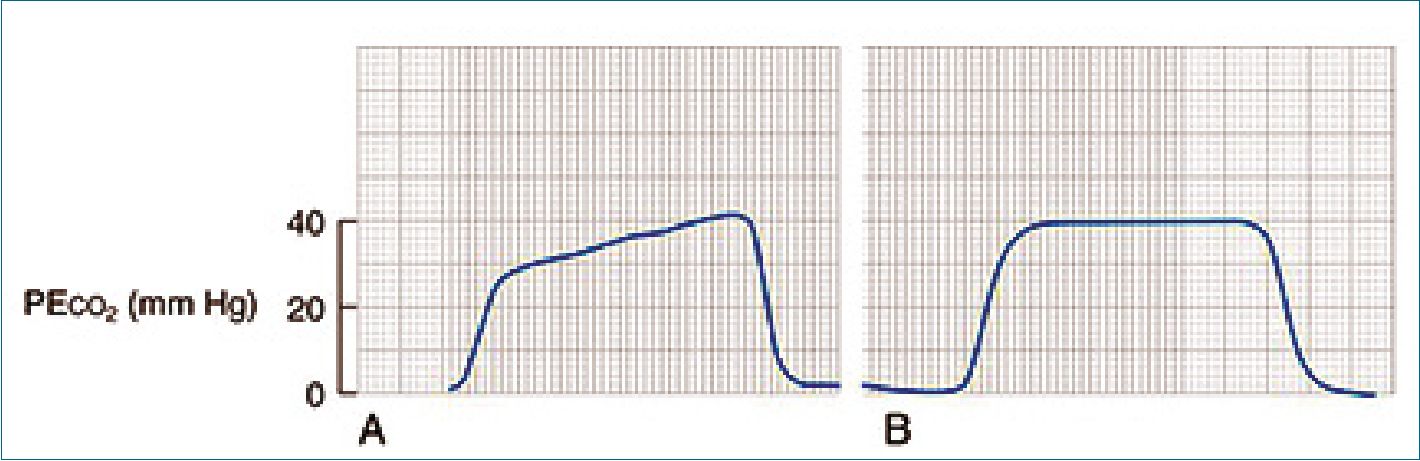
Figura 3. A. Capnografía característica de un broncoespasmo; B. Capnografía normal.
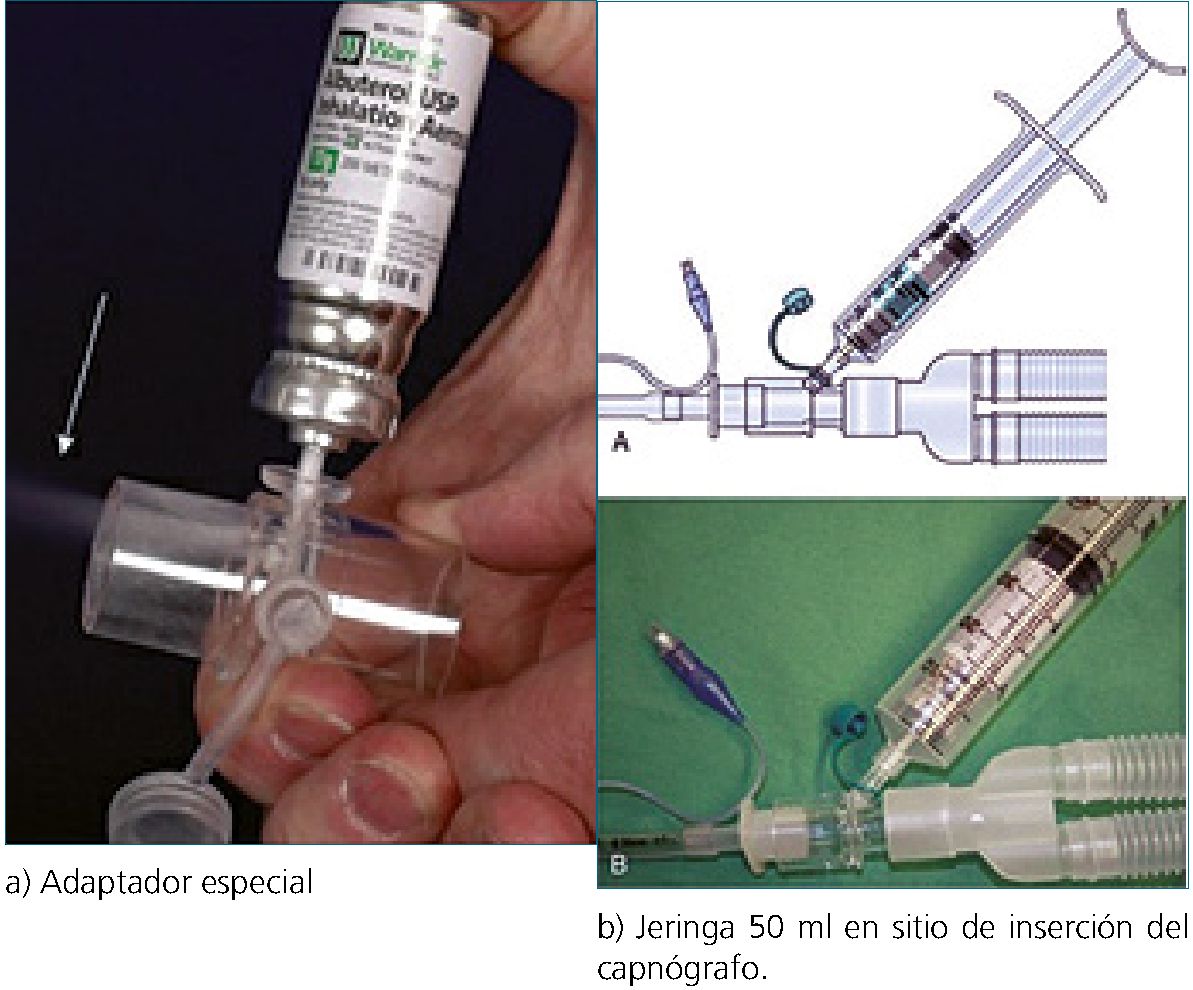

Figura 4. Alternativas de administración de B2 agonistas en el paciente intubado.
Una vez establecido el broncoespasmo en el intraoperato- rio, el tratamiento consiste en:
1) Profundizar la anestesia, aumentando la concentración de halogenados para favorecer su efecto broncodilatador. Como alternativa se puede administre ketamina (0,2-1 mg/ kg ev) al ser un inductor con propiedades broncodilatado- ras.
2) Descartar otras causas de elevación de presión respiratoria
(tubo doblado, intubación monobronquial, obstrucción del tubo con secreciones, neumotórax, etc.).
3) Aumento de la FiO2
4) Disminuir el PEEP y aumentar el tiempo espiratorio en la ventilación para evitar atrapamiento de aire.
5) Uso de B2 agonistas (Salbutamol, 2 a 10 puf de acuerdo a la distancia del tubo endotraqueal). Para mejorar la entrega del fármaco, debe ser administrado lo más cercano al tubo orotraqueal. En la Figura 4 se muestran alternativas de administración en paciente intubado:
Si dispone además de salbutamol ev. Administre 5-10 mcg/ kg en bolo, seguido de una infusión de 5-10 ug/kg/min hasta que resuelva el broncoespasmo. En pacientes extubados se puede administrar salbutamol 0,5% (1 ml en mascarilla de recirculación).
| Niños y adultos con síntomas leves y PCR (+) | Aislamiento por 5 días desde el inicio de síntomas (día 0 corresponde al primer día de los síntomas) |
| Pacientes con PCR (+), asintomáticos | Aislamiento por 5 días desde el momento de un resultado positivo. Si aparecen síntomas más tarde, se considera como día 0 el primer día de síntomas |
| Pacientes con PCR (+), síntomas moderados
Pacientes con PCR (+), enfermedad severa, inmunocompetentes |
Aislamiento por 10 días desde el inicio de los síntomas
Aislamiento por 10 días, con posibilidad de extensión del aislamiento hasta 20 días desde el fin de los síntomas |
| Pacientes con PCR (+), enfermedad moderada o severa, inmunocomprometidos | Aislamiento por 20 o más días (día 0 inicio de síntomas o test positivo). Evaluación por infectología |
Figura 5. Aislamiento sugerido según severidad de la infección por COVID-19.
Tabla 2. Mortalidad en pacientes con COVID-19 y cirugía
| Intervalo entre diagnóstico COVID y cirugía | Mortalidad a 30 días en pacientes electivos (%, IC) |
| Sin diagnóstico COVID-19 | 0,62 (0,57-0,67) |
| 0 – 2 semanas | 3,09 (1,64-4,54) |
| 3 – 4 semanas | 2,29 (1,06-3,53) |
| 5 – 6 semanas | 2,39 (0,87-3,91) |
| > 7 semanas | 0,64 (0,2-1,07) |
6) De no haber respuesta con las maniobras anteriores, considere el uso de adrenalina (1 mcg/kg EV). Se puede repetir el bolo o iniciar una infusión (0,05- 0,5 mcg/kg/min).
7) Considere la administración de esteroides endovenoso.
Pida ayuda prontamente durante este proceso, y finalmente evalúe la necesidad de ingreso a una unidad de cuidados intensivos.
-
COVID-19 en cirugía electiva
Obtener información sobre el COVID-19 es todo un desafío dada la rápida evolución que ha mostrado la pandemia en el mundo. Más aún, si hablamos de la población pediátrica, el desafío puede ser aún mayor dado el comportamiento de la enfermedad en niños, muy diferente al comportamiento de la enfermedad en adultos y a la falta de estudios de calidad en esta población.
A través del análisis de la realidad epidemiológica mundial disponible en la actualidad, la Sociedad Americana de Anestesiología publicó en marzo de 2021 las primeras recomendaciones sobre cirugía electiva en pacientes con COVID-19 y posteriormente las actualizó en febrero de 2022[36]. Estas recomendación establecen que un paciente con infección por COVID-19 se debe operar de una cirugía electiva cuando se haya recuperado de la enfermedad y siempre que el equipo quirúrgico esté de acuerdo que se debe proceder con la cirugía. Para establecer esta recomendación es necesario:
1) Determinar cuándo un paciente deja de ser contagioso, para así evitar infectar al equipo de salud.
De acuerdo a la CDC (Center for Disease Control and Pre- vention) es poco probable demostrar replicación viral después de 10 días del inicio de los síntomas, con excepción de pacientes con enfermedad severa por COVID-19 o en pacientes inmunocomprometidos. Considerando esto, la CDC recomienda que los tratantes utilicen una estrategia basada en tiempo y síntomas para decidir si un paciente sigue siendo contagioso o no (Figura 5)[37].
2) Analizar en qué momento disminuye el riesgo perioperato- rio en pacientes infectados por COVID-19, para poder proceder con cirugía electiva de forma segura.
Cirugía electiva debe posponerse por 7 semanas luego de infección por SARS-CoV-2 en pacientes NO vacunados que son asintomáticos al momento de la cirugía
La evidencia es insuficiente para generar recomendaciones en aquellos pacientes que se encuentran vacunados
Cada retraso en cirugía debe analizarse en forma individual
Si se debe proceder con la cirugía sin esperar el tiempo recomendado, los riesgos deben estar escritos en el consentimiento informado
Considere retrasar el momento de una cirugía si el paciente sigue sintomático
Cada decisión de proceder con una cirugía debe considerar:
• Severidad de la infección inicial
• El potencial riesgo de síntomas activos
• Comorbilidades y estado de fragilidad
• Complejidad de la cirugía
En base a estudios multicéntricos donde se observa la presencia de complicaciones en pacientes quirúrgicos (con y sin COVID 19) se ha podido ver que la mortalidad de los pacientes con PCR (+) se equipara a la de los pacientes con PCR (-) recién después de 7 semanas (Tabla 2)[38].
Actualmente, la Sociedad Americana de Anestesiología, en relación a si se debe proceder con una cirugía en el contexto de una infección con COVID-19, recomienda lo siguiente[36]: (ver cuadro)
¿Se debe repetir el test diagnóstico si un paciente tuvo infección COVID-19?
• La CDC no recomienda realizar un nuevo test para CO- VID19 previo a estudio para cirugía[37].
• Si aparecen síntomas después de 90 días de haber tenido COVID-19, se debe realizar un nuevo test diagnóstico.
Teniendo en consideración las recomendaciones para pacientes adultos disponible a la fecha y pensando en la población pediátrica, una población con una particular hiperreactividad respiratoria, con infecciones respiratorias frecuente y con un comportamiento particular de la infección por COVID-19 parece razonable sugerir una conducta similar, hasta contar con mayores estudios en la población pediátrica. Estas recomendaciones se resumen a continuación:

-
Conclusión
Al momento de presentarse para una cirugía electiva, 1 de cada 3 niños puede presentar una infección respiratoria alta y en consecuencia un mayor riesgo de complicaciones respiratorias perioperatorias como tos, crup posintubación, episodios de desaturación, atelectasia, neumonía, laringoespasmo y bronco-espasmo.
En este contexto, la decisión de diferir una cirugía se puede complementar con el uso de escalas como el COLDS, de tal manera de buscar un equilibrio entre la alta frecuencia de IRA en niños, el riesgo respiratorio perioperatorio, y los costos asociados a suspensión.
Por último, en el contexto pandémico actual, IRA se asocia a COVID-19, por lo que creemos necesario conocer las recomendaciones existentes en términos de tiempos de espera para programar cirugías después de una infección por COVID-19. Si bien las recomendaciones se basan en su mayoría en estudios realizados en población adulta, es posible extrapolarlas a la población pediátrica, siempre considerando la contagiosidad del virus en los niños, la gravedad y duración de los síntomas y la realidad de la salud local.
Referencias
1. Burt CW, McCaig LF, Rechtsteiner EA. Ambulatory medical care utilization estimates for 2005. Adv Data. 2007 Jun;388(388):1–15. PMID:17784725
2. Monto AS. Epidemiology of viral respiratory infection. Am J Med 2002; 112 (suppl 6ª): 4S-12S. https://doi.org/10.1016/S0002-9343(01)01058-0.
3. Heikkinen T, Järvinen A. The common cold. Lancet. 2003 Jan;361(9351):51–9. https://doi.org/10.1016/S0140-6736(03)12162-9 PMID:12517470
4. Tait AR, Malviya S. Anesthesia for the child with an upper respiratory tract infection: still a dilemma? Anesth Analg. 2005 Jan;100(1):59–65. https://doi.org/10.1213/01.ANE.0000139653.53618.91 PMID:15616052
5. Bramley TJ, Lerner D, Sames M. Productivity losses related to the common cold. J Occup Environ Med. 2002 Sep;44(9):822–9. https://doi.org/10.1097/00043764-200209000-00004 PMID:12227674
6. Monto AS, Ullman BM. Acute respiratory illness in an American community. The Tecumseh study. JAMA. 1974 Jan;227(2):164–9. https://doi.org/10.1001/jama.1974.03230150016004 PMID:4357298
7. Lee BJ, August DA. COLDS: A heuristic preanesthetic risk score for children with upper respiratory tract infection. Paediatr Anaesth. 2014 Mar;24(3):349–50. https://doi.org/10.1111/pan.12337 PMID:24372849
8. Jacoby DB, Hirshman CA. General anesthesia in patients with viral respiratory infections: an unsound sleep? Anesthesiology. 1991 Jun;74(6):969–72. https://doi.org/10.1097/00000542-199106000-00001 PMID:2042787
9. Malisse M, Habre W. [Pediatric anesthesia and upper respiratory tract infections]. Rev Med Suisse. 2010 Feb;6(237):380–3. PMID:20383966
10. Becke K. Anesthesia in children with a cold. Curr Opin Anaesthesiol. 2012 Jun;25(3):333–9. https://doi.org/10.1097/ACO.0b013e3283534e80 PMID:22499163
11. Miller RD. Miller’s anesthesia. 8th ed. Philadelphia (PA): Saunders/Elsevier; 2015.
12. Stoelting RK. Stoelting’s anesthesia and co-existing disease. 6th ed. Philadelphia (PA): Saunders/Elsevier; 2012.
13. Tait AR, Malviya S, Voepel-Lewis T, Munro HM, Seiwert M, Pandit UA. Risk factors for perioperative adverse respiratory events in children with upper respiratory tract infections. Anesthesiology. 2001 Aug;95(2):299–306. https://doi.org/10.1097/00000542-200108000-00008 PMID:11506098
14. Miller MR, Zhan C. Pediatric patient safety in hospitals: a national picture in 2000. Pediatrics. 2004 Jun;113(6):1741–6. https://doi.org/10.1542/peds.113.6.1741 PMID:15173500
15. Bhananker SM, Ramamoorthy C, Geiduschek JM, Posner KL, Domino KB, Haberkern CM, et al. Anesthesia-related cardiac arrest in children: update from the Pediatric Perioperative Cardiac Arrest Registry. Anesth Analg. 2007 Aug;105(2):344–50. https://doi.org/10.1213/01.ane.0000268712.00756.dd PMID:17646488
16. Parnis SJ, Barker DS, Van Der Walt JH. Clinical predictors of anaesthetic complications in children with respiratory tract infections. Paediatr Anaesth. 2001 Jan;11(1):29–40. https://doi.org/10.1046/j.1460-9592.2001.00607.x PMID:11123728
17. Mamie C, Habre W, Delhumeau C, Argiroffo CB, Morabia A. Incidence and risk factors of perioperative respiratory adverse events in children undergoing elective surgery. Paediatr Anaesth. 2004 Mar;14(3):218–24. https://doi.org/10.1111/j.1460-9592.2004.01169.x PMID:14996260
18. Tomaske M, Gerber AC, Weiss M. Anesthesia and periinterventional morbidity of rigid bronchoscopy for tracheobronchial foreign body diagnosis and removal. Paediatr Anaesth. 2006 Feb;16(2):123–9. https://doi.org/10.1111/j.1460-9592.2005.01714.x PMID:16430406
19. Malviya S, Voepel-Lewis T, Siewert M, Pandit UA, Riegger LQ, Tait AR. Risk factors for adverse postoperative outcomes in children presenting for cardiac surgery with upper respiratory tract infections. Anesthesiology. 2003 Mar;98(3):628–32. https://doi.org/10.1097/00000542-200303000-00009 PMID:12606905
20. Rolf N, Coté CJ. Frequency and severity of desaturation events during general anesthesia in children with and without upper respiratory infections. J Clin Anesth. 1992 May-Jun;4(3):200–3. https://doi.org/10.1016/0952-8180(92)90065-9 PMID:1610574
21. von Ungern-Sternberg BS, Saudan S, Petak F, Hantos Z, Habre W. Desflurane but not sevoflurane impairs airway and respiratory tissue mechanics in children with susceptible airways. Anesthesiology. 2008 Feb;108(2):216–24. https://doi.org/10.1097/01.anes.0000299430.90352.d5 PMID:18212566
22. Lerman J, Jöhr M. Inhalational anesthesia vs total intravenous anesthesia (TIVA) for pediatric anesthesia. Paediatr Anaesth. 2009 May;19(5):521–34. https://doi.org/10.1111/j.1460-9592.2009.02962.x PMID:19453585
23. Tait AR, Pandit UA, Voepel-Lewis T, Munro HM, Malviya S. Use of the laryngeal mask airway in children with upper respiratory tract infections: a comparison with endotracheal intubation. Anesth Analg. 1998 Apr;86(4):706–11. https://doi.org/10.1213/00000539-199804000-00006 PMID:9539588
24. Cohen MM, Cameron CB. Should you cancel the operation when a child has an upper respiratory tract infection? Anesth Analg. 1991 Mar;72(3):282–8. https://doi.org/10.1213/00000539-199103000-00002 PMID:1994755
25. Tait AR, Malviya S. Anesthesia for the child with an upper respiratory tract infection: still a dilemma? Anesth Analg. 2005 Jan;100(1):59–65. https://doi.org/10.1213/01.ANE.0000139653.53618.91 PMID:15616052
26. Coté CJ. The upper respiratory tract infection (URI) dilemma: fear of a complication or litigation? Anesthesiology. 2001 Aug;95(2):283–5. https://doi.org/10.1097/00000542-200108000-00006 PMID:11506096
27. Tait AR, Voepel-Lewis T, Munro HM, Gutstein HB, Reynolds PI. Cancellation of pediatric outpatient surgery: economic and emotional implications for patients and their families. J Clin Anesth. 1997 May;9(3):213–9. https://doi.org/10.1016/S0952-8180(97)00032-9 PMID:9172029
28. Tait AR, Reynolds PI, Gutstein HB. Factors that influence an anesthesiologist’s decision to cancel elective surgery for the child with an upper respiratory tract infection. J Clin Anesth. 1995 Sep;7(6):491–9. https://doi.org/10.1016/0952-8180(95)00087-X PMID:8534467
29. Berry FA. Preexisting medical conditions of pediatric patients. Semin Anesth. 1984;3:24–31.
30. Lee LK. Validation of the COLDS Score for Perioperative Respiratory Adverse Event Risk Assessment in the Pediatric Patient Presenting with Upper Respiratory Tract Infection. Permalink. UCLA; 2017.
31. Manual de crisis en anestesia y pacientes críticos SENSAR. Cassinello, Arnal, Gómez, Borshoff, España, 2015.
32. Gavel G, Walker R. Laryngospasm in anaesthesia. Royal Manchester Children’s Hospital Oxford Road. Continuing Education in Anaesthesia, Critical Care & Pain j Volume 14 Number 2 2014. https://doi.org/10.1093/bjaceaccp/mkt031.
33. Westhorpe RN, Ludbrook GL, Helps SC, Runciman WB. Crisis management during anaesthesia: Bronchospasm. Australian Patient Safety Foundation; 2005.
34. Update on the Management of Laryngospasm. Actualidades en el manejo del laringoespasmo en pediatria Enrique Hernández-Cortez MD Comisionado editor de la Revista Anestesia en Mexico. Federación Mexicana de Colegios de Anestesiología AC. León Guanajuato, México. ournal Anesthesia and Critical care: Open access. 2018;8(6):1-6.
35. Coté and Lerman’s. A Practice of Anesthesia for Infants and Children. 6th ed. 2018.
36. American Society of Anesthesiologists and Anesthesia Patient Safety Foundation Joint Statement on Elective Surgery/Procedures and Anesthesia for Patients after COVID-19 Infection Published: March 9, 2021 Last updated: February 22, 2022.
37. https://www.cdc.gov/coronavirus/2019-ncov/hcp/duration-isolation.html . Accessed February 15, 2022.
38. COVID-19 Surg Collaborative. GlobalSurg Collaborative. Timing of surgery following SARS-CoV-2 infection: an international prospective cohort study. Anaesthesia. 2021.
39. Deng JZ, Chan JS, Potter AL, Chen YW, Sandhu HS, Panda N, et al. The risk of postoperative complications after major elective surgery in active or resolved COVID-19 in the United States. Ann Surg. 2022 Feb;275(2):242–6. https://doi.org/10.1097/SLA.0000000000005308 PMID:34793348

 ORCID
ORCID

 Creative Commons Attribution
Creative Commons Attribution