Silvina Longo1,*, Fernando Dominela2, Ana Lucía Arnaiz2, Federico Perrote3, Natacha Brochero3, Marcela Flores4, Gonzalo Alvarez Cuevas5, Juan Carlos de Battista5
Recibido: 10-09-2022
Aceptado: 06-06-2022
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 5 pp. 572-578|https://doi.org/10.25237/revchilanestv5105071158
PDF|ePub|RIS
Abstract
Resection of tumoral lesions anatomically related to motor, sensitive and language areas of the brain, have the main goal of sparing those areas. For that purpose, Neurosurgery on awake patients helps in reducing the size of growing brain tumors in a safe manner, which leads to extending and improving quality of life. Therefore, the greatest benefit lies in maximizing tumor ex- traction while minimizing neurological injury. In this article, we review current evidence of the application of awake craniotomy, and we describe the anesthetic management that we perform during this type of procedures.
Resumen
La resección de lesiones tumorales relacionadas anatómicamente con las áreas motoras, sensitivas y especialmente las del lenguaje, tiene como objetivo principal la preservación de éstas. Para ello la neurocirugía con el paciente despierto puede ayudar a reducir de manera segura el tamaño de tumores cerebrales en crecimiento, lo que suele prolongar y mejorar la calidad de vida, verificando en tiempo real el resultado del acto quirúrgico. El mayor beneficio radica entonces en maximizar la extracción tumoral minimizando el daño neurológico. En este artículo revisamos la evidencia actual de la aplicación de la craneotomía en el paciente despierto y describimos el manejo anestésico que realizamos durante este procedimiento.
-
Introducción
La craneotomía despierta para resección de tumores cerebrales se divide en 3 fases secuenciales: craneotomía, mapeo despierto antes o a través de la resección tumoral y cierre[1],[2],[3],[4]. Se lleva a cabo para la localización y resección de tumores situados cerca de áreas elocuentes del cerebro, tales como el área motora del lenguaje (de Broca) o del área sensitiva del lenguaje (área de Wernicke) y las conexiones subcorticles o vías del lenguaje que trabajan en forma integral[5]. Esta técnica quirúrgica permite así la evaluación neurológica intraoperatoria que facilita la resección del tumor y minimiza la disfunción neurológica posoperatoria[6].
Del total de los tumores del sistema nervioso central, el glioma representa aproximadamente el 30% de todos y el 80% de los tumores malignos primarios[7],[8]. La supervivencia se prolonga en pacientes con gliomas sometidos a resección en comparación con la biopsia sola. Y además cuanto mayor sea el grado de resección, mejor será el resultado[9].
La técnica anestésica llamada: anestesia dormido/despierto/dormido (DDD), se usa principalmente para resección del glioma dada la incidencia, preferencia de ubicación (adyacentes a áreas elocuentes) y la característica infiltrativa de este tipo de tumor. Se han descripto diferentes técnicas anestésicas para cubrir las diferentes fases. La técnica con paciente despierto necesita no solo al anestesiólogo y neurocirujano comprometidos con la técnica, sino formar un equipo multidisciplinario con neurólogos y psiquiatras.
Se debe realizar una adecuada selección del paciente, que acepte despertar durante la cirugía. Es importante identificar si presentan algún grado de ansiedad, historia de convulsiones, vía aérea difícil anticipada, enfermedad pulmonar obstructiva crónica, apnea del sueño y obesidad[5].
La anestesia debe lograr una adecuada sedación, analgesia, estabilidad respiratoria y hemodinámica. Durante la segunda fase el paciente permanece sedado, pero lo suficientemente despierto como para realizar las pruebas neurológicas[10].
El rol del anestesiólogo en este tipo de cirugías es muy importante y debe establecerse una adecuada relación médico- paciente. Por este motivo, la consulta con anestesia se debe realizar tempranamente. Esta entrevista prequirúrgica alivia la ansiedad y logra una mayor cooperación durante la craneoto- mía. Los pacientes realizaron una visita al quirófano acompañados por un familiar cercano, para que no imaginen el lugar, sino que lo conozcan. Es muy importante el entrenamiento preoperatorio para que el paciente se acostumbre al ambiente característico del quirófano, evitando así situaciones de angustia o malestar que afecten el curso de la cirugía. En esta instancia el paciente conoce a su anestesiólogo, la circulante e instrumen- tadora que lo asistirán el día de la cirugía. Es el momento ideal para que los profesionales brinden toda la información posible, atendiendo dudas; proporcionando seguridad y confianza.
En la visita prequirúrgica, realizada en forma temprana, discutimos honestamente posibles sensaciones negativas (sequedad de boca, dolor durante las manipulaciones, frío o calor), y cómo corregirlos. Simulamos su posicionamiento en la mesa de operaciones. La preparación psicológica previa y el establecimiento de una relación de confianza entre el paciente y el personal quirúrgico, permite evitar sedantes en exceso como por ejemplo midazolam que luego retrasan el despertar.
Se han reportado eventos adversos durante el período pe- rioperatorio, que requieren intervención, y algunas veces el procedimiento debe ser convertido a Anestesia general, ya sea por falta de cooperación o agitación del paciente. O dificultades con la utilización de la Máscara larínea (ML) como macroglo- sia[11]. En equipos con gran experiencia el fallo de la técnica es del 2%[12].
En la Tabla 1 se presentan posibles complicaciones y su tratamiento.
Diferentes combinaciones de anestésicos y técnicas han sido reportadas para la craneotomía con paciente despierto. Sin embargo, todavía no existe un consenso sobre el régimen óptimo[13].
Durante la fase despierto se realiza electrocorticografía, estimulación cortical, mapeo cerebral de áreas elocuentes y estimulación neuropsicológica transquirúrgica. La participación del neurólogo en el intraoperatorio contribuye a disminuir la ansiedad.
En todos los casos realizamos la técnica DDD, se utilizó anestesia endovenosa, pero en la última fase sin volver a colocar un dispositivo para el manejo de la vía aérea. Realizando de esta forma, la última etapa en ventilación espontánea.
-
Materiales y Métodos
Presentamos nuestra experiencia con 10 pacientes portadores de tumor cerebral.
Tabla 1. Posibles complicaciones durante la fase del despertar y su tratamiento
| Posibles complicaciones durante el despertar | Tratamiento |
| Control hemodinámico | Evitar: TA > 160/90 mmHg
TA sistólico < 90 Considerar drogas como noradrenalina/nitroglicerina |
| Profilaxis antiemética | Ondasetron 4 mg, Metoclopramida 10 mg Propofol 10 a 20 mg |
| Profilaxis de las convulsiones | Suspender la estimulación eléctrica
Colocar solución salina helada local Midazolam 1 a 2 mg , Propofol 10 a 20 mg. Si persisten: Protección de la vía aérea, intubación orotraqueal |
| Control respiratorio: hipercapnia, apnea, hipoxemia | En la primera etapa óptima ventilación. En la tercera etapa, adecuar drogas anestésicas, aumentar la oxigenación |
| Técnica anestésica inadecuada, ansiedad, dolor, exitación, toxicidad por anestésicos locales, disconfort | Optimizar la temperatura, aliviar el dolor (mejorando el abordaje quirúrgico o medicando con bajas dosis de opiodes o antiinflamatorios no esteroideos), conversar con el paciente, aumenar la sedación |
| Factores quirúrgicos: sangrado, déficit neurológico focal, embolia venosa aérea, afasia | Comunicación con el equipo neuroquirúrgico, pasar a anestesia general |
| Factores mentales o psicológicos: fatiga, exitación, pérdida de la colaboración | Asegurar un buen descanso la noche previa. Comunicación con el equipo, aumentar la sedación, analgesia o pasar a anestesia general |
El promedio de edad fue de 34, el menor de 23 años y el mayor de 47 años. Como comorbilidades, 4 pacientes tenían antecedentes de convulsiones, 3 sobrepeso y 2 con obesidad tipo II.
Los tumores predominantes fueron lesiones temporales izquierda, oligodendroglioma de bajo grado y moderado grado. Un paciente era portador de tumor cerebral frontal izquierdo (astrocitoma difuso grado 2), manifestado con crisis convulsivas tónico-clónicas generalizadas y con síntomas cognitivos transitorios (trastornos del lenguaje). Diagnóstico con resonancia magnética (Figura 1a y b). Consumidor frecuente de marihuana, ocacional de cocaína y éxtasis. Estuvo 24 h en UCI y recibió el alta al 3er día de la cirugía. Recibió apoyo del equipo de psiquiatría en el pre y posoperatorio.
Los demás pacientes, permanecieron en promedio, 36 h en unidad de cuidados intensivos (UCI) y el alta hospitalaria fue entre el segundo y tercer día.
Ninguno de los pacientes había realizado quimio ni radioterapia preoperatoria.
El día de la cirugía y luego de la inducción, se colocó una vía venosa periférica y se procedió a anestesia general endovenosa, luego se colocó vía arterial, sonda vesical, adecuados apoyos en brazos y piernas, manta térmica y termómetro de piel. También monitor cerebral biespectral (BIS) y para la etapa del despertar cánula nasal con capnografía.
En todos los pacientes se utilizó anestesia endovenosa y se mantuvieron estables hemodinámicamente. Todos recibieron levetiracetam, como tratamiento y profilaxis de convulsiones.
Luego de la inducción se realizó anestesia local. Para lograr una adecuada analgesia tanto intra como posoperatoria se realizó un bloqueo tipo “scalp block” o “bloqueo regional del cuero cabelludo” bilateral. El mismo fue llevado a cabo mediante la aplicación de ropivacaína 0,5% con epinefrina 5 ug/ml. La técnica estándar del bloqueo regional del cuero cabelludo es realizada por infiltración dirigida de 2 a 3 ml de anestésico local (AL) por sitio, con el fin de bloquear los 6 nervios encargados de la inervación del cuero cabelludo: supraorbitario, supratroclear, cigomaticotemporal, auriculotemporal, occipital mayor, occipital menor y tercer occipital.
Primero, los nervios supraorbitario y supratroclear son bloqueados a medida que emergen de la órbita con infiltración por encima de la ceja. El nervio auriculotemporal y sus ramas son bloqueados con inyección anterior y posterior al oído, aproximadamente al nivel del trago. Finalmente, los nervios occipitales mayores, menores y terceros son bloqueados juntos con una sola inyección de AL a lo largo de la línea nucal superior, en el punto medio entre el Inión y el proceso mastoideo.
Opcionalmente, el nervio cigomático-temporal también puede bloquearse, con una inyección de AL lateral a la órbi- ta[14].
La anestesia local es uno de los pasos claves de la técnica despierto para craneotomía. El bloqueo de la sensibilidad del cuero cabelludo logra que la cirugía sea tolerable para el paciente y asegura altos niveles de satisfacción durante y después de la cirugía. Alternativamente, se puede realizar infiltración local del sitio quirúrgico y donde se coloca el cabezal de Mayfield. El bloqueo nervioso es técnicamente más desafiante y tiene una mayor tasa de complicaciones en comparación con la infiltración en el sitio quirúrgico, pero requiere dosis totales más bajas de AL[15]. Con el objetivo de lograr anestesia por un periodo mayor a 5 h optamos por el bloqueo nervioso[16]. También se realizó infiltración de la duramadre con lidocaina.
En la primera etapa se realizó la inducción con midazolam 2 mgrs, fentanilo 2 ug/kg y propofol 2 mg/kg, se colocó ML supreme, a través de la cual es aspiró el líguido estomacal. Se continuó con anestesia endovenosa con Propofol 4 a 5 ug/kg/h, remifentanilo 0,05 a 0,2 mg/kg/min y dexmedetomidina 0,4 mg/kg/h (Figura 2).
-
Resultados
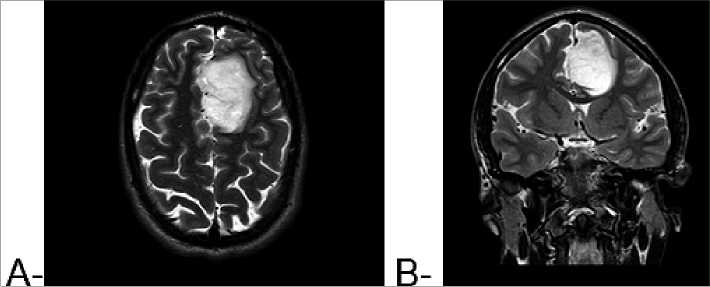
Figura 1. Resonancia magnética de cerebro, secuencia T2 hiperintenso, (A) a nivel frontal izquierdo en area premotora; (B) con efecto de masa sobre el cuerpo calloso.
Durante la fase del despertar se suspendieron propofol y remifentanilo. Se proporcionó una adecuada ansiólisis con el uso de dexmedetomidina a dosis de perfusión mínimas, entre 0,1 a 0,2 pg/kg/h durante el período despierto, lo cual permitió tener a los pacientes sedados, pero lo suficientemente despiertos como para responder a las pruebas neurológicas. Dexmede- tomidina aportó analgesia sin riesgo de depresión respiratoria.
El despertar se produjo a los 20 a 30 min con BIS de 75 a 77 y las pruebas neurológicas recién se comenzaron con BIS de 90 o superior (Figura 3 y 4).
Se eligieron pruebas específicas que valoraron funciones motoras, lenguaje y cognición social. Los distintos componentes del lenguaje fueron evaluados mediante la aplicación del Test de Nominación de Boston versión español e inglés[17],[18] y test pirámides y palmeras[18],[19]. Las pruebas de cognición social y teoría de la mente empleadas fueron el test de reconocimiento facial y test la mente en los ojos[20] (Figura 5).
Los pacientes estuvieron confortables y colaboradores. Manifestaron sequedad de boca, que se atendió inmediatamente. Una de las pacientes presentó 2 episodios de crisis convulsivas parciales simples (síntomas sensitivos en cara y miembro superior izquierdo) que cedieron, inmediatamente, solo con agua helada local).
Luego en la última etapa los pacientes vuelven a recibir anestesia con propofol/remifentanilo/dexmedetomidina en dosis suficientes para mantener BIS de aproximadamente 65 y permanecieron recibiendo oxígeno por la cánula nasal con capnografía, respirando espontáneamente, sin necesidad de colocar ML o tubo endotraqueal.
La recuperación anestésica se realizó sin complicaciones en la UCI, donde permanecieron en promedio 24 a 36 h y luego en el piso hasta el alta definitiva, con un total de tres días, sin secuelas. A los 10 pacientes se les realizó una resonancia magnética nuclear de control y fueron dados de alta con levetirace- tam y dexamentasona.
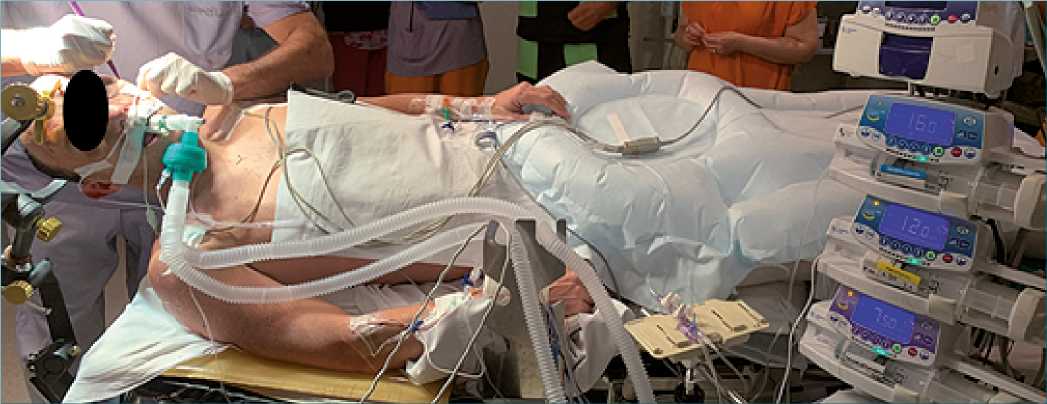
Figura 2. Paciente durante fase 1, AG: Remifentanilo/propofol/dexmedetomidina.
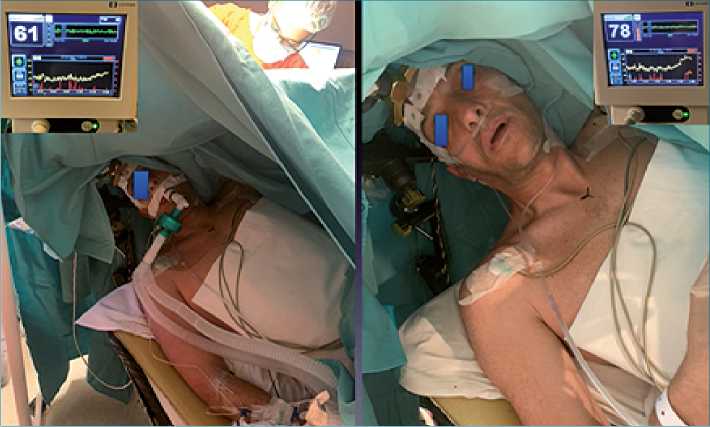
Figura 3. Primera fase dormido BIS 61 con ML supreme. Luego en el comienzo de la segunda fase ML se retira con BIS de 78.
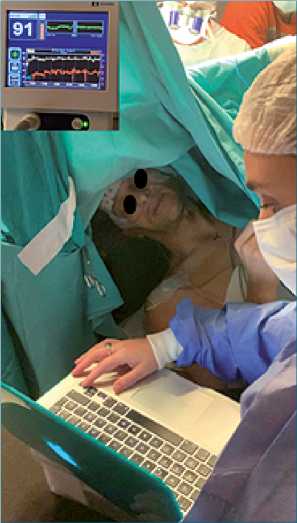
Figura 4. Fase despierto BIS 91, realizando test neurológico.
En ningún caso se necesitaron utilizar drogas vasopreso- ras. La hipotensión es poco común, especialmente durante la fase de vigilia. La dosis total de vasopresores es mucho menor que la requerida durante la anestesia general[21]. Por lo tanto, dependiendo de la técnica anestésica utilizada, la craneotomía despierta puede causar menos alteraciones fisiológicas que la AG, especialmente si se usan dosis más bajas de medicamentos debido a la combinación de anestesia locorregional y general endovenosa.
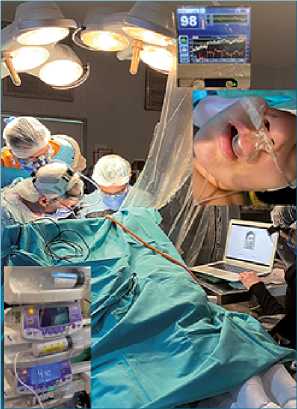
Figura 5. Durante la fase del despertar con Bis 98, recibiendo dexme- detomidina a 0,2 ug/kg/h y oxígeno por cánula nasal con capnografía, realizando pruebas de reconocimiento de emociones.
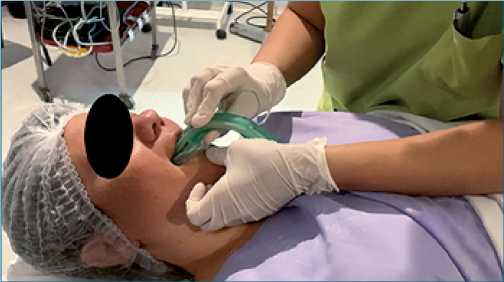
Figura 6. Colocación de ML supreme desde un plano frontal.
-
Discusión
Los procedimientos neuroquirúrgicos para tratamiento de tumores cerebrales en áreas funcionales son cada vez más frecuentes. Especialmente, los tumores gliales suelen alojarse en zonas elocuentes y necesitan del despertar intraoperatorio. Los avances en genética, neurociencias cognitivas, imágenes y tratamientos revolucionaron la comprensión de los tumores primarios de origen glial e inhibieron dogmas como por ejemplo el de “biopsia y observación”[22]. El objetivo principal del glioma cerebral no es (todavía) curar el tumor, sino ser preventivo, retrasando la transformación maligna el mayor tiempo posible mientras se preserva una óptima calidad de vida[23].
Las ventajas de utilizar la técnica DDD versus la resección bajo AG es la reducción de días de internación (4 vs 9 días), disminución de riesgos de infección nosocomial, menores complicaciones tromboembólicas y disminución de los intervalos entre la cirugía y el comienzo de quimio o radioterapia[24].
La mayor probabilidad de resección total sin daño adyacente se asocia con una mejor supervivencia, tasas más bajas de disfunción neurológica postoperatoria versus resección bajo AG (7% vs 23%)[25].
El objetivo principal de la resección quirúrgica de cualquier tumor es para curar o reducir la neoplasia. A este respecto, la suposición implícita es que la cirugía está asociada con un resultado beneficioso. Sin embargo, la creciente evidencia sugiere que la cirugía también puede generar resultados oncológicos desfavorables. Entre los agentes anestésicos, el propofol presenta propiedades favorables para la cirugía tumoral. No suprime la actividad de las células natural killer, inhibe la actividad de la ciclooxigenasa y suprime la producción de prostaglandina E2. Favorablemente, mantiene la relación periférica de linfocitos T auxiliares (T helper 1 a T helper 2) en pacientes sometidos a craneotomía para resección tumoral. Por lo tanto, el propofol puede mejorar la inmunidad antitumoral, además tiene propiedades antiinflamatorias y antioxidantes[26],[27].
El neurocirujano necesita que el paciente permanezca despierto y cooperador durante la monitorización cerebral y la exéresis de la lesión. A pesar de la alta eficacia del bloqueo del cuero cabelludo y los opioides, el dolor sigue siendo un factor adverso común en la craneotomía despierta. La principal solución a este problema puede ser un cambio en abordaje quirúrgico: acceso transcortical, evitar la tracción de los vasos y de las estructuras de la base del cráneo[28]. Y como otra alternativa utilizar analgésicos no esteroideos u opiodes en bajas dosis. Además, el cirujano realizó infiltración adicional sobre la base del colgajo miocutáneo y colocó algodones con anestésico local sobre la duramadre. Esto permitió un adecuado control del dolor durante el acto quirúrgico.
Como el cráneo se encuentra inmóvil por la sujeción con el cabezal Mayfield, se limita la movilización del cuello y la cabeza durante la cirugía y se dificulta una adecuada intubación en la tercera fase de la cirugía. Razón por la cual, y para lograr una adecuada transición hacia el despertar final, decidimos no manipular la vía aérea durante la tercera fase de la cirugía; optamos por continuar oxigenando al paciente a través de la cánula nasal y profundizar el plano anestésico endovenoso, ventilando espontáneamente. En caso de necesidad consideramos como primera opción la colocación de ML Supreme, por su cuerpo rígido que permite la colocación desde un plano frontal al paciente (Figura 6).
Para realizar las pruebas funcionales del lenguaje durante la vigilia, los pacientes deben estar completamente despiertos y cooperativos con concentraciones plasmáticas de propofol tan bajas como 0,8 ug/ ml[29].
Las convulsiones durante la cirugía son la principal preocupación, en un paciente despierto sin una vía aérea segura es un gran desafío. Sin embargo, con una solución helada local y/o un pequeño bolo de propofol, la mayoría de las convulsiones intraoperatorias se resuelven sin consecuencias[30].
La evaluación del estado mental es compleja e incluye diferentes aspectos, como la evaluación inicial de elegibilidad, preparación y apoyo, seguido de la evaluación posoperatoria y el posible tratamiento de efectos secundarios negativos, como ansiedad, despersonalización, depresión o estrés postraumáticos (EPT) que puedan ser causados por la cirugía. Se deben considerar los criterios individuales y familiares antes de someterse al procedimiento. Las respuestas del paciente y la familia permiten desarrollar un plan individual de preparación y apoyo. Se observa una mejor experiencia del procedimiento en compa
ración con otros, que no se sometieron a estas preparaciones preoperatorias. Una preparación mental completa aumentó la tolerancia del procedimiento quirúrgico y evitó que los pacientes sufrieran EPT[31],[32],[33].
-
Conclusiones
La craneotomía despierta con mapeo cortical intraoperatorio es la técnica de elección para cirugía tumoral de áreas elocuentes intracraneal.
La aceptación y entendimiento del procedimiento por el paciente es absolutamente necesario. Una vez que se involucró, es muy importante que esté bien motivado y comprenda que su colaboración es fundamental. De su actitud depende, en parte, el éxito quirúrgico. Además, es muy importante el trabajo en equipo y multidisciplinar que realizan los profesionales de la salud, cirujanos, anestesiólogos, neurólogos y psiquiatras.
Una cirugía exitosa depende de la adecuada selección y colaboración del paciente, que se logren óptimas condiciones quirúrgicas. Brindar seguridad al paciente sobre el control de la vía aérea y estar preparado para prevenir cualquier posible complicación, lograr que el paciente esté confortable, con adecuados apoyos, temperatura ideal, con correcta analgesia. Debe existir una excelente comunicación entre el anestesiólogo, cirujano y neurofisiólogo. Todo el equipo quirúrgico debe estar atento a las diferentes fases de la cirugía.
Con esta técnica anestésica logramos que el paciente esté dormido en la etapa inicial más dolorosa, controlar la vía aérea evitando la hipercapnia y por lo tanto la hipertensión endocraneal. Y al final, un paciente que vuelve a recibir AG logra mejorar el confort e impedir un paciente exhausto.
La neurocirugía con el paciente despierto constituye uno de los mejores ejemplos de trabajo en equipo y multidisciplinar. La labor conjunta de todos los profesionales que forman el equipo contribuye al éxito de la técnica.
Para finalizar vamos a citar una frase del Dr. Hugues Duffau: “En la era de la medicina basada en la evidencia, es crucial no olvidar la medicina basada en el individuo”.
Referencias
1. Piccioni F, Fanzio M. Management of anesthesia in awake craniotomy. Minerva Anestesiol. 2008 Jul-Aug;74(7-8):393–408. PMID:18612268
2. Nossek E, Matot I, Shahar T, Barzilai O, Rapoport Y, Gonen T, et al. Failed awake craniotomy: a retrospective analysis in 424 patients undergoing craniotomy for brain tumor. J Neurosurg. 2013 Feb;118(2):243–9. https://doi.org/10.3171/2012.10.JNS12511 PMID:23121432
3. Hansen E, Seemann M, Zech N, Doenitz C, Luerding R, Brawanski A. Awake craniotomies without any sedation: the awake-awake-awake technique. Acta Neurochir (Wien). 2013 Aug;155(8):1417–24. https://doi.org/10.1007/s00701-013-1801-2 PMID:23812965
4. Huncke K, Van de Wiele B, Fried I, Rubinstein EH. The asleep-awake-asleep anesthetic technique for intraoperative language mapping. Neurosurgery. 1998 Jun;42(6):1312–6. https://doi.org/10.1097/00006123-199806000-00069 PMID:9632190
5. Garavaglia MM, Das S, Cusimano MD, Crescini C, Mazer CD, Hare GM, et al. Anesthetic approach to high-risk patients and prolonged awake craniotomy using dexmedetomidine and scalp block. J Neurosurg Anesthesiol. 2014 Jul;26(3):226–33. https://doi.org/10.1097/ANA.0b013e3182a58aba PMID:24064713
6. De Witt Hamer PC, Robles SG, Zwinderman AH, Duffau H, Berger MS. Impact of intraoperative stimulation brain mapping on glioma surgery outcome: a meta-analysis. J Clin Oncol. 2012 Jul;30(20):2559–65. https://doi.org/10.1200/JCO.2011.38.4818 PMID:22529254
7. Ostrom QT, Gittleman H, Farah P, Ondracek A, Chen Y, Wolinsky Y, et al. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2006-2010. Neuro-oncol. 2013 Nov;15 Suppl 2:ii1–56. https://doi.org/10.1093/neuonc/not151 PMID:24137015
8. Goodenberger ML, Jenkins RB. Genetics of adult glioma. Cancer Genet. 2012 Dec;205(12):613–21. https://doi.org/10.1016/j.cancergen.2012.10.009 PMID:23238284
9. Laws ER, Parney IF, Huang W, Anderson F, Morris AM, Asher A, et al.; Glioma Outcomes Investigators. Survival following surgery and prognostic factors for recently diagnosed malignant glioma: data from the Glioma Outcomes Project. J Neurosurg. 2003 Sep;99(3):467–73. https://doi.org/10.3171/jns.2003.99.3.0467 PMID:12959431
10. Deras P, Moulinié G, Maldonado IL, Moritz-Gasser S, Duffau H, Bertram L. Intermittent general anesthesia with controlled ventilation for asleep-awake-asleep brain surgery: a prospective series of 140 gliomas in eloquent areas. Neurosurgery. 2012 Oct;71(4):764–71. https://doi.org/10.1227/NEU.0b013e3182647ab8 PMID:22989957
11. Cormack J, Karna S. Macroglossia During Awake Craniotomy: A Near Miss. J Neurosurg Anesthesiol. 2018 Oct;30(4):383–4. https://doi.org/10.1097/ANA.0000000000000465 PMID:29045270
12. Sewell D, Smith M. Awake craniotomy: anesthetic considerations based on outcome evidence. Curr Opin Anaesthesiol. 2019 Oct;32(5):546–52. https://doi.org/10.1097/ACO.0000000000000750 PMID:31107256
13. Meng L, Berger MS, Gelb AW. The potential benefits of awake craniotomy for brain tumor resection: an anesthesiologist’s perspective. J Neurosurg Anesthesiol. 2015 Oct;27(4):310–7. https://doi.org/10.1097/ANA.0000000000000179 PMID:25811363
14. Guilfoyle MR, Helmy A, Duane D, Hutchinson PJ. Regional scalp block for postcraniotomy analgesia: a systematic review and meta-analysis. Anesth Analg. 2013 May;116(5):1093–102. https://doi.org/10.1213/ANE.0b013e3182863c22 PMID:23477962
15. Potters JW, Klimek M. Local anesthetics for brain tumor resection: current perspectives. Local Reg Anesth. 2018 Feb;11:1–8. https://doi.org/10.2147/LRA.S135413 PMID:29440926
16. Jayaram K, Srilata M, Kulkarni D, and Ramachandran G. Regional Anesthesia to Scalp for Craniotomy: Innovation With Innervation. J Neurosurg Anesthesiol. Volume 28, Number 1, January 2016 Kaplan, E. F., Goodglass, H., & Weintraub, S. The Boston naming test. Philadelphia: Lippincott Williams & Wilkins, 1983-2001.
17. Kinoshita M, Miyashita K, Tsutsui T, Furuta T, Nakada M. Critical Neural Networks in Awake Surgery for Gliomas. Neurol Med Chir (Tokyo). 2016 Nov;56(11):674–86. https://doi.org/10.2176/nmc.ra.2016-0069 PMID:27250817
18. Howard D, Patterson K. Pyramids and palm trees: A test of semantic access from picture and words. Bury St. Edmunds: Thames Valley Publishing; 1992.
19. Baron-Cohen S, Wheelwright S, Hill J, Raste Y, Plumb I. The “Reading the Mind in the Eyes” Test revised version: a study with normal adults, and adults with Asperger syndrome or high-functioning autism. J Child Psychol Psychiatry. 2001 Feb;42(2):241–51. https://doi.org/10.1111/1469-7610.00715 PMID:11280420
20. Rajan S, Cata JP, Nada E, Weil R, Pal R, Avitsian R. Asleep-awake-asleep craniotomy: a comparison with general anesthesia for resection of supratentorial tumors. J Clin Neurosci. 2013 Aug;20(8):1068–73. https://doi.org/10.1016/j.jocn.2012.09.031 PMID:23453156
21. Duffau H, Lopes M, Arthuis F, Bitar A, Sichez JP, Van Effenterre R, et al. Contribution of intraoperative electrical stimulations in surgery of low grade gliomas: a comparative study between two series without (1985-96) and with (1996-2003) functional mapping in the same institution. J Neurol Neurosurg Psychiatry. 2005 Jun;76(6):845–51. https://doi.org/10.1136/jnnp.2004.048520 PMID:15897509
22. Duffau H. Diffuse Low-Grade Gliomas in Adults ISBN 978- 1-4471- 2212-8. DOI Springer London Heidelberg New York Dordrecht Library of Congress Control Number: 2013934834 https://doi.org/10.1007/978-1-4471-2213-5.
23. Brown T, Shah AH, Bregy A, Shah NH, Thambuswamy M, Barbarite E, et al. Awake craniotomy for brain tumor resection: the rule rather than the exception? J Neurosurg Anesthesiol. 2013 Jul;25(3):240–7. https://doi.org/10.1097/ANA.0b013e318290c230 PMID:23603885
24. Melamed R, Bar-Yosef S, Shakhar G, Shakhar K, Ben-Eliyahu S. Suppression of natural killer cell activity and promotion of tumor metastasis by ketamine, thiopental, and halothane, but not by propofol: mediating mechanisms and prophylactic measures. Anesth Analg. 2003 Nov;97(5):1331–9. https://doi.org/10.1213/01.ANE.0000082995.44040.07 PMID:14570648
25. Nossek E, Matot I, Shahar T, Barzilai O, Rapoport Y, Gonen T, et al. Failed awake craniotomy: a retrospective analysis in 424 patients undergoing craniotomy for brain tumor. J Neurosurg. 2013 Feb;118(2):243–9. https://doi.org/10.3171/2012.10.JNS12511 PMID:23121432
26. Inada T, Kubo K, Kambara T, Shingu K. Propofol inhibits cyclo-oxygenase activity in human monocytic THP-1 cells. Can J Anaesth. 2009 Mar;56(3):222–9. https://doi.org/10.1007/s12630-008-9035-0 PMID:19247743
27. Kulikov A, Lubnin A. Kulicov A ans Lubnin A. Anesthesia for awake craniotomy. Curr Opin Anaesthesiol. 2018;31(5):506–10. https://doi.org/10.1097/ACO.0000000000000625.
28. Soehle M, Wolf CF, Priston MJ, Neuloh G, Bien CG, Hoeft A, et al. Propofol Pharmacodynamics and Bispectral Index During Key Moments of Awake Craniotomy. J Neurosurg Anesthesiol. 2018 Jan;30(1):32–8. https://doi.org/10.1097/ANA.0000000000000378 PMID:27681862
29. Hervey-Jumper SL, Li J, Lau D, Molinaro AM, Perry DW, Meng L, et al. Awake craniotomy to maximize glioma resection: methods and technical nuances over a 27-year period. J Neurosurg. 2015 Aug;123(2):325–39. https://doi.org/10.3171/2014.10.JNS141520 PMID:25909573
30. Eseonu CI, Rincon-Torroella J, ReFaey K, Lee YM, Nangiana J, Vivas-Buitrago T, et al. Awake Craniotomy vs Craniotomy Under General Anesthesia for Perirolandic Gliomas: Evaluating Perioperative Complications and Extent of Resection. Neurosurgery. 2017 Sep;81(3):481–9. https://doi.org/10.1093/neuros/nyx023 PMID:28327900
31. Santini B, Talacchi A, Casagrande F, et al. Eligibility criteria and psychological profiles in patient candidates for awake craniotomy: a pilot study. J Neurosurg Anesthesiol 2012; 24:209–216. https://doi.org/10.1097/ANA. 0b013e3182464aec
32. Whittle IR, Midgley S, Georges H, Pringle AM, Taylor R. Patient perceptions of “awake” brain tumour surgery. Acta Neurochir (Wien). 2005 Mar;147(3):275–7. https://doi.org/10.1007/s00701-004-0445-7 PMID:15627921
33. Howie E, Bambrough J, Karabatsou K, Fox JR. Patient experiences of awake craniotomy: An Interpretative Phenomenological Analysis. J Health Psychol. 2016 Nov;21(11):2612–23. https://doi.org/10.1177/1359105315581513 PMID:25943343

 ORCID
ORCID
 Creative Commons Attribution
Creative Commons Attribution