Luciano Bravo P. 1 , Linder Díaz Colmenarez 2 , Belkys Zambrano Ramón 2 , Juan Villanueva Gredilla 2 , Claudio Vargas 3 , Ricardo Fuentealba R. 3 ,4,*
Recibido: 10-11-2021
Aceptado: 21-11-2021
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 2 pp. 225-230|https://doi.org/10.25237/revchilanestv5110020951
PDF|ePub|RIS
Amniotic fluid embolism
Abstract
Amniotic fluid embolism (AFE) represents a challenge for the medical team. Due to its low incidence and high mortality, it is one of the most complex conditions to manage during pregnancy and delivery. Our objective is to present the case of a 36-year- old high-risk obstetric patient, who was taken to the ward for emergency cesarean section, during which she presented acute hemodynamic collapse during fetal extraction maneuvers. Based on the clinic, echocardiographic evaluation, and hemodynamic monitoring, a diagnosis of amniotic embolism was made. In the critical care unit, the evolution was favorable with a good maternal outcome. Although the understanding of this pathology has improved in the last decade, it is still associated with a high rate of maternal and perinatal morbidity and mortality. In patients with suspected AFE, the routine use of echocardiography within the ward should be encouraged whenever available, while in the ICU the use of advanced hemodynamic monitoring is essential. Management should be early, with immediate recognition and the presence of a multidisciplinary team being key factors that reduce mortality. In this work, we review the literature with emphasis on the pathophysiology, diagnosis, obstetric, anesthetic, and intensive care management of this pathology.
Resumen
La embolia de líquido amniótico (AFE) representa un desafío para el equipo médico. Debido a su baja incidencia y alta mortalidad es una de las condiciones más complejas de manejar durante el embarazo y el parto. Nuestro objetivo es presentar el caso de una paciente de 36 años de alto riesgo obstétrico, que es llevada a pabellón para cesárea de urgencia, quien durante las maniobras de extracción fetal presenta colapso hemodinámico agudo. Según clínica, evaluación ecocardiográfica y monitoreo hemodinámico, se plantea el diagnóstico de embolia amniótica. En la Unidad de cuidados críticos la evolución fue favorable con buen resultado materno. Si bien la comprensión de esta patología ha mejorado en la última década, sigue estando asociada a una alta tasa de morbimortalidad materna y perinatal. En pacientes con sospecha de AFE, se debe alentar el uso rutinario de la ecocardiografía dentro del pabellón siempre que se encuentre disponible, mientras que en UCI el uso de monitoreo hemodinámico avanzado es imprescindible. El manejo debe ser precoz, siendo el reconocimiento inmediato y la presencia de un equipo multidisciplinario factores claves que disminuyen la mortalidad. En este trabajo se hace una revisión bibliográfica con énfasis en la fisiopatología, diagnóstico, manejo obstétrico, anestésico y de cuidados intensivos de esta patología.
La embolia de líquido amniótico (AFE) representa un desafío para el equipo médico. Debido a su baja incidencia y alta mortalidad es una de las condiciones más complejas de manejar durante el embarazo y el parto. El diagnóstico es clínico, pero se han propuesto distintos marcadores tanto de laboratorio como histológicos como ayuda diagnóstica, sin embargo, ninguno es suficiente para confirmar o descartar el diagnóstico de AFE[1]. El manejo debe ser precoz, siendo el reconocimiento inmediato y la presencia de un equipo multidisciplinario factores claves que disminuyen la mortalidad[2]. En el presente trabajo presentamos un caso de AFE en el que se logró un resultado positivo principalmente debido al; 1.- reconocimiento precoz y 2.- manejo multidisciplinario usando soporte invasivo, monitoreo hemodinámico avanzado y rescate hemodinámico con drogas vasoactivas y hemofiltración de alto volumen (HFAV).
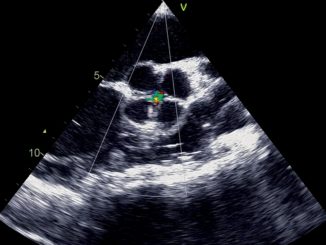
Se presenta el caso de una paciente de 36 años, triple cesárea anterior. Alérgica al paracetamol y benzocaína, sin antecedentes mórbidos y cursando un embarazo de 27+2 semanas. Es derivada a centro de referencia por metrorragia abundante del III trimestre, asociada a placenta previa oclusiva, con diagnóstico ecográfico de placenta increta como antecedente y sospecha de corioamnionitis. Con esquema de maduración fetal previamente cumplido. Se indica antibioticoterapia empírica y cesárea de urgencia. Ingresa a pabellón en donde se administra anestesia raquídea con 7,5 mg de bupivacaína hiperbárica al 0,75% + 10 gamma de fentanilo, sin incidentes y adecuado nivel anestésico. Durante los siguientes 10 minutos mantuvo una FC de 115 lpm, PAM 80 mmHg, SatO2 99%. Al realizar la histerotomía se pesquisa un líquido amniótico espeso y de mal olor por lo que se indica tratamiento antibiótico de primera línea para corioamnionitis. Inmediatamente posterior a la extracción fetal y en el momento de la extracción placentaria, la paciente presenta brusco dolor torácico, compromiso de conciencia con progresión hacia sopor profundo, hipotensión con PAM < 50 mmHg, pulso filiforme y caída de la SatO2 a 70%. De inmediato se activa protocolo de emergencia, con llamado a segundo anestesiólogo mientras se proporciona anestesia general con secuencia rápida usando 40 mg de propofol, 100 mg de succinilcolina, 100 mcg de fentanilo y una vez asegurada la vía aérea 30 mg de rocuronio, sin incidentes. Se mantuvo la anestesia con sevoflurano para índice biespectral (BIS) entre 40 y 60. Se invade con catéter venoso central (CVC) yugular derecho y línea radial izquierda con lo que se logra objetivar hipotensión con PAM de 50 mmHg y en consecuencia se inicia bomba de infusión de noradrenalina en dosis altas para lograr PAM de 70. Se realiza un ecocardiograma transtorácico intraoperatorio, limitado por ventana ecográfica de la paciente, con protocolo R.U.S.H, el cual muestra dilatación de cavidades derechas, contraste espontáneo en ventrículo derecho y ventrículo izquierdo con FEVI > 70% y signo del beso positivo. También se realiza ecografía pulmonar con protocolo B.L.U.E. la cual muestra un patrón de líneas B pulmonar en 4 cuadrantes, difuso y simétrico (Figura 1). Según clínica y hallazgos se plantea el diagnóstico diferencial de shock distributivo (anafiláctico) versus embolia am- niótica, se inicia manejo con 0,35 mg de adrenalina SC, 50 mg de ranitidina EV, 10 mg de clorfenamina EV, 100 mg de cortisol EV, 1 frasco de albúmina y 1 g de ácido tranexámico EV, además carga de volumen según metas dinámicas. Inmediatamente después la paciente evoluciona con hemorragia obstétrica no controlada con uterotónicos, por lo que se decide laparotomía exploratoria por alta sospecha de inercia uterina secundaria a incretismo.
Ante fracaso de técnicas hemostáticas convencionales se decide histerectomía obstétrica de urgencia conservándose ovarios, cursando con sangrado masivo de > 1,5 L en menos de 5 minutos, requiriendo 2 U de glóbulos rojos (GR) y 3 U de plasma fresco congelado (PFC) en forma empírica logrando control hemostático.
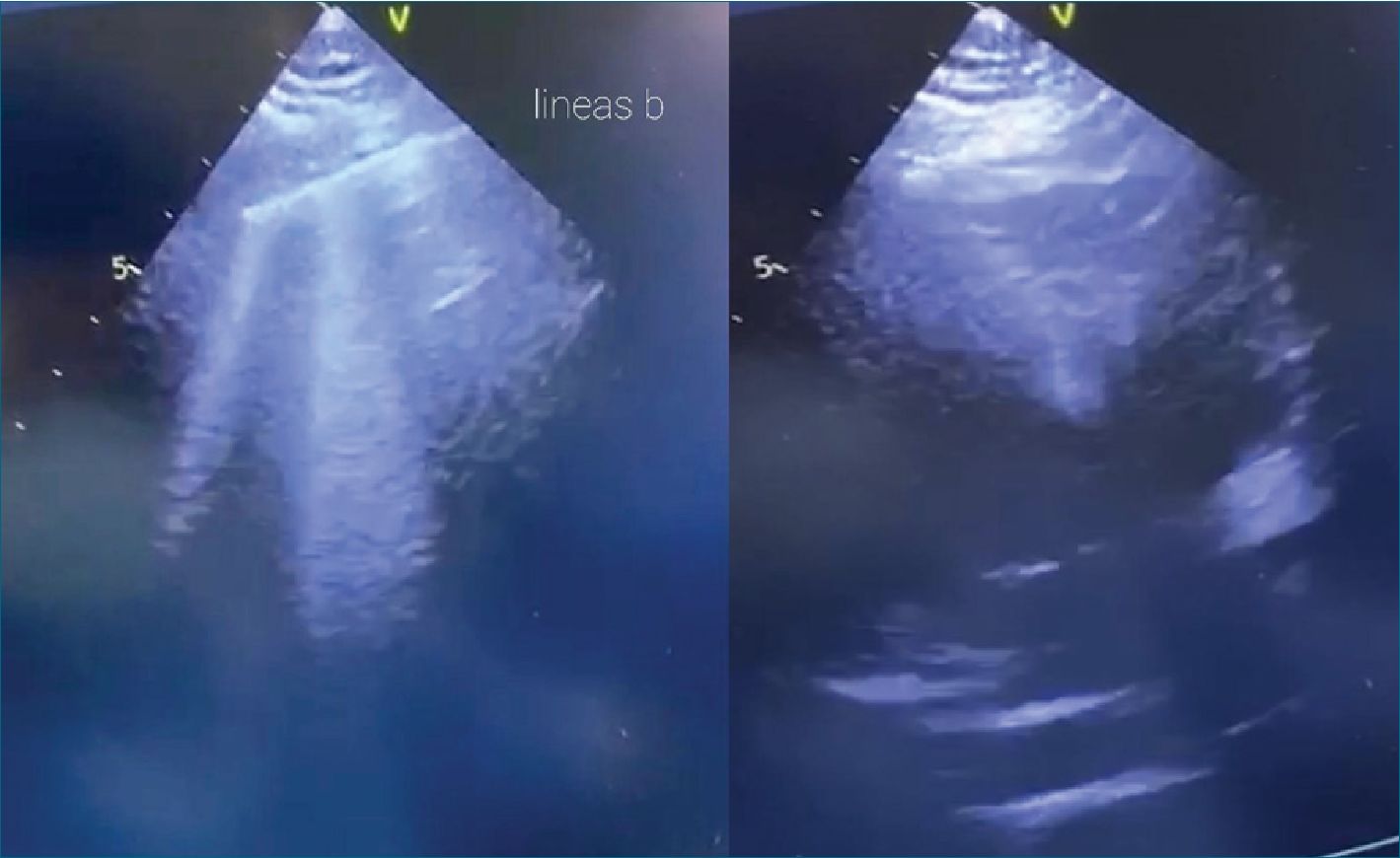
Figura 1. Ecocardiografía intraoperatoria transtorácica. Destaca líneas B en la ecografía pulmonar y en la ecocardiografía intraoperatoria, limitada por la ventana, se logra distinguir dilatación de VD y contraste espontáneo en la cavidad ventricular.
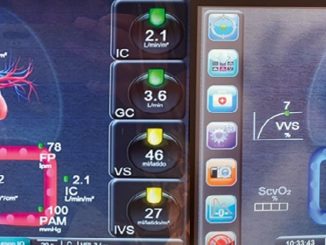
La paciente es trasladada desde pabellón a UCI en mal estado general, pálida, perfusión clínica alterada, con soporte de ventilación mecánica y requiriendo dosis altas de vasoactivos, transfundiendo 2 U de GR. Cardiólogo residente confirma hallazgos ecográficos anteriormente descritos, se indica angio- TAC de tórax que informa hallazgos compatibles con embolismo pulmonar no masivo. La paciente evoluciona con shock refractario a aumento de drogas vasoactivas y nueva ecografía (RUSH/BLUE) evidencia un ventrículo izquierdo disminuido en diámetro con fracción de eyección de 70% con signo del beso positivo. Medición de VCI 1,6 cm no colapsable, dilatación de cavidades derechas. Se observa un patrón de líneas B difuso, sin derrame pleural. Pruebas dinámicas identifican a la paciente como respondedora de volumen, por lo que se indican 2 frascos de albúmina humana y 500cc de suero RL en bolo. La paciente persiste con requerimientos de NE 0,3 mcg/kg/min. Se inicia protocolo de sedación para shock profundo con el fin de disminuir el consumo de oxígeno y se instala catéter de arteria pulmonar (CAP), constatando un shock mixto distributivo con componente obstructivo (Tabla 1). Teniendo la sospecha diagnóstica de AFE, el mal estado de la paciente y sin contar la disponibilidad de soporte ECMO en nuestro centro, se decide comenzar hemofiltración (HFAV) de alto volumen por 8 h. Las lecturas de perfil hemodinámico del CAP, muestran recuperación del shock obstructivo, aumento del trabajo ventricular derecho y disminución de las resistencias pulmonares, manteniendo el perfil distributivo, (Tabla 1) consolidándose al final de la terapia con la suspensión de vasoactivos. Durante las siguientes 12 h, la paciente evolucionó con mejoría perfusional y macro-hemodinámica (Tabla 2), con resolución de su cuadro de shock y ausencia de compromiso respiratorio, se decide en visita técnica revertir el bloqueo neuromuscular con sugammadex 4 mg/ kg EV y posterior a las 36 h del episodio se suspende sedación, siendo extubada exitosamente 48 h posterior al ingreso. Se realiza un ecocardiograma de control luego de extubación que resulta sin alteraciones patológicas.
La incidencia estimada es de AFE es de 1,7/100.000 nacimientos en UK, y es una las principales causas de mortalidad materna en países desarrollados[2].
La fisiopatogénesis no está completamente clara, Attwood en 1956 sugirió la anafilaxia como mecanismo fisiopatogénico[3]. Esta hipótesis fue probada por Benson midiendo la concentración de triptasa sérica en mujeres que presentaron AFE[4]. Sin embargo, la evidencia ha sido contradictoria, encontrando concentraciones plasmáticas en niveles normales o levemente aumentados, pero considerablemente menores a los valores encontrados en casos confirmados de anafilaxis, generando importantes dudas acerca del rol de la anafilaxis en la patogenia del cuadro[5],[6]. En cuanto a la evidencia histológica, usando inmunohistoquímica se ha encontrado una mayor densidad de mastocitos y de triptasa en mujeres fallecidas por AFE en comparación a muertes producidas por anafilaxis u otra causa[7]. Esto sugiere que la degranulación de los mastocitos tiene lugar en los pulmones en casos fatales de AFE y no en otras causas de mortalidad durante el embarazo. Es difícil de correlacionar esto con la ausencia de un aumento significativo de triptasa circulante. Estas observaciones sugieren que la participación de los mastocitos a nivel pulmonar en casos fatales puede ser un proceso secundario y no necesariamente el mecanismo primario de AFE[1].
Por otro lado, la activación del complemento podría tener un rol importante dentro de la patogénesis de esta enfermedad. Se han encontrado niveles séricos de C3 y de C4 considerablemente disminuidos en pacientes con diagnóstico de AFE y niveles disminuidos de C3a en la circulación pulmonar, lo cual sería consistente con la activación del complemento[5]. En este sentido, es posible que la activación del complemento sea la respuesta inmune inicial que desencadenaría la degranulación de los mastocitos. Finalmente, considerando la evidencia tanto serológica como histológica, la vía del complemento parece ser más prometedora que la anafilaxia como posible mecanismo de la enfermedad[1]. Sin embargo, puede que la activación del complemento como gatillante del trabajo de parto sea fisiológica, este alcanzaría su punto máximo durante el nacimiento y volvería a la normalidad durante el período postparto[8]. Se desconoce la importancia biológica de la activación del complemento durante el parto normal, pero es coherente con la evidencia actual de que el inicio del trabajo de parto puede estar mediado por una respuesta inflamatoria en lugar de sólo una fluctuación de hormonas[9].
Tabla 1. Cuadro evolutivo y perfil hemodinámico catéter arteria pulmonar
| Previo a HFAV | Inicio HFAV | Durante HFAV | Posterior HFAV | |
| Gasto Cardíaco (L/Min) | 4,5 | 4,5 | 6,8 | 5,8 |
| Índice Cardíaco (L/Min/m2 | 2,8 | 2,8 | 4,2 | 3,6 |
| Frecuencia Cardíaca (/Min) | 135 | 77 | 97 | 73 |
| PVC (mmHg) | 10 | 12 | 13 | 15 |
| PCP (mmHg) | 7 | 11 | 21 | 21 |
| IRVS (dina*s*m2/cm5) | 1.560 | 1.880 | 911 | 1.628 |
| IRVP (dina*s*m2/cm5) | 350 | 337 | 188 | 134 |
| ITSVI (g*m/m2) | 50 | 53 | 30 | 45 |
| ITSVD (g*m/m2/min) | 3 | 2 | 5 | 8 |
| PAM (mmHg) | 64 | 78 | 61 | 88 |
Se observan cambios hemodinámicos y shock obstructivo hacia distributivo y la respuesta hemodinámica a la hemofiltración de alto volumen.
Tabla 2. Resumen evolutivo exámenes de laboratorio
| Previo cirugía | Posterior cirugía | Ingreso UCI | UCI día 1 | UCI día 2 | UCI día 3 | |
| Hemoglobina (gr/dL) | 10,9 | 5 | 8,8 | 9,5 | 8,7 | 9 |
| Hematocrito (%) | 31,7 | 15 | 26,7 | 27,5 | 25 | 26 |
| Plaquetas (xmm3) | 264.000 | 150.000 | 167.000 | 187.000 | 114.000 | 128.000 |
| Leucocitos (xmm3) | * | 21.200 | 31.700 | 35.500 | 23.500 | 24.000 |
| INR | 1,57 | 1,43 | 1,13 | 0,94 | ||
| TTPK (seg) | 29,1 | 68,2 | 39,5 | 29,2 | 24,9 | 31,2 |
| Fibrinógeno (mg/dL) | 658 | 169 | 228 | 459 | ||
| Dimero D (ng/ml) | > 50.000 | 41.163 | ||||
| Creatininemia (mg/dL) | 0,4 | 0,5 | 0,5 | 0,4 | 0,4 | |
| Proteína C reactiva (mg/dL) | 8,6 | 7 | 34,7 | 26,9 | 20,6 | |
| Procalcitonina (ng/ml) | 0,2 | 0,23 | 9,91 | 4,07 | ||
| Ácido Láctico (mmol/L) | 5,5 | 5,9 | 3,7 | 0,8 | ||
| PaF¡ | 224 | > 300 | > 300 | > 300 | > 300 | |
| pH | 7,11 | 7,05 | 7,32 | 7,48 | ||
| pCO2 (mmHg) (arterial) | 42 | 51 | 58 | 35 | ||
| pO2 (mmHg) (arterial) | 112 | 89 | 81 | 48 | ||
| Troponina I (ng/ml) | 0,052 | 0,059 | 0,031 | |||
| NT- Pro-BNP (pg/ml) | 126 |
Durante la evolución se observa una mejoría de la perfusión tisular y normalización de pruebas de coagulación.
* Examen no disponible por ser realizado en centro derivador.
El líquido amniótico contiene factores vasoactivos y procoagulantes, como el factor de activación plaquetaria, citoquinas, bradiquininas, tromboxano, leucotrienos y ácido araquidónico. La concentración de factor tisular y del inhibidor de la vía del factor tisular (TFPI), quienes gatillan la coagulación intravascu- lar, es más elevada en el líquido amniótico que en el plasma materno. Se especula que la concentración de endotelina plasmática aumenta en respuesta a la entrada de líquido amnióti- co a la circulación materna. La endotelina actuaría provocando una potente broncoconstricción, vasoconstricción coronaria y vasoconstricción pulmonar, lo cual contribuiría en el proceso de colapso cardiorrespiratorio, mientras que la propiedad procoagulante intrínseca del líquido amniótico podría explicar la presentación de coagulación intravascular diseminada durante este cuadro[10].
La reacción respiratoria inicial posiblemente comienza con un vasoespasmo pulmonar transitorio que puede ser causado por microémbolos amnióticos que desencadenan la liberación de metabolitos del ácido araquidónico y dan lugar a hipertensión pulmonar, shunt, broncoconstricción e hipoxia grave. La segunda manifestación incluye inotropismo negativo e insuficiencia ventricular izquierda lo cual produce una disminución del gasto cardíaco e hipotensión. La tercera manifestación es una respuesta neurológica provocada por la falla respiratoria y el compromiso hemodinámico, que puede incluir convulsiones, confusión o coma[10]. Los criterios diagnósticos son variados según el grupo de estudio y país, sin embargo, los más recomendados para AFE[11], son los siguientes:
1. Hipotensión aguda o paro cardíaco.
2. Hipoxemia aguda: disnea, cianosis o fallo respiratorio.
3. Coagulopatía de consumo intravascular o fibrinólisis o ma
nifestaciones clínicas de hemorragia grave, pero sin razones para explicar.
4. Los síntomas ocurren durante el trabajo de parto, cesárea, legrado o puerperio inmediato (generalmente hasta 30 min luego del alumbramiento). Por lo tanto, no se debe incluir cómo diagnóstico de AFE hemorragias postparto sin coagulopatía o falla cardíaca por causas diferentes[12].
El manejo obstétrico de la paciente debe estar atento y actuar a la prontitud posible[13]. En general se indica la culminación rápida del embarazo en casos de AFE, siempre y cuando curse con edad gestacional viable. Sin embargo, un reciente análisis objetivo de la evidencia no muestra claramente que la terminación de la gestación aporte beneficios en el pronóstico materno[14]. En casos que ocurra paro cardiorrespiratorio materno, el parto debe darse de inmediato para así mejorar el pronóstico del recién nacido[15]; en general ante paro cardio- rrespiratorio si la circulación sanguínea no se recupera espontáneamente por la paciente, entonces se recomienda cesárea perimortem a los 4 minutos continuando ininterrumpidamente las medidas de reanimación cardiopulmonar y preferiblemente desde las 20 semanas de gestación en base a probable viabilidad del feto[16]. La atonía uterina se relaciona comúnmente con AFE y debe ser tratada rápidamente con uterotónicos. Es prioritario intentar mantener la circulación sanguínea y administrar hemoderivados cuando sea necesario, ya que la isquemia e inadecuada perfusión uterina juega un importante papel en la atonía del útero[13].
La hemorragia posparto puede requerir maniobras de taponamiento uterino, o técnicas quirúrgicas para devascularización o sutura de B-Lynch. La histerectomía no debe ejecutarse de forma profiláctica, pero en casos de difícil control de la hemorragia con riesgo vital, debe llevarse a cabo con rapidez[13].
El rol del anestesiólogo es fundamental, se recomienda la presencia de un segundo anestesiólogo, para otorgar soporte y diagnóstico intraoperatorio. Se debe corregir de forma inmediata la inestabilidad hemodinámica con infusión rápida de fluidos, apoyo de drogas vasoactivas y soporte transfusional para optimizar la macro y micro hemodinámia. Para guiar la fluidotera- pia resulta útil contar con una ecocardiografía transesofágica o transtorácica (según disponibilidad). La intubación orotraqueal y administración de oxígeno 100% a presión positiva debe ser lo antes posible y se debe considerar una cateterización arterial y venosa central con el fin de monitorizar de forma precisa la presión arterial y obtener una muestra de oxígeno arterial y venoso frecuente, además de iniciar y guiar la terapia con DVA, la instalación de un catéter de arteria pulmonar en la unidad de pabellón o en la unidad de paciente crítico tiene la función de definir el tipo de shock y guiar su tratamiento, la elección de vasopresor depende de la información entregada por la moni- torización invasiva y por la situación clínica. Durante la fase de resucitación el uso de glóbulos rojos, plasma fresco congelado, plaquetas y crioprecipitados deben estar disponibles y deben ser usados de forma temprana. Si la cantidad de plaquetas es < 20.000/uL o si hay presencia de hemorragia y las plaquetas están entre 20.000-50.000/uL se debe indicar transfusión de plaquetas entre 1-3U/10 kg/día. Si el nivel de fibrinógeno es < 100 mg/dL administrar crioprecipitados. Las mujeres que recibieron dosis cercanas a 2 g de ácido tranexámico tuvieron menor mortalidad con respecto a las que recibieron dosis cercanas a 0,7g por lo que la recomendación es usar dosis altas[2]-[10]-[17].
El rescate hemodinámico a través de la elección de vasopre- sores, depende de la situación clínica y del perfil hemodinámico que muestra la monitorización, El uso de noradrenalina es de primera elección debido a su adicional efecto p-adrenérgico, lo cual mejora la función cardíaca. La vasopresina como terapia coadyuvante tiene el beneficio de prevenir la vasoconstricción de vasculatura pulmonar. En caso de falla cardiaca derecha se debe considerar el uso de milrinona o de otro inhibidor de fosfodiesterasa. La epinefrina debe ser considerada posterior al uso de noradrenalina. La fenilefrina también es usualmente una excelente alternativa en el manejo temprano de AFE. El uso de otros fármacos que también deben ser considerados según contexto clínico son hidrocortisona, oxitocina, antihistamínicos H1 y H2 y factor VIIa recombinante. Como terapias de rescate hemodinámico se destaca la la membrana de oxigenación extracorpórea (ECMO) y hemofiltración de alto volumen (HFAV), cuya evidencia es aún limitada por la baja incidencia de casos, se requieren más trabajos para obtener una evidencia de mejor calidad. Con respecto a estos tratamientos de excepción, la elección depende del estado hemodinámico, la refractariedad del compromiso pulmonar y la experiencia del centro[10].
Los vasodilatadores pulmonares selectivos, como el óxido nítrico para el tratamiento de la hipertensión pulmonar grave durante la fase aguda del AFE, y el factor VIIa activado recombinante para el tratamiento de la CID grave resistente a los tratamientos convencionales merecen un estudio más detallado y se escapan a esta revisión.
Si bien la comprensión de la AFE ha mejorado en la última década, esta entidad sigue estando asociada a una alta tasa de morbimortalidad materna y perinatal. Su aparición no se puede predecir ni prevenir. Es importante siempre considerar esta condición en el diagnóstico diferencial de una inestabilidad he- modinámica súbita. La actuación en equipo multidisciplinario está relacionada con el mejor pronóstico, se debe alentar el uso rutinario de la ecocardiografía que se encuentre disponible en pacientes con AFE en pabellón y en UCI incentivar el uso del monitoreo hemodinámico avanzado, para evaluar los cambios en la perfusión y hemodinámia a fin de orientar el tratamiento con mayor precisión[1]-[10]-[18],[19].
Es necesario mayor investigación sobre marcadores séricos, llevando las investigaciones futuras sobre la fisiopatología, el diagnóstico temprano y el tratamiento, hacia el papel de los mediadores inflamatorios, como la histamina, las prostaglan- dinas, leucotrienos y el complemento, cuya actividad biológica puede explicar muchos de los acontecimientos que se producen AFE[19]. Se requiere más evidencia para realizar sugerencias con respecto al rescate hemodinámico, ya que la mayoría se desprende de reportes de caso y opinión de expertos.
Referencias
1. Benson MD. Current concepts of immunology and diagnosis in amniotic fluid embolism. Clin Dev Immunol. 2012;2012:946576. https://doi.org/10.1155/2012/946576 PMID:21969840
2. Fitzpatrick KE, van den Akker T, Bloemenkamp KW, Deneux-Tharaux C, Kristufkova A, Li Z, et al. Risk factors, management, and outcomes of amniotic fluid embolism: A multicountry, population-based cohort and nested case-control study. PLoS Med. 2019 Nov;16(11):e1002962. https://doi.org/10.1371/journal.pmed.1002962 PMID:31714909
3. Attwood HD. Fatal pulmonary embolism by amniotic fluid. J Clin Pathol. 1956 Feb;9(1):38–46. https://doi.org/10.1136/jcp.9.1.38 PMID:13306790
4. Benson MD, Lindberg RE. Amniotic fluid embolism, anaphylaxis, and tryptase. Am J Obstet Gynecol. 1996 Sep;175(3 Pt 1):737. https://doi.org/10.1053/ob.1996.v175.a74918 PMID:8828443
5. Benson MD, Kobayashi H, Silver RK, Oi H, Greenberger PA, Terao T. Immunologic studies in presumed amniotic fluid embolism. Obstet Gynecol. 2001 Apr;97(4):510–4. https://doi.org/10.1016/S0029-7844(00)01213-8 PMID:11275019
6. Fineschi V, Riezzo I, Cantatore S, Pomara C, Turillazzi E, Neri M. Complement C3a expression and tryptase degranulation as promising histopathological tests for diagnosing fatal amniotic fluid embolism. Virchows Arch. 2009 Mar;454(3):283–90. https://doi.org/10.1007/s00428-009-0730-1 PMID:19172292
7. Fineschi V, Gambassi R, Gherardi M, Turillazzi E. The diagnosis of amniotic fluid embolism: an immunohistochemical study for the quantification of pulmonary mast cell tryptase. Int J Legal Med. 1998;111(5):238–43. https://doi.org/10.1007/s004140050160 PMID:9728749
8. Benson MD, Oi H. A mild case of amniotic fluid embolism? J Matern Fetal Neonatal Med. 2007 Mar;20(3):261–2. https://doi.org/10.1080/14767050601134686 PMID:17437230
9. Li R, Ackerman WE 4th, Summerfield TL, Yu L, Gulati P, Zhang J, et al. Inflammatory gene regulatory networks in amnion cells following cytokine stimulation: translational systems approach to modeling human parturition. PLoS One. 2011;6(6):e20560. https://doi.org/10.1371/journal.pone.0020560 PMID:21655103
10. Kaur K, Bhardwaj M, Kumar P, Singhal S, Singh T, Hooda S. Amniotic fluid embolism. J Anaesthesiol Clin Pharmacol. 2016 Apr-Jun;32(2):153–9. https://doi.org/10.4103/0970-9185.173356 PMID:27275041
11. Clark SL, Hankins GD, Dudley DA, Dildy GA, Porter TF. Amniotic fluid embolism: analysis of the national registry. Am J Obstet Gynecol. 1995 Apr;172(4 Pt 1):1158–67. https://doi.org/10.1016/0002-9378(95)91474-9 PMID:7726251
12. Knight M, Tuffnell D, Brocklehurst P, Spark P, Kurinczuk JJ; UK Obstetric Surveillance System. Incidence and risk factors for amniotic-fluid embolism. Obstet Gynecol. 2010 May;115(5):910–7. https://doi.org/10.1097/AOG.0b013e3181d9f629 PMID:20410762
13. Feng Y, Yang HX. Interpretation of Chinese expert consensus on diagnosis and management of amniotic fluid embolism. Chin Med J (Engl). 2020 Jul;133(14):1719–21. https://doi.org/10.1097/CM9.0000000000000886 PMID:32558700
14. Shamshirsaz AA, Clark SL. Amniotic Fluid Embolism. Obstet Gynecol Clin North Am. 2016 Dec;43(4):779–90. https://doi.org/10.1016/j.ogc.2016.07.001 PMID:27816160
15. Clark SL. Amniotic fluid embolism. Obstet Gynecol. 2014 Feb;123(2 Pt 1):337–48. https://doi.org/10.1097/AOG.0000000000000107 PMID:24402585
16. Chu JJ, Hinshaw K, Paterson-Brown S, Johnston T, Matthews M, Webb J, et al. Paterson-Brown S y cols. Perimortem caesarean section – why, when and how. Obstet Gynaecol. 2018;20(3):151–8. https://doi.org/10.1111/tog.12493.
17. Dean LS, Rogers RP 3rd, Harley RA, Hood DD, Riou B. Case scenario: amniotic fluid embolism. Anesthesiology. 2012 Jan;116(1):186–92. https://doi.org/10.1097/ALN.0b013e31823d2d99 PMID:22129534
18. Lisonkova S, Kramer MS. Amniotic fluid embolism: A puzzling and dangerous obstetric problem. PLoS Med. 2019 Nov;16(11):e1002976. https://doi.org/10.1371/journal.pmed.1002976 PMID:31714903
19. Conde-Agudelo A, Romero R. Amniotic fluid embolism: an evidence-based review. Am J Obstet Gynecol. 2009 Nov;201(5):445.e1–13. https://doi.org/10.1016/j.ajog.2009.04.052 PMID:19879393

 ORCID
ORCID