Paulina González Navarro1,*, Guillermo Genaro Martínez Salazar2, Yuliana Isabel Olivero Vásquez1, Enrique Monares Zepeda1, Miguel Nares Torices1, Anuar Said Hurtado Martínez3.
Recibido: 12-08-2022
Aceptado: 17-08-2022
©2022 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 51 Núm. 6 pp. 662-670|https://doi.org/10.25237/revchilanestv5128091547
PDF|ePub|RIS
Uterotonic agents: post-cesarean algorithm
Abstract
Although the management of postpartum hemorrhage (PPH) has improved in recent years; even today, it continúes to be the leading cause of maternal mortality worldwide, mainly in low-income countries and represents 25%-35% of all pregnancy-related deaths, it is estimated to be responsible for around 143,000 maternal deaths per year. PPH also contributes significantly to maternal morbidity and is one of the main reasons for admission to intensive care and for obstetric hysterectomy in the postpartum period. The causes of PPH are varied and have been classified according to their underlying pathophysiology. Being the first cause of PPH uterine hypotonia/atony (70%-80%), although we must consider that there are other entities that can cause or contribute to acute hemorrhage, management of hypotonia has traditionally been based on uterotonics, so an adjustment to this scheme is suggested, granting a broad vision of the subject.
Resumen
A pesar de que el manejo de la hemorragia posparto (HPP) ha mejorado en los últimos años; aún en la actualidad, continúa siendo la primera causa de mortalidad materna a nivel mundial principalmente en países de bajos ingresos y representa el 25%-35% de todas muertes relacionadas con el embarazo, se estima que es responsable de alrededor de 143.000 muertes maternas al año. La HPP también contribuye significativamente a la morbilidad materna y es una de las principales razones para la admisión en cuidados intensivos y para la histerectomía obstétrica en el período posparto. Las causas de la HPP son variadas y se han clasificado según su fisiopatología subyacente. Siendo la primera causa de HPP la hipotonía/atonía uterina (70%-80%), aunque debemos tomar en cuenta que existen otras entidades que pueden causar o contribuir a hemorragia aguda, el manejo de la hipotonía se ha basado tradicionalmente en uterotónicos, por lo que se sugiere un ajuste a este esquema otorgando una visión amplia del tema.
-
Metodología
La obtención de artículos a revisar se realizó utilizando la información publicada en NLM (National Library of Medicine) mediante su plataforma de motor de búsqueda ubicada en https://pubmed.ncbi.nlm.nih.gov/ con bibliografía publicada en fechas dentro del período comprendido de 2007 al 2022 en revistas cuyo factor de impacto superara > 1 utilizando Pubmed Clinical QueriesTM con las siguientes palabras clave:
” Uterotonics” “Oxytocin” “Carbetocin” “Misoprostol” “Ergonovine” ” Hemorrhage” “Postpartum” “Cesarean” “Atony” “Uterine” “Hypo- tonia” “Bleeding” “Anesthesia” “Management” “Pregnancy”
-
Introducción
Actualmente, no existe una única definición satisfactoria de Hemorragia PosParto (HPP). La HPP se define comúnmente como la pérdida de sangre de 500 ml o más dentro de las 24 h posteriores al nacimiento, mientras que la HPP grave se define como la pérdida de sangre de 1.000 ml o más[1].
Aproximadamente 500 a 800 ml de sangre circula a través del útero y la placenta cada minuto, gracias a la intrincada red de vasos sanguíneos que irriga estos órganos[1]. Por lo que no es raro que de acuerdo a la irrigación de estos organos la HPP complique 1 de cada 20 partos tanto por vía vaginal como por cesárea[2].
El 60% de los casos de hipotonía/atonía uterina puede ser prevenida con el manejo activo de la tercera fase del trabajo de parto: 1) Administración profiláctica y terapéutica de medicamentos uterotónicos después del nacimiento; 2) Tracción controlada del cordón umbilical para el alumbramiento de la placenta y 3) Pinzamiento del cordón umbilical[3].
La principal diferencia entre el parto prematuro y el parto de termino, es el momento en el cual comienza en el trabajo de parto (TDP). Esto es quizás comprensible dado que ambos implican eventos clínicos similares: aumentó de la contractilidad uterina y dilatación cervical; estos eventos representan la “vía común” del trabajo de parto. La comprensión actual de este proceso es que el cambio del miometrio de un estado quiescente a un estado contráctil se acompaña de un cambio en la señalización entre vías antiinflamatorias y proinflamatorias, incluyendo quimiocinas (interleucina-8), citoquinas (interleucina-1 e interleucina-6), y las proteínas asociadas a la contracción (receptor de oxitocina, conexina 43, receptores de prostaglandinas). La progesterona mantiene la quietud uterina reprimiendo la expresión de estos genes. La maduración cervical en preparación para la dilatación está mediada por cambios en las proteínas de la matriz extracelular, que incluyen una pérdida de la red del colágeno y un aumento de los glucosaminoglicanos; así como, cambios en las propiedades de la barrera epitelial y de las células de vigilancia inmune. Esto disminuye la resistencia a la tracción del cuello uterino, clave para la dilatación cervical. La activación decidual/membrana se refiere a los eventos anatómicos y bioquímicos involucrados en la retirada del apoyo decidual para el embarazo, la separación de las membranas corioamnióticas de la decidua, y finalmente, la ruptura esta membrana amniótica. Se ha implicado en este proceso una mayor expresión de citoquinas inflamatorias (TNF-a e IL-1), quimioquinas y una mayor actividad de proteasas (MMP-8 y MMP-9), disolución de cementos celulares tales como fibronectina y apoptosis[4].
-
Uterotónicos
Los uterotónicos son fármacos que modulan la fuerza de la contracción uterina. Actúan activando el músculo liso del útero, lo cual se traduce en un aumento de la frecuencia, intensidad y duración de las contracciones. Los fármacos uterotónicos se clasifican en: oxitócicos, alcaloides del cornezuelo de centeno y prostaglandinas.
Aunque la oxitocina es el fármaco uterotónico de elección o de primera línea, existe una falta de consenso en los principales textos de obstetricia y entre los profesionales de las sociedades de obstetricia, con respecto a su dosis óptima, velocidad y tiempo de administración (temprana o tardía), seguridad y eficacia[5].
La administración de oxitocina y otros agentes uterotónicos adicionales, está relacionada con efectos adversos maternos, fetales y neonatales significativos; estos efectos secundarios particularmente están relacionados con la dosis y la tasa de administración. Recientemente, se han demostrado mejoras en los resultados perioperatorios de las pacientes con el uso de algoritmos y modelos de comunicación más efectivos, que establezcan y estandaricen protocolos claros que sirvan de ayuda al médico para ministrar una terapia adecuada. El equipo multidisciplinario encargado del manejo de las pacientes con hemorragia obstétrica: médicos anestesiólogos, ginecólogos, medicina crítica y enfermería debemos estar más familiarizados con el conocimiento, la selección y uso racional de los diferentes uterotónicos[6].
-
Oxitocina
La oxitocina, es una hormona nonapéptida que tiene un papel central en la regulación del parto y lactancia e influye en el comportamiento materno, es producida principalmente en el hipotálamo y liberada en pulsos por la hipófisis posterior. El nivel fisiológico de la oxitocina en plasma durante el embarazo es de 10-10 mol/L y actúa a nivel central como neuromodulador y neurotransmisor; tiene acciones autocrinas, paracrinas y en- docrinas[5],[7].
El primer uso clínico de la oxitocina fue por Blair Bell en 1909 para detener la hemorragia posparto. La oxitocina es ahora utilizada ampliamente en su forma sintética de octapéptida, para inducir y conducir el trabajo de parto, elevando su concentración en plasma a 10-8 mol/L. Clínicamente una infusión intravenosa continúa de oxitocina puede no ser óptima, ya que no reproduce su liberación pulsátil natural y también puede causar desensibilización del receptor de oxitocina (OTR) y disminución de OTR-RNAm[8].
La respuesta a la administración de oxitocina es variable, ya que hasta el 50% de las mujeres tienen pobre trabajo de parto y finalmente requieren parto por cesárea. Por vía intravenosa; la oxitocina tiene un efecto máximo a los 3 a 5 minutos y una vida media de eliminación de 3 a 12 minutos, por lo cual requiere de una administración en infusión para prolongar su acción, no se une a proteínas lo que permite una mayor fracción libre[3],[5].
Mecanismo de acción y señalización del receptor de oxitocina en el miometrio durante el embarazo y parto
El receptor de oxitocina (OTR) es regulado por cambios en la expresión del receptor, la desensibilización del receptor y los cambios locales en la concentración de oxitocina.
La oxitocina estimula la contractilidad uterina uniéndose al receptor miometrial de oxitocina. Codificada por el gen del receptor de oxitocina como una copia única asignada al locus 3p25-3p26,2[9],[10]; la proteína del receptor de oxitocina es un polipéptido de 389 aminoácidos compuesto por 7 dominios transmembrana y pertenece a la clase I de rodopsina de la su- perfamilia de receptores acoplados a proteínas G (GPCR).
La función del receptor de oxitocina está mediada por la ruta Gq / PLC / inositol 1, 4, 5-trifosfato[11]. Cuando se estimula con oxitocina, el receptor de oxitocina se acopla con la clase Gq / 11 de proteínas de unión a trifosfato de guanosina
(G -proteínas), que activa la fosfolipasa C (PLC) a través de sus subunidades Ga o Gbg. La PLC hidroliza adicionalmente fos- fatidilinositol 4, 5-bisfosfato (PIP2) a inositol trifosfato (InsP3) y diacilglicerol (DAG). El InsP3 libera iones Ca2 + del retículo sarcoplásmico al citosol a través de canales de calcio activados por voltaje y por receptor, mientras que DAG activa la proteína quinasa C y media los eventos de fosforilación que conducen a la síntesis de prostaglandinas. Los iones Ca2 + se unen a la calmodulina formando el complejo calcio-calmodulina, que activa las quinasas de la cadena ligera de la miosina y da como resultado la contracción del músculo liso del miometrio[3].
-
Expresión de los Receptores de Oxitocina (OTR)
Los OTR se encuentran localizados en el sistema nervioso central, retina, útero, tejido coriodecicual, mama, testículos, cuerpo lúteo, médula adrenal, corazón, endotelio vascular y se expresan entre la 20-30 semanas de gestación (SDG). Las concentraciones más altas de estrógeno durante el embarazo aumentan la densidad y la cinética de unión del receptor de oxitocina y aumentan la sensibilidad uterina a la oxitocina[12].
Los niveles perinatales de ARNm-OTR aumentan en cantidad y localización hasta 300 veces[13], y un aumento acompañante en la expresión de uniones gap durante el trabajo potencia aún más conductividad de las células miometriales[14].
Los OTR tienen una baja expresión en la etapa temprana de la gestación, pero aumentan hasta 12 veces entre las 37 a 41 SDG y su expresión máxima es al inicio del TDP (30 veces). Como consecuencia, las contracciones uterinas durante el TDP pueden ser estimuladas con oxitocina en concentraciones que no son efectivas en el estado no preñado. La expresión de los OTR es principalmente en el fondo uterino (200 veces) y menor proporción en el segmento bajo. La expresión de los OTR también aumenta en tejido coriodecidual durante el parto. En el Posparto inmediato la densidad de los OTR declina rápidamente en el útero y tejido coriodecidual. En este punto la oxitocina está sobreregulada en mamás y lactancia[5].
Esteroides: Se sugiere que la concentración de ARNm del receptor está regulada hormonalmente porque existe correlación entre las concentraciones de esteroides circulantes y la expresión de OTR. El consenso general es que los estrógenos aumentan la cantidad de ARNm de OTR uterino y el número de sitios de unión a OTR, mientras que, por el contrario, la proges- terona suprime la expresión de OTR. En cambio, se considera que los seres humanos sufren una “retirada funcional de la pro- gesterona”, que es probable que resulte del metabolismo local de la progesterona, un cambio en la proporción de la expresión de las isoformas del receptor de progesterona (PR-A/PR-B) y la expresión alterada del cofactor receptor de progesterona. Por lo tanto, una presencia continua de alta concentración de pro- gesterona, como durante la gestación, mantendría los OTR en un estado de baja afinidad. La capacidad de respuesta de los receptores a la oxitocina aumentaría a medida que cambiarían a su estado de alta afinidad[3],[5].
El estiramiento del miometrio es considerado el mayor estímulo para incrementar la expresión de OTR y es considerado el nivel más fuerte de control de la actividad uterina. El incremento aberrante de distensión puede ayudar a explicar el elevado rango de partos prematuros asociados frecuentemente con casos de polihidramnios, embarazo múltiple, particularmente si el útero es sujeto a alto grado de estiramiento en un punto temprano de la gestación[5].
-
Desensibilización
La exposición repetida o prolongada de células de algunos receptores acoplados a proteína G (RPCRs) de las células miometriales a la oxitocina da como resultado la pérdida de la respuesta hormonal conocida como desensibilización. Hay baja regulación del OTR, dando como resultado una disminución de la respuesta contráctil uterina con respecto al tiempo, asociado a la perdida de los sitios de unión de oxitocina y disminución de RNAm del OTR; así como, a internalización del OTR. El mecanismo molecular responsable de la desensibilización está mediado por el reclutamiento de b-arrestina al OTR después de la estimulación agonista. Después de la unión agonista, las qui- nasas GPCR (u otras quinasas tales como PKC) fosforilan la cola C-terminal del OTR provocando el reclutamiento de b-arrestina, que estéricamente impide cualquier acoplamiento adicional de Proteína G; así disminuye la señalización del segundo mensajero. A menudo, los OTR se llegan a internalizar por la vía clásica mediada por clatrina, donde luego son dirigidos para el ciclado en la membrana celular o la degradación por lisosomas. Dicho de otra manera, se bloquean todos los OTR y por más dosis sucesivas que se administren, éstas, serán ineficaces. Este fenómeno de desensibilización de los OTR uterinos ocurre tanto con la liberación fisiológica de oxitocina, como con la administración de oxitocina sintética, lo cual predispone y favorece la perdida sanguínea postparto[3],[5],[7],[8].
En el estudio de Balki y col.[15], la respuesta atenuada observada de la contractilidad inducida por oxitocina en las tiras del miometrio pretratadas con oxitocina confirma el fenómeno de desensibilización del receptor de oxitocina previamente establecido. En un estudio previo de Balki y col., se encontró que la contractilidad inducida por la oxitocina se atenuaba de una manera dependiente de la concentración y del tiempo cuando las tiras del miometrio se pretrataban con oxitocina 10-10, 10-8 o 10-5 M durante 2, 4, 6 o 12 h[16]. El efecto se observó predominantemente con pretratamiento con oxitocina 10-5 M durante al menos 2 h o 10-8 M durante al menos 4 h. Este modelo de desensibilización establecida se utilizó como base para estudiar diversos fármacos uterotónicos en el presente estudio.
-
Dosis y efectos
Durante el periparto la oxitocina se administra por vía intravenosa con el fin de controlar adecuadamente la dosis y suprimir su administración en caso de efectos adversos, ya que la administración de oxitocina está asociada con eventos adversos significativos maternos, fetales y neonatales. Puede haber arritmias maternas, hipotensión arterial, hiper estimulación uterina; así como, disminución en la saturación de oxígeno fetal relacionada con la frecuencia de las contracciones y convulsiones neonatales, hiperbilirrubinemia o hemorragia de retina. También se ha reportado nausea, vómito, cefalea, rubor y efecto antidiurético (retención acuosa, hiponatremia, convulsión, coma). Sin duda los efectos adversos más relevantes son los cardiovasculares: hipotensión arterial, taquicardia, dolor precordial, isquemia miocárdica, arritmias que pueden llegar a ser letales; dichos efectos pueden ser de mayor gravedad en pacientes con miocardiopatías, preeclampsia e hipovolemia[17].
La hipotensión arterial es causada principalmente por la va- sodilatación mediada por los OTR en el endotelio vascular a través de la estimulación calcio dependiente de la vía del óxido nítrico. La oxitocina también provoca la liberación de péptido natriurético atrial a través de los receptores de oxitocina dentro del corazón que conduce a diuresis, natriuresis y vasodilatación y posiblemente modula la liberación de acetilcolina de las neuronas colinérgicas cardíacas intrínsecas conduciendo a un efecto inotrópico negativo moderado. La administración rápida y las dosis crecientes pueden dar lugar a inestabilidad hemodinámi- ca, colapso cardiovascular y muerte. Varios estudios han indicado que se observan consecuencias hemodinámicas más profundas con la oxitocina en bolo de 10 UI en comparación con 5 UI[18]-[23]. Reducir la dosis de oxitocina de 5 a 3 UI disminuye estos cambios aún más sin afectar la pérdida de sangre o la necesidad de dosis adicionales agentes uterotónicos[24],[25].
Una lenta (por lo menos en un minuto) inyección IV de 5 UI de oxitocina recomendada (Grado A), la administración de oxitocina debe de hacerse con extrema precaución, en infusión intravenosa lenta y debe durar al menos 5 minutos para limitar sus efectos hemodinámicos. El tratamiento de mantenimiento de la rutina mediante una infusión de oxitocina intravenosa puede realizarse siempre y cuando no supere los 10 UI/h (consenso profesional) con dosis máxima en 24 h de 40 UI. El tratamiento puede ser detenido al final de dos horas si el tono uterino es satisfactorio, no hay factores de riesgo en la gestante y no hay sangrado anormal evidente (consenso profesional) [26].
Los estudios con respecto a la dosis y ruta de administración de la oxitocina son limitados, como consecuencia en la mayoría de los casos se continúa utilizando según a las diferentes costumbres y preferencias de los distintos profesionales e instituciones de salud. Las Guías Nacionales e Internacionales para la administración de oxitocina en parto por cesárea son diversas y empíricas con una gran variabilidad en la práctica clínica global. La Organización Mundial de la Salud sugiere una infusión de oxitocina 20 IU/L, el boletín de práctica del Colegio Americano de Obstetra y Ginecólogos indica un rango de oxitocina de 10 a 40 UI/L para la prevención de HPP[27],[28]. El Royal College of Obstetricians and Gynaecologists[29] recomendan oxitocina 5 IU por inyección IV lenta, y la Sociedad de Obstetras y Ginecólogos de Canadá[30] recomienda carbetocina 100 mcg IV en 1 minuto en lugar de oxitocina para la prevención de HPP durante la cesárea electiva. Además de estas disparidades, no hay una orientación clara sobre si se debe usar la oxitocina de una manera profiláctica o terapéutica, si ha de utilizarse en bolo, infusión continua o ambas, ni tampoco respecto al inicio y finalización de la perfusión, pero sí se ha demostrado que tanto la dosis total como el tiempo de exposición a la oxitocina a lo largo del trabajo de parto aumentan el riesgo de HPP de forma independiente.
Las inconsistencias en las directrices de la sociedad han dado lugar a una variación significativa en los regímenes de oxitocina clínica utilizados durante el parto por cesárea. El uso rutinario de una infusión de oxitocina varió en gran medida (rango 11% a 55%) en Gran Bretaña e Irlanda, aunque cuando se utilizó un bolo de oxitocina de 5 UI, fue administrado por 88% (85% a 95%) de 391 encuestados y el resto utilizó una dosis de bolo de 10 UI. Una encuesta similar realizada en Australia y Nueva Zelanda reveló el uso de 68 regímenes diferentes durante la cesárea electiva; sin embargo, aproximadamente el 98% de los encuestados utilizaron un bolo de oxitocina IV de 5 UI (32%) o 10 UI (67%), así como una infusión de mantenimiento con oxitocina, de forma rutinaria o selectiva[3].
-
Oxitocina en el parto por cesárea
En la última década múltiples estudios han demostrado evidencia que indican dosis eficaces mucho más reducidas. Carval- ho y col.[31], reportaron un rango de dosis efectiva 90 (DE90) 0,3 a 1 UI en bolo para cesárea electiva (sin exposición previa a oxitocina); por otro lado, Balki y col.[32], determinaron una DE90 de 3 UI en casos de cesáreas después de suspender el trabajo de parto, seguido una infusión continua entre 5 y 10 UI/h.
Butwick y col.[34] en su estudio no encontró diferencias significativas en la prevalencia de tono uterino adecuado entre los grupos de estudio a los 2 min (73%, 100%, 93%, 100% y 93% para 0, 0.5, 1, 3 y 5 UI de oxitocina, respectivamente). Concluyeron que el uso rutinario de 5 unidades de oxitocina durante cesárea electiva ya no puede recomendarse, ya que el tono uterino adecuado puede ocurrir con dosis más bajas de oxitocina (0,5-3 unidades), además, la prevalencia de hipotensión arterial fue significativamente mayor después de 5 unidades de oxitocina.
Como resultado de las respuestas farmacocinéticas, far- macodinámicas clínicas conocidas de la oxitocina, Balki y Tsen[3],[17] desarrollaron un protocolo estandarizado llamado “regla de tres” para el uso de oxitocina durante la cesárea para guiar a los profesionales de una manera clara y concisa (Figura 1). Este algoritmo incluye a las mujeres con y sin trabajo de parto; así como, los usos profilácticos y terapéuticos de la oxitocina:
1) 3 dosis de oxitocina IV durante 30 segundos.
2) 3 minutos de intervalo antes de una dosis adicional de oxi- tocina.
3) 3 dosis totales (carga inicial + 2 dosis de rescate).
4) 3 UI/h de oxitocina para infusión de mangenimiento (3 UI/L a 100 ml/h).
5) 3 opciones farmacológicas (ergonovina, carboprost y miso- prostol) si las 3 dosis de oxitocina son ineficaces.
El protocolo “Regla de los Tres” para la administración de oxitocina y otros agentes uterotónicos durante el parto por cesárea. Se refiere a la fuerza del tono uterino medida por el obstetra en el momento de la cesárea. Administración intramuscular (IM); intramiometrial (IMM); intravenosa (IV)[3],[17].
La infusión de oxitocina de mantenimiento se puede administrar hasta 8 horas después del parto.
Aunque se ha demostrado que la dosis intravenosa de oxi- tocina en mujeres de bajo riesgo y sin trabajo de parto es más baja que en las mujeres con trabajo de parto y exposición previa a la inducción o aumento de la oxitocina (ED90 0,35 vs 2,99 UI; es decir a la dosis en la cual el 90% de las pacientes responden adecuadamente a la oxitocina), la dosis única de oxitocina 3IU es eficaz para la prevención de la atonia uterina y la HPP en ambos escenarios. En conjunto, el protocolo “Regla de los Tres” enfatiza las siguientes precauciones durante la administración de oxitocina después del parto por cesárea:
1.- La oxitocina no debe administrarse rápidamente como un bolo IV (menos de 15 segundos).
2.- Una dosis inicial de oxitocina debe ser seguida de una infusión de mantenimiento.
3.- La dosis inicial y de infusión altas de oxitocina no ofrecen ningún beneficio clínico, pueden causar más efectos adversos y deben ser evitados.
4.- Si la oxitocina no produce contracciones uterinas efectivas, se deben administrar otros agentes uterotónicos que actúan a través de otras vías (Tabla 1).
5.- El uso de oxitocina en pacientes con hipovolemia, preeclampsia, enfermedades cardíacas o pulmonares deben ser vigilados estrechamente para detectar cambios cardiovasculares o respiratorios.
6.- Drogas vasopresoras y otros fármacos para reanimación deben de estar disponibles cuando se administre oxitocina[3],[17].
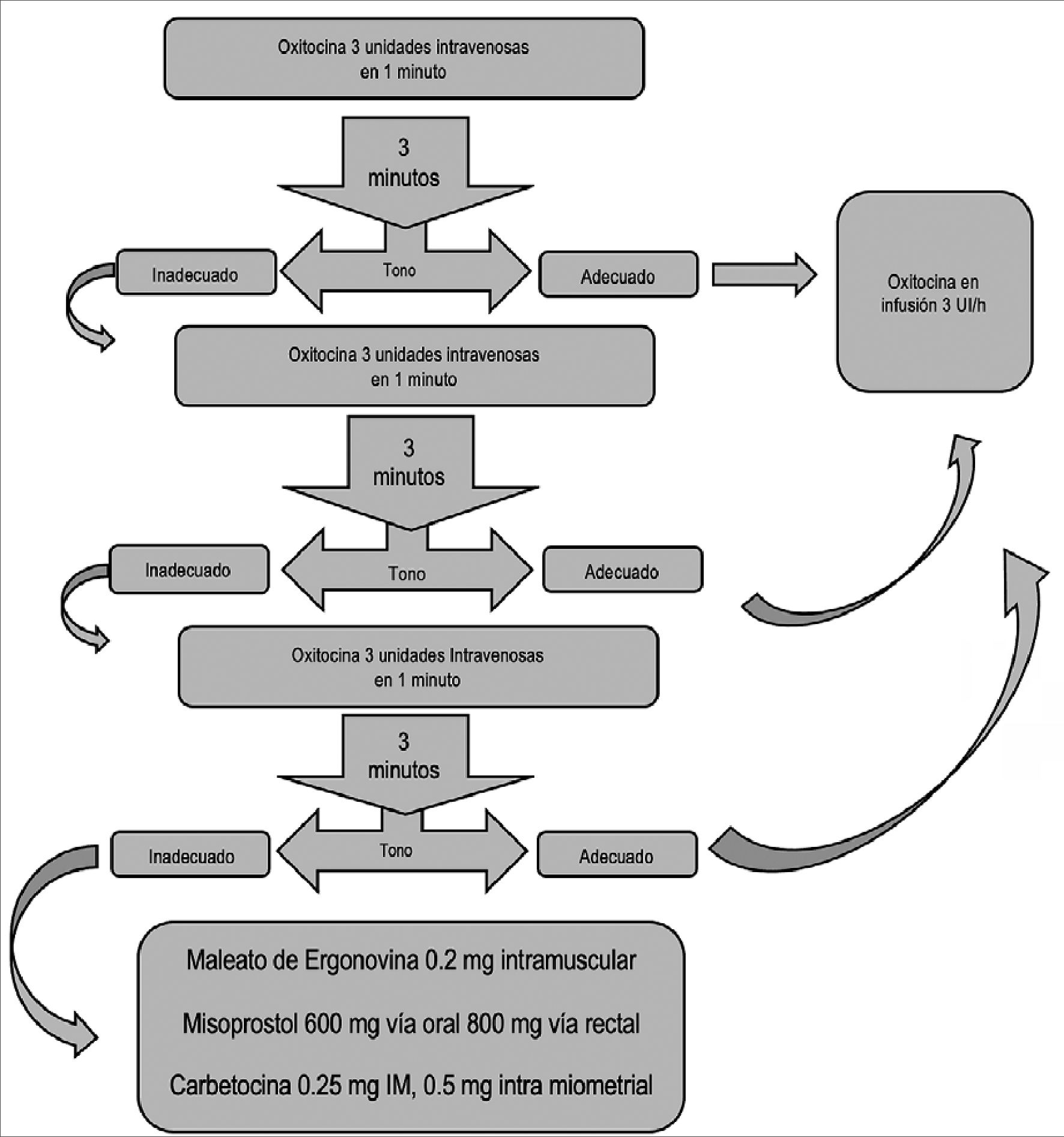
Figura 1. Algoritmo de oxitocina en posparto por cesárea.
Kovacheva y col.[6], evaluaron la seguridad y eficacia del protocolo de la “regla de 3” al comprarlo con el manejo standard. Se trata de un ensayo clínico prospectivo, randomizado, doble ciego; donde se incluyeron 60 pacientes sanas divididas en dos grupos de 30 embarazadas, sometidas a cesárea electiva con anestesia neuroaxial. A un grupo se le administró oxitocina como lo indica el protocolo “regla de 3” como se mencionó en párrafos anteriores. Por otro lado, el grupo control comenzó con una infusión de oxitocina con 30 UI/500 ml de Sol. Salina inmediatamente después de la cirugía y manteniendo la infusión hasta que se logró una contracción suficiente. Si a los 9 minutos no se lograba contraer el útero se administraba un uterotónico adicional de rescate, iniciando con la ergonovina seguida de carboprost y misoprostol. En ambos grupos una vez conseguida la contracción uterina se administró oxitocina en infusión en dosis de 3 UI/h (30 UI en 500 ml de solución fisiológica), hasta que la paciente abandonaba el quirófano. Se demostró que el grupo “regla de 3” requirió menos de la mitad de la dosis de oxitocina que el grupo control (4,0 vs 8,4 UI) y no se observaron diferencias respecto a alteraciones hemodinámicas ni pérdidas sanguíneas. Cuando la administración de oxitocina falla y no es suficiente para corregir la contracción uterina durante la cesárea se debe pasar a uterotónicos de segunda línea.
Balki[7] y col., realizaron un estudio donde se comparó la efectividad de diferentes fármacos uterotónicos en tiras de miometrio humano in vitro; el cual concluyó que la oxitocina induce contracciones miometriales superiores en comparación con ergonovina, PGF2a y misoprostol. Además de que el efecto de la oxitocina se reduce en el miometrio de las mujeres con trabajo de parto conducido o pretratadas con oxitocina (fenómeno de desensibilización); sin embargo, sigue siendo superior a los otros uterotónicos. Balki[15] y col., determinó que, en el miometrio pretratado con oxitocina, es evidente una respuesta sinérgica con la combinación de oxitocina con ergonovina o carboprost, se produce una respuesta superior en comparación con la oxitocina sola, por lo tanto, en cesáreas urgentes después de trabajo de parto con oxitocina, la combinación de otros uterotónicos debe tenerse en cuenta desde el inicio.
Se deben tomar pasos adicionales y el manejo debe adaptarse según la cantidad de sangrado, si la hemorragia persiste durante 15-30 min después del diagnóstico y manejo inicial correcto. Este límite de tiempo debe reducirse si la hemorragia es muy abundante desde el inicio del evento o si la tolerancia hemodinámica materna es deficiente. Se debe solicitar ayuda cuando la hemorragia empeora. Por lo tanto, el umbral de intervención para el inicio del tratamiento activo depende de la tasa de hemorragia, su causa y su contexto clínico[26].
-
Carbetocina
La carbetocina [1-deamino-1-carba-2-tirosina (0-metil) oxi- tocina] es un análogo sintético de la oxitocina que comparte el mismo mecanismo de acción y perfil de seguridad con la oxitocina principal ventaja es su semivida más larga de aproximadamente 40 a 120 minutos lo que conduce a una duración de acción de aproximadamente cuatro a diez veces mayor que la oxitocina[35]. En varios ensayos[36],[37] y una revisión recien- te[38] han comparado la eficacia de la carbetocina y la oxitocina en la prevención de la HPP después de los partos por cesárea. Lo más consistente en estos estudios fue la reducción de la necesidad de uterotónicos adicionales en pacientes a los que se les administró carbetocina. En el de estudio de Khan y col.[39], encontraron que la DE90 de la carbetocina fue de 14,8 mcg (intervalo de confianza del 95% 13,7 a 15,8 mg) en cesárea electiva y es menos de un quinto de la dosis actualmente recomendada de 100 mcg, la pérdida sanguínea total estimada (SD) fue de 786 (403) ml y la incidencia global de hipotensión arterial (disminución de la presión arterial sistólica 20% basal) fue del 37,5%. Después de 40 mcg administrados no hay mayor efecto de contracción uterina, pero sí es más probable efectos secundarios. Los efectos secundarios que puede presentar son: arritmias, cefalea, enrojecimiento, hipotensión arterial, dolor abdominal, náuseas, prurito y temblor. Como desventaja cabe decir que, tiene un costo mayor y que aún hay pocos estudios que la avalen. Su uso en la profilaxis debería ser individualizado. Se ha demostrado su beneficio para profilaxis sistemática de HPP en cesáreas electivas bajo anestesia regional y con más de un factor de riesgo de sangrado.
La carbetocina reduce el riesgo de HPP, pero en ausencia de un ensayo de no inferioridad, la oxitocina sigue siendo la referencia de tratamiento preventivo para prevenir la HPP después de parto por cesárea[26].
Las contracciones in vitro producidas por la oxitocina son superiores a la carbetocina en el miometrio humano con o sin pretratamiento con oxitocina. El pretratamiento con oxitocina da como resultado atenuación de las contracciones inducidas tanto por la oxitocina como por la carbetocina[40].
En el estudio de Widmer[40] reclutaron a 29.645 mujeres en 21 países; en este ensayo multicéntrico, doble ciego, alea- torizado, encontramos que la administración intramuscular de 100 pg de carbetocina no era inferior a la administración de 10 UI de oxitocina para la prevención de la hemorragia posparto después del parto vaginal. La frecuencia de pérdida de sangre de al menos 500 ml o el uso de agentes uterotónicos adicionales fue del 14,5% en el grupo de carbetocina y del 14,4% en el grupo de oxitocina (riesgo relativo, 1.01; intervalo de confianza [IC] del 95%, 0,95 a 1,06) un hallazgo que fue consistente con la no inferioridad. La frecuencia de pérdida de sangre de al menos 1.000 ml fue del 1,51% en el grupo de carbetocina y del 1,45% en el grupo de oxitocina (riesgo relativo: 1,04; IC del 95%: 0,87 a 1,25), con el intervalo de confianza cruzando el margen de no inferioridad. Como conclusión, no hubo diferencias significativas entre los dos grupos con respecto al uso de agentes uterotónicos adicionales, las intervenciones para detener el sangrado y los efectos adversos.
| Tabla 1. Propuesta de Uterotónicos adicionales de rescate |
| Segunda Línea |
| • Maleato de metilergonovina 0,2 mg intramuscular (IM) |
| Derivado de la ergotamina |
| Evitar en: Hipertensión/Preeclampsia-Eclampsia
Administrar en intervalos de 20 minutos y repetir hasta 1 mg |
| • Carboprost trometamina 0,25 mg intramuscular (IM), 0,5 mg intramiometrial (IMM) |
| Prostaglandina F2-alfa |
| Evitar en: Asma |
| Administrar en intervalos de 20 minutos, repetir hasta 1 mg; o bien |
| • Misoprostol 800 mcg vía rectal o 600 mg vía bucal |
| Análogo de la prostaglandina E1 |
| FDA para reducir úlcera gástrica por AINES |
| Vida media terminal 20-40 minutos |
-
Alcaloides del cornezuelo del centeno
Los alcaloides del cornezuelo del centeno (ergonovina o ergometrina y ergotamina) fármacos de segunda línea, es a partir de que se introdujo la metilergometrina o metilergonovina (derivado semisintético de la ergonovina), la cual presenta menores efectos secundarios que otros preparados anteriores del mismo grupo. Agonista parcial y antagonista de los receptores seroto- ninérgicos, dopaminérgicos y alfa-adrenérgicos. Contraindicado su uso en casos de hipertensión y cardiopatía moderada-severa, por sus efectos secundarios derivados de su acción vasoconstrictora. Se han descrito hipertensión, cefalea, retención de placenta, inversión uterina, erupciones cutáneas, espasmo coronario, convulsiones, dolor abdominal, náuseas, vómitos, vértigo, y otros. En varias revisiones sistemáticas de Cochrane sobre su utilización profiláctica, se concluye que disminuye el sangrado uterino sin necesidad de adicional, otros uterotónicos, que comparada con oxitocina y carbetocina no se asoció a menor HPP y sí a mayor número de efectos secundarios, y que por vía oral no aporta ninguna ventaja frente al placebo. Actualmente las recomendaciones de su administración son como uterotónico de segunda línea a dosis de 0,2 mg IV lenta o IM y respetando estrictamente las contraindicaciones[40].
-
Prostaglandinas
Las prostaglandinas (PG) son lípidos bioactivos derivados del ácido araquidónico, son sintetizadas dentro de las membranas fetales humanas (amnios y corión) y decidua. Juegan un papel importante tanto en la iniciación como en el mantenimiento del trabajo de parto “maduración cervical”, grupo de fármacos indicados como tercera línea en el tratamiento de la HPP. Actúan como mensajeros de señalización en varias rutas bioquímicas. Tienen acciones de manera paracrina o autocrina, median su función por unirse a varios receptores acoplados a Proteínas G (GPCRs). Cada PG tiene su propio receptor específico, facilitan el paso de calcio hacia el interior celular e impiden su fijación en el sarcoplasma. En el miometrio los dos mayores estimulantes de PG son PGF2-alfa y PGE2, los niveles de estas dos PGs dependen del tiempo durante la gestación tardía por lo cual son importantes en el proceso del trabajo de Parto; ambas PGs influyen en la contractilidad miometrial, pero sus efectos varían.
La prostaglandina E2 o dinoprostona y sulprostona, la prostaglandina F2a o carboprost y dinoprost, o la prostaglandina E1 o misoprostol
Hay controversia si las PG de la variedad “E” ayudan a la contracción o relajación. Hay 4 isoformas de receptor de PGE (EP 1-4) el cual actúa mediante diferentes vías intracelulares: receptores EP-1 acoplados a la movilización de calcio y así son uterotónico. Receptor EP-3 inhiben adenil ciclasa y así al AMPc y a la Proteincinasa A (PKA); tantos AMPc y la PKA principal
mente relajan el miometrio a través de una variedad de mecanismos, incluyendo disminución de la apertura de los canales de calcio, fosforilación MLCK y estimulación de MLCP. Por tanto, el receptor EP-3 será estimulante. Contrariamente EP-2 y EP-4 estimulan el AMPc mediando la relajación.
La prostaglandina E2 o dinosprona (Propess*) Entre sus efectos secundarios encontramos, náuseas, vómitos, diarrea, cefalea, hipertensión, broncoespasmo, fiebre. Esto hace que sus indicaciones sean consideradas como fármaco de tercera línea, utilizado a la mínima dosis que produzca una contracción uterina adecuada, dosis inicial 2,5 pg/min. Está contraindicada en pacientes con enfermedad cardiaca, pulmonar, renal o hepática.
La prostaglandina F2a o carboprost (Hemabate*), es la prostaglandina de elección para el tratamiento de la HPP por atonía; ejerce su efecto uterotónico por incremento de la concentración de calcio intracelular. Está indicada como fármaco de tercera línea debido a los efectos secundarios y las contraindicaciones asociadas. Se administran 250 pg (1 ampolla) por vía IM. Se puede repetir cada 10 minutos hasta un máximo de 1 mg.
La prostaglandina E1 o misoprostol (Cytotec*), ha sido usado exitosamente para maduración cervical, está indicada en la profilaxis y el tratamiento de la HPP por atonía. Tiene una serie de ventajas respecto a otras prostaglandinas: bajo coste, larga vida media, no necesita refrigeración y es de fácil administración. Puede ser una alternativa a la oxitocina en lugares donde no hay disponibilidad de ésta, o bien, por su fácil administración (vía oral, vaginal, sublingual, bucal o rectal), pero ningún estudio ha demostrado que sea más eficaz. Respecto al manejo activo de la tercera fase del parto, no se justifica el uso de misoprostol si se puede hacer con uterotónicos convencionales. Los efectos secundarios más comunes son: náuseas, vómitos, diarrea, fiebre, escalofríos. La vía sublingual es la que tiene una menor variación a la absorción, esta se produce de forma rápida alcanzando una concentración plasmática más alta y dando lugar a una contracción uterina similar a la de la vía vaginal[8].
-
Conclusiones
La tendencia actual, es el uso racional de los fármacos ute- rotónicos en la profilaxis y tratamiento de la HPP, se trata de individualizar las dosis periparto, ajustándolas a cada escenario clínico y a los factores de riesgo de cada paciente. La oxitocina sigue siendo el fármaco de primera línea para la prevención y el tratamiento de la hemorragia posparto secundaria a hipoto- nía/atonía uterina. Se han demostrado mejorías en los resultados perioperatorios de los pacientes con el uso de algoritmos y modelos de comunicación más efectivos establecidos por protocolos claros que sirven de ayuda para un manejo y terapia adecuada, que nos permitirá utilizar la dosis mínima óptima de fármacos uterotónicos y de esta manera disminuir sus efectos secundarios maternos, fetales y neonatales.
Referencias
1. Abdul-Kadir R, McLintock C, Ducloy AS, El-Refaey H, England A, Federici AB, et al. Evaluation and management of postpartum hemorrhage: consensus from an international expert panel. Transfusion. 2014 Jul;54(7):1756–68. https://doi.org/10.1111/trf.12550 PMID:24617726
2. Sibai BM. 10 practical, evidence-based recommendations for managing severe postpartum hemorrhage. OBG Manag. 2011 Jun;23(6):44–8.
3. Balki M, Tsen L. Oxytocin protocols for cesarean delivery. Int Anesthesiol Clin. 2014;52(2):48–66. https://doi.org/10.1097/AIA.0000000000000016 PMID:24667448
4. Romero R, Dey SK, Fisher SJ. Preterm labor: one syndrome, many causes. Science. 2014 Aug;345(6198):760–5. https://doi.org/10.1126/science.1251816 PMID:25124429
5. Arrowsmith S, Wray S. Oxytocin: its mechanism of action and receptor signalling in the myometrium. J Neuroendocrinol. 2014 Jun;26(6):356–69. https://doi.org/10.1111/jne.12154 PMID:24888645
6. Kovacheva VP, Soens MA, Tsen LC. A Randomized, Double-blinded Trial of a “Rule of Threes” Algorithm versus Continuous Infusion of Oxytocin during Elective Cesarean Delivery. Anesthesiology. 2015 Jul;123(1):92–100. https://doi.org/10.1097/ALN.0000000000000682 PMID:25909969
7. Balki M, Erik-Souss M, Kingdom J, Carvalho JC. Comparative efficacy of uterotonic agents: in vitro contractions in isolated myometrial strips of labouring and non-labouring women. Can J Anesth/J Can Anesth (2014) 61: 808. https://doi.org/10.1007/s12630-014-0190-1.
8. Arrowsmith S, Kendrick A, Wray S. Drugs acting on the pregnant uterus. Obstetrics, Gynaecol Reprod Med. 2010 Aug;20(8):241–7. https://doi.org/10.1016/j.ogrm.2010.05.001 PMID:24443652
9. Inoue T, Kimura T, Azuma C, Inazawa J, Takemura M, Kikuchi T, et al. Structural organization of the human oxytocin receptor gene. J Biol Chem. 1994 Dec;269(51):32451–6. https://doi.org/10.1016/S0021-9258(18)31656-9 PMID:7798245
10. Michelini S, Urbanek M, Dean M, Goldman D. Polymorphism and genetic mapping of the human oxytocin receptor gene on chromosome 3. Am J Med Genet. 1995 Jun;60(3):183–7. https://doi.org/10.1002/ajmg.1320600303 PMID:7573168
11. Gimpl G, Fahrenholz F. The oxytocin receptor system: structure, function, and regulation. Physiol Rev. 2001 Apr;81(2):629–83. https://doi.org/10.1152/physrev.2001.81.2.629 PMID:11274341
12. Zeeman GG, Khan-Dawood FS, Dawood MY. Oxytocin and its receptor in pregnancy and parturition: current concepts and clinical implications. Obstet Gynecol. 1997 May;89(5 Pt 2):873–83. https://doi.org/10.1016/S0029-7844(97)00056-2 PMID:9166360
13. Kimura T, Takemura M, Nomura S, Nobunaga T, Kubota Y, Inoue T, et al. Expression of oxytocin receptor in human pregnant myometrium. Endocrinology. 1996 Feb;137(2):780–5. https://doi.org/10.1210/endo.137.2.8593830 PMID:8593830
14. Garfield RE. Control of myometrial function in preterm versus term labor. Clin Obstet Gynecol. 1984 Sep;27(3):572–91. https://doi.org/10.1097/00003081-198409000-00007 PMID:6488606
15. Balki M, Erik-Soussi M, Ramachandran N, Kingdom J, Carvalho JC. The Contractile Effects of Oxytocin, Ergonovine, and Carboprost and Their Combinations: an In Vitro Study on Human Myometrial Strips. Anesth Analg. 2015 May;120(5):1074–84. https://doi.org/10.1213/ANE.0000000000000682 PMID:25822922
16. Balki M, Erik-Soussi M, Kingdom J, Carvalho JC. Oxytocin pretreatment attenuates oxytocin-induced contractions in human myometrium in vitro. Anesthesiology. 2013 Sep;119(3):552–61. https://doi.org/10.1097/ALN.0b013e318297d347 PMID:23676375
17. Tsen LC, Balki M. Oxytocin protocols during cesarean delivery: time to acknowledge the risk/benefit ratio? Int J Obstet Anesth. 2010 Jul;19(3):243–5. https://doi.org/10.1016/j.ijoa.2010.05.001 PMID:20570503
18. Pinder AJ, Dresner M, Calow C, Shorten GD, O’Riordan J, Johnson R. Haemodynamic changes caused by oxytocin during caesarean section under spinal anaesthesia. Int J Obstet Anesth. 2002 Jul;11(3):156–9. https://doi.org/10.1054/ijoa.2002.0970 PMID:15321540
19. Langesaeter E, Rosseland LA, Stubhaug A. Hemodynamic effects of oxytocin during cesarean delivery. Int J Gynaecol Obstet. 2006 Oct;95(1):46–7. https://doi.org/10.1016/j.ijgo.2006.05.032 PMID:16920118
20. Thomas JS, Koh SH, Cooper GM. Haemodynamic effects of oxytocin given as i.v. bolus or infusion on women undergoing Caesarean section. Br J Anaesth. 2007 Jan;98(1):116–9. https://doi.org/10.1093/bja/ael302 PMID:17142825
21. Svanström MC, Biber B, Hanes M, Johansson G, Näslund U, Bålfors EM. Signs of myocardial ischaemia after injection of oxytocin: a randomized double-blind comparison of oxytocin and methylergometrine during Caesarean section. Br J Anaesth. 2008 May;100(5):683–9. https://doi.org/10.1093/bja/aen071 PMID:18385263
22. Jonsson M, Hanson U, Lidell C, Nordén-Lindeberg S. ST depression at caesarean section and the relation to oxytocin dose. A randomised controlled trial. BJOG. 2010 Jan;117(1):76–83. https://doi.org/10.1111/j.1471-0528.2009.02356.x PMID:19781043
23. McLeod G, Munishankar B, MacGregor H, Murphy DJ. Maternal haemodynamics at elective caesarean section: a randomised comparison of oxytocin 5-unit bolus and placebo infusion with oxytocin 5-unit bolus and 30-unit infusion. Int J Obstet Anesth. 2010 Apr;19(2):155–60. https://doi.org/10.1016/j.ijoa.2009.08.005 PMID:20194013
24. Sartain JB, Barry JJ, Howat PW, McCormack DI, Bryant M. Intravenous oxytocin bolus of 2 units is superior to 5 units during elective Caesarean section. Br J Anaesth. 2008 Dec;101(6):822–6. https://doi.org/10.1093/bja/aen273 PMID:18845650
25. Kim TS, Bae JS, Park JM, Kang SK. Hemodynamic effects of continuous intravenous injection and bolus plus continuous intravenous injection of oxytocin in cesarean section. Korean J Anesthesiol. 2011 Dec;61(6):482–7. https://doi.org/10.4097/kjae.2011.61.6.482 PMID:22220225
26. Sentilhes L, Vayssière C, Deneux-Tharaux C, Aya AG, Bayoumeu F, Bonnet MP, et al. Postpartum hemorrhage: guidelines for clinical practice from the French College of Gynaecologists and Obstetricians (CNGOF): in collaboration with the French Society of Anesthesiology and Intensive Care (SFAR). Eur J Obstet Gynecol Reprod Biol. 2016 Mar;198:12–21. https://doi.org/10.1016/j.ejogrb.2015.12.012 PMID:26773243
Edifix has not updated this reference because the article title in PubMed significantly differs from the author’s original. The PubMed reference is Sentilhes L, Vayssière C, Deneux-Tharaux C, Aya AG, Bayoumeu F, Bonnet MP, et al. Postpartum hemorrhage: guidelines for clinical practice from the French College of Gynaecologists and Obstetricians (CNGOF): in collaboration with the French Society of Anesthesiology and Intensive Care (SFAR). Eur J Obstet Gynecol Reprod Biol. 2016 Mar;198:12–21. (Ref. 26 “Sentilhes y cols. Postpartum hemorrhage, 2016”)
Edifix has not found an issue number in the journal reference. Please check the volume/issue information. (Ref. 26 “Sentilhes y cols. Postpartum hemorrhage, 2016”)
27. WHO guidelines for the management of postpartum haemorrhage and retained placenta; 2009.
28. American College of Obstetricians and Gynecologists. ACOG Practice Bulletin: Clinical Management Guidelines for Obstetrician-Gynecologists Number 76, October 2006: postpartum hemorrhage. Obstet Gynecol. 2006 Oct;108(4):1039–47. PMID:17012482
29. Royal College of Obstetricians and Gynaecologists: prevention and management of postpartum haemorrhage. RCOG Green-top Guideline No. 52.
30. Leduc D, Senikas V, Lalonde AB, Leduc D, Ballerman C, Biringer A, et al. Active Management of the Third Stage of Labour: Prevention and Treatment of Postpartum Hemorrhage. J Obstet Gynaecol Can. 2009 Oct;31(10):980–93. https://doi.org/10.1016/S1701-2163(16)34329-8.
31. Carvalho JC, Balki M, Kingdom J, Windrim R. Oxytocin requirements at elective cesarean delivery: a dose-finding study. Obstet Gynecol. 2004 Nov;104(5 Pt 1):1005–10. https://doi.org/10.1097/01.AOG.0000142709.04450.bd PMID:15516392
32. Balki M, Ronayne M, Davies S, Fallah S, Kingdom J, Windrim R, et al. Minimum oxytocin dose requirement after cesarean delivery for labor arrest. Obstet Gynecol. 2006 Jan;107(1):45–50. https://doi.org/10.1097/01.AOG.0000191529.52596.c0 PMID:16394038
33. George RB, McKeen D, Chaplin AC, McLeod L. Up-down determination of the ED(90) of oxytocin infusions for the prevention of postpartum uterine atony in parturients undergoing Cesarean delivery. Can J Anaesth. 2010 Jun;57(6):578–82. https://doi.org/10.1007/s12630-010-9297-1 PMID:20238255
34. Butwick AJ, Coleman L, Cohen SE, Riley ET, Carvalho B. Minimum effective bolus dose of oxytocin during elective Caesarean delivery. Br J Anaesth. 2010 Mar;104(3):338–43. https://doi.org/10.1093/bja/aeq004 PMID:20150347
35. Sweeney G, Holbrook AM, Levine M, y cols. Pharmacokinetics of carbetocin, a long-acting oxytocin analogue, in nonpregnant women. Curr Ther Res Clin Exp. 1990;47:528–40.
36. Attilakos G, Psaroudakis D, Ash J, Buchanan R, Winter C, Donald F, et al. Carbetocin versus oxytocin for the prevention of postpartum haemorrhage following caesarean section: the results of a double-blind randomised trial. BJOG. 2010 Jul;117(8):929–36. https://doi.org/10.1111/j.1471-0528.2010.02585.x PMID:20482535
37. Borruto F, Treisser A, Comparetto C. Utilization of carbetocin for prevention of postpartum hemorrhage after cesarean section: a randomized clinical trial. Arch Gynecol Obstet. 2009 Nov;280(5):707–12. https://doi.org/10.1007/s00404-009-0973-8 PMID:19229549
38. Su LL, Chong YS, Samuel M. Carbetocin for preventing postpartum haemorrhage. Cochrane Database Syst Rev. 2012;4:CD005457.
39. Khan M, Balki M, Ahmed I, Farine D, Seaward, Carvalho JC. Carbetocin at elective Cesarean delivery: a sequential allocation trial to determine the minimum effective dose. Can J Anesth/J Can Anesth (2014) 61:242–248
40. Cole NM, Carvalho JC, Erik-Soussi M, Ramachandran N, Balki M. In Vitro Comparative Effect of Carbetocin and Oxytocin in Pregnant Human Myometrium with and without Oxytocin Pretreatment. Anesthesiology. 2016 Feb;124(2):378–86. https://doi.org/10.1097/ALN.0000000000000940 PMID:26569172

 ORCID
ORCID

 Creative Commons Attribution
Creative Commons Attribution