Alexander García Castañeda1,*, Mario Villaveces1, Carlos Alberto Ortiz1
Recibido: 05-10-2022
Aceptado: 22-12-2022
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 4 pp. 422-425|https://doi.org/10.25237/revchilanestv52n04-17
PDF|ePub|RIS
Identification and successful timely treatment of malignant hyperthermia
Abstract
Malignant hyperthermia (MH) is an acute hypermetabolic pharmacogenetic syndrome triggered by succinylcholine and inhaled anesthetics; the prevalence of MH episodes ranges from 1:10,000 to 1:220,000 cases per administered anesthesia; there is a deregulation in intracellular calcium homeostasis generating muscle rigidity, high energy expenditure, increased VO, without timely treatment mortality is greater than 65% due to rhabdomyolysis, hyperkalaemia, increased CPK and múltiple organ failure, with treatment specific decreases to 10%. We report the first case of malignant hyperthermia in preschool with extubation and early hospital discharge after the crisis; It is a 2-year-old female with no previous history diagnosed with syndactyly since birth. She is scheduled for correction of congenital deformity. She is performed under a balanced general anesthetic technique with sevoflorane and remifentanil. At the second hour of surgery, she presents symptoms compatible with malignant hyperthermia (tachycardia). , hypercapnia, hyperthermia) treatment was started according to the SCARE protocol with maintenance doses of dantrolene for 24 h, extubation at 24 h and discharge on the third day with follow-up in an outpatient clinic without sequelae. This case report highlights the importance of timely recognition of malignant hyperthermia crisis, the early initiation of pharmacological and non-pharmacological treatment during and after the crisis, the use of cognitive aids such as SCARE crisis protocols and the training of health personnel as a determining factor of the morbidity and mortality of these patients.
Resumen
La hipertermia maligna (HM) es un síndrome farmacogenético agudo hipermetabólico, desencadenado por succinilcolina y anestésicos inhalados; la prevalencia de los episodios de HM va desde 1:10.000 hasta 1:220.000 casos por anestesia administrada; se produce una desregulación en la homeostasis del calcio intracelular generando rigidez muscular, alto gasto de energía, aumento del VO, sin un tratamiento oportuno la mortalidad es superior al 65% debido a rabdomiólisis, hiperpotasemia, aumento de CPK y falla multiorgánica, con el tratamiento específico disminuye al 10%. Reportamos el primer caso de hipertermia maligna en preescolar con extubación y egreso hospitalario temprano tras la crisis; se trata de femenina de 2 años sin antecedentes previos con diagnóstico de sindactilia desde el nacimiento se programa para corrección de deformidad congénita, se realiza bajo técnica anestésica general balanceada con sevoflorane y remifentanilo a la segunda hora de cirugía presenta sintomatología compatible con hipertermia maligna (taquicardia, hipercapnia, hipertermia) se inicia tratamiento según protocolo de la SCARE con dosis de mantenimiento de dantroleno por 24 h, extubación a las 24 h y egreso al tercer día con seguimiento en consulta externa sin secuelas. Este reporte de caso destaca la importancia de reconocer de manera oportuna la crisis de hipertermia maligna, el inicio temprano del tratamiento farmacológico y no farmacológico durante y después de la crisis, el uso de las ayudas cognitivas como son los protocolos de crisis de la SCARE y el entrenamiento del personal de salud como factor determinante de la morbimortalidad de dichos pacientes.
-
Introducción
La hipertermia maligna (HM) es un síndrome farmacogené- tico agudo hipermetabólico, desencadenado por succinilcolina y anestésicos inhalados (excepto óxido nitroso)[1].
Se caracteriza por signos como rigidez muscular, hipercapnia y aumento de la temperatura corporal que pueden progresar en menos de una hora a un trastorno metabólico irreversible[2], muestra tasas de mortalidad cercanas al 65% si no se emplea un tratamiento específico y oportuno[3]. La incidencia exacta de la hipertermia maligna es desconocida; la prevalencia de los episodios de HM va desde 1:10.000 hasta 1:220.000 casos por anestesia administrada[2], En un estudio realizado en Bogotá entre 1988 y 1990 se estimó una incidencia de 1:65.000 actos anestésicos[4].
Los pacientes sensibles solo desarrollan HM tras exponerse a fármacos específicos y excepcionalmente a calor extremo (golpe de calor) o actividad física extenuante. Dos tercios de los pacientes susceptibles manifiestan la HM tras administrarse la primera anestesia general y el tercio restante en anestesias posteriores[5]. La fisiopatología se explica a través de una mutación en los receptores de rianodina y de dihidropiridina con alteración en el control del Ca++ intracelular, es entonces cuando se genera un estado persistente posterior a la despolarización debido a agentes anestésicos volátiles o succinilcolina (Tabla 1) en el músculo esquelético con susceptibilidad genética de una hipercalcemia intracelular anormal, que genera una contracción muscular persistente por lo tanto, con un hiper- metabolismo con aumento en el consumo de ATP por lo que aumenta el VO2; el organismo intenta mantener el equilibrio a través del aumento del DO2; todos estos procesos clínicamente se refleja en un aumento del CO2, aumento en el gasto cardíaco a través de taquicardia, hipertermia y la activación de la vía anaeróbica con generación de lactato, cuando los mecanismos de equilibrio son superados inicia la rabdomiólisis con aumento de la CPK, mioglobina, hiperpotasemia, falla multiorgánica y finalmente la muerte si no hay un tratamiento oportuno[6].
El objetivo de este trabajo es reportar un caso clínico de una patología anestésica considera en Colombia como huérfana[7], y a partir del mismo exponer el diagnóstico y tratamiento oportuno con desenlace exitoso.
-
Presentación del caso
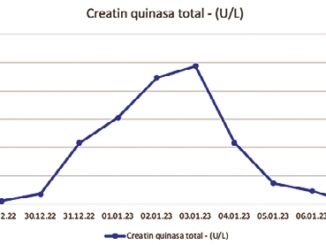
Paciente femenina de 2 años de edad quien ingresa al servicio de cirugía ambulatoria del Hospital Universitario de Santander con diagnóstico de sindactilia en segundo espacio interdigital de mano derecha programada para corrección en segundo espacio interdigital y plastias en z en primer espacio interdigital por parte del servicio de ortopedia, madre niega antecedentes médicos previos, se valora paciente a su ingreso con signos vitales peso: 11 kg FC: 134 L/MIN , SatO2: 97%, T° 36.2 °C TA: 96/52 ansiosa poco colaboradora por lo cual se indica premediación con midazolam 5 mg vía oral + acetaminofén 150 mg vía oral, se traslada a salas de cirugía, se realiza lista de chequeo, se procede a realizar inducción anestésica con signos vitales TA: 92/50 mmHg FC: 115 L/MIN FR: 30 resp/min SatO2: 99% FIO2: 21%, se realiza previa saturación del circuito de anestesia con sevoflorane con el dial ubicado en 8% y flujo 4 Ltr/min con Fio2: 100% por 2 minutos inmediatamente se procede a oxigenación y ventilación con máscara facial, se asegura vía endovenosa y se administra fentanilo 50 mcg logrando condiciones óptimas para realizar maniobra de IOT con tubo # 3.5 mm con neumotaponador, procedimiento exitoso sin complicaciones, posterior a la inducción signos vitales de TA: 68/32 mmHg FC: 100 L/min SatO2: 99% ETCO2: 35, ventilador en modo asistido controlado por volumen FR: 30 VT: 75 FIO2: 70% I:E 1:2 procedimiento transcurre sin complicaciones durante 2 horas, momento en el cual se evidencia taquicardia sinusal de 150 L/min, con TA: 94/60 mmHg T°: 40,8°C, ETCO2: 54, se abordan diagnósticos diferenciales (Tabla 2) se concluye sospecha de hipertermia maligna, se activa el sistema de emergencia, se toma como guía los algoritmos de crisis de la SCARE (Figura 1), se solicitan gases arteriales, resultados posterior a el primer abordaje de la crisis con pH 7,31 PaCO2: 40 PaO2 86,7 CHO3:20 PAFI 124 Lactato sérico: 1,19 BE -5,7 Hemoglobina: 11,49 g/dl, K +: 5,8 mEq/l, Ca++ sérico: 4,59 mEq/l, Na+ sérico: 140 mEq/l, adicionalmente se obtienen reportes de creatinina sérica: 0,29 mg/dl, TP: 15,6 seg, TPT: 38,8 seg, INR: 1,15, por problemas técnicos en la recolección de muestra durante la crisis se vuelven a repetir toma de muestras después de 8 h de iniciada la crisis donde se obtienen los siguientes resultados creatin quinasa: 67 U/L y cuadro hemático: HB 8,4 mg/dl, HTO 26,7% Leucocitos: 9.730 U/L Linfocitos: 18,6%, Neutro- filos: 71,2%, Plaquetas 192.000/L, los signos vitales posterior al abordaje de la crisis fueron: T: 36,5°C FC: 102 SatO2: 100% FIO2: 100% ETCO2: 37 por lo que se suspende bolos de dantroleno y se traslada a la UCIP con ventilación mecánica invasiva, infusión para sedación con midazolam 0,3 mg/kg/h se indica a la UCIP manejo con dantroleno a 1 mg/kg cada 6 h por 24 h, extubación a las 24 h exitosa seguimiento clínico y paraclínico por 48 h sin alteraciones por lo que se da egreso al tercer día, seguimiento a las 2 semanas en consulta externa con paciente en buenas condiciones de salud sin secuelas con indicación de cita control por ortopedia, anestesiología y consejería genética.
| Tabla 1. Desencadenante de crisis de hipertermia maligna | ||
| Anestésico | Frecuencia | % |
| (+) succinilcolina; Anestésico volátil (-) | 2 | 0,7 |
| (+) succinilcolina; Anestésico volátil (+) | 153 | 53,9 |
| (-) succinilcolina; Anestésico volátil (+) | 128 | 45,1 |
| (-) succinilcolina; Anestésico volátil (-) | 1 | 0,4 |
Carranza Zamora, A. J., Mora Sandino, V., & Villalobos Vega, E. (2020). Presentación, diagnóstico y tratamiento de hipertermia maligna. Revista Medica Sinergia, 5(7), e530. https://doi.org/10.31434/rms.v5i7.530 , estudio en 284 pacientes con hipertermia maligna.

Figura 1. Algoritmo de manejo crisis de hipertermia maligna.
| Tabla 2. Diagnósticos diferenciales | |
| Diagnóstico | Características clínicas
– Hipotensión – Broncoespasmo |
| Anafilaxia | – Presión elevada de la vía aérea
– Taquicardia – Urticaria – Taquicardia |
| Anestesia o analgesia insuficiente | – Hipertensión
– Diaforesis, cambios pupilares – Alteración de curva de capnografía |
| Sepsis | – SIRS
– QSOFA |
| Hipertiroidismo | – Hipertermia
– Taquicardia – Hipotensión – Hipopotasemia |
Carranza Zamora, A. J., Mora Sandino, V., & Villalobos Vega, E. (2020). Presentación, diagnóstico y tratamiento de hipertermia maligna. Revista Medica Sinergia, 5(7), e530. https://doi.org/10.31434/rms.v5i7.530
-
Discusión
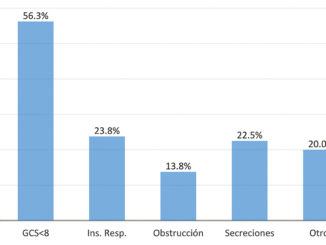
La hipertermia maligna por exposición a agentes anestésicos, constituye un síndrome de carácter hereditario autosómico dominante con una epidemiologia muy variable debido a su baja incidencia, dificultad diagnóstica que implican casos subdiagnosticados por presentar sintomatología leve; por lo cual, el conocimiento de los factores predisponentes a este síndrome, el riguroso interrogatorio clínico en la valoración preanestésica, el conocimiento de la sintomatología típica y atípica que van desde la variabilidad de la presentación por edades como ejemplo, la piel moteada en niños de 0 a 24 meses, de 25 meses a 12 años ETCO2 alto y el espasmo de los maseteros, de los 13 a 18 años el potasio sérico elevado y excesiva sudoración[8], así como identificar la frecuencia con la que se presentan los síntomas (Tabla 3)[9] facilita el reconocimiento oportuno de la crisis que es uno de los pilares primordiales que ha marcado la diferencia en mortalidad en los casos reportados a nivel global.
Otro de los hitos que a marcado diferencia en mortalidad es el uso oportuno de dantroleno, el único medicamento disponible para el tratamiento específico durante la crisis y posterior a ella para evitar recaídas en las primeras 48 h, aunque representa una carga económica muy alta para las instituciones dado que un kit completo está compuesto por 36 ampollas de 20 mg que tienen una vida media muy corta[3], en Colombia la SCARE propone la conformación de redes hospitalarias que compartan dicho kit para disminuir gastos pero principalmente para poder garantizar dicho medicamento, dado que es obligatorio tenerlo en sitios donde se usen anestésicos que predisponen a la hipertermia maligna.
Actualmente, las ayudas cognitivas como las listas de crisis propuestas por la SCARE y los talleres de simulación de crisis han demostrado que mejoran la capacidad de respuesta ante estas situaciones de estrés teniendo impacto en la mortalidad de los pacientes; en este caso en particular el reconocimiento oportuno de los síntomas como la hipercapnia, la taquicardia, la hipertermia, la consideración de los diagnósticos diferenciales (Tabla 2)[10], la activación del protocolo de crisis en anestesia y ayudas cognitivas propuestos por la SCARE, la disponibilidad del dantroleno para el bolo y el mantenimiento por 24 h más el seguimiento paraclínico y la disponibilidad de UCIP fue determinante para el desenlace exitoso de este caso clínico antes presentado; sin embargo, es de resaltar la importancia del fortalecimiento de las redes hospitalarias para mantener la disponibilidad de kits completos de dantroleno, la necesidad de capacitación del personal de salud frente a las crisis en anestesia y la importancia de la comunicación permanente del equipo de sanidad que atienda la crisis.
Tabla 3. Frecuencia de las manifestaciones clínicas
| Manifestaciones | Frecuencia (IC) |
| Manifestaciones tempranas | |
| Hipercapnia | 92% (89-95%) |
| Taquicardia sinusal | 73% (67-78%) |
| Rigidez muscular | 41% (35-47%) |
| Taquipnea | 27% (22-33%) |
| Espasmo del masetero | 27% (21-32%) |
| Manifestaciones clínicas tardías | |
| Hipertermia | 52% (46-58%) |
| Sudoración | 18% (13-22%) |
| Coluria | 14% (10-18%) |
| Cianosis | 9% (6-13%) |
| Piel moteada | 6% (3-9%) |
| Manifestaciones paraclínicas | |
| CK > 100 U/L | 100% (99-100%) |
| CK 100-20.000 U/L | 65% (42-87%) |
| CK > 20.000 U/L | 35% (13-58%) |
| Mioglobinuria | 41% (18-65%) |
| Acidosis mixta | 29% (8-51%) |
Referencias
1. Rosenberg H, Pollock N, Schiemann A, Bulger T, Stowell K. Malignant hyperthermia: a review. Orphanet J Rare Dis. 2015 Aug;10(1):93. https://doi.org/10.1186/s13023-015-0310-1 PMID:26238698
2. Bandschapp O, Girard T. Malignant hyperthermia. Swiss Med Wkly. 2012 Jul;142:w13652. https://doi.org/10.4414/smw.2012.13652 PMID:22851008
3. Rincón-Valenzuela DA, Sessler DI. Hipertermia maligna. (2015). Tratado de Anestesia Pediátrica. Bogotá: Editorial S.C.A.R.E, p. 1034–72.
4. Neira VM. Hipertermia maligna en Bogotá. Rev Colomb Anestesiol. 1993;21(4):385–96.
5. Wappler F. Malignant hyperthermia. Eur J Anaesthesiol. 2001 Oct;18(10):632–52. https://doi.org/10.1097/00003643-200110000-00002 PMID:11553240
6. Rincón David A, Sessler Daniel I. Hipertermia Maligna. Crisis en anestesiología SCARE 2013. www.HipertermiaMaligna.co
7. Ley 1392 de 2010. Ley 1438 de 2011.
8. Kollmann-Camaiora A, Alsina E, Domínguez A, Del Blanco B, Yepes MJ, Guerrero JL, et al. Protocolo clínico asistencial de manejo de la hipertermia maligna. Rev Esp Anestesiol Reanim. 2017 Jan;64(1):32–40. https://doi.org/10.1016/j.redar.2016.06.004 PMID:27633384
9. Larach MG, Gronert GA, Allen GC, Brandom BW, Lehman EB. Clinical presentation, treatment, and complications of malignant hyperthermia in North America from 1987 to 2006. Anesth Analg. 2010 Feb;110(2):498–507. https://doi.org/10.1213/ANE.0b013e3181c6b9b2 PMID:20081135
10. Carranza Zamora AJ, Mora Sandino V, Villalobos Vega E. Presentación, diagnóstico y tratamiento de hipertermia maligna. Revista Medica Sinergia. 2020;5(7):e530. https://doi.org/10.31434/rms.v5i7.530.

 ORCID
ORCID