Germán Soto1, Juan José Guerra Londono2,3, Juan P. Cata2,3,*
Recibido: 18-11-2023
Aceptado: 20-11-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 8 pp. 768-775|https://doi.org/10.25237/revchilanestv52n8-12
PDF|ePub|RIS
Antiproliferative effects of intravenous lidocaine and recurrence of cancer and cancer recurrence
Abstract
Backround: Current evidence suggests that oncologic surgery, therapeutics used in treatment of solid tumors, may paradoxically increase the risk of metastasis due to stress, immunosuppression, and perioperative inflammation. Lidocaine is an amide-type local anesthetic commonly used in oncologic surgery. Lidocaine has analgesic, anti-inflammatory and immunomodulatory properties, allowing it to reduce the neuroendocrine response to stress. Preclinical studies also indicate that lidocaine in vitro and in vivo induces cytotoxic effects by interfering with the pathogenic processes of tumor progression and metastasis. Objectives: In this context, the working hypothesis of several clinical investigations has been that intravenous administration of lidocaine perioperatively would reduce tumor progression. This narrative review aims to summarize the current evidence on the antiproliferative mechanisms of lidocaine and its possible influence on cancer recurrence.
Resumen
Introducción: La evidencia actual sugiere que la cirugía oncológica, terapéutica utilizada en tratamiento de tumores sólidos, paradójicamente podría incrementar el riesgo de metástasis debido al estrés, inmunosupresión e inflamación perioperatoria. La lidocaína es un anestésico local tipo amida comunmente usada en cirugía oncológica. La lidocaína tiene propiedades analgésicas, antiinflamatorias e inmunomoduladoras, permitiendo reducir la respuesta neuroendocrina al estrés. Estudios preclínicos también indican que la lidocaína in vitro e in vivo induce efectos citotóxicos, al interferir en los procesos patogénicos de progresión y metástasis tumoral. Objetivos: En este contexto, la hipótesis de trabajo de varias investigaciones clínicas, ha sido que la administración intravenosa de lidocaína perioperatoria reduciría la progresión tumoral. Esta revisión narrativa tiene como objetivo resumir la evidencia actual sobre los mecanismos antiproliferativos de la lidocaína y su posible influencia en la recurrencia de cáncer.
-
Introducción
Efectos directos de la lidocaína sobre células tumorales
En Latino América y el Caribe se diagnosticaron aproximadamente 1,5 millones de nuevos cánceres en el 2022. Cáncer es la causa número dos de muerte en el mundo después de enfermedad cardiovascular y se ha estimado que 700.000 muertes ocurren anualmente debido a cáncer en Latino América y el Caribe[1].
Evidencia actual sugiere que la cirugía oncológica, terapéutica utilizada en tratamiento de tumores sólidos, paradójicamente podría incrementar el riesgo de metástasis[2]. Estudios preclínicos han sugerido que la cirugía asociada a injuria tisular, podría estimular la progresión cancerígena debido al crecimiento de tumores “dormidos” distantes o micrometastasis[3],[4]. Inflamación, estrés quirúrgico (catecolaminas) e inmunosupresión han sido marcados como mecanismos contribuyentes de recurrencia de cáncer posquirúrgica[5].
Datos experimentales sugieren que las diferentes drogas anestésicas podrían impactar negativa o positivamente sobre los mecanismos involucrados en progresión tumoral[5]-[7]. Entre los anestésicos locales, la lidocaína, fue motivo de numerosas investigaciones preclínicas y clínicas. Administrada de forma intravenosa (IV), la lidocaína posee propiedades analgé- sicas[2],[3], antiinflamatorias[9] e inmunomoduladoras[10]. El efecto analgésico se ejerce principalmente por el bloqueo de canales de sodio dependientes de voltaje (CSDV), en tejidos neuronales centrales y periféricos[7]. Otros receptores como N- acetil-D-aspartato (NMDA), canales de K+, canales de Ca++, sistema glicinérgico, pueden ser bloqueados por la lidocaína contribuyendo con sus efectos antinociceptivos[8]. Respecto a sus efectos antiinflamatorios, la lidocaína bloquea pasos de la respuesta inflamatoria sistémica, modulando la marginación, la adherencia y la diapédesis de polimorfonucleares hacia el sitio de la lesión[9]. Al interferir en la respuesta inflamatoria, provoca acciones inmunomoduladoras, bloqueando la degradación lisosomal de los neutrófilos, la producción de especies reactivas de oxígeno y la secreción de citoquinas, tanto en macrófagos como en células gliales[10]. En cultivos de microglias, la lido- caina inhibe la liberación de citoquinas proinflamatorias como la interleucina-(IL-)ip), factor de necrosis tumoral-a (TNF-a), e IL-6[10].
Estudios in vitro e in vivo demuestran que la lidocaína induce efectos citotóxicos, interfiriendo en los procesos patogénicos de progresión y metástasis tumoral[4]-[8]. En células cancerígenas, la lidocaína bloquea CSDV 4, induce apoptosis[5]-[8], altera la formación de moléculas de adherencia (ICAM-i) 96, disminuye la disponibilidad de calcio intrace- lular[i7],[i8] y modula la expresión de micro ARNs[i9],[20]. Estos hallazgos junto a datos que surgen de trabajos retrospectivos, abren la posibilidad de estudios clínicos aleatorios prospectivos sobre la administración de lidocaina IV y su posible relación con la recurrencia de cáncer. Esta revisión narrativa tiene como objetivo describir las propiedades an- tiproliferativas de la lidocaína, que realiza mediante efectos directos sobre células tumorales, y efectos inmunomodu- ladores en marcadores sistémicos. También, se discutirá la evidencia clínica, con respecto a los efectos de lidocaína en progresión tumoral, después de cirugía oncológica con intento curativo.
-
Bloqueo de canales de sodio dependientes de voltaje
Las células tumorales expresan CSDV en una gran variedad de carcinomas, incluyendo el de mama, cuello uterino, colon, pulmón (células pequeñas, no células pequeñas y mesotelioma), piel, ovario y próstata[21]. Uno de los CSDV más investigado en tumor de mama, es la variante neonatal CSDV 1,5[22]. Se ha demostrado in vitro que el bloqueo de CSDV 1,5, reduce la invasión celular, mientras que su activación de CSDV aumenta la movilidad y la invasión, destacándose la importancia de estos canales en el proceso de metástasis[23]. De esta manera al activarse CSDV, las células tumorales se comportan como «eléctricamente excitables», tornándose hiperactivas y adquiriendo agresividad. Este fenómeno se lo conoce como efecto CELEX (Celular Excitability), el cual representa una hipótesis de progresión metastásica tumoral[24].
Lidocaína tiene efectos directos sobre células tumorales, bloqueando específicos CSDV. Al respecto, Chamaroux-Tran et al., demostraron que lidocaína a concentraciones crecientes (0, 1, 0,5, 1,5 y 10 mM), reduce in vitro la migración y viabilidad en líneas celulares de cáncer de mama altamente metastásico (MDA-MB-231), incluyendo células de alta malignidad como triple negativo y HER2 positivo[11] (Tabla 1). En este sentido, Fraser et al., proponen que el uso de anestésicos locales intra y posquirúrgicos, al bloquear los CSDV, podría reducir el poder metastásico de las células tumorales, reduciendo su motilidad e invasividad[24].
-
Inducción de apoptosis
Se denomina apoptosis al proceso de muerte celular programada, caracterizado por cambios morfológicos y bioquímicos, que tiene como desenlace la activación de enzimas líticas llamadas caspasas[25]. Estudios demuestran propiedades anti- proliferativas de la lidocaína mediante la inducción de apoptosis, en diferentes cultivos de células tumorales[12]-[15] (Tabla 1) Chang et al., hallaron en células tumorales de tiroides, que lidocaína incrementa proteínas proapoptóticas (Bax) y disminuye proteínas antiapoptóticas (Bcl-2), situadas en la mitocondria. Esta modificación permite liberación de citocromo C mitocon- drial al citosol, activando caspasas, las cuales inicia el proceso de apoptosis[12] (Tabla 1) En otro estudio, Xing et al., demostraron inducción de apoptosis en células de hepatocarcinoma (HepG2), al ser expuestas a lidocaína. El mismo estudio, en un modelo xenográfico in vivo, la exposición de lidocaína disminuyó el desarrollo tumoral, y aumentó la susceptibilidad a la quimioterapia con cisplatino[15]. En concordancia con estos resultados, investigaciones realizadas por Lirk et al., evidencian que la lidocaína interfiere en el proceso de regulación genética, alterando la metilación de ADN en cultivos de células cancerígenas. La metilación es catalizada por la enzima ADN metil- transferasa (DNMT1), cuya función es considerada primordial en la patogenia tumoral, y su inhibición reduce el crecimiento tumoral[26]. Se especula que la lidocaína altera la metilación, al inhibir DNMT1 (Tabla 1).
-
Efecto sobre la expresión de moléculas de adherencia intracelular (ICAM)
La barrera endotelial juega un rol transcendental en la progresión tumoral, cuya actividad es regulada principalmente por la proteína Src tirosina quinasa[27]. Src es activada por citoqui- nas inflamatorias liberadas por el estrés quirúrgico como TNFa, permitiendo la síntesis a novo de moléculas de adherencia in- tracelular-1 (ICAM-1), iniciando la adhesión y transmigración de los neutrófilos[27]. Se sabe que las células tumorales pueden sintetizar ICAM-1, permitiendo la unión al neutrófilo, teniendo como consecuencia la extravasación y la transmigración. En referencia a lo anterior, Piegeler et al., hallaron que lidocaína preserva la integridad de la barrera endotelial modulando Src tirosina quinasa, evitando el escape de células tumorales hacia la circulación sistémica, necesario en la generación de metásta- sis[16]. Estudios in vitro usando células endoteliales microvasculares de pulmón incubadas con TNFa, lidocaína o ropivacaina, sugieren que ambos anestésicos locales bloquearían el receptor para TNFa (RTNFa), impidiendo la activación de Src y la síntesis de ICAM[16] (Tabla 1).
-
Efecto sobre el flujo de calcio
Nueva evidencia demuestra las células tumorales utilizan Ca++ para movilizarse, mediante receptores de calcio transitorios tipo V6 (Transient Receptor Potential channel subfamily V, member 6, TRPV-6). TRPV-6 han sido hallados en gran variedad de células tumorales, incluyendo mama, ovario y próstata[17]. Al respecto, Jiang et al., hallaron disminución de la expresión de los canales TRPV-6 en células tumorales de mama (MDA- MB-231), al ser expuestas a lidocaína durante 12 h[18] (Tabla 1). La disminución de la disponibilidad de calcio intracelular, inhibe la migración y la invasión en células cancerígenas.
-
Efecto sobre microARN
Los microARNs (miARN) representan un grupo de ARN no codificantes de secuencia corta (20-24 nucleótidos), que ejercen importantes funciones reguladoras postranscripciona- les[28]. Actúan principalmente como reguladores negativos de la expresión genética, inhibiendo la síntesis de proteínas. Específicamente, los miARN se unen a mARN (ARN mensajeros), pudiendo actuar inhibiendo la transducción, o bien degradando el mARN[19]. Al respecto, estudios indican que la lidocaína induce modulación de diferentes microARNs. En este contexto, Sun et al., hallaron que la exposición de lidocaína a células tumorales pulmón incrementa la expresión de miR-539, el cual inhibe la expresión del receptor epidermal growth factor (EGFR), bloqueando la invasión y la migración[20] (Tabla 1). En otra investigación en células de carcinoma gástrico, Sui et al., demostraron que la exposición a lidocaína incrementa la expresión de miR-145, el cual bloquea la invasión tumoral al inhibir las vías de activación MEK/ERK y NF-kB[20].
Tabla 1. Efectos directos in vitro e in vivo de lidocaína sobre células tumorales
| Mecanismo de acción | Efecto en célula tumoral | Línea celular | Tipo de estudio | Referencia |
| Bloqueo CSDV | Disminución progresión y migración celular en CENM comparado con CETM
Mejora supervivencia en ratones |
Células cancerígenas de mama (MCF-7 luminal A, MDA-MB-231 triple-negative y SKBr3 HER2 positive) | In vitro e in vivo | Charaux-Tran et al. (Ref 11) |
| Apoptosis | Disrupción m i tocon d ria l, liberación de Citocromo C, activación de caspasas 3 y7, incremento radio Bax/Bcl-2 | Células cancerígenas de tiroides (8505C y K1) | In vitro e in vivo | Chang et al. (Ref 12) |
| Apoptosis | Estimula MAPK, produce disrupción mitocondrial y desregulación de ERO | Células cancerígenas de pulmón (NSCLC A549 y H520) | In vitro | Wang et al. (Ref 14) |
| Apoptosis | Estimula ERK / y p38, incremento radio Bax/Bcl-2 y activación de caspasas-3, en ratones aumenta la susceptibilidad a Cisplatino | Células cancerígenas de hígado (HepG2) | In vitro e in vivo | Xing et al. (Ref 15) |
| Bloqueo ICAM | Bloqueo de activación Src inducida por TNF-a, con bloqueo de la fosforilación de ICAM-1 | Células cancerígenas de pulmón (NCI-H838) | In vitro | Piegeler et al. (Ref 15) |
| Bloqueo flujo calcio | Inhibición expresión de TRPV- 6, y bloqueo flujo de Ca++ intracelular | Células cancerígenas de mama (MDA-MB-231), OVARIO (PC-3) Y PROSTATA (S-2) | In vitro | Jiang et al. (Ref 18) |
| Demetilación de ADN | Inhibición de metilación en tiempo y dosis dependiente a la exposición de lidocaina | Células cancerígenas de mama BT-20 (ER-negative) y MCF-7 (ER-positive) | In vitro | Lirk et al. (Ref 26) |
| Efecto sobre microARN | Incrementa la expresión de miR- 539, bloquea receptor EGFR | Células cancerígenas de pulmón (A549 y NCI-H1299) | In vitro | Sun et al. (Ref 19) |
| CSDV: Canales de Sodio Dependientes de Voltaje; ICAM: Moléculas de Adherencia Intracelular; TRPV-6: Receptor de Calcio Transitorio Tipo V-6; CENM: células epiteliales normales de mama; CETM: células epiteliales tumorales de mama; ERO: especies reactivas de oxígeno; MAPK: mitogen-activated protein kinase; ERK: extracellular signal-regulated kinase. | ||||
Resumiendo, diferentes estudios demuestran una acción multimolecular de la lidocaína sobre células tumorales, las cuales podría disminuir el riesgo de metástasis (Tabla 1) (Figura 1).
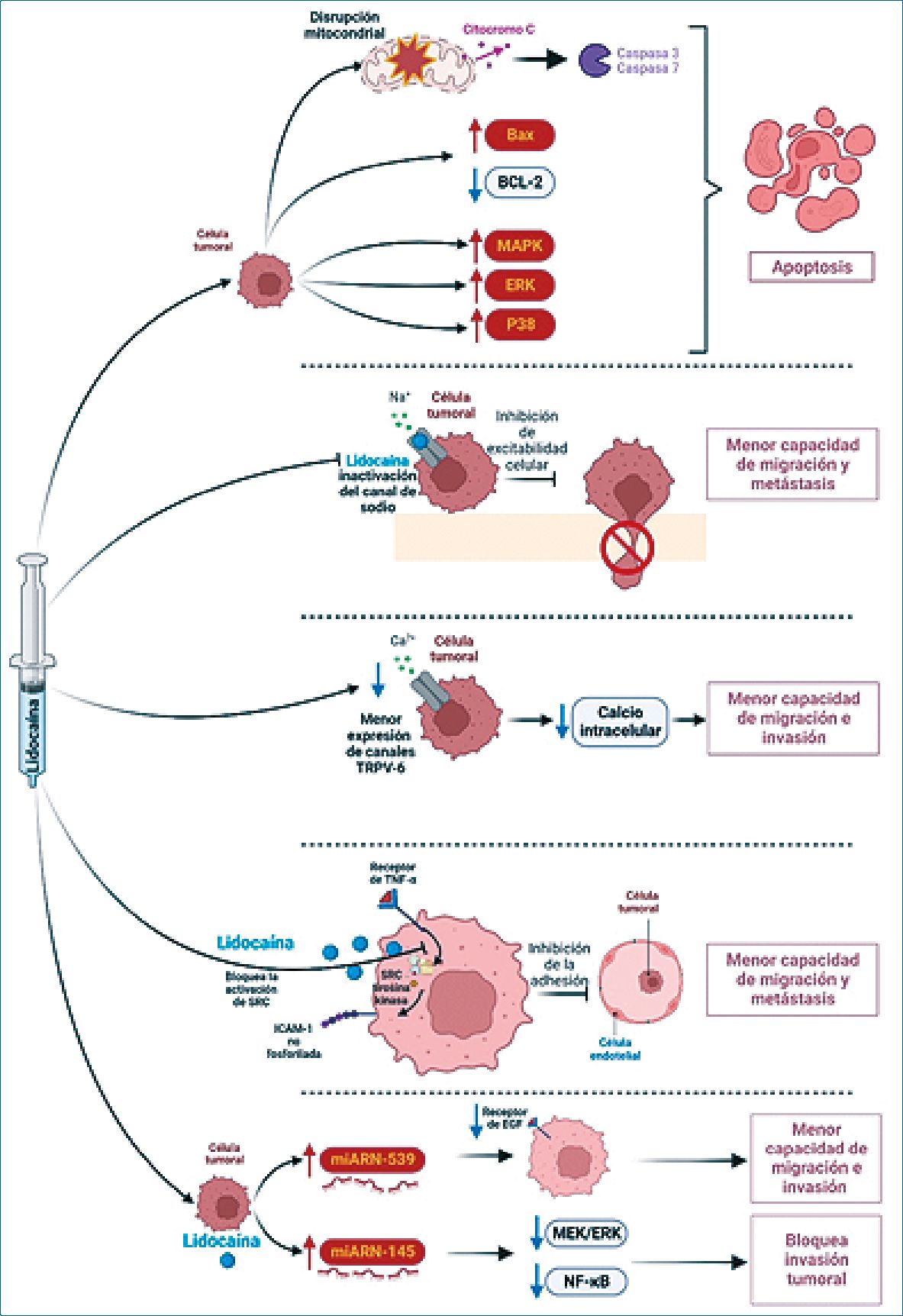
Figura 1. Se muestran los diferentes efectos de la lidocaína sobre células tumorales: inducción de apoptosis, bloqueo de canales de sodio dependiente de voltaje, bloqueo de canales de calcio ((TRPV-6), bloqueo de moléculas de adherencia intracelular (ICAM) y los efectos sobre micro ARN. (Creada usando BioRender®).
-
Efectos antinflamatorios e inmunomoduladores
-
Efectos sobre la liberación de citoquinas
Las citoquinas son glucoproteínas o proteínas de bajo peso molecular producidas por el inicio o la fase efectora de la respuesta inmune, secretadas por la activación de leucocitos, fibroblastos, células neuronales y endoteliales[29]. Se conoce que lidocaína y otros anestésicos locales pueden influenciar en la secreción de citoquinas[14]. En relación a lo expresado, Ortiz et al., hallaron disminución de los niveles de IL-1, IL-6, TNF-a y IFN-y a las 24 h, en grupo lidocaína IV (bolo 1,5 mg.kg-1 luego 3 mg.kg-1.h-1, hasta 1 h posterior a la cirugía) versus placebo, en pacientes (n = 43) sometidos a cirugía no oncológica[30]. En otro estudio, en pacientes (n = 60) sometidos a cirugía oncológica de colon, Herroeder et al., hallaron menores niveles de IL-6, IL-8, IL-1ra a las 2 h y al tercer día posoperatorio, en grupo lidocaína IV (bolo 1,5 mg.kg-1 seguido de 3 mg.kg-1.h-1 hasta 4 h posterior a la cirugía) versus placebo[31]. En contraposición, un reciente estudio realizado por Ostovic et al., no se halló diferencia respecto a niveles de IL-6, IL-8, proteína C reactiva y recuento leucocitario en cirugía abierta de colon (n = 82), en grupos tratados con lidocaína IV (bolo 1 mg.kg-1 luego infusión de 2 mg. kg-1.h-1) versus ketamina IV (bolo 0,5 mg/kg, luego infusión de 0,2 mg. kg-1.h-1), o lidocaina más ketamina IV[32] (Tabla 2). Los diferentes resultados pueden deberse a diferentes dosis, duración de infusión posoperatoria y tiempo de dosaje de citoquinas, utilizados en los diferentes estudios. Se especula que la lidocaína, al disminuir la liberación de citoquinas, podría contribuir a bloquear las señales de proliferación y metástasis[5].
Tabla 2. Efectos antiinflamatorios e inmunomoduladores en marcadores sistémicos
| Mecanismo de acción | Dosis de lidocaína IV | Resultados | Tipo de cirugía | Referencia |
| Efecto sobre citoquinas | Bolo 1,5 mg/kg1 luego infusión 3 mg.kg1.h1 (hasta 1 hora posterior a cirugía) | Disminución IL-1, IL-6, TNF-a y IFN-y (Grupo lidocaína vs placebo) | Cirugía no oncológica (Colecistectomía VDLP) | Ortiz et al. (Ref 30) |
| Efecto sobre citoquinas | Bolo 1,5 mg/kg1 luego infusión 3 mg.kg1.h1 (hasta 4 hora posterior a cirugía) | Disminucion il-6, IL-8, IL-1ra (grupo lidocaína vs placebo) | Cirugía oncológica (Colectomía) | Herroeder et al. (Ref 31) |
| Efecto sobre citoquinas | Bolo 1,5 mg/kg1 luego infusión 3 mg.kg1.h1 | No diferencia IL-1, IL-8, PCR, recuento leucocitario (Grupo lidocaína vs ketamina vs lidocaína más ketamina vs placebo) | Cirugía abierta de colon | Ostovic et al. (Ref 32) |
| Efecto sobre NETosis y progresión tumoral | Bolo 1,5 mg/kg1 luego infusión 3 mg.kg1.h1 (hasta 24 h posterior a cirugía) | Disminución marcadores H3Cit, MPO, MMP-3 (Grupo lidocaína vs placebo) | Cirugía de cáncer de mama | Galos et al. (Ref 35) |
| Efecto sobre NETosis y progresión tumoral | Bolo 2 mg/kg1 luego infusión
1,5 mg.kg1.h1 |
Disminución marcadores H3Cit Y MPO-DNA (Grupo lidocaína) | Cirugía de cáncer de páncreas | Zhang et al. (Ref 36) |
| Efecto sobre NETosis y progresión tumoral | 8 mg.kg1.h1 (15 min) luego infusión 2 mg.kg1.h1 luego
2 mg.kg1.h1 (hasta 24 h posterior a cirugía) |
Disminución marcadores H3Cit, MPO, MMP-3, MMP- 9 Y VEGF-A (Grupo lidocaina mas dexmedetomidina) | Cirugía de cáncer pulmonar | Ren et al. (Ref 37) |
| Efecto sobre función leucocitaria | Bolo 1,5 mg/kg1 luego infusión 1,5 mg.kg1.h1 | Modula liberación IFN-y e IL-4 (preserva balance Th1/ Th2). Disminuye marcador de inflamación HMGB1 | Histerectomía por cáncer cervical | Wang et al. (Ref 41) |
| Efecto sobre Función leucocitaria | 8 mg.kg1.h1 (15 min) luego infusión 2 mg.kg1.h1 luego
2 mg.kg1.h1 (hasta 24 h posterior a cirugía) |
Modula liberación IFN-y e IL-4. Preserva función células NK | Cirugía de cáncer pulmonar | Ren et al. (Ref 37) |
IL-6: Interleuquina 6; IL-8: Interleuquina 8; IL-4: Interleuquina 4; TNF-a: Factor de Necrosis Tumoral a; IFN-y: Interferon y; H3Cit: Histona Citrulinada, MPO: Mioloperoxidasa, MMP-3: Matrix Metaloproteinasa 3; Células NK: Natural killer.
-
Efectos sobre el proceso de NETosis
El proceso de NETosis, (Neutrophil Extracellular Trapping) es una respuesta inmunológica debido a la presencia de antí- genos o células tumorales circulantes, en cual los neutrófilos degranulan al torrente sanguíneo histonas de ADN y matrix metaloproteinasas (MMP)[33]. NETosis es proceso inmunológico fuertemente ligado a incremento de riesgo de metásta- sis[34]. Al respecto, Galos et al., estudiaron dos marcadores de NETosis: histona citrulinada (H3Cit) y mieloperoxidasa (MPO), junto a otros marcadores de progresión tumoral como VEGF-A (vascular endothelial growth factor-A), MMP-3 y MMP-9, 24 h posteriores a la cirugía[35]. El estudio se llevó a cabo en mujeres con cáncer de mama (n = 120) comparando dos técnicas anestésicas (propofol IV versus sevofluorano) con o sin infusión de lidocaína IV (bolo 1,5 mg.kg-1 luego infusión 3 mg. kg-1.h-1 intraoperatoria; reducida a 1 mg. kg-1.h-1 24 h posteriores a la cirugía). Los autores hallaron que el agregado de lidocaína IV, tanto en anestesia basada en propofol IV como inhalatoria, reduce marcadores de NETosis (H3Cit y MPO) y MMP-3. En concordancia con estos resultados, Zhang et al., hallaron que la lidocaína IV (bolo 1,5 mg.kg-1 seguido de 2 mg. kg-1.h-1) disminuyo marcadores de NETosis (H3Cit) y de complejos MPO-DNA, en pacientes sometidos a pancreatectomía, sin hallar diferencias al ser comparado con placebo[36]. Los autores señalan que estas diferencias, se deben a que no se alcanzaron adecuadas concentraciones de lidocaína en el microambiente tumoral (Tabla 2). En otro reciente estudio (n = 132), Ren et al., hallaron que la combinación de lidocaína IV (8 mg.kg-1.h-1 15 min, luego 2 mg.kg-1.h-1 intraoperatoria, luego 1 mg.kg-1.h-1 24 h posteriores a la cirugía) más dexmedetomidina IV (8 mg.kg-1.h-1 15 min, luego 2 mg.kg-1.h-1 intraoperatoria, luego 1 mg.kg-1.h-1 24 h posteriores a la cirugía) redujo marcadores de NETosis (H3Cit y MPO) y progresión tumoral (MMP-3, MMP-9, VEGF-A), en pacientes con cáncer pulmonar sometidos a cirugía torácica video asistida[37]. Los autores sugieren que la combinación de lidocaína junto dexmedetomidina, podrían bloquear la señal de activación TLR2/NF-kB/NLRP3, high mobility group box-1 (HMGB- 1), y granulocyte-colony stimulating factor (G-CSF), mediadores fundamentales para el inicio del proceso de NETosis[35].
-
Efectos sobre la función linfocitaria
Las células NK (Natural Killer) son un subgrupo de linfocitos con capacidad de inducir muerte en células malignas, mediante un mecanismo secretorio de enzimas líticas llamadas granzima B y perforina[38]. Investigaciones clínicas demuestran que el número y función de estas células está disminuido después de cirugía oncológica. Estudio también muestran que una reducción en la función de las células NK facilitarían la formación de metástasis en modelos animales. Como ejemplo, ratas sujetas a laparotomía muestran una significante disminución de la función de células NK, lo que facilita el implante de células malignas en pulmón.
Anestésicos locales han demostrado modular la función de las células NK[39],[40]. Estudios in vitro fueron utilizados para evaluar el efecto de lidocaina en celulas NK. Estas investigaciones demostraron que cuando células NK fueron expuestas a concentraciones clínicamente relevante de lidocaína su función citotóxica aumento significativamente, sugiriendo potencial efecto beneficioso del anestésico local en caso de infusión intravenosa[39]. En relación a los expresado, se ha evidenciado que la administración combinada de lidocaína más dexmedetomidina preserva la función de células NK, al modular la liberación de IFN-y e IL-2, mejorando el control del estrés[37]. (Tabla 2). En otro estudio sobre función linfocitaria, Wang et al., demostraron que lidocaína IV (bolo 1,5 mg.kg-1 seguido 1,5 mg.kg-1.h-1) versus placebo, preserva la inmunidad linfocitaria, mantiene el balance Th1/Th2 y disminuye marcador de inflamación HMGB1, en mujeres sometidas a histerectomía de cáncer cervical[41] (Tabla 2).
-
Aplicación clínica de lidocaína
Por todo lo anterior expuesto, la evidencia de estudios in vitro e in vivo y translacionales sugieren que la lidocaína ejerce efectos antiproliferativos en diferentes extirpes de células tumorales e inmunoestimuladores, que podrían ser preventivos sobre recurrencia de cáncer. Esto dio lugar a investigaciones clínicas sobre el impacto de lidocaína endovenosa y recurrencia de cáncer.
En un estudio retrospectivo (n = 2.239), Zhang et al., hallaron mejor tasa de sobrevida a los 12 y 36 meses, en pacientes tratados con lidocaína IV (bolo 1,5 mg.kg-1 luego 2 mg.kg-1.h-1) [42]. En contraste, en un estudio aleatorio (n = 563), lidocaína IV versus placebo en pacientes sometidos a pancreatectomía por tumor de páncreas, no se halló diferencias respecto a tasa de sobrevida y porcentaje libre de enfermedad[42]. Los diferentes resultados pueden deberse a la diferencia entre número de pacientes estudiados, dosis y duración de la infusión de lidocaína, como también los diferentes tipos de cáncer o extensión del estrés quirúrgico.
-
Conclusion
A pesar de la evidencia in vitro e in vivo sobre las propiedades antitumorales de la lidocaína, estudios no han podido encontrar mejora de la sobrevida y de la tasa de supervivencia. Mientras se aguardan los resultados de otros estudios sobre lidocaína y recurrencia de cáncer, el uso de lidocaina IV no es indicada para reducir recurrencia de cáncer.
-
Referencias
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394-424. https://doi.org/10.3322/caac.21492
2. Alieva M, van Rheenen J, Broekman MLD. Potential Impact of Invasive Surgical Procedures on Primary Tumor Growth and Metastasis. Clin Exp Metastasis 2018; 35(4):319-31. https://doi.org/10.1007/s10585-018-9896-8
3. Bar-Yosef S, Melamed R, Page GG, Shakhar G, Shakhar K, Ben-Eliyahu S. Attenuation of the tumor-promoting effect of surgery by spinal blockade in rats. Research Support, Non-U.S. Gov’t Research Support, U.S. Gov’t, P.H.S. Anesthesiology. Jun 2001;94(6):1066-73.3. https://doi.org/10.1097/00000542-200106000-00022
4. Levi B, Matzner P, Goldfarb Y, et al. Stress impairs the efficacy of immune stimulation by CpG-C: Potential neuroendocrine mediating mechanisms and significance to tumor metastasis and the perioperative period. Brain, behavior, and immunity. Aug 2016; 56:209-20. https://doi.org/10.1016/j.bbi.2016.02.025
5. Sosa MS, Bragado P, Aguirre-Ghiso JA. Mechanisms of disseminated cancer cell dormancy: an awakening field. Nat Rev Cancer 2014; 14, 9:611-622. https://doi.org/10.1038/nrc3793
6. Wall T, Sherwin A, Ma D, Buggy DJ. Influence of perioperative anaesthetic and analgesic interventions on oncological outcomes: a narrative review. Br J Anaesth 2019; 123: 135e50 https://doi.org/10.1016/j.bja.2019.04.062
7. Scholz A. Mechanisms of (local) anaesthetic on voltage-gated sodium and other ion channels. Br J Anaesth. 2002; 89:5261. https://doi.org/10.1093/bja/aef163
8. Hermanns H, Hollmann MW, Stevens MF, Lirk P, Brandenburger T, Piegeler T, Werdehausen R. Molecular mechanisms of action of systemic lidocaine in acute and chronic pain: a narrative review. Br J Anaesth. 2019; 123 3:335-349. https://doi.org/10.1016/j.bja.2019.06.014
9. Hollmann MW, Gross A, Jelacin N, Durieux ME. Local anesthetic effects on priming and activation of human neutrophils. Anesthesiology 2001; 95: 113e22 https://doi.org/10.1097/00000542-200107000-00021
10. Su D, Gu Y, Wang Z, Wang X. Lidocaine attenuates proinflam- matory cytokine production induced by extracellular adenosine triphosphate in cultured rat microglia. Anesth Analg 2010; 111: 768-74. https://doi.org/10.1213/ANE.0b013e3181e9e897
11. Chamaraux-Tran TN, Mathelin C, Aprahamian M, Joshi GP, To- masetto C, Diemunsch P, et al. Antitumor effects of lidocaine on human breast cancer cells: an in vitro and in vivo experimental trial. Anticancer Res. 2018; 38, 1:95-105. https://doi.org/10.21873/anticanres.12196
12. Chang YC, Hsu YC, Liu CL, Huang SY, Hu MC, Cheng SP. Local anesthetics induce apoptosis in human thyroid cancer cells through the mitogen activated protein kinase pathway. PLoS One 2014;9 (2):e89563. https://doi.org/10.1371/journal.pone.0089563
13. Chang Y, Liu CH, Chen M, Hsu Y, Chen S, Lin CH, et al. Local anesthetics induce apoptosis in human breast tumor cells. Anesth Analg 2014; 118:116-24. https://doi.org/10.1213/ANE.0b013e3182a94479
14. Wang HW, Wang LY, Jiang L, et al. Amide-linked local anesthetics induce apoptosis in human non-small cell lung cancer. J Thorac Dis 2016; 8:2748-57. https://doi.org/10.21037/jtd.2016.09.66
15. Xing W, Chen DT, Pan JH, Chen YH, Yan Y, et al. Lidocaine induces apoptosis and suppresses tumor growth in human hepatocellular carcinoma cells in vitro and in a xenograft model in vivo. Anesthesiology 2017; 126:868-81. https://doi.org/10.1097/ALN.0000000000001528
16. Piegeler T, Votta-Velis EG, Liu G, Place AT, Schwartz DE, Beck- Schimmer B, et al. Antimetastatic potential of amide-linked local anesthetics: Inhibition of lung adenocarcinoma cell migration and inflammatory Src signaling independent of sodium channel blockade. Anesthesiology. 2012; 117:548-59. https://doi.org/10.1097/ALN.0b013e3182661977
17. Bowen CV, DeBay D, Ewart HS, Gallant P, Gormley S, Ilenchuk TT, Iqbal U, Lutes T, Martina M, Mealing G, Merkley N, Sperker S, Moreno MJ, Rice C, Syvitski RT, Stewart JM. In vivo detection of human TRPV6-rich tumors with anti-cancer peptides derived from soricidin. PLoS One. 2013; 8(3): e58866. https://doi.org/10.1371/journal.pone.0058866
18. Jiang Y, Gou H, Zhu J, Tian S and Yu L: Lidocaine inhibits the invasion and migration of TRPV6-expressing cancer cells by TRPV6 down-regulation. Oncol Lett 2016; 12: 1164-1170. https://doi.org/10.3892/ol.2016.4709
19. Sun H, Sun Y. Lidocaine inhibits proliferation and metastasis of lung cancer cell via regulation of miR-539/EGFR axis. Artif Cells Nanomed Biotechnol. 2019;47(1):2866-2874. https://doi.org/10.1080/21691401.2019.1636807
20. Sui H, Lou A, Li Z, Yang J. Lidocaine inhibits growth, migration and invasion of gastric carcinoma cells by up-regulation of miR- 145. BMC Cancer. 2019;19(1):233. doi:10.1186/s12885-019- 5431-9. https://doi.org/10.1186/s12885-019-5431-9
21. Roger S, Gillet L, LeGuennec JY, Besson P. Voltage-gated sodium channels and cancer: is excitability their primary role? Front Pharmacol 2015; 6:152. https://doi.org/10.3389/fphar.2015.00152
22. Brackenbury WJ, Chioni AM, Diss JK, Djamgoz MB. The neonatal splice variant of Nav1.5 potentiates in vitro invasive behavior of MDA-MB-231 human breast cancer cells. Breast Cancer Res. Treat 2007; 101, 149-160. https://doi.org/10.1007/s10549-006-9281-1
23. Brackenbury WJ. Voltage-gated sodium channels and metastatic disease. Channels. 2014;6(5):352-361. https://doi.org/10.4161/chan.21910
24. Fraser S, Foo I, Djamgoz M. Local anaesthetic use in cancer surgery and disease recurrence: role of voltage-gated sodium channels? Br J Anaesth. 2014; 113:899902. https://doi.org/10.1093/bja/aeu221
25. Wong, R.S. Apoptosis in cancer: from pathogenesis to treatment. J Exp Clin Cancer Res 30, 87 (2011). https://doi.org/10.1186/1756-9966-30-87
26. Lirk P, Berger R, Hollmann MW, et al. Lidocaine time- and dose- dependently demethylates deoxyribonucleic acid in breast cancer cell lines in vitro. Br J Anaesth. 2012; 109:200-207. https://doi.org/10.1093/bja/aes128
27. Hu G, Minshall RD. Regulation of Transendothelial Permeability by Src Kinase. Microvasc Res 2009; 77(1):21-5. https://doi.org/10.1016/j.mvr.2008.10.002
28. Neudecker V, Brodsky KS, Kreth S, Ginde AA, Eltzschig HK. Emerging Roles for MicroRNAs in Perioperative Medicine. Anesthesiology. 2016 Feb;124(2):489-506. https://doi.org/10.1097/ALN.0000000000000969
29. Helmy SA, Wahby MA, El-Nawaway M. The effect of anaesthesia and surgery on plasma cytokine production. Anaesthesia. 1999; 54(8):733-8. https://doi.org/10.1046/j.1365-2044.1999.00947.x
30. Ortiz MP, Godoy MC, Schlosser RS, Ortiz RP, Godoy JP, Santiago ES, et al. Effect of Endovenous Lidocaine on Analgesia and Serum Cytokines: Double- Blinded and Randomized Trial. J Clin Anesth (2016) 35:70-7. https://doi.org/10.1016/j.jclinane.2016.07.021
31. Herroeder S, Pecher S, Schönherr ME, Kaulitz G, Hahnenkamp K, Friess H, et al. Systemic Lidocaine Shortens Length of Hospital Stay After Colorectal Surgery: A Double-Blinded, Randomized, Placebo-Controlled Trial. Ann Surg 2007; 246, 2:192-200. https://doi.org/10.1097/SLA.0b013e31805dac11
32. Ostovic H, Simac B, Prazetina M, Bradic N, Persec J. The Effect of Intravenous Lidocaine, Ketamine, and Lidocaine-Ketamine Combination in Colorectal Cancer Surgery: A Randomized Controlled Trial. Anesth Analg. 2023 May 24. https://doi.org/10.1213/ANE.0000000000006555
33. Jung HS, Gu J, Kim J-E, Nam Y, Song JW, Kim HK. Cancer cell-induced neutrophil extracellular traps promote both hypercoagulability and cancer progression. PloS One 2019; 14, e0216055. https://doi.org/10.1371/journal.pone.0216055
34. Snoderly HT, Boone BA, Bennewitz MF. Neutrophil extracellular traps in breast cancer and beyond: current perspectives on NET stimuli, thrombosis and metastasis, and clinical utility for diagnosis and treatment. Breast Canc Res 2019; 21: 1-13. https://doi.org/10.1186/s13058-019-1237-6
35. Galon EV, Tat TF, Popa R, Efrimescu CI, Finnerty D, Buggy DJ, Ionescu DC, Mihu CM. Neutrophil extracellular trapping and angiogenesis biomarkers after intravenous or inhalation anaesthesia with or without intravenous lidocaine for breast cancer surgery: a prospective, randomised trial. Br J Anaesth. 2020 Nov;125(5):712-721. https://doi.org/10.1016/j.bja.2020.05.003
36. Zhang H, Qu M, Guo K, Wang Y, Gu J, Wu H, Zhu X, Sun Z, Cata JP, Chen W, Miao C. Intraoperative lidocaine infusion in patients undergoing pancreatectomy for pancreatic cancer: a mechanistic, multicentre randomised clinical trial. Br J Anaesth. 2022 Aug;129(2):244-253. https://doi.org/10.1016/j.bja.2022.03.031
37. Ren B, Cheng M, Liu C, Zheng H, Zhang J, Chen W, Song J, Zhuang J, Liu T, Wang R and Wang Z (2023) Perioperative lidocaine and dexmedetomidine intravenous infusion reduce the serum levels of NETs and biomarkers of tumor metastasis in lung cancer patients: A prospective, single-center, double-blinded, randomized clinical trial. Front. Oncol. 13:1101449. https://doi.org/10.3389/fonc.2023.1101449
38. Ackerman RS, Luddy KA, Icard BE, Piñeiro Fernández J, Gatenby RA, Muncey AR. The effects of anesthetics and perioperative medications on immune function: A narrative review. Anesth Analgesia (2021) 133(3):676-89. https://doi.org/10.1213/ANE.0000000000005607
39. Cata JP, Ramirez MF, Velasquez JF, et al. Lidocaine stimulates the function of natural killer cells in different experimental settings. Anticancer Res. 2017;37(9):4727-4732. https://doi.org/10.21873/anticanres.11879
40. Ramirez MF, Tran P, Cata JP. The effect of clinically therapeutic plasma concentrations of lidocaine on natural killer cell cytotoxicity. Reg Anesth Pain Med. 2015;40(1):43-48. https://doi.org/10.1097/AAP.0000000000000191
41. Wang HL, Yan HD, Liu YY, Sun BZ, Huang R, Wang XS, et al. Intraoperative Intravenous Lidocaine Exerts a Protective Effect on Cell-Mediated Immunity in Patients Undergoing Radical Hysterectomy. Mol Med Rep 2015; 12, 5:7039-44. https://doi.org/10.3892/mmr.2015.4235
42. Zhang H, Yang L, Zhu X, Zhu M, Sun Z, Cata JP, et al. Association Between Intraoperative Intravenous Lidocaine Infusion and Survival in Patients Undergoing Pancreatectomy for Pancreatic Cancer: A Retrospective Study. Br J Anaesth (2020) 125(2):141-8. https://doi.org/10.1016/j.bja.2020.03.034

 ORCID
ORCID

 Creative Commons Attribution
Creative Commons Attribution