María Mónica Rey Atehortúa1,3,*, Fabián Alexander Leal Arenas1,2, Yurley Andrea Martínez Zambrano1,4
Recibido: 02-08-2023
Aceptado: 02-09-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 8 pp. 7785-788|https://doi.org/10.25237/revchilanestv52n8-13
PDF|ePub|RIS
Palliative sedation in patients with refractory dyspnea
Abstract
Backround: Refractory dyspnea (DR) refers to the subjective experience of respiratory discomfort that persists despite the optimal treatment for the underlying pathophysiology, conditioning an important functional limitation with the consequent affectation in the quality of life; It is part of the effects of terminal chronic diseases (PCT), it is associated as a marker of poor prognosis and it is often considered the most distressing symptom experienced by cancer patients, in whom in many cases palliative sedation is required as final treatment. of life. Methodology: Given the prevalence of DR in cancer patients with terminal cancer pathologies, a review of the literature is carried out. Results: The cause of DR was mostly due to lung metastasis secondary to breast cancer and sigmoid colon adenocarcinoma. The sedative drugs used were Midazolam in doses from 1 to 2 mg IV every 4 to 6 hours, the maximum dose being 10 mg/hour; In addition to this, opioids were used to optimize the effects of the sedative and symptomatic pain management. the most widely used opioid was morphine at a dose of 1mg/h (rescue 3mg/pain or marked dyspnea), followed by hydromorphone 0.5-0.7 mg/4 hours (rescue 1.2 mg; maximum 4/24 h). fentanyl at 200 mcg/kg/h and oxycodone 3 mg/h, which generated symptomatic control with decreased dyspnea. The survival of the patients once the sedation was started was generally short, the patients died the same day or the day after the start of the sedation[1],[2],[3]. Conclusions: The use of benzodiazepines as a pillar in palliative sedation, accompanied by low-dose systemic opioids are useful in the management of DR in terminal cancer patients with SP. SP does not prolong or reduce the patient’s lifetime. Even when DR is low, it must be considered and managed, given the effects on the patient and the family, so treating it improves the quality of life of the patient and the family at the end of their life.
Resumen
Introducción: La disnea refractaria (DR), hace referencia a la experiencia subjetiva de malestar respiratorio que persiste a pesar del tratamiento óptimo para la fisiopatología subyacente, condicionando una importante limitación funcional con la consecuente afectación en la calidad de vida; hace parte de los efectos de patologías crónicas terminales (PCT), se asocia cómo marcador de mal pronóstico y a menudo se considera cómo el síntoma más angustioso que experimentan los pacientes con cáncer, en quienes en muchos casos se requiere la sedación paliativa como tratamiento de fin de la vida[1],[2],[3]. Metodología: Dada la prevalencia de DR en pacientes oncológicos en patologías oncológicas terminales se realiza una revisión de la literatura. Resultados: La causa de DR se debió en su mayoría a expensas de metástasis pulmonar secundario a cáncer de mama y adenocarcinoma de colon sigmoide. Los medicamentos sedativos utilizados fueron midazolam en dosis desde 1 a 2 mg iv cada 4 a 6 h, siendo la dosis máxima 10 mg/h; adicional a ello se hizo uso de opioides para optimizar efectos del sedante y manejo sintomático del dolor; el opiáceo más usado fue morfina en dosis de 1 mg/h (rescate 3 mg/dolor o disnea marcada), seguido de hidromorfona 0,5-0,7 mg/4 h (rescate 1,2 mg; máximo 4/24 h), fentanilo a 200 mcg/kg/h y oxicodona 3 mg/h, los cuales generaron control sintomático con disminución de la disnea. La supervivencia de los pacientes una vez iniciada la sedación fue en general corta, los pacientes fallecieron el mismo día o al día siguiente de iniciada la sedación. Conclusiones: El uso de benzodiazepinas como pilar en la sedación paliativa, acompañada de opioides sistémicos a dosis bajas son útiles en el manejo de la DR en pacientes oncológicos terminales con SP. La SP no prolonga ni reduce el tiempo de vida del paciente. Aun cuando la DR es baja, se debe considerar y manejar, dado los efectos en el paciente y la familia, por lo que tratarla mejora la calidad de vida del paciente y la familia en el momento final de su vida.
-
Introducción
Desde 1990 la Organización Mundial de la Salud (OMS) definió los cuidados paliativos (CP) como “el cuidado integral de los pacientes cuya enfermedad no responde al tratamiento curativo”, enfatizando en la importancia del control del dolor y de otros síntomas y problemas, enfocado en mejorar la calidad de vida para el paciente y su familia[4],[5]. Así mismo, la Ley Consuelo Devis Saavedra de 2014, resalta el apoyo integral en este proceso[6].
En Colombia, según el Observatorio Colombiano de Cuidados Paliativos (OCCP) tres de cada 10 colombianos fallecidos requerían de CP[5]; y el Instituto Nacional de Cancerología (INC) en Colombia, como centro de referencia, brinda desde la década de los 90 dicho servicio a sus pacientes[5],[7],[8]. Y dado la incidencia de cáncer en el mundo es del 21% del total de las enfermedades no transmisibles[9], el porcentaje de pacientes oncológicos que requieren CP es importante.
Sin embargo, uno de los retos en CP es el control de síntomas refractarios al final de la vida, definidos como: aquellos que no pueden ser adecuadamente controlados a pesar de los esfuerzos para identificar una terapia tolerable que no comprometa la consciencia, causando un grave impacto en la calidad de vida del enfermo y su familia[10]-[12]. Por ende, la sedación paliativa (SP) se considera una estrategia de tratamiento eficaz para el manejo de estos síntomas refractarios cuando los esfuerzos agresivos no proporcionan alivio y consiste en la aplicación de medicamentos para inducir sedación y disminución del nivel de conciencia con el objetivo de aliviar el sufrimiento[4],[13]-[15].
Los estudios han reportado que la sedación paliativa (SP) se administra en una proporción que va del 2% al 52% de los pacientes con enfermedades terminales y que resulta ser exitosa en el manejo de los síntomas intratables al final de la vida, sin generar efectos perjudiciales sobre la supervivencia y en cambio su proporciona alivio para los familiares[4],[13]-[15].
Indagando la prevalencia de la sedación paliativa en Colombia, se calculó que en el 2016 se necesitaba cobertura en un 71% en solo enfermedades no transmisibles[16], con requerimiento en 62% de los pacientes fallecidos, y 31,3% para los pacientes con neoplasias.
Desde la perspectiva del derecho, la sedación paliativa es propia de los cuidados paliativos que hacen parte de los derechos humanos al final de la vida[1],[17], contando en Colombia con la ley 1.733 de 2014, que regula los “derechos de los pacientes con enfermedades crónicas, degenerativas o irreversibles con alto impacto en la vida, incluido el derecho a los cuidados paliativos y la prestación de estos servicios por parte de entidades de salud públicas y privadas”[18], y con la regulación de la atención mediante la guía clínica de atención y la regulación en los medicamentos de soporte para el acceso a los medicamentos para este fin[19],[20].
La disnea es un síntoma común de carácter muy angustiante en diversas patologías crónicas graves[1],[21],[22]. Se calcula que al año esta se presenta en de 75 millones de pacientes, en más del 90% de pacientes con enfermedad pulmonar grave, más del 50% de pacientes con neoplasias no tratables y falla cardíaca[1],[23],[24]. La disnea aumenta a medida que la enfermedad progresa[25], generando un estado de pánico impactante y aterrador por la sensación de pérdida del dominio sobre la respiración para los pacientes, familias o cuidadores, y motivando necesariamente a acudir a atención de urgencias e ingreso hospitalario[26],[27].
En dichas patologías crónicas graves, al optimizarse el manejo de los efectos clínicos subyacentes, la presencia continua de disnea que no cede con el manejo se considera refracta- ria[21], y en pacientes con disnea refractaria en estado avanzado se presentan diversos síntomas complejos e interactuantes, razón por la cual los cuidados paliativos son esenciales en esta condición[11],[23].
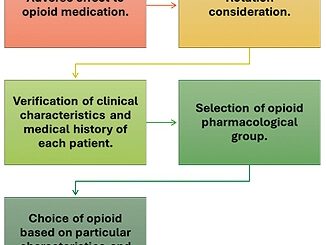
De forma general, en la literatura, los medicamentos más usados en sedación paliativa son las benzodiacepinas de vida media corta y rápido inicio de acción, entre ellos es el midazolam el fármaco usado con mayor frecuencia[14], ya que el 100% de la sedación se realiza con dicho fármaco, a dosis que en infusión continua se encuentran en el rango de dosis efectiva usual[28] administradas.
El uso de los opioides a dosis bajas continuas para el tratamiento paliativo de la disnea y el dolor, aprovechando el bajo riesgo de depresión respiratoria asociada[29], contando actualmente los opioides sistémicos con evidencia solida en el escenario de la DR[1],[29]-[31], cuyos resultados también fueron observados en nuestra serie. Sin embargo, el temor a la depresión respiratoria es probablemente una de las razones por las cuales no se utilice con tranquilidad[31], así como tampoco se cuenta con evidencia suficiente para efectuar el tratamiento de forma oral o nebulizada en la DR cuando las condiciones lo permitan[32].
Mejorar clínicamente la DR con opioides se ha visto tanto en ensayos clínicos, como en revisiones sistemáticas y metaanálisis. En este sentido, Higginson et al (2014), reportan en 105 casos reclutados en su estudio una diferencia de medias en la mejoría de la DR de 0,58 (IC 95%: 0,01-1,15; p = 0,048; tamaño del efecto 0,44) y una tasa de supervivencia del 73% versus 70% (grupo tratado vs grupo no tratado)[30]. Otro ensayo clínico aleatorizado que analizo 111 pacientes con EPOC con DR tratados con morfina; reporta en pacientes con mMRC entre 3 y 4 una mejoría de 1,33 puntos menos en el grupo de morfina versus grupo de control (IC 95%: -2,50 a -0,16; p = 0,03)[33].
Un estudio multinacional que acogió 213 casos con diversas patologías y DR incluidos pacientes oncológicos, menciona que una edad más joven se comporta como factor predictor de una mejor respuesta en la disminución de la DR. Sin embargo, la participación de los pacientes con cáncer fue baja (13%)[32]. Aun cuando en nuestra serie se encontró un rango en la edad entre 29 y 77 años, la respuesta en la disminución de la DR en todos los casos fue similar sin presentarse discriminación alguna por la edad.
También se ha visto que los pacientes perciben y manifiestan los beneficios del uso de opioides en la DR. Un estudio que acogió tres ensayos clínicos aleatorizados doble ciego serie en los que se incluyeron 65 pacientes con patologías oncológicas y DR presentaron preferencias en el uso de la morfina para tratarla con un OR de 0,85 (IC 95%: 0,78-0,93; p < 0,001), dados los efectos percibidos por ellos en cuanto a la disminución de la disnea, sedación y calidad el sueño[33].
Por otra parte, en una revisión sistemática efectuada por Barnes et al (2016), en 26 estudios con 526 participantes con DR incluidos pacientes oncológicos, dan cuenta de una mejor puntuación en las diferentes escalas de disnea utilizadas en las investigaciones incluidas; siendo el aumento de 0,32 puntos con respecto de los grupos de control[32]. Otra revisión realizada en 13 estudios con 88 pacientes menciona un alivio exitoso de la DR en pacientes con cáncer de pulmón tratados con fentanilo por vía transdérmica, nebulizada, intranasal, oral y endovenosa[35]. Sin embargo, los resultados no mostraron diferencias significativas, pero a pesar de esta situación, este estudio permite apreciar el efecto del medicamento en la mejoría de la DR, comportamiento que fue similar en el paciente que fue tratado con este fármaco.
En cuanto a supervivencia posterior al inicio de la SP, los pacientes valorados tuvieron una supervivencia promedio de 4,8 día, con un rango que va desde 1 día hasta 15 días de supervivencia desde el comienzo de la SP hasta la muerte, lo que muestra una diferencia amplia en días de supervivencia entre los casos; sin embargo, comparándolo con una revisión sistemática generada en 2012, por Maltoni et al[14], donde se comparan supervivencia entre 1.807 pacientes sedados y no sedados, con valores de medias en pacientes sedados varían de 7 a 36,5 días, encontrándose la supervivencia encontrada en esta serie de casos dentro del rango estimado, y a pesar de la limitación de nuestro estudio para la comparación con los pacientes no sedados, consideramos importante mencionar que la revisión sistemática mencionada los pacientes no sedados obtuvieron valores de medias de 4 a 39,5 días, siendo sus diferencias no es estadísticamente significativas, y por tanto, concluyendo que la SP no acorta la vida de los pacientes[36].
Dentro de la motivación o razones para no indicar SP están los aspectos o consideraciones, psicosociales, éticas y aspectos asociados al ejercicio médico propio de los profesionales, entre ellos miedos y desconocimiento[(36]; ya que si bien el objetivo de la SP está asociado a disminuir el sufrimiento del paciente mediante el control de síntomas refractarios, estos se presentan con frecuencia en pacientes al final de la vida, siendo por lo anterior uno de los desenlaces la muerte. Por lo anterior consideramos es importante reforzar la comunicación con familiares y demás equipo médico para que la toma de decisiones sea consensuada y basada en evidencia actualizada.
Por esto se requieren escenarios idóneos para el manejo de la DR con opioides, así como también de estudios que permitan aportar un mayor nivel de evidencia que con el que se cuenta para consolidar con mayor fuerza las bondades de los opiáceos en estos pacientes.
En conclusión, existe evidencia del uso de SP como buena práctica médica ante pacientes con DR, ya que se ha demostrado que no disminuye la supervivencia, y su ejecución va acorde a disminuir el sufrimiento del paciente y su familiar, debido a los efectos angustiantes que genera.
El midazolam es el fármaco más usado en la SP y su titulación permite obtener diferentes grados de sedación según los objetivos que se determinen en el paciente y disminuyendo la probabilidad de presentar efectos adversos asociados.
Los opioides sistémicos con dosis bajas son útiles en el manejo de la DR en pacientes oncológicos terminales con SP.
Fuentes de financiación: Los autores manifiestan que el presente estudio fue financiado con recursos propios, sin intervención de otras fuentes.
Conflictos de intereses: Los autores manifiestan no presentar conflictos de intereses en el presente estudio.
-
Referencias
1. Parshall MB, Schwartzstein RM, Adams L, Banzett RB, Manning HL, Bourbeau J, et al.; American Thoracic Society Committee on Dyspnea. An official American Thoracic Society statement: update on the mechanisms, assessment, and management of dyspnea. Am J Respir Crit Care Med. 2012 Feb;185(4):435–52. https://doi.org/10.1164/rccm.201111-2042ST PMID:22336677
2. Soto JG, et al. Manual diagnóstico y terapéutica en neumología. 3rd ed. Vol. 1. NEUMOSUR; 2016. 253–64 p.
3. Hui D, Maddocks M, Johnson MJ, Ekström M, Simon ST, Ogliari AC, et al.; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Management of breathlessness in patients with cancer: ESMO Clinical Practice Guidelines†. ESMO Open. 2020 Dec;5(6):e001038. https://doi.org/10.1136/esmoopen-2020-001038 PMID:33303485
4. Covarrubias Castro A. SPH. Sedación paliativa. Rev Mex Anest. 2019;2:8–10.
5. Ministerio de Salud-Minsalud. ABECÉ Cuidados Paliativos [Internet]Bogotá; 2018.
6. de Colombia C. Ley 1733 de 2014 [Internet]. Ley 1733 de 2014, Ley 1733 de 2014 Colombia: https://www.funcionpublica.gov.co/eva/gestornormativo/norma.php?i=59379; 2014. Available from: https://www.funcionpublica.gov.co/eva/gestornormativo/norma_pdf.php?i=59379
7. Instituto Nacional de Cancerología. Cuidados paliativos [Internet]. Cuidados paliativos. 2016 [cited 2023 May 5]. Available from: https://www.cancer.gov.co/portafolio-1/soporte-oncologico/cuidados-paliativos
8. Care IIA for H& P. Glossary-Palliative Care Definitios [Internet]. Glossary-Palliative Care Definitios. 2022 [cited 2022 Jan 27]. Available from: https://hospicecare.com/what-we-do/projects/consensus-based-definition-of-palliative-care/glossary/
9. León M, Perdomo K PJ et al. “Cuidados Paliativos” buscando mejorar la calidad de vida del paciente y la familia. Anuario del observatorio colombiano de cuidados paliativos. 2016;8–10.
10. Bausewein C, Booth S, Gysels M, Higginson IJ. Non-pharmacological interventions for breathlessness in advanced stages of malignant and non-malignant diseases. In: Bausewein C, editor. Cochrane Database of Systematic Reviews. Chichester, UK: John Wiley & Sons, Ltd; 2008. https://doi.org/10.1002/14651858.CD005623.pub2.
11. Bausewein C, Booth S, Gysels M, Kühnbach R, Haberland B, Higginson IJ. Understanding breathlessness: cross-sectional comparison of symptom burden and palliative care needs in chronic obstructive pulmonary disease and cancer. J Palliat Med. 2010 Sep;13(9):1109–18. https://doi.org/10.1089/jpm.2010.0068 PMID:20836635
12. Booth S, Moosavi SH, Higginson IJ. The etiology and management of intractable breathlessness in patients with advanced cancer: a systematic review of pharmacological therapy. Nat Clin Pract Oncol. 2008 Feb;5(2):90–100. https://doi.org/10.1038/ncponc1034 PMID:18235441
13. Bruinsma SM, Rietjens JA, Swart SJ, Perez RS, van Delden JJ, van der Heide A. Estimating the potential life-shortening effect of continuous sedation until death: a comparison between two approaches. J Med Ethics. 2014 Jul;40(7):458–62. https://doi.org/10.1136/medethics-2013-101459 PMID:23845927
14. Maltoni M, Scarpi E, Rosati M, Derni S, Fabbri L, Martini F, et al. Palliative sedation in end-of-life care and survival: a systematic review. J Clin Oncol. 2012 Apr;30(12):1378–83. https://doi.org/10.1200/JCO.2011.37.3795 PMID:22412129
15. Claessens P, Menten J, Schotsmans P, Broeckaert B. Palliative sedation: a review of the research literature. J Pain Symptom Manage. 2008 Sep;36(3):310–33. https://doi.org/10.1016/j.jpainsymman.2007.10.004 PMID:18657380
16. León M, Perdomo K PJ et al. “Cuidados Paliativos” buscando mejorar la calidad de vida del paciente y la familia. Anuario del observatorio colombiano de cuidados paliativos. 2016;8–10.
17. Calvache J, Gil F VE. ¿Cuántas personas requieren cuidados paliativos para enfermedades oncológicas y no oncológicas en un país de ingresos medios? Análisis de datos de mortalidad. Rev Col Anest. 2020;48(4):e201.
18. I PA. Cuidados paliativos el abordaje de la atención en salud desde un enfoque de derechos humanos. Dejusticia; 2016. pp. 42–8.
19. Social M de S y P. Circular No. 022 de 2016 Lineamientos y Directrices para la gestión del acceso a medicamentos opioides para el manejo del dolor. Colombia; 2016.
20. Ministerio de salud. Guía de práctica clínica Cuidados paliativos [Internet]. Colombia; 2016. Available from: http://gpc.minsalud.gov.co/gpc_sites/Repositorio/Otros_conv/GPC_paliativo/gpc_paliativo.aspx
21. Currow DC, Abernethy AP, Ko DN. The active identification and management of chronic refractory breathlessness is a human right. Thorax. 2014 Apr;69(4):393–4. https://doi.org/10.1136/thoraxjnl-2013-204701 PMID:24212892
22. Gysels MH, Higginson IJ. The lived experience of breathlessness and its implications for care: a qualitative comparison in cancer, COPD, heart failure and MND. BMC Palliat Care. 2011 Oct;10(15):15. https://doi.org/10.1186/1472-684X-10-15 PMID:22004467
23. Sorenson HM. Palliative care for lung disease: start early, stay late. Lancet Respir Med. 2013 Jun;1(4):279–80. https://doi.org/10.1016/S2213-2600(13)70083-3 PMID:24429141
24. Solano JP, Gomes B, Higginson IJ. A comparison of symptom prevalence in far advanced cancer, AIDS, heart disease, chronic obstructive pulmonary disease and renal disease. J Pain Symptom Manage. 2006 Jan;31(1):58–69. https://doi.org/10.1016/j.jpainsymman.2005.06.007 PMID:16442483
25. Austin J, Williams R, Ross L, Moseley L, Hutchison S. Randomised controlled trial of cardiac rehabilitation in elderly patients with heart failure. Eur J Heart Fail. 2005 Mar;7(3):411–7. https://doi.org/10.1016/j.ejheart.2004.10.004 PMID:15718182
26. Barbera L, Taylor C, Dudgeon D. Why do patients with cancer visit the emergency department near the end of life? CMAJ. 2010 Apr;182(6):563–8. https://doi.org/10.1503/cmaj.091187 PMID:20231340
27. Seow H, Barbera L, Sutradhar R, Howell D, Dudgeon D, Atzema C, et al. Trajectory of performance status and symptom scores for patients with cancer during the last six months of life. J Clin Oncol. 2011 Mar;29(9):1151–8. https://doi.org/10.1200/JCO.2010.30.7173 PMID:21300920
28. Bobb B. A Review of Palliative Sedation. Nurs Clin North Am. 2016 Sep;51(3):449–57. https://doi.org/10.1016/j.cnur.2016.05.008 PMID:27497018
29. Currow DC, Ekstrom M, Abernethy AP. Opioids for chronic refractory breathlessness: right patient, right route? Drugs. 2014 Jan;74(1):1–6. https://doi.org/10.1007/s40265-013-0162-8 PMID:24327297
30. Higginson IJ, Bausewein C, Reilly CC, Gao W, Gysels M, Dzingina M, et al. An integrated palliative and respiratory care service for patients with advanced disease and refractory breathlessness: a randomised controlled trial. Lancet Respir Med. 2014 Dec;2(12):979–87. https://doi.org/10.1016/S2213-2600(14)70226-7 PMID:25465642
32. Marciniuk DD, Goodridge D, Hernandez P, Rocker G, Balter M, Bailey P, et al.; Canadian Thoracic Society COPD Committee Dyspnea Expert Working Group. Managing dyspnea in patients with advanced chronic obstructive pulmonary disease: a Canadian Thoracic Society clinical practice guideline. Can Respir J. 2011;18(2):69–78. https://doi.org/10.1155/2011/745047 PMID:21499589
32. Johnson MJ, Bland JM, Oxberry SG, Abernethy AP, Currow DC. Opioids for chronic refractory breathlessness: patient predictors of beneficial response. Eur Respir J. 2013 Sep;42(3):758–66. https://doi.org/10.1183/09031936.00139812 PMID:23258776
33. Verberkt CA, van den Beuken-van Everdingen MH, Schols JM, Hameleers N, Wouters EF, Janssen DJ. Effect of Sustained-Release Morphine for Refractory Breathlessness in Chronic Obstructive Pulmonary Disease on Health Status: A Randomized Clinical Trial. JAMA Intern Med. 2020 Oct;180(10):1306–14. https://doi.org/10.1001/jamainternmed.2020.3134 PMID:32804188
34. Ferreira DH, Silva JP, Quinn S, Abernethy AP, Johnson MJ, Oxberry SG, et al. Blinded Patient Preference for Morphine Compared to Placebo in the Setting of Chronic Refractory Breathlessness—An Exploratory Study. J Pain Symptom Manage. 2016 Feb;51(2):247–54. https://doi.org/10.1016/j.jpainsymman.2015.10.005 PMID:26598037
35. Simon ST, Köskeroglu P, Gaertner J, Voltz R. Fentanyl for the relief of refractory breathlessness: a systematic review. J Pain Symptom Manage. 2013 Dec;46(6):874–86. https://doi.org/10.1016/j.jpainsymman.2013.02.019 PMID:23742735
36. Palliative D, Shorten S, Lives THE, Patients OF. ¿La sedación paliativa acorta la vida de los pacientes? 2017;204–18.

 ORCID
ORCID