Yerlin Andrés Colina Vargas1,*, Santiago Barrientos Henao2, Cristian Vera Marín3, Cristina Posada Giraldo4, José Julián Aristizábal5, William Henry Joaqui Tapia6
Recibido: 12-11-2023
Aceptado: 06-01-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 8 pp. 789-795|https://doi.org/10.25237/revchilanestv52n8-14
PDF|ePub|RIS
Abstract
Introduction: Ketamine is an antagonist of the N-methyl-d-aspartate receptor that intervenes in the amplification of pain signals, the development of central sensitization and tolerance to opioids. Objective: To determine the relationship of ketamine infusion for more than 72 hours with the alteration of liver function tests, in hospitalized patients with acute or chronic pain, in a high complexity center. Methods: Retrospective analytical study. Hospitalized patients were recruited, during a year of study, who received ketamine infusion for at least 72 hours for pain control, and who underwent control of liver tests, before the infusion and 72 hours after the infusion. Univariate and bivariate methods were applied using SPSSv.24 software. Results: 101 patients who met the eligibility criteria were included. The median age was 52 years (IQR, 34-68). The median visual analog scale (VAS) of pain on admission and discharge was 8 (IQR, 7-9) (severe) and 2 (IQR, 1-3) (mild), respectively. The infusion time varied between 72 and 168 hours. There was no difference in hemodynamic variation during infusion. There was also no significant incidence of adverse events (6 patients had some psychiatric symptoms and 4 patients reported nausea / vomiting). Regarding liver tests, there was a statistical difference (greater after the infusion), but not clinically significant. Conclusion: The ketamine infusion added to an adequate multimodal management, achieves adequate pain control, without altering liver function tests.
Resumen
Introducción: La ketamina es un antagonista del receptor de N-metil-d-aspartato que interviene en la amplificación de las señales de dolor, el desarrollo de sensibilización central y la tolerancia a opioides. Objetivo: Determinar la relación de la infusión de ketamina por más de 72 h con la alteración de las pruebas de función hepática, en pacientes hospitalizados con dolor agudo o crónico, en un centro de alta complejidad. Métodos: Estudio analítico retrospectivo. Se captaron pacientes hospitalizados, durante un año de estudio, quienes recibieron infusión de ketamina durante al menos 72 h para control del dolor, y que se les realizara control de pruebas hepáticas, antes de la infusión y 72 h después de la infusión. Se aplicaron métodos univariados y bivariados mediante el software SPSSv.24. Resultados: Se incluyó 101 pacientes que cumplieron con los criterios de elegibilidad. La mediana de edad fue de 52años (IQR, 34-68). La mediana de la escala analógica visual (EVA) del dolor al ingreso y al alta fue de 8 (IQR, 7-9) (severo) y 2 (IQR, 1-3) (leve), respectivamente. El tiempo de infusión varió entre 72 y 168 h. No hubo diferencia en la variación hemodinámica durante la infusión. Tampoco hubo una incidencia significativa de eventos adversos (6 pacientes presentaron algunos síntomas psiquiátricos y 4 pacientes refirieron náuseas/vómitos). En cuanto a las pruebas hepáticas, hubo diferencia estadística (mayor tras la infusión), pero no clínicamente significativa. Conclusión: La infusión de ketamina sumada a un adecuado manejo multimodal, logra un adecuado control del dolor, sin alterar las pruebas de función hepática.
-
Introducción
La ketamina es un antagonista no competitivo de los receptores NMDA, con un amplio mecanismo de acción, involucrando los receptores AMPA, kainato, ácido gamma-aminobutírico, opioides, monoaminérgicos, muscarínicos y nicotínicos[1],[2].
Actúa sobre los canales de calcio y sodio voltaje-dependientes, interviene en la síntesis y liberación del óxido nítrico e inhibe la recaptación de serotonina. La interacción con todos estos mecanismos de acción hace que tenga una importante participación sobre mecanismos del dolor, inflamación, neuro- protección y tolerancia de opioides[1]-[3].
Esta se N-desmetila en norketamina, principalmente por el citocromo P450 (CYP) 2C9, CYP2B6 y CYP3A4 en el hígado, y luego se excreta por los riñones. Al biotransformarse algunos estudios han sugerido que puede inducir hepatotoxicidad, indicando que puede generar apoptosis en las células humanas HepG2 a través de la vía de la proteasa Bax-mitocondrias-caspasa; además, de suprimir la expresión génica de la CYP3A4, induciendo estrés en el retículo endoplásmico, y respuesta apoptótica[4].
Por otro lado, también su uso como droga recreativa, se asocia con pruebas de función hepática anormales y anomalías del tracto biliar; existen reportes de caso, con abuso crónico de keta- mina en tres jóvenes que presentaban ictericia obstructiva y anomalía del tracto biliar[5]. Y otro en el cual el uso prolongado de ketamina provocó anomalías biliares graves generando molestias epigástricas recurrentes y aumento de las enzimas[6]. Algunas series de caso incluso han informado sobre fibrosis hepática, lesión de las vías biliares y enfermedad hepatobiliar similar a la colangitis esclerosante en consumidores recreativos crónicos[7].
Sin embargo, se desconoce la patogenia exacta de la lesión hepática inducida por ketamina; la dosis y duración de su uso no se han asociado con una bioquímica hepática anormal, sugiriendo que la lesión hepática inducida por ketamina es de naturaleza idiosincrásica. Sin embargo, esto no excluye la posibilidad de un componente dependiente de la dosis, especialmente altas. Se ha postulado que el daño que puede generar y alterar las pruebas de función hepática esté en relación a un efecto directo sobre el músculo liso biliar o por discinesia de la vesícula biliar a través de la vía central; en términos generales la ketamina puede afectar al hígado de dos formas diferentes, la lesión parenquimatosa con daño de los conductos biliares, y afectación del músculo liso del esfínter que conduce a la dilatación del conducto biliar[7].
Por lo anterior nos planteamos como objetivo del estudio, determinar la relación de la infusión de ketamina por más de 72 h con la alteración de las pruebas de función hepática, en pacientes hospitalizados con dolor agudo o crónico, en un centro de alta complejidad.
-
Métodos
Diseño de la investigación
Estudio analítico retrospectivo
Se incluyeron hospitalizados durante un año de estudio, en
diferentes servicios de un centro de alta complejidad, que habían recibido infusión intravenosa de ketamina durante al menos 72 h para el control del dolor. Se excluyeron los pacientes que no habían realizado pruebas paraclínicas antes de la infusión y 72 h después.
Se consideraron las variables sociodemográficas, clínicas, paraclínicas y farmacológicas. Las principales variables de resultado fueron el nivel de dolor evaluado mediante una escala analógica visual (EVA) y los resultados de las pruebas de función hepática. Además, se consideró la presencia de náuseas/vómi- tos, cistitis hemorrágica y el desarrollo de cualquier fenómeno psicotomimético. El momento de administración de la infusión de ketamina y la dosis total infundida se consideraron como las principales variables de exposición.
Se monitorizaron y midieron las variables de los pacientes de la siguiente manera: se midió la EVA antes del inicio de la infusión dentro de las 12 h y posteriormente cada 24 h hasta las 72 h. La presión arterial se registró antes de la infusión, luego cada 8 h hasta las 24 h y, por último, cada 24 h hasta el final de la infusión. Las pruebas de función hepática se realizaron antes de la infusión y 72 h después de la infusión.
La investigación se basó en la evaluación de un protocolo institucional para la infusión de ketamina en pacientes con dolor agudo o crónico, en el cual se indica una dosis de 0,15 mg/kg/h. La información se obtuvo mediante la revisión de las historias clínicas, registros de enfermería y datos paraclínicos de los pacientes ingresados a través del protocolo mencionado. Posteriormente, la información obtenida se introdujo en una base de datos diseñada y validada para el propósito de este estudio.
El objetivo era reducir el sesgo de selección homogeneizan- do y seleccionando a los pacientes que cumplían los criterios de elegibilidad. El sesgo de información se minimizó mediante la elaboración estandarizada de un instrumento de recolección de datos y la adecuada capacitación de los investigadores que registraron los datos.
Se realizó un muestreo no probabilístico de casos consecutivos durante el período mencionado. El análisis se realizó mediante métodos estadísticos descriptivos sobre las variables sociodemográficas, con la ayuda de frecuencias absolutas y relativas, y medidas de dispersión basadas en las pruebas de normalidad de distribución poblacional (que en este caso no fue normal). Asimismo, se aplicaron métodos univariados y bivariados. Se aplicó la prueba estadística de Wilcoxon para las pruebas de función hepática. Además, se aplicó la prueba de Friedman para rastrear la presión arterial, expresada como presión arterial media y el nivel de dolor, expresado con EVA. Se realizaron diferentes análisis para diferentes subgrupos con el fin de determinar el comportamiento del dolor en cada paciente en el momento de la infusión de ketamina. Posterior
mente, se analizaron los subgrupos en función del tipo de diagnóstico al ingreso, el tipo de dolor, el tipo de cirugía realizada y la evolución del dolor en cada paciente. Cada análisis se realizó con el paquete estadístico SPSS v.24 (Inc., Chicago, IL).
-
Consideraciones éticas
La investigación se realizó luego de obtener la aprobación del Comité de Ética de la Institución, otorgada en el Registro número 9 y de fecha 28 de mayo de 2018.
-
Resultados
Se incluyeron un total de 101 pacientes, con una mediana de edad de 52 años (IQR, 34-68), la mayoría mujeres (58,4%). En la Tabla 1 se muestran las características sociodemográficas, clínicas, farmacológicas y los eventos adversos de la población evaluada. La duración de la infusión de ketamina estuvo entre 72 h (mínimo) y 168 h (máximo).
Se presentó una baja frecuencia de eventos adversos, como se muestra en la Tabla 1. No se informaron eventos adversos de toxicidad urinaria, úlceras gástricas, extravasación, ni hiperter- mia, en ninguno de los pacientes. Antes de la administración de la infusión de ketamina, se realizaron pruebas de función hepática, incluidas AST, ALT, bilirrubina y fosfatasa alcalina. Posteriormente, se realizó un control de las mencionadas pruebas paraclínicas dentro de las 72 h con el fin de determinar la evolución (Tabla 2).
Con la infusión de ketamina de logró un adecuado control del dolor, la diferencia media entre el dolor antes de la infusión y 72 h después de la infusión para determinar el alivio del dolor en cada subgrupo, que se expresa en la Tabla 3. La Figura 1 muestra la dinámica del dolor evaluada 5 veces después de la administración de la infusión de ketamina, demostrando un alivio progresivo significativo del dolor, p < 0,05.
No se demostró una variación hemodinámica significativa según la evaluación con la presión arterial media (PAM) (p = 0,132) en pacientes durante la infusión de ketamina. En la Figura 2 se muestra la evolución de la PAM, los respectivos rangos intercuartílicos y los valores mínimo y máximo.
-
Discusión
Los hallazgos de nuestro estudio demuestran la importancia de definir una dosis óptima de infusión de ketamina para lograr un buen control del dolor. Hasta donde sabemos, antes de nuestro estudio no existen en la literatura otros que demuestren la importancia de realizar pruebas de función hepática antes y después de la infusión para demostrar la seguridad de la infusión de ketamina en el tratamiento del dolor. Esto también se evidencia por la baja frecuencia de ocurrencia de eventos adversos.
La dosis óptima de infusión de ketamina es la dosis a la que se obtienen los máximos beneficios clínicos con un mínimo de efectos adversos. El estudio de Motov S et al., definieron que las dosis subanestésicas de la infusión de ketamina oscilaban entre 0,05 y 0,25 mg/kg/h; sugiriendo que cuanto mayor es la dosis de ketamina, mayor es la probabilidad de que ocurran eventos adversos; y cuanto menor sea la dosis de ketamina, menor será la eficacia en el control del dolor[8].
En el presente estudio, una dosis de 0,15 mg/kg/h de keta- mina demostró una baja incidencia de eventos adversos y una buena efectividad clínica evidenciada en un buen control del dolor. Estos hallazgos podrían explicarse en función de la dosis utilizada y la posible asociación dosis-respuesta con los eventos adversos y la efectividad clínica. Sin embargo, se requieren más investigaciones para comparar la incidencia de eventos adversos y la efectividad en el control del dolor a diferentes dosis y con poblaciones más grandes para probar esto último.
Hasta donde sabemos, no existen estudios previos que hayan investigado la importancia de la medición de las pruebas de función hepática antes y después de la administración de ketamina en infusión y la alteración de las funciones hepáticas asociadas. Por tanto, la importancia de nuestro estudio radica en la demostración de esta correlación, ya que existe evidencia en la literatura acerca de la asociación entre la infusión de ketamina y la hepatotoxicidad, tal y como informan Ingeborg N, et al.[9]. Se observó hepatotoxicidad en tres casos después de la infusión de ketamina a 10 a 20 mg/h en 100 h, lo que sugiere la asociación de dosis supraterapéuticas de ketamina con daño hepático (> 3 a 4 mg/kg). El proceso de glucogénesis y formación de urea a partir de alanina es inhibido por las dosis supraterapéuticas de ketamina debido a los niveles de ATP y la liberación de LDH dependiente de la dosis[10],[11].
Por lo tanto, la medición de los valores de la función hepática en este estudio antes y después de la infusión de ketamina demostró objetivamente que la infusión de ketamina a una dosis de 0,15 mg/kg/h no genera alteración en los paraclínicos de función hepática. Aunque existe una diferencia estadística en los valores (mayor después de la infusión), no es clínicamente significativa en ninguno de los pacientes (tres veces el límite superior).
Sin embargo, el uso de ketamina ha sido muy limitado debido a sus efectos secundarios, como alucinaciones, paranoia, despersonalización, ataques de pánico, náuseas, vómitos, cistitis hemorrágica, alteraciones hepáticas, aumento de la presión arterial, entre otros según lo informado por Rasmussen KG et al[12], llevaron a cabo un estudio de eventos adversos psiquiátricos, es decir, agitación, confusión o alucinaciones, a dosis subanestésicas de ketamina en 50 pacientes e informaron una incidencia del 22%, que es más alta que la observada en nuestro estudio (6%). Esto puede atribuirse al hecho de que las dosis utilizadas en la investigación de Rasmussen fueron más altas.
Una limitación de nuestro estudio es la naturaleza retrospectiva de la evaluación de los eventos adversos y también el hecho de que los eventos adversos psiquiátricos fueron informados por los especialistas tratantes y no por psiquiatras. Por lo tanto, no se realizó una escala objetiva o evaluación para definir si los eventos adversos fueron realmente secundarios a la infusión de ketamina, otras causas como el delirio en pacientes hospitalizados, otros medicamentos como los anticolinérgicos u opioides, o las patologías subyacentes de los pacientes[13],[14]. Sin embargo, la incidencia de eventos adversos fue menor que la informada en la literatura. Además, el beneficio de la ke- tamina al proporcionar un control adecuado del dolor superó los posibles riesgos de eventos adversos, lo que sugiere que el uso de dosis subanestésicas de infusión de ketamina se puede extender en pacientes que la requieren para el tratamiento del dolor.
| Tabla 1. Características sociodemográficas, clínicas, farmacológicas y eventos adversos | |
| Característica | Estadístico |
| Características sociodemográficas | |
| Edad (años), Me (RIQ) | 52 (34 – 68) |
| Mujeres, n (%) | 59 (58,4) |
| Etnia | 99 (98) |
| Mestizo, n (%) | 2 (2) |
| Afrocolombiano, n (%) | |
| Tipo de diagnóstico de hospitalización | |
| Infeccioso, n (%) | 21 (20,7) |
| Traumático, n (%) | 20 (19,8) |
| Inflamatorio, n (%) | 23 (22,7) |
| Quirúrgico, n (%) | 4 (3,9) |
| Síndrome doloroso, n (%) | 21 (20,7) |
| Otro, n (%) | 12 (11,8) |
| Tipo de dolor | |
| Neuropático, n (%) | 16 (15,8) |
| Somático, n (%) | 44 (43,5) |
| Mixto, n (%) | 41 (40,5) |
| Evolución del dolor | |
| Agudo, n (%) | 53 (52,4) |
| Crónico, n (%) | 48 (47,5) |
| Otro analgésico recibido* | |
| Opioide potente, n (%) | 42 (41,5) |
| Opioide débil, n (%) | 33 (32,6) |
| AINE/Acetaminofén, n (%) | 56 (55,4) |
| Adyuvantes, n (%) | 65 (64,3) |
| Tipo de procedimiento quirúrgico | |
| Ortopédico, n (%) | 11 (10,8) |
| Neuroquirúrgico, n (%) | 14 (13,8) |
| Abdominal, n (%) | 9 (8,9) |
| Gineco-obstétrico, n (%) | 3 (2,9) |
| Torácico, n (%) | 7 (6,9) |
| Otro, n (%) | 7 (6,9) |
| Ninguno, n (%) | 50 (49,5) |
| Variables clínicas | |
| Peso (kg), Me (RIQ) | 65 (59 – 70) |
| Dolor ingreso (EVA), Me (RIQ) | 8 (7 — 9) |
| Dolor egreso (EVA), Me (RIQ) | 2 (1 – 3) |
| Presión arterial sistólica ingreso (mmhg), Me (RIQ) | 119 (104 – 132) |
| Presión arterial diastólica ingreso (mmhg), Me (RIQ) | 70 (64 – 80) |
| Presión arterial media ingreso (mmhg), Me (RIQ) | 87 (78,85 – 96,52) |
| Presión arterial sistólica egreso (mmhg), Me (RIQ) | 117,5 (108 – 128) |
| Presión arterial diastólica egreso (mmhg), Me (RIQ) | 70,5 (64 – 80) |
| Presión arterial media egreso (mmhg), Me (RIQ) | 86,7 (80 – 93,3) |
| POP hepatobiliar o pancreática n (%) | 0 (0) |
| Hepatotóxicos** n (%) | 4 (4) |
| Hepatopatía previa n (%) | 4 (4) |
| Variables farmacológicas | |
| Tiempo administración ketamina (horas), Me (RIQ) | 72 (72 – 96) |
| Dosis total ketamina (mg), Me (RIQ) | 504 (432 – 636) |
| Eventos adversos | |
| Síntoma psiquiátrico, n (%) | 6 (5,9) |
| Náuseas/vómitos, n (%) | 4 (4) |
| *el 100% de los pacientes recibió otro analgésico desde, antes y durante la infusión de ketamina, y podría estar recibiendo más de uno.**inicio de cualquier medicamento potencialmente hepatotóxico al menos 24 horas previas al inicio de la infusión de ketamina.Fuente: autores. | |
Tabla 2. paraclínicos hepáticos previo al inicio de infusión de ketamina y a las 72 h posterior del inicio
| Paraclínico | Previo al inicio de la infusión, Me (RIQ) | 72 h del inicio de la infusión, Me (RIQ) | Wilcoxon |
| AST | 23 (15,4 – 36,85) | 28,75 (19,07 – 47,7) | p = 0,02 |
| ALT | 23 (18 – 42,65) | 29,55 (18,22 – 45,8) | p = 0,00 |
| BT | 0,31 (0,22 – 0,45) | 0,28 (0,22 – 0,42) | p = 0,18 |
| BD | 0,16 (0,12 – 0,22) | 0,14 (0,11 – 0,22) | p = 0,16 |
| BI | 0,15 (0,09 – 0,21) | 0,13 (0,08 – 0,18) | p = 0,05 |
| FA | 96 (75,5 – 137) | 101 (70 -138) | p = 0,71 |
| Fuente: autores. | |||
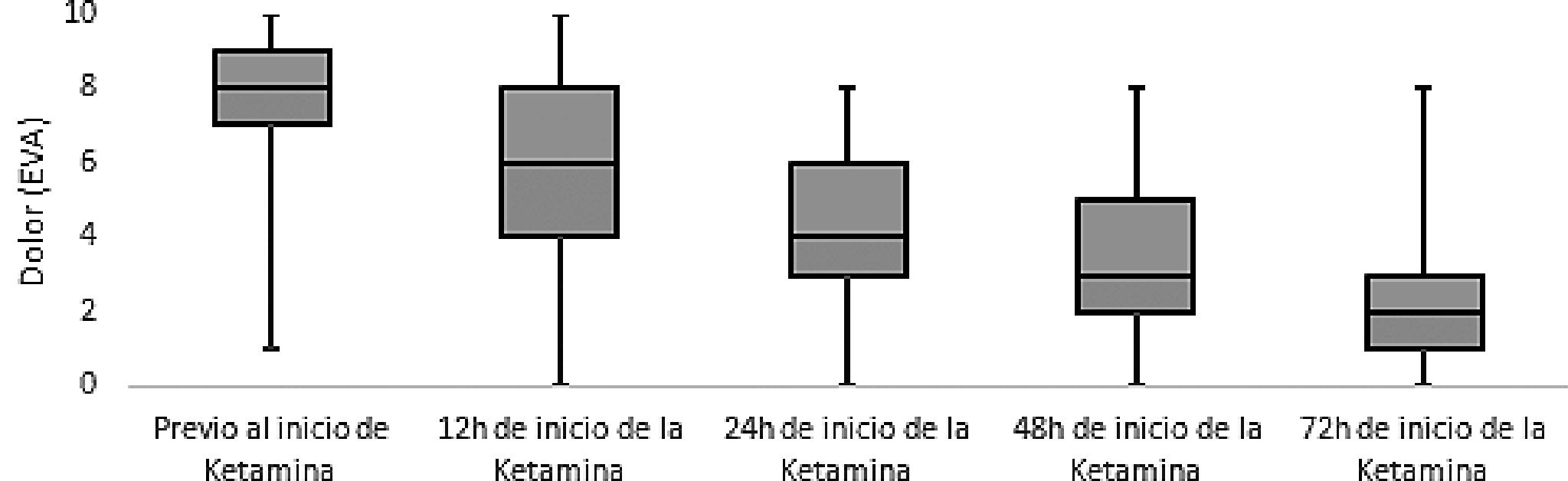
Figura 1. Evolución de la escala visual análoga del dolor en los diferentes momentos.
Tabla 3. reducción (previo inicio de infusión – cierre de infusión) del dolor medido con la escala visual análoga, posterior a la infusión de ketamina por subgrupos
| Subgrupo | Reducción dolor |
| Tipo de diagnóstico de hospitalización | |
| Infeccioso, Me (RIQ) | 7 (6 – 8) |
| Traumático, Me (RIQ) | 7 (4 – 8) |
| Inflamatorio, Me (RIQ) | 5 (4 – 6) |
| Quirúrgico, Me (RIQ) | 7 (3 – 10) |
| Síndrome doloroso, Me (RIQ) | 6 (4 – 6) |
| Otro, Me (RIQ) | 6 (3 – 7) |
| Tipo de dolor | |
| Neuropàtico, Me (RIQ) | 6 (4 – 8) |
| Somático, Me (RIQ) | 6 (3 – 8) |
| Mixto, Me (RIQ) | 6 (4 – 7) |
| Tipo de procedimiento quirúrgico | |
| Ortopédico, Me (RIQ) | 7 (6 – 9) |
| Neuroquirúrgico, Me (RIQ) | 4 (2 – 7) |
| Abdominal, Me (RIQ) | 7 (4 – 8) |
| Gineco-obstétrico, Me (RIQ) | 6 (5 – 6) |
| Torácico, Me (RIQ) | 6 (6 – 10) |
| Otro, Me (RIQ) | 8 (6 – 8) |
| Ninguno, Me (RIQ) | 5 (4 – 7) |
| Evolución del dolor | |
| Agudo, Me (RIQ) | 6 (4 – 7) |
| Crónico, Me (RIQ) | 6 (4 – 8) |
| Fuente: autores. |
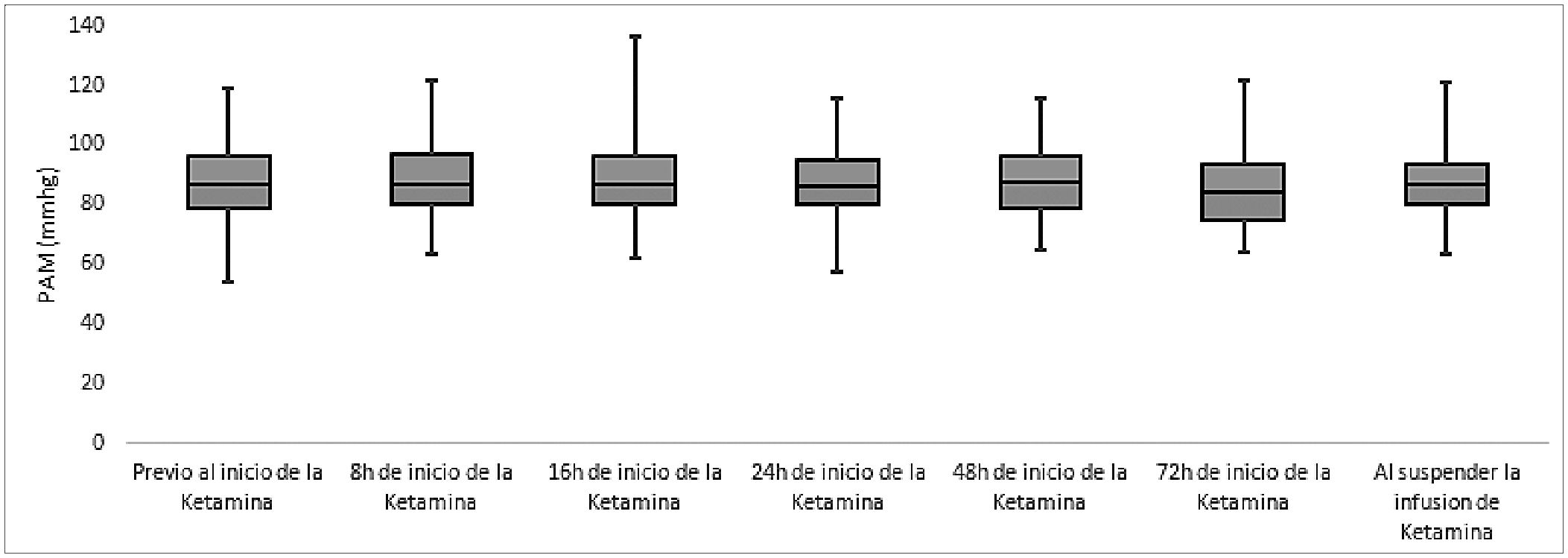
Figura 2. Evolución de la presión arterial media en los diferentes momentos.
Entre las otras limitaciones de nuestro estudio se encuentra el hecho de que los análisis de los resultados fueron realizados basados en datos obtenidos de fuentes secundarias. Por otro lado, el alivio del dolor y los efectos adversos observados no podrían atribuirse exclusivamente a la infusión de ketamina porque todos los pacientes de este estudio también habían recibido otros fármacos analgésicos como AINE, sulfato de magnesio y opioides como parte de un tratamiento multimodal del dolor. Sin embargo, las dosis subanestésicas de la infusión de ketamina como parte de la estrategia de control del dolor en el manejo del dolor multimodal sí mostraron un alivio del dolor objetivamente. Finalmente, con el presente estudio también se mostró que la dosis utilizada de infusión de ketamina resultó en la menor incidencia de eventos adversos y un buen control del dolor como parte de una estrategia multimodal. La ausencia de hepatotoxicidad en todos los pacientes incluidos en el estudio junto con una baja incidencia de eventos adversos evidenció la seguridad clínica del tratamiento.
-
Conclusiones
La infusión continua por más de 72 h de ketamina a una dosis de 0,15 mg/kg/h es una opción adecuada para el tratamiento del dolor agudo y crónico severo dentro de un manejo multimodal; con una baja presentación de eventos adversos. Ningún paciente incluido en el estudio desarrolló alguna alteración en las pruebas de función hepática clínicamente significativa debido a la infusión.
Agradecimientos : Ninguno.
Declaración de conflicto de interés: Los autores declaran no tener ningún conflicto de intereses.
-
Referencias
1. Neira Reina F, Ortega García JL, Neira Ortega B. La ketamina en el tratamiento del dolor crónico según medicina basada en la evidencia. Rev Soc Esp Dolor. 2016;23(6):292–306. https://doi.org/10.20986/resed.2016.3462/2016.
2. Niesters M, Martini C, Dahan A. Ketamine for chronic pain: risks and benefits. Br J Clin Pharmacol. 2014 Feb;77(2):357–67. https://doi.org/10.1111/bcp.12094 PMID:23432384
3. Correll GE, Maleki J, Gracely EJ, Muir JJ, Harbut RE. Subanesthetic ketamine infusion therapy: a retrospective analysis of a novel therapeutic approach to complex regional pain syndrome. Pain Med. 2004 Sep;5(3):263–75. https://doi.org/10.1111/j.1526-4637.2004.04043.x PMID:15367304
4. Chen JT, Chen RM. Mechanisms of ketamine-involved regulation of cytochrome P450 gene expression. Expert Opin Drug Metab Toxicol. 2010 Mar;6(3):273–81. https://doi.org/10.1517/17425250903505108 PMID:20163319
5. Lo RS, Krishnamoorthy R, Freeman JG, Austin AS. Cholestasis and biliary dilatation associated with chronic ketamine abuse: a case series. Singapore Med J. 2011 Mar;52(3):e52–5. PMID:21451916
6. Seto WK, Ng M, Chan P, Ng IO, Cheung SC, Hung IF, et al. Ketamine-induced cholangiopathy: a case report. Am J Gastroenterol. 2011 May;106(5):1004–5. https://doi.org/10.1038/ajg.2010.485 PMID:21540907
7. Wong GL, Tam YH, Ng CF, Chan AW, Choi PC, Chu WC, et al. Liver injury is common among chronic abusers of ketamine. Clin Gastroenterol Hepatol. 2014 Oct;12(10):1759–62.e1. https://doi.org/10.1016/j.cgh.2014.01.041 PMID:24534547
8. Motov S, Mai M, Pushkar I, Likourezos A, Drapkin J, Yasavolian M, et al. A prospective randomized, double-dummy trial comparing IV push low dose ketamine to short infusion of low dose ketamine for treatment of pain in the ED. Am J Emerg Med. 2017 Aug;35(8):1095–100. https://doi.org/10.1016/j.ajem.2017.03.004 PMID:28283340
9. Noppers IM, Niesters M, Aarts LP, Bauer MC, Drewes AM, Dahan A, et al. Drug-induced liver injury following a repeated course of ketamine treatment for chronic pain in CRPS type 1 patients: a report of 3 cases. Pain. 2011 Sep;152(9):2173–8. https://doi.org/10.1016/j.pain.2011.03.026 PMID:21546160
10. Sear JW, McGivan JD. Cytotoxicity of i.v. anaesthetic agents on the isolated rat hepatocyte. Br J Anaesth. 1979 Aug;51(8):733–9. https://doi.org/10.1093/bja/51.8.733 PMID:497070
11. Yu WL, Cho CC, Lung PF, Hung EH, Hui JW, Chau HH, et al. Ketamine-related cholangiopathy: a retrospective study on clinical and imaging findings. Abdom Imaging. 2014 Dec;39(6):1241–6. https://doi.org/10.1007/s00261-014-0173-2 PMID:24934474
12. Rasmussen KG. Psychiatric side effects of ketamine in hospitalized medical patients administered subanesthetic doses for pain control. Acta Neuropsychiatr. 2014 Aug;26(4):230–3. https://doi.org/10.1017/neu.2013.61 PMID:25142291
13. Rasmussen KG. Psychiatric side effects of ketamine in hospitalized medical patients administered subanesthetic doses for pain control. Acta Neuropsychiatr. 2014 Aug;26(4):230–3. https://doi.org/10.1017/neu.2013.61 PMID:25142291
14. Bell RF. Ketamine for chronic noncancer pain: concerns regarding toxicity. Curr Opin Support Palliat Care. 2012 Jun;6(2):183–7. https://doi.org/10.1097/SPC.0b013e328352812c PMID:22436323

 ORCID
ORCID