Ana María Espinoza U. 1 y Luis Brunet L. 1
Rev Chil Anest Vol. 40 Núm. 3 pp. 272-282|doi:
PDF|ePub|RIS
Introducción
La analgesia epidural torácica es en la actualidad uno de los métodos más utilizados por las unidades de tratamiento del dolor agudo para el manejo del dolor postoperatorio de la cirugía torácica y abdominal mayor. En los últimos 25 años la analgesia epidural y, en especial la analgesia epidural torácica, se ha trasformado en una técnica anestésica común, asociada a una anestesia general durante la cirugía abierta de tórax y de abdomen superior, y en el tratamiento del dolor postoperatorio 1 . Ha mantenido una gran popularidad debido a las ventajas que se le atribuyen, entre las cuales las más importantes son la mejor calidad de la analgesia, la mayor satisfacción de los pacientes, la preservación de la actividad muscular normal de las extremidades inferiores y la disminución de las complicaciones postoperatorias 2 . Aun cuando los progresos de la cirugía mínimamente invasiva y el aumento del uso de los bloqueos paravertebral y del plano transverso abdominal con la asistencia de ultrasonografía han reducido su uso en los últimos tiempos, la analgesia epidural torácica continúa siendo una técnica de gran utilidad en algunos casos seleccionados, de ahí la importancia de conocer la técnica, usos e indicaciones (Tabla 1) 3 , 4 .
Tabla 1 Cirugías que se pueden beneficiar del uso de analgesia epidural torácica
|
Cardiovascular |
Tórax |
Abdomen superior |
Colon |
Nefrourológica |
Ginecológica |
Plástica |
| Revascularización Miocárdica sin CEC | Deformación de Pectum y Tórax | Esofagectomía y Cirugía Antirreflujo | Resección de Colon | Nefrectomía | Histerectomía abdominal radical | Abdominoplastía |
| Reparación Ductus | Toracotomía | Gastrectomía y Cirugía Bariátrica | Resección Enteral | Cistectomía | Exanteración pélvica | Hernioplastía incisional |
| Reparación Coartación Aórtica | Timectomía | Resección Hepática | Resección Abdominoperineal | Cirugía ureteral | Resección de tumores anexiales | Plastía mamaria |
| Reparación Aneurisma Aorta Torácica | Mastectomía | Pancreatectomía | Derivaciones Digestivas | Prostatectomía radical abdominal | ||
| Esplenectomía
Colecistectomía y Vía Biliar |
Linfadenectomía lumboaórtica |
-
Consideraciones Anatómicas
El objetivo de la analgesia epidural torácica se logra administrando los anestésicos locales o las soluciones analgésicas elegidas en el punto medio o central de los segmentos metaméricos responsables de la inervación de la zona de la cual se originan los estímulos nociceptivos. Es necesario un adecuado conocimiento de las representaciones anatómicas metaméricas para elegir el sitio de punción y cateterización epidural en concordancia con el área quirúrgica a desaferentar (Tabla 2). Habitualmente la punción se realiza a ciegas, guiada por referencias anatómicas externas conocidas. Las referencias más utilizadas debido a su fácil reconocimiento son: la apófisis espinosa más prominente de la región cérvico-torácica C7, la espina de la escápula que corresponde a T3 y el borde inferior de la escápula a T7. Todas suelen ser más fáciles de reconocer y visualizar poniendo al paciente en posición sentada, en especial si se trata de pacientes obesos. La punción e instalación de un catéter en el espacio epidural torácico resulta técnicamente más difícil que en la región lumbar debido a la marcada angulación inferior o caudal de las apófisis espinosas en relación a los cuerpos vertebrales, y a que el espacio interespinoso es más estrecho a nivel de las vértebras torácicas. El acceso al espacio epidural por la línea media obliga a puncionar en una angulación cefálica marcada, pasando a través de un espacio intervertebral estrecho que dificulta la técnica. El acceso paramediano suele ser más fácil y permite acceder al espacio epidural con una menor angulación, motivo por el cual es recomendado por muchos autores.
Tabla 2 Sitio de instalación del catéter epidural: sugerencia según tipo de cirugía
|
Tipo de Cirugía |
Sitio de Punción Epidural |
| Cardíaca y Aorta torácica |
C7 – T2 |
| Torácica |
T2 – T6 |
| Hepática y Gastroesofágica |
T4 – T8 |
| Enterocolónica y Nefrourológica |
T6 – T12 |
| Pélvica y Ginecológica |
T8 – T12 |
-
Técnica
Previa monitorización y habiendo instalado una vía venosa, se coloca al paciente en posición sentada con los pies apoyados sobre un escabel y las rodillas flectadas. Se le solicita que mantenga la espalda recta, flexionando el cuello y la porción superior del tórax y se le invita a relajar la musculatura cervical y de la cintura escapular. La punción paramediana se realiza 1 a 2 cm. por fuera de la línea media a nivel del borde inferior de la apófisis espinosa superior del espacio elegido, se infiltra la piel y el tejido subcutáneo con anestésico local y se avanza con el trocar de punción epidural en 90° en relación al plano de la piel, paralelo a la apófisis espinosa, hasta alcanzar la lámina de la vértebra inferior (Figura 1).
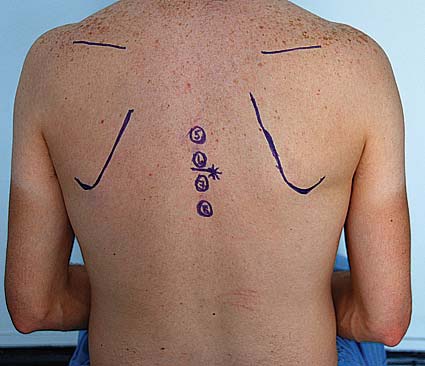
Figura 1 Relación entre borde inferior escapular y T7 (El asterisco marca sitio de punción con técnica paramediana a nivel T6-T7.
Se mide la distancia entre la piel y la lámina y se retira el trocar hasta la piel, volviendo a puncionar con una inclinación de 5 a 10° hacia la línea media y 70° a cefálico en relación a la piel, avanzando hasta la distancia a la cual se encontró la lámina. Posteriormente se continúa avanzando, midiendo la resistencia con una jeringa en forma secuencial, hasta lograr la pérdida de la resistencia al ingresar al espacio epidural que suele encontrarse entre 4 a 6 cm de la piel 5 . Si durante el avance, el trocar chocara con estructuras óseas, debe corregirse la inclinación de la punción hacia cefálico hasta lograr “cabalgar” sobre el borde superior de la lámina inferior e ingresar al espacio cubierto por el ligamento amarillo. El operador debe tratar de trasladar la sensibilidad de las manos, o mejor aun su visión, a la punta del trocar. Con el trocar en el espacio epidural torácico se avanza el catéter hasta que su extremo distal quede 5 a 6 cm dentro del espacio, luego se retira el trocar evitando que se salga el catéter, el que debe fijarse cuidadosamente a la piel de la espalda para evitar que se desplace o angule. Los errores en la fijación y las fallas en los cuidados del catéter son causa del mayor problema de la analgesia epidural continua, cual es el retiro o desplazamiento accidental anticipado del catéter y la consecuente falla en la analgesia 6 (Figura 2).
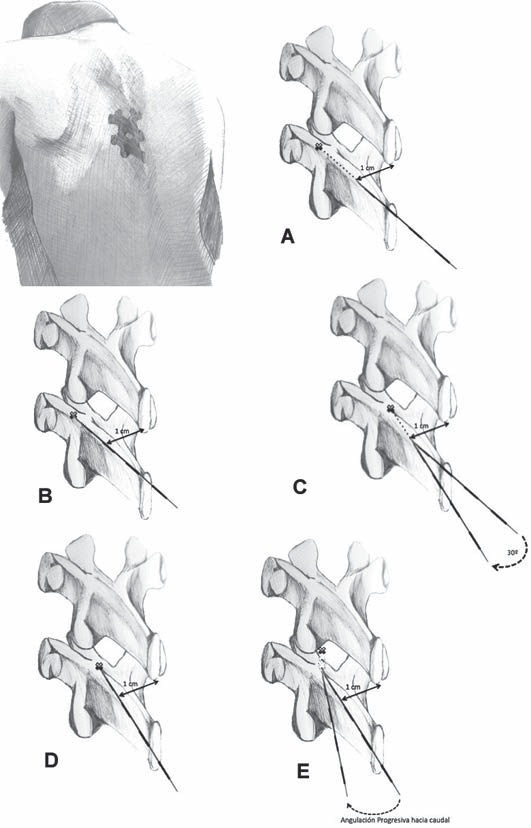
Figura 2 Representación esquemática del acceso al espacio epidural por una punción paramediana a nivel de la columna torácica. A: el trocar de Touhy se avanza perpendicular al plano de la piel, a través de la zona previamente anestesiada, 1 cm lateral al borde inferior de la apófisis espinosa del espacio intervertebral elegido. B: se avanza el trocar hasta topar con la lámina ipsilateral de la vértebra inferior, midiendo la distancia desde la piel. C y D: se retira el trocar y se reinserta, modificando la orientación de acceso en aproximadamente 30º hacia la línea media, hasta volver a topar con la lámina ipsilateral a la misma profundidad anterior. E: finalmente se retira algunos centímetros y reinserta con una angulación cefálica hasta pasar por sobre el borde superior de la lámina, comprobando el acceso al espacio epidural por la pérdida de resistencia (Imagen gentileza del Dr. Juan Morales Santelices).
Durante la punción e instalación del catéter deben utilizarse las medidas antisépticas habituales para un procedimiento invasivo: el operador debe usar mascarilla facial, gorro, guantes y delantal estériles y debe realizar un lavado de manos con jabón antiséptico. La piel del paciente debe lavarse y prepararse con solución antiséptica previo a la punción 7 . En aquellos pacientes que no puedan mantenerse en posición sentada, estén bajo anestesia general o sedación profunda, o en ventilación mecánica, se puede hacer la punción y cateterización epidural en decúbito lateral, accediendo por vía paramediana desde la dirección del piso hacia la línea media. El acceso por la línea media, aunque técnicamente es más difícil, puede realizarse tanto en posición sentada como en decúbito lateral, usando una mayor angulación cefálica para el acceso al espacio epidural.
-
Dosificación
Una vez posicionado el catéter en el espacio epidural y comprobada la ausencia de sangre o líquido cefalorraquídeo a través de la aspiración, se puede administrar la dosis del anestésico local o de la solución analgésica elegida, de acuerdo al nivel de anestesia quirúrgica o de bloqueo analgésico deseado. La mantención ulterior del nivel obtenido se logra con bolos intermitentes o por dosificación continua. Se ha sugerido el uso de volúmenes de 0,5-1 ml (0,7 ml) por segmento torácico a bloquear, a diferencia de los 1-2 ml utilizados comúnmente a nivel epidural lumbar, como dosis de carga inicial. Debido a los marcados efectos hemodinámicos que puede producir el bloqueo de los nervios simpáticos cardioaceleradores en la anestesia epidural torácica alta (AETA), es preferible fraccionar la dosis de carga y limitarla a volúmenes no mayores a 5 ml, administrados a intervalos de 5 minutos, de manera de permitir la observación de la respuesta y la medición de la altura del bloqueo previo a la siguiente dosis. La comprobación del bloqueo sensitivo y la medición de la altura del bloqueo pueden realizarse por la técnica del “pin prick” o pinchazo con una aguja roma, antes y después de la administración de una nueva dosis de anestésicos y previo a la inducción de la anestesia general en los casos de una anestesia general-epidural.
Los factores determinantes de la altura y la duración de la anestesia epidural torácica (AET) son principalmente el sitio de inyección, la masa de anestésico local administrado, la concentración del anestésico local y el uso de medicamentos coadyuvantes. Los factores del paciente son menos importantes, pero deben ser considerados, en especial las condiciones extremas de peso, edad, estatura, el embarazo y la obesidad 8 .
Para la dosis inicial de carga se usan volúmenes variables de 3 a 10 ml de bupivacaína al 0,5% y de 5 a 15 ml al 0,25% con o sin opioides, como fentanilo 50 a 100 μg. Se puede iniciar una infusión continua de solución analgésica a través del catéter después de un período de tiempo variable cercano a los 30 minutos de la dosis inicial. Generalmente las velocidades de infusión varían entre 3 a 10 ml·h-1 y las soluciones más comúnmente usadas contienen bupivacaína al 0,1% (0,0625%-0,125%) y fentanilo 2 a 4 μg·ml-1 o bien sufentanil, morfina o hidromorfona. Se pueden utilizar también las técnicas de analgesia epidural controlada por el paciente (AECP) usando para ello bombas especiales que permiten dar infusiones continuas y bolos en demanda, o bien solo bolos epidurales en demanda. Las dosis más comúnmente usadas en la AECP son bolos de 3 a 10 ml a intervalos de 30 a 60 minutos, de la misma solución administrada en infusión continua. La AECP permite administrar analgesia en forma prolongada en el período perioperatorio y se ha asociado a un alto grado de satisfacción por parte del paciente, junto con una excelente calidad de la analgesia y menor incidencia de efectos no deseados que cuando se la compara con manejo analgésico con opiodes parenterales OP 9 .
-
Control
Las tasas de infusión se pueden modificar en el período postoperatorio de acuerdo a la relación entre el nivel de bloqueo sensitivo medido y el requerido, a la calidad del control del dolor y a la presencia de efectos adversos atribuibles al bloqueo, tales como hipotensión o inestabilidad cardiovascular, presencia de náusea y/o vómitos frecuentes, y retención urinaria. Las infusiones epidurales en general y en especial las epidurales torácicas, requieren del control seriado de sus efectos analgésicos, del nivel del bloqueo sensitivo, de la presencia de efectos adversos y de la aparición de respuestas inesperadas o inexplicables. Los bloqueos sensitivos extensos, la presencia o aparición de bloqueo motor de las extremidades inferiores, y los cambios en los niveles de bloqueo sin causa aparente entre otros, deben hacernos sospechar de la presencia de disfunción o de complicaciones. Es requisito para dar analgesia postoperatoria con infusiones epidurales torácicas continuas y AECP, contar con protocolos de control, vigilancia y monitorización, dirigidos por Unidades de Dolor organizadas.
-
Efectos fisiológicos
La AET al igual que la anestesia raquídea, produce bloqueo simpático, analgesia y bloqueo motor, pero a diferencia de la primera, la solución anestésica es inyectada en el espacio epidural (EE). Para lograr su efecto se requiere de una masa y volumen de droga anestésica mayor que la utilizada en la anestesia raquídea y se caracteriza por producir un boqueo más gradual, con un período de latencia mayor, menor compromiso motor y por dar la posibilidad de prolongar su efecto anestésico o analgésico a través de un catéter epidural.
Los efectos dependerán del nivel de punción y de la extensión del bloqueo, como también de las características de la solución inyectada. Una vez inyectada la solución en el EE, ésta no se distribuye en forma homogénea, si no que avanza como en pequeños “canales paralelos” que existen a través de nervios, grasa y duramadre 10 . La distribución circunferencial alrededor de la duramadre es completa y sólo se limita por la fascia del ligamento longitudinal posterior, lo que facilita la distribución hacia lateral a través de los agujeros de conjunción, siendo probablemente el ganglio de las raíces dorsales y el espacio en que los nervios espinales abandonan el espacio subaracnoídeo y se envuelven en la vaina nerviosa, los principales sitios de acción de los anestésicos locales a nivel epidural 10 ,11 .
La analgesia epidural produce un bloqueo segmentario que se caracteriza por producir interrupción de la transmisión nerviosa en los segmentos más cercanos al sitio de punción, disminuyendo la calidad del bloqueo en los segmentos espinales más distales, preservando la función neurológica de estos últimos. Al existir una congruencia entre el espacio vertebral donde se punciona y los segmentos de las raíces nerviosas comprometidas durante el acto quirúrgico (congruencia catéter-incisión), se logra un mejor efecto anestésico o analgésico, con menor volumen y masa de drogas y con menor incidencia de efectos indeseados como hipotensión, retención urinaria, bloqueo motor, etc 12 .
La analgesia epidural produce un bloqueo diferencial, que se expresa por un nivel de bloqueo simpático mayor que el nivel de bloqueo sensitivo y motor. Durante la analgesia epidural este bloqueo diferencial es menos importante que el que se produce por la anestesia raquídea en que la diferencia entre el bloqueo simpático y sensitivo puede ser hasta de seis segmentos espinales. Lo anterior probablemente se puede explicar por la distribución menos homogénea que se produce en el EE comparado con el espacio subaracnoídeo 13 . Este bloqueo diferencial está dado por la mayor susceptibilidad de bloqueo que poseen las fibras nerviosas tipo C y B, que trasmiten la información autonómica, comparado con la menor susceptibilidad de bloqueo que poseen las fibras Aα y Aβ (motoras), que necesitan una mayor concentración de anestésico local para bloquearse.
-
Efectos Cardiovasculares
El tono vascular periférico está mediado por el sistema nervioso autónomo, cuyas fibras actúan sobre los receptores adrenérgicos α y β, por el efecto de las catecolaminas circulantes secretadas por la médula adrenal (T5-L1) y también por el sistema renina-angiotensina-aldosterona. La magnitud de la caída de la presión arterial dependerá del compromiso de los mecanismos antes mencionados, que se afectan según el número de segmentos bloqueados y de la capacidad de compensación por parte de los segmentos no bloqueados. La vasodilatación compromete principalmente al territorio venoso ya que el arterial tiende a mantener su tono autónomo gracias a la mayor presencia de musculatura lisa vascular. La simpatectomía disminuye el retorno venoso al corazón, por venodilatación (el 80% de la volemia está en el lecho venoso) y redistribución de la volemia hacia el lecho esplácnico y extremidades inferiores. Cuando el bloqueo torácico o toracolumbar es extenso, la magnitud de la hipotensión y vasodilatación mesentérica es mayor, en cambio, bloqueos limitados a segmentos lumbares o a torácicos altos, mantienen el tono mesentérico y la caída de la presión es más discreta 14 . La caída de la presión arterial en bloqueos epidurales lumbares produce aumento del tono simpático de fibras esplácnicas no bloqueadas, estimulando la liberación de catecolaminas por parte de la médula adrenal. La AE también afecta a los sistemas renina-angiotensina y vasopresina al producir bloqueo de las fibras simpáticas preganglionares que inervan el riñón, lo que hace que se estimule la secreción de vasopresina para compensar la caída de presión arterial 11 ,14 .
En pacientes sanos y normovolémicos se estima que la caída de la resistencia vascular (RVS) sistémica alcanza sólo un 15-18% y el gasto cardíaco (GC) se mantiene casi inalterable. En pacientes añosos se puede ver hasta un 25% de la caída de la RVS y de un 10% de caída del GC. Si se obtienen niveles de bloqueo altos la frecuencia cardíaca (FC) tiende a caer por bloqueo de las fibras cardioaceleradoras que se originan de T1 a T4 15 .
Junto con la disminución de la presión arterial media (PAM), disminuye el flujo sanguíneo coronario. La disminución de la FC y de la tensión ventricular sisto-diastólica (disminución de precarga y postcarga) explican la disminución del consumo de oxígeno miocárdico (MVO2). La disminución de la actividad simpática y el bloqueo motor disminuyen el consumo global de oxígeno, mientras que el gasto cardíaco se mantiene constante, lo que evita la deuda de oxígeno. Este equilibrio “aporte/consumo” se pierde frente a disminuciones de la PAM superiores al 30% que comprometen el aporte de oxígeno miocárdico 16 .
-
Efectos cardiovasculares de la anestesia epidural torácica alta
Los efectos cardiovasculares secundarios a AETA han sido estudiados en animales y en humanos y dado su importancia clínica se analizarán en forma separada. El inotropismo y cronotropismo cardíaco están en gran parte controlados por las fibras autonómicas aferentes y eferentes provenientes de los cinco primeros segmentos espinales torácicos. A nivel cardíaco se ha visto que la AETA favorece la redistribución de flujos regionales y afecta positivamente los determinantes del consumo de oxígeno, generando un menor daño isquémico 14 .
-
Frecuencia cardíaca: la AETA produce una pequeña pero significativa reducción del cronotropismo en voluntarios sanos y en pacientes quirúrgicos. En animales de estudio se ha visto que AETA posee efecto sobre el tejido éxito conductor produciendo un aumento marcado del período refractario y del tiempo de conducción a nivel del nódulo atrio ventricular y a nivel ventricular. La disminución del tono simpático reduce el riesgo de arritmias, lo que se ha objetivado en pacientes de cirugía cardíaca, aún cuando estudios controlados randomizados han demostrado que no disminuye la incidencia de fibrilación auricular 14 ,17,18,19,20 .
-
Función ventricular: los efectos de la disminución de la actividad simpática sobre la función ventricular tanto en animales como humanos, son controversiales. Algunos trabajos han demostrado una disminución de la contractilidad ventricular izquierda, aún en pacientes sanos y en otros trabajos se han medido mejores índices de función miocárdica en la actividad contráctil segmentaria y global, en pacientes coronarios y también sanos 7 ,21,22,23 .
-
Flujo sanguíneo coronario: los vasos coronarios epicárdicos y arteriolas coronarias están ampliamente inervadas por fibras simpáticas adrenérgicas. El aumento de la actividad simpática genera vasoconstricción en arterias coronarias sanas y estenóticas. Actualmente existe evidencia que establece que AETA ya sea en animales o en humanos produce efectos favorables. En perros se ha demostrado que AETA produce una redistribución del flujo coronario hacia el endocardio en corazones normales e infartados 24 . En humanos ha demostrado tener un efecto antianginoso y antisquémico en pacientes cursando con IAM o angina inestable, ya que favorece el balance de consumo de oxígeno al disminuir su consumo y redistribuir flujo hacia zonas vulnerables. Se ha demostrado no sólo alivio del dolor precordial sino efectos beneficiosos sobre los principales determinantes del consumo de oxígeno, disminuyendo la presión arterial sistólica, frecuencia cardíaca y presiones de llenado de ventrículo izquierdo, sin afectar significativamente la presión de perfusión coronaria 25 ,26,27 . En modelo canino se ha descrito una disminución de la magnitud del daño isquémico, al reducir el tamaño de tejido infartado y de la hiperemia postisquémica 28 .
La AETA con opiodes y anestésicos locales se ha asociado con disminución de la secreción de péptidos natriuréticos en pacientes sometidos a cirugía abdominal y de mayor riesgo de de isquemia perioperatoria. Estas hormonas se liberan al producirse aumento de la tensión de la pared ventricular y auricular y son considerados marcadores de fenómenos isquémicos miocárdicos sin necrosis del miocito 29 .
La mayoría de los mejores índices se asocian principalmente a la AETA y no a anestesia epidural lumbar (AEL), situación que no nos permite extrapolar resultados. La AEL genera bloqueo simpático, pero junto con vasoconstricción de los segmentos torácicos no bloqueados y sin los beneficios directos sobre el corazón, lo que teóricamente no representaría mayor beneficio, salvo un mejor control de la analgesia. La hipotensión puede ser deletérea en ambos grupos, pero la AETA simultáneamente favorece la redistribución de flujo y vasodilatación coronaria 12 ,30,31 .
-
Efectos pulmonares
En pacientes sanos, los efectos de AET de segmentos bajos o la AEL casi no poseen repercusión clínica sobre la función respiratoria. En voluntarios sanos y en perros bajo acción de AET se ha visto una alteración de los movimientos de la caja torácica, resultando en una disminución de la respuesta ventilatoria al aumento de dióxido de carbono, lo que probablemente se explica por el bloqueo de músculos intercostales, sin embargo, el diafragma es capaz de mantener una adecuada ventilación a pesar de la reducción del componente torácico. Los volúmenes y capacidades pulmonares se afectan según la magnitud de la extensión del bloqueo. La CV se compromete en un 13%, la CRF en un 6% y la CPT en un 9%. La PaO2 puede caer pero sin repercusión clínica 32 .
En pacientes sometidos a cirugía abdominal alta o torácica habitualmente se produce una disfunción pulmonar postoperatoria con disminución de CRF, CV y VEF1, los que pueden demorarse hasta 14 días en recuperarse. Varios estudios han demostrado un menor impacto sobre VEF1 y CVF en grupos con AET, encontrando una disminución de un 20% comparado con un 50% del grupo control 33 . También se ha demostrado que pacientes bajo acción de AET, al tener un buen control del dolor poseen una tos más efectiva, disminuyendo el riesgo de atelectasia y neumonía, al igual que se favorece una extubación más precoz 33 .
En pacientes con disminución de la reserva pulmonar que dependen o hacen uso de su musculatura accesoria, existe la duda sobre los beneficios de AET, ya que teóricamente al comprometerse los músculos interscostales y abdominales aumentaría el riesgo de insuficiencia respiratoria. Sin embargo, trabajos en obesos han demostrado que la recuperación de la función ventilatoria es más rápida en pacientes con AET que los pacientes manejados con analgesia con opiodes parenterales 30 ,34,35 .
-
Función gastrointestinal
La motilidad gastrointestinal se regula por factores nociceptivos, mediadores endógenos y por un equilibrio entre los sistemas simpático y parasimpático, inhibiendo y estimulando respectivamente. Durante la cirugía se produce un aumento de la actividad simpática producto del estrés, manipulación quirúrgica y dolor, lo que puede producir hipoperfusión y parálisis intestinal, constituyendo un problema y una causal de morbilidad. La hipoperfusión gastrointestinal se ha asociado a aumento de la permeabilidad de la mucosa, endotoxemia, falla multiorgánica y aumento de la morbimortalidad en pacientes graves 30 ,32 .
Por otro lado, la anestesia neuroaxial per se puede producir náuseas y vómitos casi en un 20%, lo que se asocia a un estado de aumento de la peristalsis secundario al predominio de la función vagal, sobretodo en bloqueos altos 15 y también por la acción de opiodes. Sin embargo, diversos estudios han demostrado que AET tiene un rol protector, ya que se asocia a un aumento del flujo gastrointestinal en humanos. En animales se ha visto una menor acidosis e isquemia intestinal, producto de hipoxia mantenida. Los efectos se deberían principalmente al bloqueo simpático de vasos mesentéricos que aumentan el flujo sanguíneo hacia las mucosas, aun en condiciones de bajas presión de perfusión sistémica 30 ,32 .
El íleo postoperatorio es una complicación bastante frecuente posterior a cirugía abdominal y obedece a múltiples factores (neurogénicos, inflamatorios, farmacológicos). Existe evidencia que demuestra que la AET con anestésicos locales favorece una recuperación más precoz de la función intestinal, beneficio que es más evidente cuando el catéter está puesto sobre T12 36 . Estos beneficios se pueden explicar por la mejor supresión del estrés quirúrgico, alivio del dolor y menor necesidad de uso de opioides y bloqueo simpático intestinal 31 .
Existe cierta evidencia que sugiere un rol protector de la anestesia epidural (AE) en relación con la disminución de la incidencia de dehiscencia de anastomosis gastrointestinales. El aumento del flujo esplácnico favorecería la oxigenación y flujos en áreas de anastomosis; sin embargo, trabajos en humanos y en animales no han demostrado diferencias entre AE y anestesia general 37 .
-
Coagulación
Durante el período perioperatorio se genera un estado de hipercoagulabilidad desencadenado por varios factores como el estrés quirúrgico, estasia sanguínea y daño endotelial, lo que genera aumento de los fenómenos trombóticos arteriales y venosos. Posterior a la cirugía se han detectado altos niveles de sustancias procoagulantes, bajas concentraciones de inhibidores de la coagulación, inhibición de la fibrinolisis y aumento de la función plaquetaria. La anestesia neuroaxial con anestésicos locales se asociaría a un aumento del flujo sanguíneo periférico, a una mejor preservación de la actividad fibrinolítica, atenuación del aumento de factores de coagulación, disminución en la viscosidad sanguínea y de la actividad plaquetaria 38 .
-
Termorregulación
Durante la AE se produce una pérdida de calor por la vasodilatación secundario al bloqueo y por el medio ambiente más frío. Los mecanismos reguladores de la temperatura estarían “engañados” al censar aumento de la temperatura en los segmentos bloqueados, junto con la imposibilidad de generar vasocontricción compensadora en esos segementos. Posteriormente se desencadenan mecanismos compensadores para generar calor, produciéndose aumento de la actividad muscular, generándose calofríos y vasoconstricción en los segmentos no bloqueados.
-
Función renal
El efecto sobre la perfusión renal aún en bloqueos altos es de bajo impacto, ya que el riñón posee una gran reserva funcional. El mayor efecto se ve asociado a la función urinaria ya que se produce una atonía de la vejiga, secundaria al bloqueo de las raíces S2-S4 y también al uso de opiodes neuroaxiales 11 .
-
Efectos endocrinos
La anestesia regional y fundamentalmente el uso de anestésicos locales por vía neuroaxial pueden llegar a abolir la respuesta neuroendocrina frente al estrés quirúrgico, lo que parece no ser posible con el uso de anestesia general. El estrés quirúrgico produce cambios sobre el sistema endocrino y metabólico, llevando al aumento de diversas hormonas y sustancias como catecolaminas, cortisol, glucosa, hormonas antidiuréticas y de crecimiento, etc. La capacidad de la AE para abolir la respuesta al estrés depende de lograr un adecuado nivel de bloqueo sensitivo, que el inicio de la anestesia sea previo a la agresión quirúrgica y que la solución anestésica posea anestésicos locales. La capacidad de la AE para bloquear toda esta respuesta es menor que la de la anestesia raquídea probablemente por la incapacidad de la primera de bloquear completamente todas las aferencias nociceptivas 39 .
-
Efecto sobre sistema inmune
El acto quirúrgico, la anestesia, el dolor perioperatorio y el estrés sicológico son factores que producen depresión en la respuesta inmunológica celular y humoral, la que puede prolongarse por un período variable de tiempo. Se ha medido las concentraciones de interleukina (IL) 1, 2 y 6, linfocitos NK (natural killer) y linfocitos mitogénicos, encontrando que los pacientes con AE presentaban mejor analgesia y que los niveles de IL 1 y 6 no cambiaba en comparación con grupos que reciben opioides. El grupo de AE presenta una respuesta proinflamatoria menor, con preservación de la función linfocitaria 30 .
-
Impacto clínico
Dados los numerosos efectos benéficos descritos, la AE debería asociarse teóricamente a mejores resultados clínicos, como menores índices de mortalidad y de complicaciones mayores en el período perioperatorio.
Durante varias décadas los investigadores han estudiado diversas variables clínicas y de laboratorio, encontrando resultados favorables en términos de mejor calidad de la analgesia, disminución de fenómenos tromboembólicos venosos, disminución de reoperación en cirugía vascular periférica, disminución de pérdidas sanguíneas, mayor rapidez de la recuperación de la función pulmonar, disminución de la morbimortalidad de origen cardiovascular, disminución de los días de estadía en UTI, disminución de complicaciones renales, disminución de la incidencia de dolor crónico, extubación y deambulación precoz, disminución de la respuesta al estrés, recuperación más rápida de la función intestinal, etc. 30 ,32 . Sin embargo, la calidad de la evidencia científica no ha podido sustentar que todos los beneficios atribuidos a la AE se asocien a mejores resultados en términos de mortalidad o que puedan ser reproducidos en los distintos grupos poblacionales. Una de las principales dificultades que tenemos para que estos beneficios sean demostrados, es la limitación que ofrece la interpretación de resultados provenientes de casuísticas pequeñas asociadas a distintos protocolos de anestesia/analgesia epidural: tiempo de inicio (preoperatorio, intraoperatorio, postoperatorio), anestesia general concomitantemente, duración de la analgesia, composición de la solución administrada, nivel de cateterización del espacio epidural, etc.
-
Calidad de la analgesia
Block et al 1 , realizaron un metaanálisis que incluyó 100 trabajos controlados randomizados que medían eficacia de la analgesia epidural comparada con manejo de la analgesia con opiodes parenterales (OP). Los autores encontraron que los pacientes sometidos AE tenían en forma significativa un mejor control del dolor postoperatorio en los distintos grupos estudiados independientemente del sitio quirúrgico, del lugar de cateterización epidural y de la solución utilizada (anestésicos locales con o sin opiodes u opiodes solos). Sólo en un estudio no se encontró diferencia entre ambos grupos, correspondiendo a pacientes sometidos a cirugía torácica manejados con analgesia epidural con opiodes sin anestésicos locales. La complicación más frecuente fue el bloqueo motor en el grupo de AE y las náuseas y vómitos la complicación más frecuente en grupo con OP. El grupo de AEL con opiodes presentó una incidencia mayor de prurito (38%) comparado el grupo OP (6%). El grupo de AET con o sin opiodes presentó mayor incidencia de hipotensión (14%) que el grupo OP (2%). Estos resultados concuerdan con otra revisión sistemática que incluyó cerca de 20.000 pacientes, en que el uso de AE se asoció a un porcentaje más bajo de dolor moderado y severo que cuando se comparó con administración de OP. Un 71% de los pacientes con AE estuvo libre de dolor, comparado con un 54% en el grupo con PCA endovenosa 40 .
Más recientemente se publicó un meta-análisis, midiendo el efecto de las distintas técnicas analgésicas en relación a la calidad de la analgesia y a la evaluación del propio paciente, en términos de satisfacción, calidad de vida y calidad de recuperación postoperatoria. Se encontró que las técnicas regionales proveen al paciente de una mejor calidad de analgesia que los OP, pero no se tradujo en una diferencia en las otras variables evaluadas por el paciente. El subgrupo que recibió AE mostró una superior calidad de la analgesia comparada con la analgesia con OP, efecto más notorio cuando las soluciones contienen anestésicos locales el catéter está ubicado lo más cercano a los segmentos que cubren el área quirúrgica. En términos de efectos adversos la anestesia epidural se asocia a menor incidencia de náusea y vómitos, pero mayor incidencia de prurito, retención urinaria y bloqueo motor 31 .
La literatura actual establece que la AE provee mejor calidad de analgesia cuando se compara con OP, en término de mejores puntuaciones de escalas que evalúan dolor en reposo o dinámico y en términos de menos efectos colaterales en los distintos grupos quirúrgicos. La calidad de la analgesia es mejor si las soluciones infundidas poseen anestésicos locales y si existe congruencia catéter-incisión 41 .
-
Morbilidad-mortalidad
Durante la década de los años ochenta y noventa se publicaron trabajos que mostraron mejores resultados en términos de mortalidad, episodios coronarios y menor número de reoperaciones en pacientes sometidos a cirugía vascular y en pacientes de alto riesgo, que estaban bajo acción de AE 42 –45 . Posteriormente se incorporó la AET a pacientes sometidos a revascularización coronaria, demostrando una disminución de la incidencia de infarto postoperatorio y mejoría en los índices de función ventricular en pacientes manejados con esta técnica 26 ,27 . También al medir en forma dirigida resultados pulmonares se han obtenido mejores índices y menor tasa de complicaciones en grupos bajo acción de AE 46 .
En relación con los beneficios de la AE, considerando su efecto “protector” en términos de prevención de fenómenos trombóticos venosos, existen trabajos randomizados y meta-análisis 47 que han encontrado mejores resultados respecto de los fenómenos trombóticos cuando se compara anestesia neuroaxial con anestesia general más OP, aún cuando no siempre se consigna si los diversos grupos reciben terapia antitrombótica. Un meta-análisis demostró una menor incidencia de trombosis venosa diagnosticada radiológicamente, pero no demostró una diminución en la incidencia de trombosis clínica, en pacientes sometidos a artroplastía de rodilla 11 ,42 .
Dentro de los trabajos más comentados en la literatura en la última década está el meta-análisis de Rodgers y cols 47 , quienes hicieron una revisión que incluyó 9.559 pacientes provenientes de 141 trabajos, teniendo por objetivo principal medir diferencias en morbimortalidad en pacientes bajo acción de anestesia neuroaxial (raquídea y/o epidural) (grupo I) comparado con pacientes bajo acción de anestesia general (grupo II) sometidos a diferentes tipos de cirugía. La mortalidad general descrita fue menor en un tercio en el grupo I, aún cuando no hubo diferencias entre los distintos grupos quirúrgicos. En los pacientes sometidos a técnicas neuroaxiales el riesgo de trombosis venosa profunda disminuyó en un 44%, el de tromboembolismo pulmonar en un 55%, infarto miocárdico 33% y de depresión respiratoria en un 59%. Cuando se comparó anestesia raquídea con AE no se encontró diferencia en la mortalidad, pero sí cuando la analgesia se prolongaba en el período postoperatorio. También se describió una reducción de un 50% en la necesidad de transfusión y una reducción en el riesgo de neumonía y falla renal.
Beattie y cols, encontraron una disminución en la incidencia de infarto miocárdico en pacientes de riesgo sometidos a cirugía vascular y abdominal, bajo acción de AE por más de 24 horas, comparado con el grupo control. La incidencia de infarto miocárdico fue menor para el grupo con AE, siendo mayor la diferencia para el grupo de AET que para AEL. El grupo con AE tuvo una incidencia de 2,86% y el control de 5,25%. Cuando se hizo el análisis por nivel de AE, los pacientes con AET presentaron una incidencia de 4% comparado con un 8,45% del grupo control, calculándose una disminución del riesgo de un 40% en este subgrupo. La mortalidad fue de un 3,3% pero sin diferencia significativa entre los grupos. La calidad de la analgesia presentó diferencia significativa en relación al grupo control 48 .
Posteriormente Rigg y cols 49 , publicaron un trabajo multicéntrico en 925 pacientes de alto riesgo sometidos a cirugía abdominal mayor, que fueron aleatorizados para recibir anestesia epidural-general/analgesia epidural o anestesia general/analgesia parenteral con opiodes. En este estudio, a diferencia de lo encontrado por Yaeger y Rodgers, no se encontraron diferencias significativas en términos de mortalidad a 30 días ni en morbilidad mayor, exceptuando una menor incidencia de insuficiencia respiratoria en el grupo AE/AE. La calidad de la analgesia fue mejor en grupo I, encontrándose diferencias significativas en las puntuaciones de dolor.
Más recientemente Liu y cols 50 , realizaron una actualización y análisis de la evidencia disponible, en que incluyó 18 meta-análisis, 10 revisiones sistemáticas, 8 trabajos randomizados controlados y 2 trabajos observacionales. Los autores realizaron un análisis de distintas técnicas analgésicas, concluyendo que la evidencia disponible no permite reafirmar o descartar la superioridad de una técnica analgésica sobre otra, en términos de mortalidad y morbilidad postoperatoria.
En suma, dada la evidencia disponible, se puede establecer que la AET se asocia a una mejor calidad de la analgesia pero que el impacto clínico, en términos de mortalidad o morbilidad, aún es incierto. La AET y principalmente la AETA se asocian a una menor incidencia de complicaciones cardiovasculares y pulmonares, pero sólo en pacientes de alto riesgo o sometidos a cirugía vascular mayor.
Comentario final
La AET es una alternativa para el manejo analgésico en cirugía de tórax y abdominal alto. Si bien la evidencia actual no ha podido definir el impacto sobre la mortalidad y morbilidad comparada con otras técnicas, la calidad de la analgesia, satisfacción y confort de los pacientes la posicionan como una excelente alternativa. Dado que existen diferencias anatómicas y de abordaje en relación con la AEL, se necesita desarrollar cierta experticia para una práctica más segura. La posibilidad de prolongar la analgesia a través de una técnica continua requiere de un control por un equipo especializado, que no sólo valore la calidad de la analgesia sino que también la eventual aparición de complicaciones.
REFERENCIAS
- Block B, Liu S, Rowlingson A, Cowan A, Cowan J, Wu C. Efficacy of postoperative epidural analgesia. A meta-analysis. JAMA 2003; 290: 2455-2463.
- Werawatganon T, Charuluxanun S. Patient controlled intravenous opioid analgesia versus continuous epidural analgesia for pain after intra-abdominal surgery. Cochrane Database Syst Rev 2005; CD004088.
- Davies R, Myles P, and Graham J. A comparison of the analgesic efficacy and side-effects of paravertebral vs epidural blockade for thoracotomy: A systematic review and metaanalysis of randomized trials. Br J Anaesth 2006; 96: 418-426.
- Manion S, Brennan T. Thoracic Epidural Analgesia and Acute Pain Management. Anesthesiology 2011; 115: 181-188.
- Rosenberg H, Keyhak M. Distance to epidural space in nonobese patients. Anesth Analg 1984; 63: 539-540.
- Königsrainer I, Bredanger S, Drewel-Frohnmeyer S, et al. Audit of motor weakness and premature catheter dislodgement after epidural analgesia in major abdominal surgery. Anaesthesia 2009; 64: 27-31.
- Good practice in the management of continuous epidural analgesia in the hospital setting (Acceso el 9 de septiembre de 2011 en: http. www.rcoa.ac.uk /docs/epid-analg.pdf).
- Visser WA, Lee RA, Gielen MJM. Factors Affecting the Distribution of Neural Blockade by Local Anesthetics in Epidural Anesthesia and a Comparison of Lumbar Versus Thoracic Epidural Anesthesia. Anesth Analg 2008; 107: 708-721.
- Viscusi E. Emerging techniques in the management of acute pain: epidural analgesia. Anesth Analg 2005; 101: S23-S29.
- Hogan Q. Distribution of solution in the epidural space: examination by cryomicrotome section. Reg Anesth Pain Med 2002; 27: 150-156.
- Cousins M, Carr D, Horlocket T, Bridenbaugh P. Neural blockade in clinical anesthesia and pain medicine. Fourth editon. Lippincott Williams & Wilkins, 2009.
- Wu C, Thomsen R. Effect of postoperative epidural analgesia on patient outcomes. Tech Reg Anaesth Pain Med 2003; 7: 140-147.
- Rolf N, Van Haken H. Physiology and patophysiology of thoracic sympathetic blockade. Bailliere’s Clinical Anaesthesiology 1999; 13: 1-7.
- Clemente A, Carli F. Thoracic epidural analgesia and the cardiovascular system. Tech Reg Anaesth Pain Med 2008; 12: 41-45.
- Brown D. Spinal, epidural, and caudal anesthesia. En Miller RD. Anesthesia. 6th edition. Philadelphia, Churchill Livingstone, 2005: 1653-1683.
- Liu S, McDonald S. Current issues in Spinal Anesthesia. Anesthesiology 2001; 94: 888-906.
- Takeshima R, Dohi S. Circulatory responses to baroreflexes, Valsalva maneuver, coughing, swallowing, and nasal stimulation during acute cardiac sympathectomy by epidural blockade in awake humans. Anesthesiology 1985; 63: 500-508.
- Bonnet F, Szekely B, Abhay K, et al. Baroreceptor control after cervical epidural anesthesia in patients undergoing carotid artery surgery. J Cardiothorac Anesth 1989; 3: 418-424.
- Jideus L, Joachimsson P, Stridsberg M, et al. Thoracic epidural anesthesia does not influence the occurrence of postoperative sustained atrial fibrillation. Ann Thorac Surg 2001; 72: 65-71.
- Groban L, Dolinski S, Zvara D, et al. Thoracic epidural analgesia: its role in postthoracotomy atrial arrhythmias. J Cardiothorac Vasc Anesth 2000; 14: 662-665.
- Goertz A, Seeling W, Heinrich H, et al. Influence of high thoracic epidural anesthesia on left ventricular contractility assessed using theend-systolic pressure-length relationship. Acta Anaesthesiol Scand 1993; 37:38-44.
- Niimi Y, Ichinose F, Saegusa H, et al. Echocardiographic evaluation of global left ventricular function during high thoracic epidural anesthesia. J Clin Anesth 1997; 9: 118-124.
- Berendes E, Schmidt C, Van Aken H, et al. Reversible cardiac sympathectomy by high thoracic epidural anesthesia improves regional left ventricular function in patients undergoing coronary artery bypass grafting: a randomized trial. Arch Surg 2003; 138: 1283-1290.
- Klassen GA, Bramwell RS, Bromage PR, et al. Effect of acute sympathectomy by epidural anesthesia on the canine coronary circulation. Anesthesiology 1980; 52: 8-15.
- Blomberg S, Emanuelsson H, Ricksten SE. Thoracic epidural anesthesia and central hemodynamics in patients with unstable angina pectoris. Anesth Analg 1989; 69: 558-562.
- Lagunilla J, García-Bengochea JB, Fernandez AL, et al. High thoracic epidural blockade increases myocardial oxygen availability in coronary surgery patients. Acta Anaesthesiol Scand 2006; 50: 780-786.
- Blomberg S, Emanuelsson H, Kvist H, et al. Effects of thoracic epidural anesthesia on coronary arteries and arterioles in patients with coronary artery disease. Anesthesiology 1996; 73: 840-847.
- Groban L, Zvara DA, Deal DD, et al. Thoracic epidural anesthesia reduces infarct size in a canine model of myocardial ischemia and reperfusion injury. J Cardiothorac Vasc Anesth 1999; 13: 579-585.
- Suttner S, Lang K, Piper S, et al. Continuous intra and postoperative thoracic epidural analgesia attenuates brain natriuretic peptide release after major abdominal surgery. Anesth Analg 2005; 101: 896-903.
- Waurick R, Van Haken H. Update in thoracic epidural anaesthesia. Best Practice & Research Clinical Anaesthesiology 2005; 19: 201-213.
- Liu S, Wu C. Effect of Postoperative Analgesia on Major Postoperative Complications: A Systematic Update of the Evidence. Anesth Analg 2007; 104: 689-702.
- Clemente A, Carli F. The physiological effects of thoracic epidural anesthesia nd analgesia on the cardiovascular, respiratory and gastrointestinal systems. Minerva Anestesiol 2008; 74: 549-563.
- Manikian B, Cantineau J, Bertrand M, Kieffer E, Satene R, Viars P. Improvement of diaphragmatic function by a thoracic extradural block after upper abdominal surgery. Anesthesiology 1998; 68: 379-386.
- von Unger-Sternberg B, Regli A, Reber A, Schneider M. Effect of obesity and thoracic epidural analgesia on perioperative spirometry. Br J Anaesth 2005; 94: 121-127.
- Gelman S, Laws H, Potzick J, et al. Thoracic epidural vs balanced anesthesia in morbid obesity: an intraoperative and postoperative hemodynamic study. Anesth Analg 1980; 59: 902-908.
- Steinbrook R. Epidural anesthesia and gastrointestinal motility. Anesth Analg 1998; 86: 837-844.
- Sinha A, Carli F. The role of regional anaesthesia in patient outcome: thoracic and abdominal surgeries. Tech Reg Anesth Pain Man 2008; 12: 183-193.
- Moore J. Epidural analgesia and clinical outcomes. Seminars in Anesthesia, Perioperative Medicine and Pain 2003; 197-208.
- Cousins M, Bridenbaugh P. Neural blockade in clinical Anesthesia and Management of Pain. 3a ed. Filadelfia: Lippincontt-Raven; 1998. pp 243-320.
- Dolin S, Cashman J, Bland J. Effectivness of acute postoperative pain management: evidence from published data. Br J Anaesth 2002; 89: 409-423.
- Mathur V, Bravos D, Vallera C, Wu C. Regional anesthesia and patient outcomes: evidence-based medicine. Tech Regional Anesth Pain Man 2008; 12:163-170.
- Yeager M, Glass D, Neff R, et al. Epidural anesthesia and analgesia in high-risk surgical patients. Anesthesiology 1987; 66: 729-736.
- Tuman K, McCarthy R, March R, et al. Effects of epidural anesthesia and analgesia on coagulation and outcome after major vascular surgery. Anesth Analg 1991; 73: 696-704.
- Christopherson R, Beattie C, Frank SM. Perioperative morbidity in patients randomized to epidural or general anesthesia for lower extremity vascular surgery. Anesthesiology 1993; 79: 422-434.
- Schmidt C, Hinde F, Van Aken H, et al. The effect of high thoracic epidural Anesthesia on systolic and diastolic left ventricular function in patients with coronary artery disease. Anesth Analg 2005; 100: 1561-1569.
- Ballantyne JC, Carr DB, de Ferranti S, et al. The comparative effects of postoperative analgesic therapies on pulmonary outcomes: cumulative meta-analysis of randomized controlled trials. Anesth Analg 1998; 86: 598-612.
- Rodgers A, Walker N, Schug S, McKee A, Kehlet A, van Zundert A, Sage D, Futter M, Saville G, Clark T, MacMahon S. Reduction of postoperative mortality and morbidity with epidural or spinal anaesthesia: results from overview of randomized trials. BMJ 2000; 321: 1493-1497.
- Beattie S, Badner N, Choi P. Epidural analgesia reduces postoperative myocardial infarction: A Meta-Analysis. Anesth Analg 2001; 93: 853-858.
- Rigg J, Jamrozik K, Myles P, Silbert B, Peyton P, Parsons R, Collins K, for the MASTER Anaesthesia Trial Study Group. Epidural anaesthesia and analgesia and outcome of major surgery: a randomized trial. Lancet 2002; 359: 1276-1282.
- Liu S, Block B, Wu C. Effects of perioperative central neuraxial analgesia on outcome after coronary artery bypass surgery: a meta-analysis. Anesthesiology 2004; 101: 153-161.