Tomas Ruiz Duran1,*, Guadalupe Margarita Castellanos Rosas2
Recibido: 24-07-2023
Aceptado: 12-08-2023
©2023 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 52 Núm. 8 pp. 840-844|https://doi.org/10.25237/revchilanestv52n8-23
PDF|ePub|RIS
Awake intubation of patient diagnosed with Merckel cell tumor
Abstract
Merkeloma or Merkel cell carcinoma is a rare tumor with a very aggressive evolutionary course that causes locoregional recurrences and metastases. It occurs predominantly in photo-exposed areas in elderly patients. In recent decades there has been an increase in its incidence due to the aging of the population and a greater diagnosis, thanks to current immunohistochemical techniques. Its pathogenesis is not well determined, there are several theories such as; immunosuppression or the presence of ultraviolet radiation damage. The objective of this article is to present the clinical case of a patient with a merckel cell tumor whose growth sites were at the ocular level and in the parotid gland, there was an invasion of the temporomandibular joint that limited the oral opening, conditioning an expected difficult airway, for the anesthetic approach intubation with the patient awake under adequate sedation and local anesthetic is proposed.
Resumen
El Merkeloma o carcinoma de células de Merkel es un tumor poco frecuente con un curso evolutivo muy agresivo que origina recidivas locorre- gionales y metástasis. Se presenta predominantemente en zonas foto expuestas en pacientes ancianos. En las últimas décadas existe un aumento en su incidencia debido a el envejecimiento de la población y a un mayor diagnóstico, gracias a las técnicas de inmunohistoquímica actuales. Su patogenia no está bien determinada, existen varias teorías como; inmunosupresión o la presencia de daño por radiación ultravioleta. El objetivo de este artículo es presentar el caso clínico de un paciente con tumor de células de Merckel que tuvo como sitios de crecimiento a nivel ocular y en glándula parótida, se produjo invasión a la articulación temporomandibular que limitaba la apertura oral, condicionando una vía aérea difícil prevista, para el abordaje anestésico se propone intubación con el paciente despierto bajo sedación adecuada y anestésico local.
-
Introducción
Las células de Merkel fueron descritas inicialmente por Friedrich Sigmund Merkel, el cual las denomino “Touch Cells” debido su supuesto rol en las respuestas sensitiva-perceptiva táctil. Hoy en día tanto su origen como su función son inciertos. Estas células residen de forma predominante en la capa basal de la epidermis y epitelio folicular donde se cree que están involucradas en síntesis de somatostatina, soporte neuronal y otros efectos paracrinos y endocrinos. Estas células han demostrado receptores para percepción táctil y su inervación sensitiva es dada por fibras nerviosas mielinizadas tipo A y p[1],[4].
El carcinoma de células de Merkel es un cáncer de piel raro y agresivo, caracterizado por una alta incidencia de recurrencias locales, adenopatías regionales y metástasis a distancia, con una elevada mortalidad. Fue descrito por primera vez en 1972 por Toker, este se presenta como una lesión indolora y poco característica en zonas expuestas al sol. Los pacientes suelen consultar por una lesión dérmica de crecimiento rápido. La incidencia anual en Estados Unidos aumentó de 0,22 casos por 100.000 habitantes en 1986 a 0,79 pacientes por 100.000 habitantes en el 2011, se estima un número de 1.600 casos anuales en Estados Unidos, en América latina no se cuenta con datos estadísticos[1],[4],[5].
Afecta en mayor medida a caucásicos (de raza blanca), entre 60 y 80 años, pero también puede manifestarse en personas de otras razas y edades. No se conoce la causa de este cáncer, pero se cree relacionado con la exposición del sol y la supresión del sistema inmune[2]. Se cree que la pigmentación cutánea tiene un efecto protector ya que pacientes asiáticos e hispanos tienen menor riesgo en comparación con individuos de piel blanca, se asocia a la exposición solar ya que es frecuente en pacientes de edad avanzada en piel con exposición solar crónica, el riesgo de diseminación a ganglios linfáticos es alto[4],[6].
Los sitios más frecuentes son cabeza y cuello (50%), y extremidades (30%). Sin embargo, el sol no es un factor imprescindible, puesto que existe 10% de casos en vulva y glúteos, zonas claramente no foto expuestas. El merckeloma se suele presentar como una placa infiltrada o bien nódulo rojizo o violáceo, doloroso y en ocasiones ulcerado. Suelen medir entre 0,5 y 2 cm de diámetro y muestran un crecimiento rápido[3].
La definición de vía aérea difícil según la ASA: Es la situación clínica en la que un médico capacitado en el cuidado de la anestesia experimenta una dificultad o falla anticipada o no anticipada, que incluye, entre otros, uno o más de los siguientes: ventilación con máscara facial, laringoscopia, ventilación con una vía aérea supraglótica, intubación traqueal, extubación o vía aérea invasiva[7].
El objetivo de la evaluación de la vía aérea tiene como finalidad identificar factores que se han asociado a la presencia de laringoscopia, ventilación o intubación difícil.
El índice predictivo de intubación difícil (IPID) es un instrumento de correlación y suma de las escalas de predicción de vía aérea difícil que lo conforman, cuya suma total, dependiendo de la clase o grado de las escalas, proporciona un puntaje de 5 a 18 puntos que se divide de la siguiente manera: 5-7 puntos intubación fácil, 8-10 puntos dificultad discreta, 11-13 puntos franca dificultad, 14-16 puntos gran dificultad y finalmente 1718 puntos intubación difícil[8].
Las escalas que componen este índice predictivo son las siguientes:
– Mallampati modificada: Esta prueba tiene una sensibilidad de 60% y una especificidad de 70% con un valor predictivo positivo de 13%[9].
– Patil – Aldreti (distancia tiromentoniana): Tiene una sensibilidad de 60%, una especificidad de 65% y un valor predic- tivo positivo de 15%[9].
– Distancia esternomentoniana: Tiene una sensibilidad de 80%, una especificidad de 85% y un valor predictivo positivo de 27%[9].
– Distancia interinsicivos: Tiene una sensibilidad de 40%, una especificidad de 90% y un valor predictivo positivo de 17%[9].
– Protusion mandibular: Tiene una sensibilidad de 30%, una especificidad de 85% y un valor predictivo positivo de 9%[9].
La evaluación de los pacientes antes de la cirugía es uno de los componentes críticos de la práctica anestésica. Debe ser realizada en cada paciente que será expuesto a un procedimiento anestésico con el fin de asegurar un resultado satisfactorio. El objetivo principal de la evaluación preoperatoria es preestablecer el riesgo al cual será expuesto el paciente y la elaboración de un consecuente plan de manejo perioperatorio de dicho riesgo. En el caso de la vía aérea, por la relevancia de las complicaciones derivadas de un inadecuado manejo, resulta imprescindible el poder determinar si el paciente presenta un riesgo elevado de dificultad para así actuar en consecuencia[9],[10].
Actualmente, las pruebas de detección disponibles para intubación difícil tienen un poder de discriminación único de bajo a moderado cuando se usan solas. La combinación de las pruebas incrementa el valor diagnóstico de la intubación difícil, por lo que el índice predictivo de intubación difícil (IPID) es una herramienta de ayuda para estos probables casos. Esto a su vez reduce el riesgo de complicaciones perioperatorias, los casos más comunes se presentan en la vía aérea inesperada o imprevista, en la que ocurre una obstrucción aguda de la vía aérea debido a inexperiencia o a la ejecución de maniobras erróneas sobre ella, que es a su vez dependiente del operador en su habilidad y experiencia ante el manejo de este tipo de casos[9],[10].
La falta de evaluación, capacitación y enseñanza de las vías aéreas parece ser motivo de preocupación. Según las intubaciones emergentes, el 10% de los pacientes tienen una vía aérea difícil, que es un predictor independiente de complicaciones de la vía aérea. Es por ello de suma importancia que el personal de salud tenga conocimiento de las diferentes escalas de evaluación de vía aérea , así como los médicos en formación tengan experiencia en el manejo de estos casos[11].
-
Presentación del caso
Masculino de 79 años, originario del estado de Veracruz, residente del estado de México, antecedentes familiares: padre finado a causa de cáncer de laringe. Antecedentes personales patológicos: hipertensión arterial sistémica de 20 años de evolución en tratamiento con losartan 50 mg cada 12 h más hidroclorotiazida 12,5 mg cada 24 h, evento vascular cerebral isquémico hace 9 años con secuelas RANKIN 1, portador de marcapasos por bloqueo AV completo desde hace 13 años con un cambio de generador hace 6 años. Antecedentes, quirúrgicos: apendicectomía abierta en la infancia sin complicaciones. Tabaquismo y alcoholismo positivo durante la juventud.
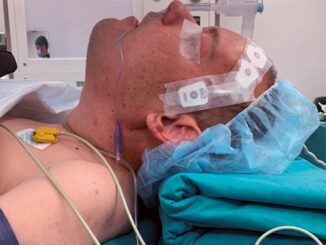
Padecimiento actual: Inicia su padecimiento en marzo de 2022 presentando lesión en parpado superior izquierdo de aproximadamente 0,5 cm que amerita manejo por oftalmología, con reporte histopatológico neoplasia maligna poco diferenciada, bordes quirúrgicos con presencia de invasión. En agosto de 2022 se obtiene resultado de inmunohistoquimica que reporta carcinoma de células de Merckel. Se realiza Tomografía Axial computarizada teniendo como hallazgos: Lesiones ocupantes de espacio hacia región ocular y cigomática izquierda que pueden corresponder a implantes tumorales de cáncer primario ya conocido, con actividad ganglionar en cadenas cervicales izquierdas, orbita izquierda con ausencia de globo ocular y perdida de la morfología habitual de los tejidos, con imágenes redondeadas con densidad de aire en su interior, glándula parótida con aumento de volumen que invade cigomático y la articulación temporomandibular izquierda (Figura 1 y 2).
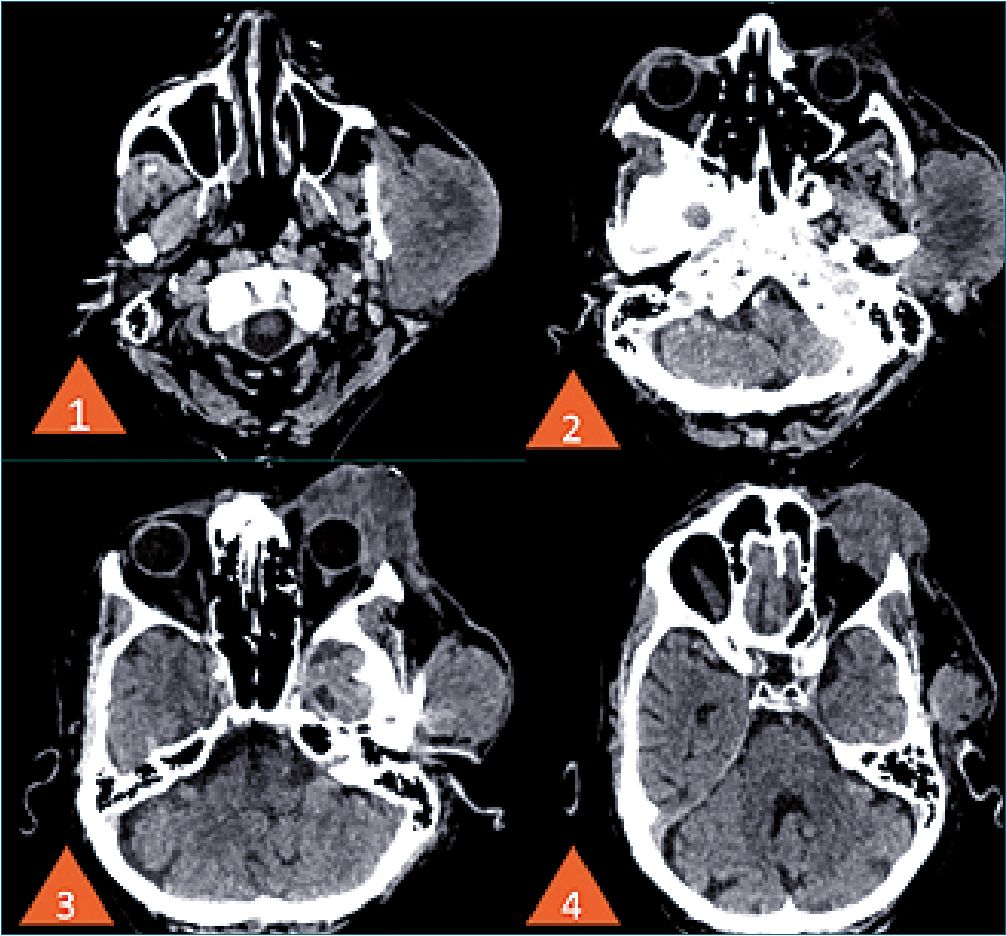
Figura 1. Se observan en los diferentes cortes tomográficos la perdida de la anaromia ocular, el crecimiento tumoral va desde el globo ocular izquierdo siguiendo hasta la glándula parotida ipsilateral.
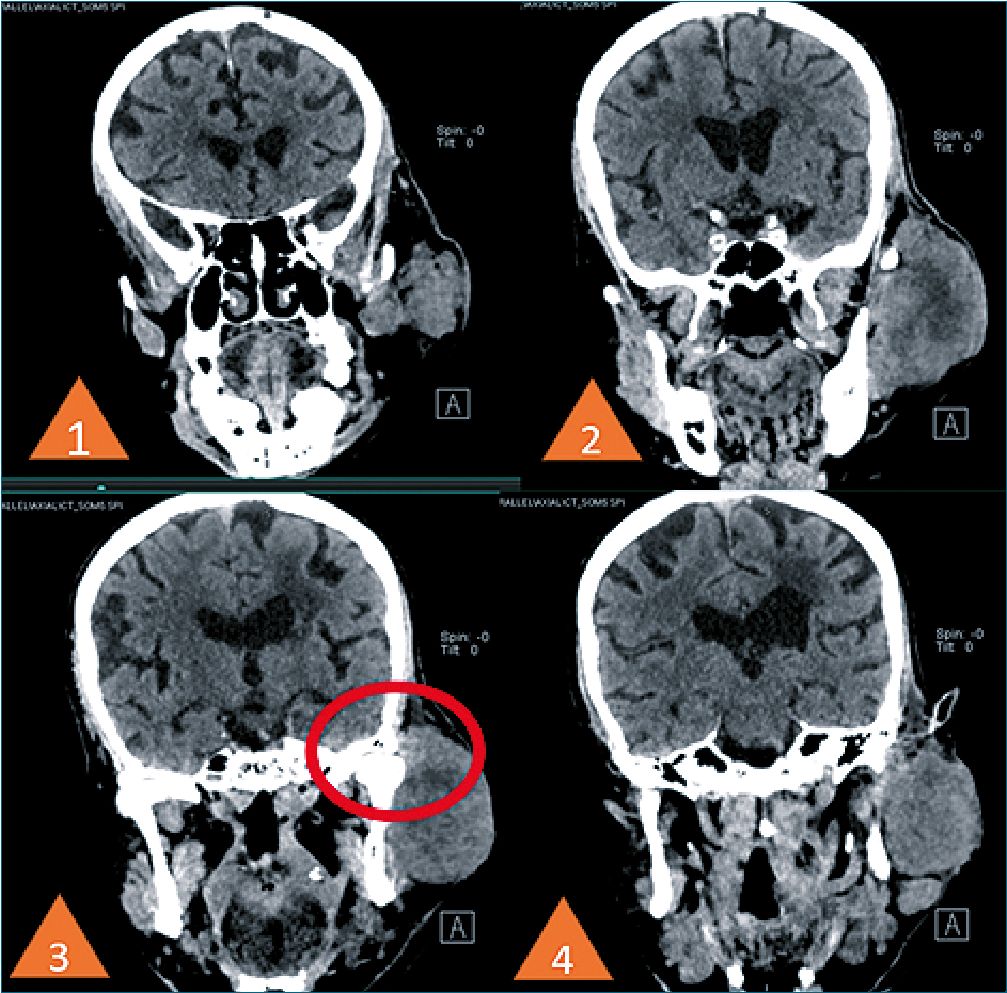
Figura 2. En el 3er corte tomográfico se aprecia la invasión del tumor sobre la articulación temporomandibular, el crecimiento tumoral de la glándula parotida.
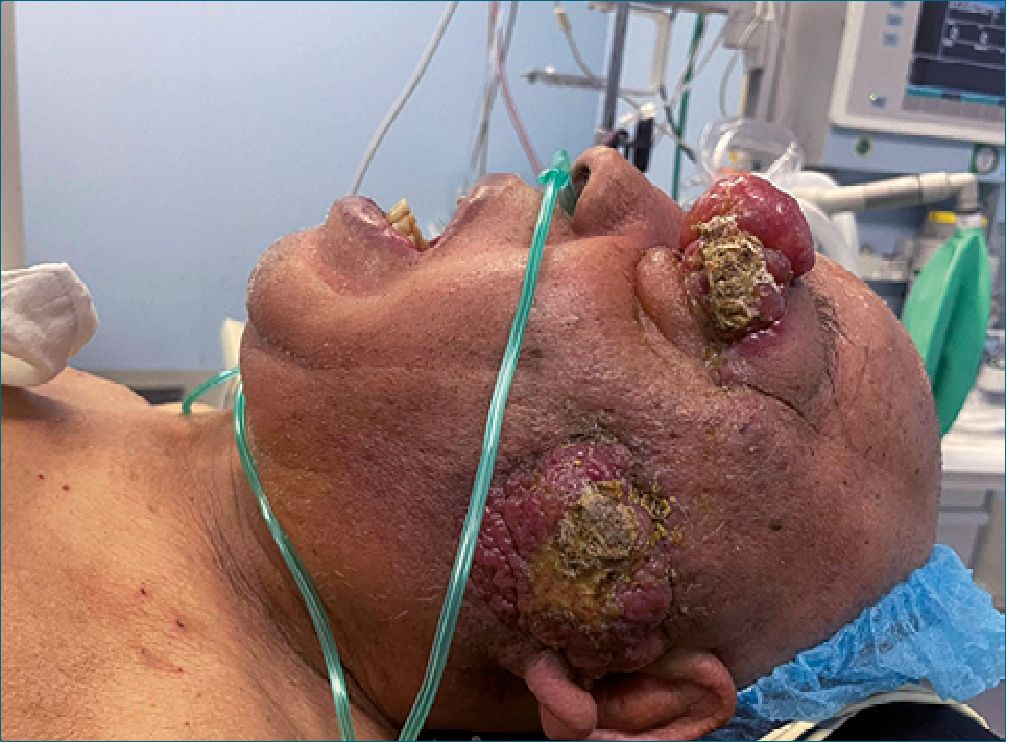
Figura 3. Apertura oral limitada por tumoración parotídea.
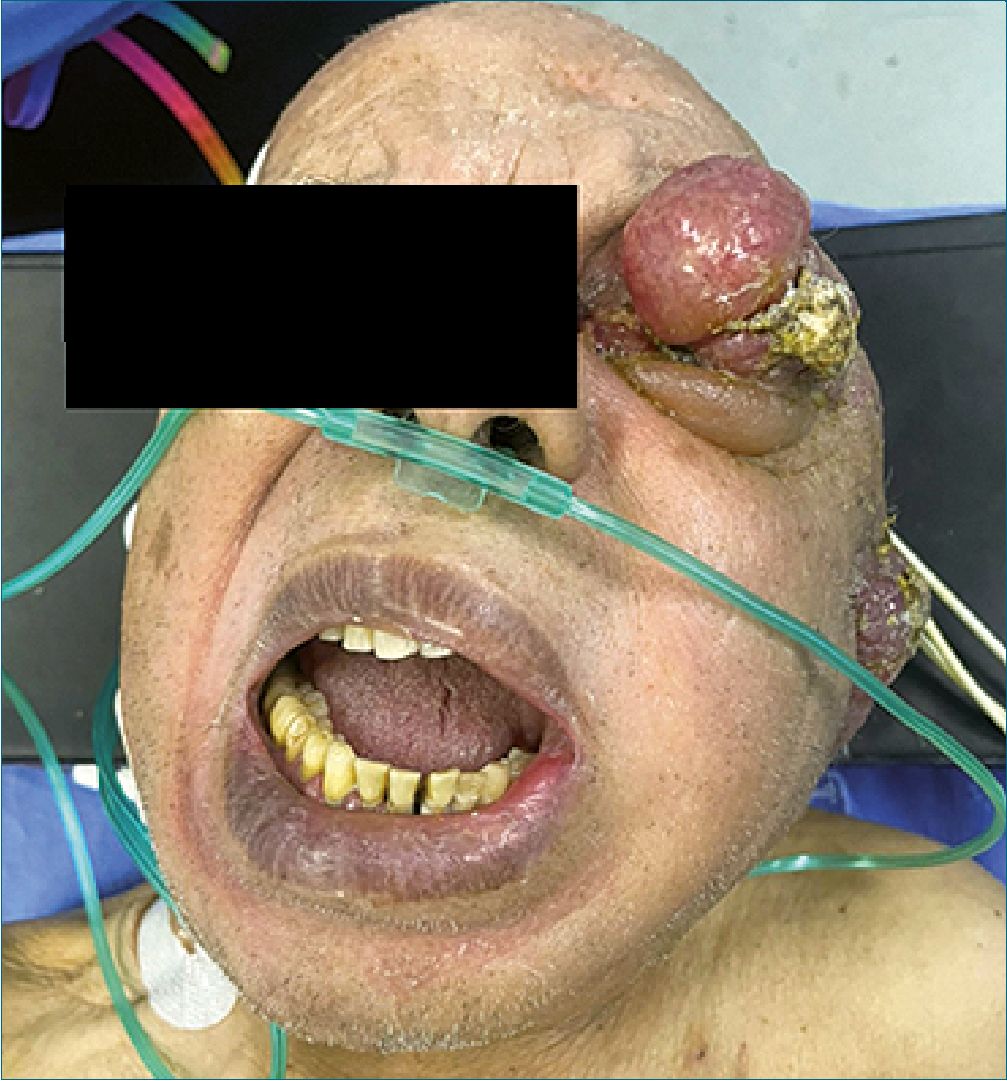
Figura 4. Apertura oral limitada por tumoración parotídea.
A la exploración física paciente consciente, activo, reactivo, alerta cooperador, Glasgow 15/15 orientado en sus 3 esferas, cráneo normocéfalo, pupila derecha isocórica normoreflexica, con pérdida de visión en ojo izquierdo, presencia de masa tumoral en ojo izquierdo, narinas permeables, mucosa oral hidratada con Mallampati IV, Patil Aldreti II, Belhouse II, distancia interinsicivos de 20 mm, protrusión mandibular de II, distancia tiro mentoniana I, IPID 11 puntos (se clasifica como una vía aérea difícil prevista) apertura oral limitada por la presencia de la tumoración parotídea derecha (Figura 3 y 4), cuello cilíndrico con tranquea central, se palpan presencia de cadena ganglionar izquierda, tórax simétrico con ruidos cardíacos rítmicos, sin soplos, campos pulmonares sin estertores ni sibilancias, abdomen blando depresible sin dolor a la palpación, extremidades integras, simétricas, con disminución de la fuerza en hemicuer- po derecho.
Laboratorios: biometría hemática con Hb 13,6 mg/dL, Htco 40,1%, plaquetas 236.000 leucocitos 6,9 Tiempos de coagulación Tp 10,5 seg, INR 0,9%, TPT: 21,6 seg, química sanguínea: glucosa 102 mg/dL, urea 17,1 mg/dL, creatinina 0,8 mg/dL.
Escalas de valoración, riesgo ASA: III riesgo cardiovascular GOLDMAN Clase 3 (10,1% de riesgo de muerte infarto al miocardio o paro cardíaco a los 30 días), GUPTA de 0,8%, ARISCAT con 34 puntos riesgo intermedio (13,3% de complicaciones pulmonares posoperatorias), CAPRINI 5 puntos alto riesgo, KARNOFSKY de 80% (actividad normal con esfuerzo, algunos signos y síntomas de la enfermedad).
Se informo a paciente y familiar responsable respecto a la técnica anestésica, los beneficios de la intubación en paciente despierto y posibles riesgos y complicaciones del procedimiento debido a el abordaje de la vía aérea, se resolvieron dudas y firmaron consentimiento informado para el procedimiento anestésico. El paciente se encontraba previamente hospitalizado donde se inició manejo con protector de mucosa gástrica, antibiótico profiláctico y se aseguró una vía central con catéter subclavio derecho.
Previo al procedimiento quirúrgico se realiza premediación para intubación despierto con dexmedetomidina a 0,7 mcg/kg en perfusión continua para 20 minutos, se inició nebulización con lidocaína al 2% 60 mg con 2 ml se solución salina al 0,9% durante 5 minutos, posteriormente, se ingresa paciente a sala y se realiza monitoreo no invasivo y monitoreo invasivo con BIS, posterior a la perfusión de dexmedetomidina con valores entre 60-65, se realiza asepsia y antisepsia de región cervical y se realiza bloqueo de nervios laríngeos tomando como referencia las astas mayores del hueso hioides, se administra lidocaína simple al 2% 20 mg perineural bilateral, se tiene preparado carro de vía aérea difícil y equipo quirúrgico en caso de requerir abordaje quirúrgico urgente de la vía aérea. Ya en posición de decúbito dorsal con bulto en cabeza de 10 cm de altura, se procede a administrar fentanilo fraccionado sin perder ventilación espontánea, con un total de 150 pg IV, se inicia abordaje con video laringoscopio C-MAC hoja MAC 4 observando un POGO de 100% sin alteraciones anatómicas en anillo glótico, utilizamos como guía introductor traqueal de Eschmann, se desliza a través del introductor cánula endotraqueal tipo Sanders 8,0 mm de diámetro interno, se corrobora posición de tubo endotraqueal por clínica y capnometria, se sella neumoempaque con 5 ml de aire, se procede a realiza inducción anestésica con propofol a 1,5 mg /kg, cisatracurio 100 pg/kg.
El monitoreo hemodinámico invasivo se realizó con transductor de Presión True Wave de Edwards, previa prueba de Allen en mano izquierda se procede a infiltrar lidocaína al 2% 4 mg subcutáneo, se identifica pulso de arterial radial y se cánula arteria con técnica de Seldinger.
El manejo hipnótico durante el transanestesico fue con sevofluorane manteniendo CAM entre 0,7 y 0,8 guiado por objetivos con BIS entre 40-50, manejo de analgesia con fentanilo en perfusión continua entre 2,0-3,0 mcg/kg/h, durante el transanestesico en 2 ocasiones presentó bradicardia de 30 latidos minuto condicionada por un franco reflejo óculo-motor mientras se realizaba la enucleación, la cual revierte en ambas ocasiones tras el cese del estímulo quirúrgico sin necesidad de administración de atropina, se administraron como adyuvantes: paracetamol 1 g IV, ketorolaco 30 mg IV, ondansetron 7 mg IV, dexametasona 8 mg IV. Se realizo extubación con paciente despierto en sala quirúrgica sin eventualidades, emersión por redistribución farmacológica, presenta reflejos protectores de vía aérea, ventilación espontánea, se egresa de sala de operaciones y continúa con monitoreo continuo no invasivo en la unidad de cuidados posoperatorios, hemodinámicamente estable y con Escala Visual Análoga 2/10 sin opioides (Figura 5).
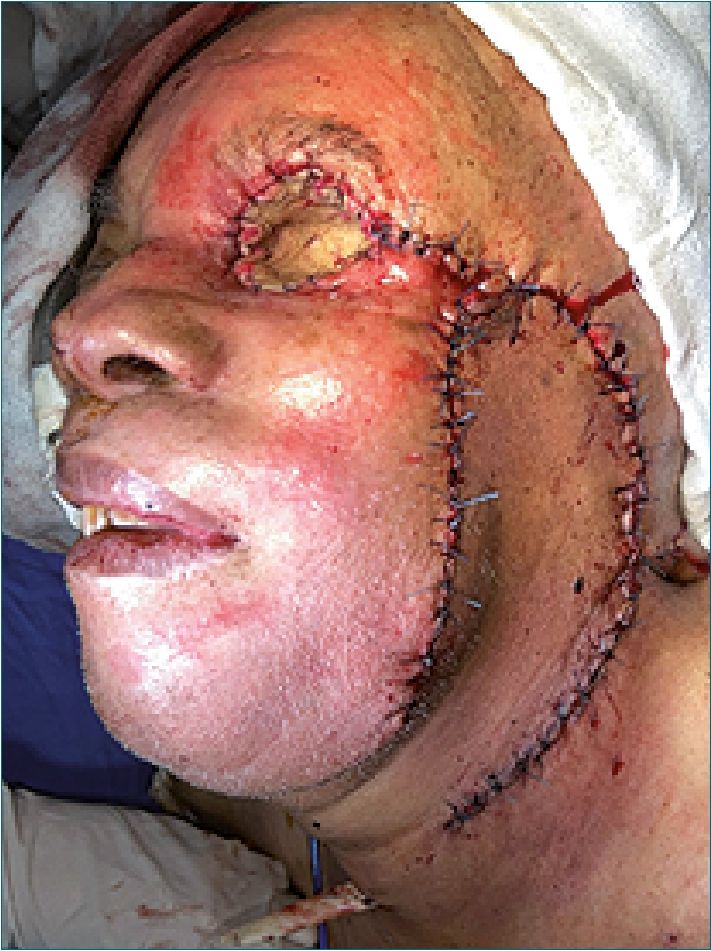
Figura 5. Vía aérea asegurada con canula sanders.
-
Discusión
La principal indicación para intubación en el paciente despierto es una vía aérea difícil prevista que conlleva a una intubación difícil. En este caso se tenía una enfermedad que ocasiona un alto riesgo de complicaciones condicionado por un índice predictivo de intubación difícil alto y la presencia de una tumo- ración en cabeza y cuello, por lo que se decide realizar intubación con paciente despierto.
Xing-Ying y colaboradores, realizaron una revisión sistemática en el 2014 donde mencionan la seguridad de la administración de dexmedetomidina como parte de la preparación del paciente en el que se realizara intubación despierto. La dexme- detomidina es un alfa 2 agonista con los efectos antes mencionados y también brinda analgesia. En dosis elevadas tiene mínima depresión respiratoria, a altas concentraciones plasmáticas puede resultar en bradicardia y disminución de la presión arterial por lo que Xing-Ying y cols., recomiendan administrar al menos 1 microgramo por kilo por lo menos 10 minutos y continuando con una perfusión de 0,2 a 0,5 mcg/kg/h. Medicamentos como las benzodiacepinas y los opioides se han utilizado como manejo en este tipo de pacientes, pero se ha reportado una mayor incidencia de depresión respiratoria[12].
Nosotros decidimos utilizar dexmedetomidina en perfusión con el objetivo de que nuestro paciente respondiera y fuera cooperador, evitando la ansiedad y depresión respiratoria.
Navarro-Vargas y cols., reportan el beneficio que se obtiene al utilizar un estilete de Eschmann ante una vía aérea difícil prevista la cual se encuentra en ocasiones subutilizada a pesar de su evidencia clínica ya demostrada, este dispositivo es útil, eficaz y de muy fácil manejo para facilitar la intubación ante la dificultad de visualizar las cuerdas vocales, sirviendo como una alternativa segura y económica de asegurar la vía aérea difícil prevista y con esto se reducen el número de intentos de larin- goscopia[13].
Las técnicas locorregionales como el bloqueo de nervio laríngeo superior se realizan a nivel del hueso hioides y el cartílago tiroideo, de 2 a 4 mm inferior a la membrana tirohioidea. Se recomiendan 2 mL de lidocaína al 2%, sin atravesar la membrana. El bloqueo del nervio laríngeo recurrente no se realiza directamente en el nervio porque puede causar parálisis bilateral de las cuerdas vocales y por ende ocasionar una urgencia de intubación[14].
-
Conclusión
El conocimiento de la anatomía de la vía aérea, las escalas que la valoran y los factores de riesgo que el paciente tiene son fundamentales para decidir de qué manera se abordara la vía aérea, ya sea una técnica convencional de inducción o intubación con paciente despierto. Esto nos ayudara a reducir el riesgo de complicaciones perioperatorias, teniendo en consideración el conocimiento y la habilidad del anestesiólogo. Si bien la estadística nos menciona que la incidencia de estos casos es baja, el anestesiólogo debe de estar preparado en todo momento para la atención correcta de estos pacientes.
-
Referencias
1. Vila Blanco JM, Nabhan S. Carcinoma de células de Merkel. Estudio de 3 casos. Rev Chil Cir [Internet]. 2016;68(6):456–61. Disponible en: https://doi.org/10.1016/j.rchic.2016.04.001.
2. De Caso P, Yohorlin M, Céspedes Fonseca M, Lilianne E, Cespedes D, Annaily E, et al. Universidad de Ciencias Médicas Holguín CC BY-NC-SA. Available from: http://scielo.sld.cu/pdf/ccm/v23n3/1560-4381-ccm-23-03-1070.pdf
3. Clín R. Fam. Carcinoma de células de Merkel. A propósito de un caso. 2013;6(1):43–6. Available from: https://scielo.isciii.es/pdf/albacete/v6n1/paciente1.pdf
4. Barquero Orias DE, Recinos DU, Guevara JM. Carcinoma de células de Merkel: patogénesis, manejo y tratamientos emergentes. Revista Médica Sinergia [Internet]. 2019 May;4(5):15–23. [cited 2021 Nov 3] https://doi.org/10.31434/rms.v4i5.189.
5. Chang P, Sangueza M, Ramos Elias P, Cabrera LM. Merckeloma, Reporte de un caso [Internet]. Dermatología cosmética, médica y quirúrgica. Medigraphic; 2010. Available from: https://www.medigraphic.com/pdfs/cosmetica/dcm-2010/dcm101f.pdf
6. Hennequin C, Rio E, Mahé MA. Radiothérapie des cancers cutanés. Cancer Radiother. 2016 Sep;20 Suppl:S249–55. https://doi.org/10.1016/j.canrad.2016.07.026 PMID:27522189
7. Jeffrey L. Apfelbaum, Carin A. Hagberg, Richard T. Connis, Basem B. Abdelmalak, Madhulika Agarkar, Richard P. Dutton, John E. Fiadjoe, Robert Greif, P. Allan Klock, David Mercier, Sheila N. Myatra, Ellen P. O’Sullivan, William H. Rosenblatt, Massimiliano Sorbello, Avery Tung; 2022 American Society of Anesthesiologists Practice Guidelines for Management of the Difficult Airway. Anesthesiology. 2022;136(1):31–81. https://doi.org/10.1097/ALN.0000000000004002.
8. Dominguez Perez M. Gonzalez R del S. Correlación entre el Índice predictivo de intubación difícil y el Cormack. Revista Medica del Instituto Mexicano del Seguro Social. Instituto Mexicano del Seguro Social; 2022. Available from: http://revistamedica.imss.gob.mx/editorial/index.php/revista_medica/article/view/4536/4479
9. Ramírez-Acosta JA, Torrico-Lara GG, Encinas-Pórcel CM. Índices predictores de vía aérea en pacientes obesos. Revista Mexicana de Anestesiología. 2019;36(3):193–201.
10. Escobar DJ. ¿CUÁNTO PODEMOS PREDECIR LA VÍA AÉREA DIFÍCIL? Rev Chil Anest, 2009; 38: 84-90 Available from: https://revistachilenadeanestesia.cl/cuanto-podemos-predecir-la-via-aerea-dificil/#b1
11. Abdulla S, Abdulla S, Schwemm KP, Eckhardt R, Abdulla W. Making endotracheal intubation easy and successful, particularly in unexpected difficult airway. Int J Crit Illn Inj Sci. 2014 Jan;4(1):24–8. https://doi.org/10.4103/2229-5151.128009 PMID:24741494
12. He XY, Cao JP, He Q, Shi XY. Dexmedetomidine for the management of awake fibreoptic intubation. Cochrane Database Syst Rev. 2014 Jan;2014(1):CD009798. https://doi.org/10.1002/14651858.CD009798.pub2 PMID:24442817
13. Navarro-Vargas JR, Becerra-Orjuela RM, Gutiérrez-León MA. El bougie o «estilete táctil», una alternativa clásica útil en la intubación moderna. A propósito de un caso clínico en el Hospital Universitario Nacional de Colombia. Colomb J Anesthesiol [Internet]. 2017;45(3):262–6. Disponible en: https://doi.org/10.1016/j.rca.2017.05.001.
14. Regional and topical anesthesia for awake endotracheal intubation [Internet]. NYSORA. 2018 [citado el 24 de julio de 2023]. Disponible en: https://www.nysora.com/techniques/head-and-neck-blocks/airway/regional-topical-anesthesia-awake-endotracheal-intubation/

 ORCID
ORCID