Fredy Ariza PhD.1,2,*, Edward Ocampo-Mateus MD.2, Isabella Caicedo-Muriel3, Laura V. Restrepo3, Sergio Alzate-Ricaurte MD.5, Mabel Moreno MSc.4,5
Recibido: 23-01-2023
Aceptado: 11-05-2023
©2024 El(los) Autor(es) – Esta publicación es Órgano oficial de la Sociedad de Anestesiología de Chile
Revista Chilena de Anestesia Vol. 53 Núm. 1 pp. 44-51|https://doi.org/10.25237/revchilanestv53n1-09
PDF|ePub|RIS
Abstract
Postoperative acute kidney injury (PAKI) is a frequent complication in patients undergoing major surgery. Its multifactorial nature and severe consequences warrant the identification of perioperative care components that effectively reduce its occurrence. To identify risk factors associated with the development of PAKI related to components of the Patient Blood Management (PBM) policy in subjects undergoing major non-cardiac surgery (MNS). A prospective cohort analytical study was carried out from an institutional database including adult patients undergoing MNS between 2015-2019. A multivariate logistic model and survival curves were performed to determine the power of association between significant variables of the model and the outcome of interest. From 1,429 subjects included an incidence of PAKI of 3.1% was found. Arterial hypertension, ASA status 2 and 3, and an age range between 50-80 years were common conditions among the cases. A preoperative hemoglobin level > 10 gr/dL was determined to be protective for postoperative renal failure [OR 0.29 (95%CI 0.120.71); p = 0.00]. The survival analysis stratified by hemoglobin levels (> 10 vs < 10 g/dL) and intraoperative bleeding volume (> 500 vs < 500 ml), showed significant differences for both comparisons (LogRank test; p = 0.00). Preoperative anemia and significant intraoperative bleeding work as independent determinants for the presentation of PAKI in adult patients undergoing MNS. These findings support the critical need to promote the implementation of institutional PBM programs.
Resumen
La injuria renal aguda postoperatoria (IRAP) es una complicación frecuente en los pacientes sometidos a cirugía mayor. Su carácter multifactorial y severas consecuencias ameritan la identificación de componentes del cuidado perioperatorio que reduzcan efectivamente su aparición. Identificar factores de riesgo asociados al desarrollo de IRAP que se relacionen con componentes del principio Gestión de la Sangre del Paciente (GSP) en sujetos sometidos a cirugía mayor no cardíaca (CMNC). Se realizó un estudio analítico de cohortes prospectivas a partir de una base de datos institucional que incluyó pacientes adultos llevados a CMNC entre 2015-2019. Se construyó un modelo logístico multivariado y curvas de sobrevida para determinar el poder de asociación entre variables significativas del modelo y el evento principal. Se incluyeron 1.429 sujetos con una incidencia de IRAP del 3,1%. La hipertensión arterial, los estados ASA 2 y 3 y un rango de edad entre 50-80 años fueron condiciones comunes entre los casos encontrados. Un nivel de hemoglobina preoperatoria > 10 g/dL se determinó como protector para falla renal posoperatoria [OR 0,29 (IC95% 0,12-0,71); p = 0,00]. Los análisis de sobrevida estratificados por niveles de hemoglobina (> 10 < 10 g/dL) y volumen de sangrado intraoperatorio (> 500 < 500 ml), mostraron diferencias significativas entre los grupos (Test LogRank; p = 0,00). La anemia preoperatoria y el volumen de sangrado intraoperatorio funcionan como determinantes independientes para la presentación de IRAP en pacientes adultos llevados a CMNC. Estos hallazgos apoyan la necesidad crítica de promover la implementación de programas institucionales de GSP.
-
Introducción
Métodos
La injuria renal aguda posoperatoria (IRAP) es una complicación frecuente en pacientes sometidos a cirugía mayor. Un tercio de todos los casos de lesión renal aguda asociada a cirugía se presenta en el posoperatorio, incrementando el riesgo de progresión a insuficiencia renal crónica, necesidad de terapia de reemplazo renal, falla renal terminal y muerte. La disfunción renal puede tener diferentes grados de severidad y está asociada a múltiples complicaciones, así como sobrecostos y sobrecarga a los sistemas de salud. Del total de eventos reportados de IRAP, 10%-19% pueden progresar a falla renal tardía[1].
La Gestión de la Sangre del Paciente (GSP) se ha descrito como un “paquete de cuidados” integral basado en la mejor evidencia y centrado en la mejora oportuna del tejido sanguíneo del sujeto, con el fin de optimizar su propia respuesta fisiológica ante diversas causas de pérdida sanguínea o incrementos en la demanda metabólica tisular sin la clásica dependencia a las transfusiones alogénicas. Los pilares de este abordaje mul- tidisciplinario incluyen la detección y corrección de la anemia preoperatoria, la reducción del sangrado y la optimización de la tolerancia a la anemia[2]. Su objetivo fundamental es mejorar los desenlaces clínicos y lograr beneficios para pacientes, instituciones y sistemas de salud. Reducir la carga de morbi- mortalidad posoperatoria sería el gran logro de los programas de GSP, en donde la IRAP resalta como una grave complicación con consecuencias devastadoras en salud que ameritan la identificación de componentes del cuidado perioperatorio que reduzcan efectivamente su aparición.
En Suramérica, un estudio reciente en pacientes de cirugía cardíaca alertó sobre el comportamiento de la lesión renal asociada a cirugía mayor y los factores pronósticos asociados a la falla renal aguda postoperatoria[3]. Pese a la relevancia que tiene este desenlace, existen pocos estudios que evalúen la incidencia de la IRAP y sus factores asociados en pacientes sometidos a cirugía mayor no cardíaca (CMNC), que al igual que las cirugías cardíacas se realizan con alta frecuencia en instituciones de salud de alta complejidad.
El objetivo de este estudio fue identificar condiciones clínicas e intervenciones perioperatorias relacionadas con la política GSP que puedan estar asociadas a incremento o reducción en el riesgo de ocurrencia de IRAP en pacientes adultos sometidos a CMNC urgente y electiva en una institución hospitalaria latinoamericana de alta complejidad con un programa estructurado de vigilancia para el correcto uso de la sangre y sus componentes.
-
Tipo y diseño general del estudio
Se realizó un estudio observacional analítico, a partir de un registro institucional prospectivo que incluyó pacientes mayores de 18 años llevados a CMNC (registro de anestesia y medicina perioperatoria – RAMP) en el Hospital Universitario Fundación Valle del Lili de la ciudad de Cali-Colombia durante el período comprendido entre 2015 y 2019.
-
Tamaño de muestra
Para el tamaño de la muestra, se realizaron cálculos teniendo en cuenta la prevalencia de la presión arterial media (PAM) intraoperatoria menor a 60 mmHg como el factor que más tamaño de muestra requeriría para determinar la relación con la ocurrencia de la falla renal aguda posoperatoria. La elección de los supuestos se obtuvo a partir de los resultados de un estudio de cohorte retrospectivo realizado por Sun et al (2015)[4]. El cálculo se realizó en Epidat 4.2 teniendo en cuenta la proporción de sujetos con injuria renal postoperatoria y PAM < 60 mmHg (5,5%) en relación con los no expuestos (razón de expuestos: no expuestos de 1:2) (2) con un nivel de confianza del 95% y poder de 80% para un total de 1.764 pacientes: 588 con PAM < 65 mmHg y 1.174 con PAM > 65 mmHg. Fueron excluidos del análisis los pacientes menores de 18 años, embarazadas, con diagnóstico de falla renal crónica o terapia de reemplazo renal previa, no requerimiento de hospitalización posoperatoria y los registros con datos inconsistentes o incompletos. En general, se lograron incluir en este estudio 1.429 pacientes (Figura 1).
-
Definición operacional de las variables
Para este estudio se definió cirugía mayor como todo procedimiento quirúrgico que debido a su complejidad o dificultad presenta un riesgo elevado de complicaciones y requerimiento de atención posoperatoria en unidad de cuidados intensivos y/o hospitalización superior a 24 h. La identificación de eventos de IRAP se basó en la escala sugerida por KDIGO y referida como un aumento de 1 a 5 veces del nivel de creatinina en plasma en comparación con los valores preoperatorios o un aumento en el valor absoluto de 26 pmol/l (0,3 mg/dl) dentro de los 7 días después de la cirugía[5]. Se definió injuria renal severa como la presencia de disfunción renal que deriva en la necesidad de terapia de reemplazo renal (TRR).
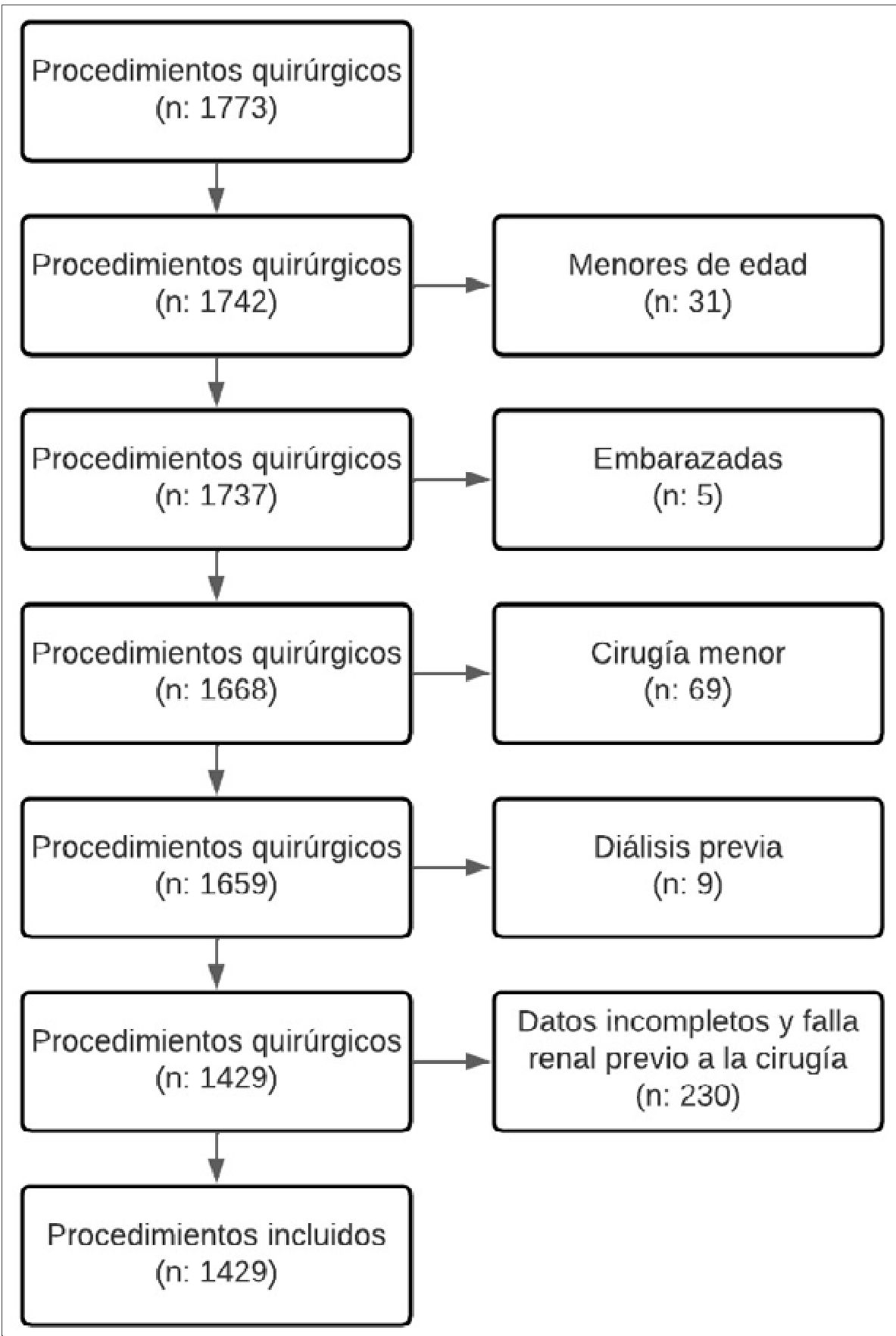
Figura 1. Diagrama de flujo.
Como variables independientes de riesgo para el modelo logsítico se establecieron la edad (< 50 años; 50-80 años y > 80 años); obesidad (IMC > 30 kg/m2); el estado funcional ASA (1-4) [6]; los niveles de hemoglobina sérica > 10 g/dl y la presencia de morbilidad preoperatoria (hipertensión, diabetes mellitus, falla cardíaca, hipotiroidismo, insuficiencia renal crónica, hipertensión pulmonar, enfermedad pulmonar obstructiva, cáncer, coagulopatía y tabaquismo crónico). Como variables explicativas durante el intraoperatorio se incluyeron la transfusión de al menos una unidad de glóbulos rojos empaquetados; el uso de ácido tranexámico (> 10 mg/kg); el uso de coloides; más de un evento registrado de PAM < 60 mmHg[4] y la presencia de sangrado > 500 ml[5].
-
Análisis estadístico
Los datos se obtuvieron directamente de la historia clínica electrónica. La información fue consignada en BD Clinic registrando las variables demográficas y clínicas del paciente, las va
riables del procedimiento intraquirúrgico y posoperatorio, así como la presentación del evento. En la revisión de la calidad de datos se realizó verificación de valores atípicos en las variables cuantitativas y de la información contenida en las variables categóricas. Inicialmente, la normalidad de las variables cuantitativas se evaluó con la prueba de Kolmogorov-Smirnov.
Las variables numéricas con distribución normal se describieron como medias y desviaciones estándar y para las variables con distribución no paramétrica como medianas y rangos inter- cuartílicos. Las variables categóricas se describieron en frecuencias absolutas y relativas. Para determinar diferencias estadísticamente significativas entre las variables independientes y el desenlace principal, se realizó la prueba t de Student (U Mann Whitney) para variables numéricas según su distribución y la prueba x2 de Pearson (prueba exacta de Fisher) para variables categóricas.
Se realizó un análisis bivariado para identificar variables incluibles en el modelo inicial de regresión logística. Se aceptaron valores de p < 0,2 para la selección de una variable. La
asociación entre las variables y el desenlace principal se estimó utilizando un modelo de regresión logística multivariada para eventos de baja frecuencia y el método de selección de variables por eliminación progresiva (backward). Se evaluó la fuerza de la asociación entre las variables independientes y la ocurrencia del desenlace mediante la razón de probabilidades (OR) y su intervalo de confianza (IC) del 95%. Se utilizó una regresión logística sesgada (scobit) para desenlaces desbalanceados.
Para las variables con poder de asociación estadísticamente significativo dentro del modelo de regresión se construyeron análisis de sobrevida evaluando la probabilidad de ocurrencia del desenlace principal mediante curvas de Kaplan-Meier y su correspondiente comparación mediante la prueba de Log-Rank. El seguimiento de los pacientes se realizó a partir del procedimiento quirúrgico y finalizó a los 60 días del posoperatorio. Si el paciente no presentó el evento principal durante el período de observación, se consideró como censura. Los análisis se procesaron en Stata 14.0. El nivel de significancia estadística aceptado para todas las pruebas fue un valor p < 0,05.
-
Consideraciones éticas
Este estudio fue aprobado por el comité de ética de Fundación Valle del Lili mediante el acta No 056 de 2022 y por el comité de ética de la Universidad ICESI mediante el acta No 456 de 2022.
-
Resultados
De 1.429 pacientes incluidos en este análisis se identificaron 43 (3,1%) casos de IRAP, de los cuales 3 (0,2%) requirieron TRR. La mayoría de los sujetos (55%) se encontraba en un rango de edad entre 50-80 años, sin diferencias en su presentación por género. Los estados ASA 2 y 3 ocuparon el 90% de los casos encontrados, con diferencias significativas en términos de duración del procedimiento quirúrgico [mediana 200 (RIQ 100300) vs 135 (95-195) min; (p = 0,01)] y diagnósticos previos de hipertensión arterial, enfermedad cerebrovascular, diabetes mellitus, cáncer y enfermedad renal crónica. El valor de creati- nina preoperatoria fue significativamente mayor en el grupo de pacientes con IRAP (1,06 (0,71-1,49) vs 0,8 (0,69-1,0) mg/dL; p = 0,01) (Tabla 1).
De acuerdo con los resultados obtenidos en el modelo de regresión logística múltiple, la probabilidad de presentar IRAP en pacientes con niveles preoperatorios de hemoglobina mayor o igual a 10 g/dL fue significativamente menor al compararla con individuos que reportaban valores inferiores (OR 0,29 (IC95% 0,12-0,71); p = 0,00). Adicionalmente, la probabilidad de presentar falla renal aguda posoperatoria entre los pacientes con un volumen de sangrado intraoperatorio igual o mayor a 500 ml fue de casi 8 veces mayor comparado con aquellos pacientes con menores tasas reportadas de sangrado, a pesar de no encontrarse una asociación estadísticamente significativa (p: 0,06). No se encontraron asociaciones de probabilidad significativas entre el desenlace principal y la transfusión de glóbulos rojos, uso de ácido tranexámico, hipotensión o uso de coloides durante el intraoperatorio (Tabla 2).
Resultados según un modelo para eventos de baja frecuencia y selección de variables por eliminación progresiva (bac-
kward). El resto de las variables adicionales a la hemoglobina preoperatoria se refieren a eventos o intervenciones ocurridas durante el intraoperatorio. IRAP, injuria renal aguda posoperatoria; GRE, glóbulos rojos empaquetados; PAM, presión arterial media.
El análisis de sobrevida estratificado por nivel de hemoglobina mostró que el 9% de los pacientes con niveles de hemoglobina menor o igual a 10 g/dL presentaron falla renal aguda postoperatoria a los 15 días de seguimiento, en comparación con sólo 2% de los sujetos con niveles de hemoglobina superiores a este punto de corte. La prueba de Log Rank demostró diferencias estadísticamente significativas entre los grupos (p = 0,000) (Figura 2).
Al analizar el número de días libres de IRAP estratificando por el volumen de sangrado intraoperatorio, se encontró que la probabilidad de tener el evento principal a los 3 días del posoperatorio fue de 12% en individuos con sangrado intraoperato- rio mayor o igual a 500 ml, en comparación con 2% en aquellos que presentaron sangrados menores (p = 0,000) (Figura 3).
-
Discusión
Este análisis derivado de un registro prospectivo de CMNC muestra una asociación estadísticamente significativa entre la presencia de anemia preoperatoria, sangrado mayor intraope- ratorio y aumento en la incidencia de IRAP en pacientes adultos llevados a cirugía mayor no cardíaca. Estas dos condiciones con amplio potencial de optimización a partir de la implementación de rutas clínicas relacionadas a la GSP han sido reconocidas previamente como marcadores independientes de afectación del curso posoperatorio normal a partir de su asociación con múltiples condiciones serias con gran impacto sobre la recuperación y la probabilidad de retorno temprano a la actividad cotidiana.
La IRAP representa una carga para los sistemas de salud al aumentar el riesgo de progresión a enfermedad renal crónica y mortalidad a 1 año[12],[14],[16],[17],[18]. Se ha postulado un origen multifactorial para la aparición de IRAP que incluye la carga de enfermedad preoperatoria, el daño renal subclínico y disparadores perioperatorios principalmente relacionados con disbalance agudo en la perfusión tisular. La edad ha sido ampliamente descrita como un factor de riesgo para IRAP. Grams et al., y posteriormente, Romagnoli describieron sujetos de CNMC típicamente entre la sexta y séptima década de vida con mayor prevalencia de este evento en el posoperatorio. La HTA fue el antecedente patológico más frecuentemente relacionado, como lo confirma el trabajo de Li et al.[8]. Como posible mecanismo de lesión renal se estima que estos pacientes podrían ser más susceptibles a la instauración de defectos microcirculatorios renales segmentarios derivados de una autorregulación anormal con respuesta inapropiada ante umbrales de presión de perfusión renal superiores a los de sujetos no hipertensos[1]. Otros factores de riesgo como la enfermedad cerebrovascular y la población con cáncer también fueron significativamente más frecuentes en los sujetos con IRAP.
Arbitrariamente, se escogió para este análisis un punto de corte preoperatorio de hemoglobina de 10 g/dL debido a la relativa frecuencia con que se suelen admitir estos niveles mínimos como requisito para cirugía mayor no cardiaca. Previa-
Tabla 1. Características demográficas y clínicas de la población de estudio
| Injuria renal | |||
| Característica | General | No | Si |
| 1.429 (100%) | 1.386 (96%) | 43 (4%) | |
| Edad (años) <50 | 436 (30,51) | 425 (97,48) | 11 (2,52)* |
| 50 – 80 | 910 (63,68) | 886 (97,36) | 24 (2,64) |
| > 80 | 83 (5,81) | 75 (90,36) | 8 (9,64) |
| Género Femenino | 910 (63,68) | 889 (97,69) | 21 (2,31)* |
| Masculino | 519 (36,32) | 497 (95,76) | 22 (4,24) |
| Estado ASA 1 | 261 (18,26) | 259 (99,23) | 2 (0,77)* |
| 2 | 830 (58,08) | 808 (97,35) | 22 (2,65) |
| 3 | 321 (22,46) | 304 (94,70) | 17 (5,30) |
| 4 | 17 (1,19) | 15 (88,24) | 2 (11,76) |
| Creatinina basal (mg/dL) | 0,8 (0,69-1) | 0,8 (0,69-1) | 1,06 (0,71-1,49)* |
| Duración de la cirugía (min) | 135 (95-200) | 135 (95-195) | 200 (100-300)* |
| HTA No | 842 (59,21) | 827 (98,22) | 15 (1,78)* |
| Si | 580 (40,79) | 552 (95,17) | 28 (4,83) |
| Diabetes Mellitus No | 1.255 (88,26) | 1.223 (97,45) | 32 (2,55)* |
| Si | 167 (11,74) | 156 (93,41) | 11 (6,59) |
| Enf. coronaria No | 1.380 (97,11) | 1.338 (96,96) | 42 (3,04) |
| Si | 41 (2,89) | 40 (97,56) | 1 (2,44) |
| Falla cardíaca No | 1.395 (98,24) | 1.354 (97,06) | 41 (2,94) |
| FEVI > 40% | 8 (0,56) | 7 (87,5) | 1 (12,50) |
| FEVI < 40% | 17 (1,20) | 16 (94,12) | 1 (5,88) |
| Hipotiroidismo No | 1174(82.73) | 1137(96.85) | 37(3.15) |
| Si | 245 (17,27) | 239 (97,55) | 6 (2,45) |
| IRC No | 1.341 (94,37) | 1.312 (97,84) | 29 (2,16)* |
| Si | 80 (5,63) | 66 (82,50) | 14 (17,5) |
| IMC > 30 kg/m2 No | 1.236 (87,35) | 1.200 (97,09) | 36 (2,91) |
| Si | 179 (12,65) | 173 (96,66) | 6 (3,35) |
| HTP No | 1.406 (98,87) | 1.363 (96,94) | 43 (3,06) |
| Si | 16 (1,13) | 16 (100,00) | 0 (0,00) |
| EPOC No | 1.394 (98,03) | 1.353 (97,06) | 41 (2,94) |
| Si | 28 (1,97) | 26 (92,86) | 2 (7,14) |
| ECV No | 1.395 (98,24) | 1.355 (97,13) | 40 (2,87)* |
| Si | 25 (1,76) | 22 (88,00) | 3 (12,00) |
| Cáncer No | 936 (66,01) | 918 (98,08) | 18 (1,92)* |
| Si | 482 (33,99) | 457 (94,81) | 25 (5,19) |
| Coagulopatía No | 1.413 (99,51) | 1.370 (96,96) | 43(3.04) |
| Si | 7 (0,49) | 7 (100,00) | 0 (0,00) |
| Tabaquismo No | 1.271 (90,33) | 1.232 (96,93) | 39 (3,07) |
| Exfumador | 101 (7,18) | 97 (96,04) | 4 (3,96) |
| Fumador actual | 35 (2,49) | 35 (100,00) | 0 (0,00) |
HTA, Hipertensión arterial; IRC, insuficiencia renal crónica; IMC, índice de masa corporal; HTP, hipertensión pulmonar; EPOC, enfermedad pulmonar obstructiva crónica; ECV, enfermedad cerebrovascular. *Valores de p estadísticamente significativos al realizar el análisis multivariado.
mente, Kattou et al., describieron en sujetos de cirugía cardíaca una relación entre valores bajos de hemoglobina preoperatoria y complicaciones posoperatorias entre las cuales se encontraba la IRAP. No obstante, los valores de corte identificados como predictores fueron superiores a los propuestos en este estudio (Hb < 13 g/dL para hombres y < 11,8 g/dL para mujeres)[7]. Este y otros estudios similares reportaron una incidencia de IRAP similar a la obtenida en nuestro trabajo[1],[2],[3].
Dentro de las principales recomendaciones preventivas para la IRAP se describen el mantenimiento de la normotensión, euvolemia, normoglicemia y el uso restrictivo de nefrotóxi- cos[1],[13],[16]. Este trabajo confirma los hallazgos descritos por Ida et al., donde el sangrado intraoperatorio > 500 ml se estableció como un factor de riesgo independiente para IRAP (OR: 3,81; IC95% 1,51-9,58; p = 0,005)[16]. En el estudio de
Li et al., se encontró mayor incidencia del evento en pacientes que requirieron transfusión de glóbulos rojos durante el intrao- peratorio (6% vs 2,8%). Aunque nuestro estudio no coincide con este hallazgo, múltiples reportes confirman la asociación entre transfusiones alogénicas y lesión renal, en contravía con la errónea percepción de reducción del riesgo derivado de la anemia perioperatoria con las intervenciones transfusiona- les[9],[10],[11].
Tabla 2. Modelo de regresión logística para falla renal aguda posoperatoria en pacientes adultos de cirugía mayor no cardíaca
| Variable | IRAP n = 43 | No IRAP n = 1.386 | OR ajustado (IC95%) | Valor p |
| Hemoglobina preoperatoria > 10 g/dL | 32 | 1.167 | 0,29 (0,12 – 0,71) | 0,00 |
| Transfusión de > 1 U de GRE | 5 | 72 | 1,00 (1,00 – 1,01) | 0,21 |
| Ácido tranexámico | 5 | 110 | 1,48 (0,37 – 5,89) | 0,58 |
| > 1 evento de PAM < 60 mmHg | 11 | 435 | 0,77 (0,33 – 1,80) | 0,55 |
| Uso de coloides | 2 | 32 | 1,00 (0,99 – 1,01) | 0,45 |
| Sangrado intraoperatorio > 500 ml | 6 | 47 | 7,69 (0,99 – 66,15) | 0,06 |
Resultados según un modelo para eventos de baja frecuencia y selección de variables por eliminación progresiva (backward). El resto de las variables adicionales a la hemoglobina preoperatoria se refieren a eventos o intervenciones ocurridas durante el intraoperatorio. IRAP: injuria renal aguda posoperatoria; GRE: glóbulos rojos empaquetados; PAM: presión arterial media.
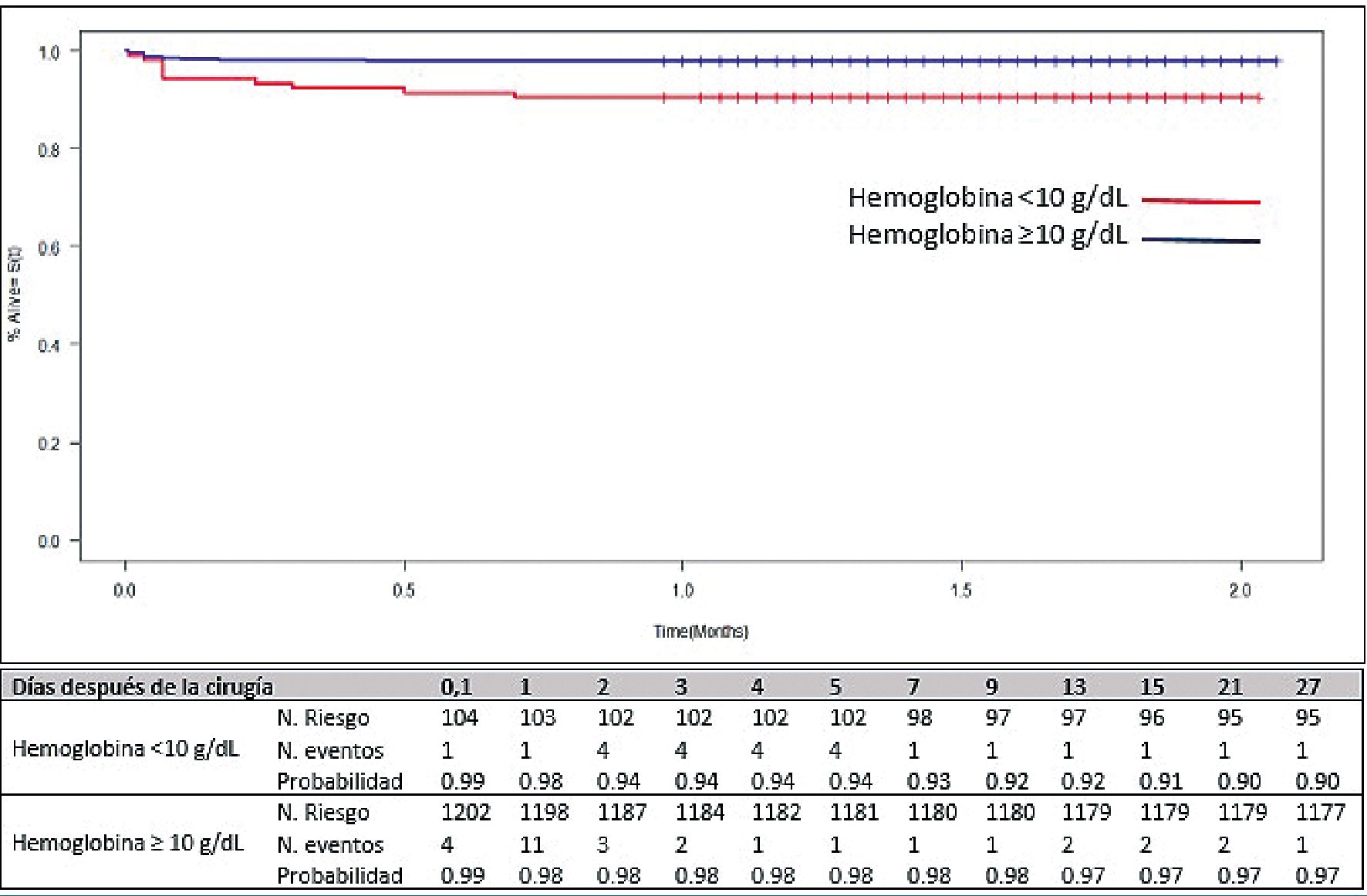
Figura 2. Curva de sobrevida por método de Kaplan-Meier estratificada por nivel de hemoglobina (g/dL).
Nuestro estudio presenta limitaciones importantes relacionadas con la estratificación de la IRAP en lugar de haberla abordado como una variable dicotómica (criterios KDIGO), lo cual impidió la identificación de factores de riesgo por subgrupos específicos de lesión renal. Adicionalmente, el hecho de no haber analizado un número mayor de pacientes, puede haber condicionado el hecho de no encontrar otras asociaciones típicamente descritas en estudios previos
En conclusión, este estudio muestra que la anemia preoperatoria y el volumen de sangrado intraoperatorio funcionan como determinantes independientes para la presentación de IRAP en pacientes adultos llevados a CMNC. Estos hallazgos apoyan la necesidad crítica de promover la implementación de programas institucionales de GSP en nuestra región, basados en su potencial impacto sobre condiciones preoperatorias inapropiadas como la anemia ferropénica y eventos perioperatorios relacionados con desenlaces serios como la lesión renal aguda y su potencial progresión a falla renal crónica y muerte. Se requieren futuros estudios con tamaños de muestra mayores y mejores metodologías de análisis que confirmen y validen nuestros resultados.
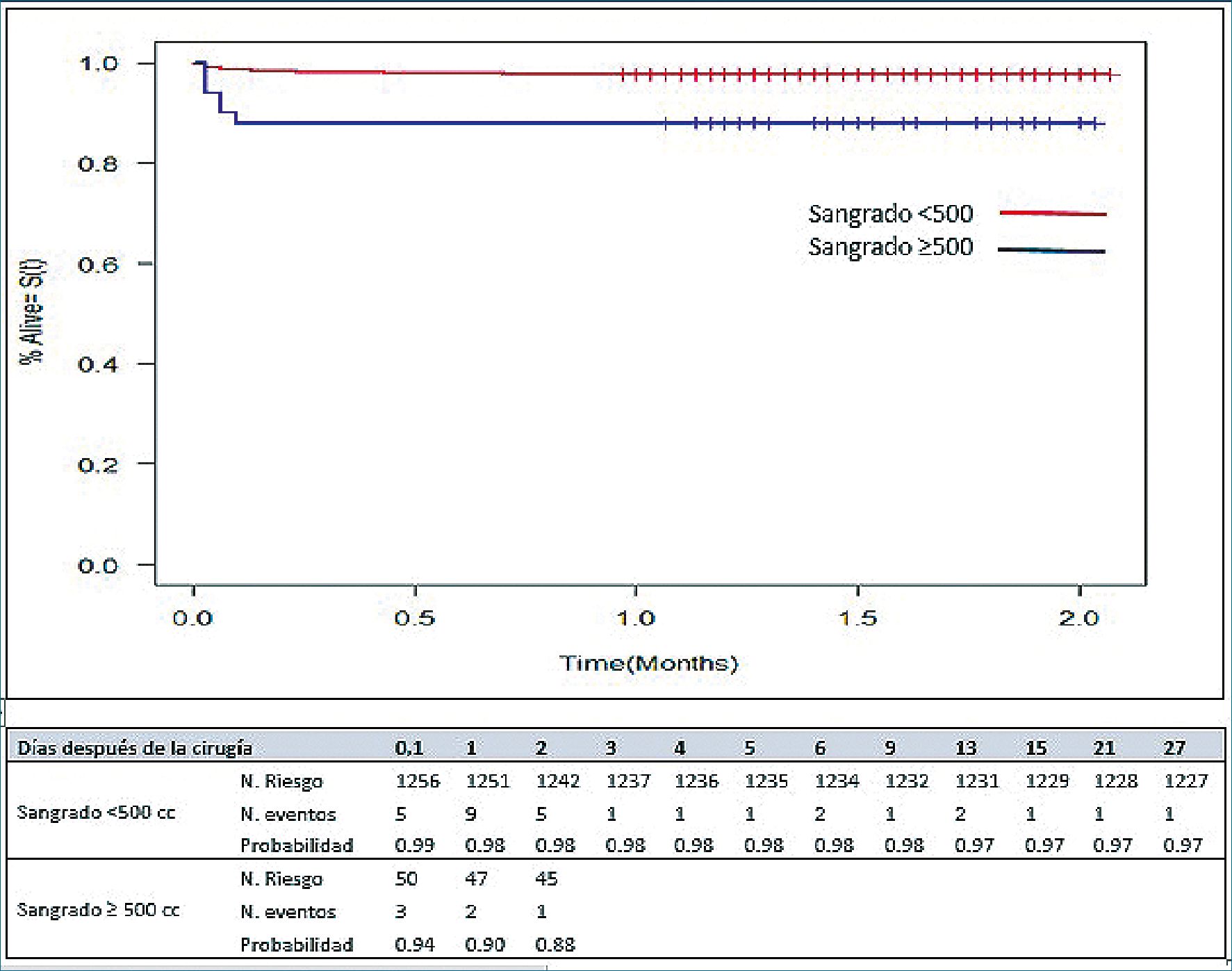
Figura 3. Curvas de sobrevida por método de Kaplan-Meier estratificada por volumen de sangrado (ml).
El presente estudio no ha sido enviado a otra revista científica nacional o internacional. Conflicto de interés: No se declaró ningún conflicto de intereses en el presente estudio.
-
Referencias
1. Prowle JR, Forni LG, Bell M, Chew MS, Edwards M, Grams ME, Grocott MPW, Liu KD, McIlroy D, Murray PT, Ostermann M, Zarbock A, Bagshaw SM, Bartz R, Bell S, Bihorac A, Gan TJ, Hobson CE, Joannidis M, Koyner JL, Levett DZH, Mehta RL, Miller TE, Mythen MG, Nadim MK, Pearse RM, Rimmele T, Ronco C, Shaw AD, Kellum JA. Postoperative acute kidney injury in adult noncardiac surgery: joint consensus report of the Acute Disease Quality Initiative and PeriOperative Quality Initiative. Nat Rev Nephrol. 2021 Sep;17(9):605-618. doi: 10.1038/s41581-021-00418-2. Epub 2021 May 11. https://doi.org/10.1038/s41581-021-00418-2
2. Sam D. Gumbert, Felix Kork, Maisie L. Jackson, Naveen Vanga, Semhar J. Ghebremichael, Christy Y. Wang, Holger K. Eltzschig; Perioperative Acute Kidney Injury. Anesthesiology 2020; 132:180-204 5. Desai N, Schofield N, Richards T. Perioperative Patient Blood Management to Improve Outcomes. Anesth Analg. 2018 Nov;127(5):1211-1220. https://doi.org/10.1097/ALN.0000000000002968
3. León, Cristian, Cieza, Javier, & Valenzuela, Raúl. (2014). Injuria renal aguda, perfil epidemiológico intrahospitalario y factores asociados al riesgo de muerte. Revista Médica Herediana, 25(4), 189-195. Recuperado en 25 de octubre de 2021, de https://doi.org/10.20453/rmh.2014.2175
4. Sun LY, Wijeysundera DN, Tait GA, Beattie WS. Association of intraoperative hypotension with acute kidney injury after elective noncardiac surgery. Anesthesiology. 2015 Sep;123(3):515-23. https://doi.org/10.1097/ALN.0000000000000765
5. Vaara ST, Bellomo R. Postoperative renal dysfunction after noncardiac surgery. Curr Opin Crit Care. 2017 Oct;23(5):440-446. https://doi.org/10.1097/MCC.0000000000000439
6. Doyle DJ, Hendrix JM, Garmon EH. American Society of Anesthesiologists Classification. 2022 Dec 4. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan-.
7. Kattou F, Montandrau O, Rekik M, Delentdecker P, Brini K, Zannis K, Beaussier M. Critical Preoperative Hemoglobin Value to Predict Anemia-Related Complications After Cardiac Surgery. J Cardiothorac Vasc Anesth. 2022 Jul;36(7):1901-1907. https://doi.org/10.1053/j.jvca.2022.01.013
8. Li S, Wang S, Priyanka P, Kellum JA. Acute Kidney Injury in Critically Ill Patients After Noncardiac Major Surgery: Early Versus Late Onset. Crit Care Med. 2019 Jun;47(6):e437-e444. https://doi.org/10.1097/CCM.0000000000003710
9. Morgan E. Grams, Yingying Sang, Josef Coresh, Shoshana Ballew, Kunihiro Matsushita, Miklos Z. Molnar, Zoltan Szabo, Kamyar Kalantar-Zadeh, Csaba P. Kovesdy, Acute Kidney Injury After Major Surgery: A Retrospective Analysis of Veterans Health Administration Data, American Journal of Kidney Diseases, Volume 67, Issue 6, 2016, Pages 872-880, ISSN 0272-6386. https://doi.org/10.1053/j.ajkd.2015.07.022
10. Romagnoli S, Ricci Z, Ronco C. Perioperative Acute Kidney Injury: Prevention, Early Recognition, and Supportive Measures. Nephron. 2018;140(2):105-110. Epub 2018 Jun 26. https://doi.org/10.1159/000490500
11. Romagnoli S. 1, Ricci Z. 2 . Postoperative acute kidney injury Department of Human Health Sciences, Section of Anesthesiology and Intensive Care, University of Florence, Azienda Ospedaliero- Universitaria Careggi, Florence, Italy; 2 Department of Cardiology and Cardiac Surgery, Pediatric Cardiac Intensive Care Unit, Bambino Gesù Children’s Hospital, IRCCS, Rome, Italy
12. Wilson T, Quan S, Cheema K, Zarnke K, Quinn R, de Koning L, Dixon E, Pannu N, James MT. Risk prediction models for acute kidney injury following major noncardiac surgery: systematic review. Nephrol Dial Transplant. 2016 Feb;31(2):231-40. https://doi.org/10.1093/ndt/gfv415
13. S. Sabaté, C. Gomar, J. Canet, P. Sierra, J. Castillo,Factores de riesgo de insuficiencia renal aguda postoperatoria. Análisis en una cohorte de 2.378 pacientes de 59 hospitales, Revista Española de Anestesiología y Reanimación, Volume 58, Issue 9, 2011, Pages 548-555, ISSN 0034-9356, https://doi.org/10.1016/S0034-9356(11)70139-6
14. Bell S, Ross VC, Zealley KA, Millar F, Isles C. Management of postoperative acute kidney injury. QJM. 2017 Nov 1;110(11):695- 700. https://doi.org/10.1093/qjmed/hcw175
15. Ida M, Sumida M, Naito Y, Tachiiri Y, Kawaguchi M. Impacto da hipotensáo e perda sanguínea intraoperatórias na lesáo renal aguda após cirurgia de páncreas [Impact of intraoperative hypotension and blood loss on acute kidney injury after pancreas surgery]. Braz J Anesthesiol. 2020 Jul-Aug;70(4):343-348. https://doi.org/10.1016/j.bjan.2020.04.011
16. Gu WJ, Hou BL, Kwong JSW, Tian X, Qian Y, Cui Y, Hao J, Li JC, Ma ZL, Gu XP. Association between intraoperative hypotension and 30-day mortality, major adverse cardiac events, and acute kidney injury after non-cardiac surgery: A meta-analysis of cohort studies. Int J Cardiol. 2018 May 1;258:68-73. https://doi.org/10.1016/j.ijcard.2018.01.137
17. Hobson C, Ozrazgat-Baslanti T, Kuxhausen A, Thottakka- ra P, Efron PA, Moore FA, Moldawer LL, Segal MS, Bihorac A. Cost and Mortality Associated With Postoperative Acute Kidney Injury. Ann Surg. 2015 Jun;261(6):1207-14. https://doi.org/10.1097/SLA.0000000000000732
18. M. E. O’Connor R. W. Hewson, C. J. Kirwan G. L. Ackland, R. M. Pearse and J. R. Prowle. Acute kidney injury and mortality 1 year after major non-cardiac surgery. 1Critical Care and Perioperative Medicine Research Group,William Harvey Institute, Barts and the London School of Medicine and Dentistry, Queen Mary University of London, and 2Adult Critical Care Unit, 3Department of Anaesthesia and 4Department of Renal and Transplant Medicine, Royal London Hospital, Barts Health NHS Trust, London, UK. https://doi.org/10.1002/bjs.10498

 ORCID
ORCID